Способ и установка для определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток
Иллюстрации
Показать всеПроводят термостатирование биокатализатора на основе иммобилизованных микробных клеток и неинокулированного носителя, входящего в состав биокатализатора, инфракрасное сканирование поверхности биокатализатора и носителя с помощью высокочувствительной инфракрасной камеры, и получение тепловых характеристик биокатализатора, таких как распределение температур на его поверхности и разница температур между поверхностью биокатализатора и неинокулированного носителя. Распределение температур позволяет контролировать однородность распределения активности на поверхности биокатализатора. Разницу температур используют для определения интенсивности адсорбции и метаболической активности закрепленных бактериальных клеток. Установка для определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов включает инфракрасную камеру, закрепленную на штативе, и соединенную с компьютером, и термоизолирующий бокс с отверстием сверху, закрывающимся крышкой, что позволяет минимизировать колебания температуры окружающей среды до ±1°С/ч и снижает влияние инфракрасной камеры на результаты анализа. Изобретение обеспечивает сокращение времени проведения анализа, повышение эффективности и рентабельности биологических методов трансформации химических соединений и биологической утилизации опасных веществ. 3 н. и 3 з.п. ф-лы, 2 ил., 3 табл., 6 пр.
Реферат
Уровень техники.
Изобретение относится к прикладной микробиологии и биотехнологии, конкретно к способам оценки эффективности биокатализаторов на основе иммобилизованных клеток углеводородокисляющих микроорганизмов для деградации гидрофобных поллютантов или окислительной трансформации целевых органических соединений. Разработан простой экспрессный метод определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функциональной активности биокатализаторов на основе иммобилизованных микробных клеток, пригодный для использования на этапах получения, эксплуатации и хранения микробных биокатализаторов. Известны два способа исследования адсорбционной иммобилизации микробных клеток, позволяющие прогнозировать эффективность данного процесса. Первый способ заключается в измерении краевых углов смачивания поверхности носителя и бактериальных клеток стандартными жидкостями с известными показателями свободной поверхностной энергии. Полученные значения краевых углов смачивания подставляют в формулу Юнга, вычисляют энергии взаимодействия между клетками и носителем γкн, клетками и питательной средой γкс, частицами носителя и средой γнс, из значения γкн вычитают γкс и γнс согласно уравнению теплового баланса и находят величину свободной энергии Гиббса ΔGадг (мДж/м2). Величина ΔGадг является показателем сродства бактериальных клеток к поверхности исследуемого носителя. Отрицательные значения ΔGадг свидетельствуют о том, что при взаимодействии клеток с носителем выделяется избыточная энергия, данный процесс является термодинамически выгодным, и клетки характеризуются высоким сродством к поверхности носителя. Чем больше по модулю величина ΔGадг, тем выше сродство клеток к носителю [1, 2, 3]. Второй способ заключается в измерении величины электрофоретической подвижности клеток и частиц носителя в камере для микроэлектрофореза или с помощью анализатора дзета-потенциалов [3, 4]. Электрофоретическая подвижность связана со знаком и величиной заряда на взаимодействующих поверхностях и позволяет судить о сродстве клеток и носителя, возникающем в результате электростатического притяжения между ними. Таким образом, оба способа позволяют оценить степень сродства микроорганизмов к твердым носителям на основании данных об их физико-химических свойствах еще до проведения процедуры иммобилизации. Однако следует отметить, что данные способы заимствованы из физической и коллоидной химии и основаны на допущении, что клетки и носитель представляют собой гладкие сферические частицы, взаимодействующие всей площадью поверхности. В связи с этим не учитывается сложная геометрическая форма частиц носителя и бактериальных клеток, которые в действительности могут контактировать друг с другом лишь отдельными участками, при этом адсорбция может быть обусловлена простым механическим удержанием клеток в порах или других неровностях носителя. Способы определения эффективности адсорбционной иммобилизации на основе данных о краевых углах смачивания и электрофоретической подвижности часто не позволяют предсказать результаты адсорбции, вычислить действительную величину адсорбционной емкости носителя в отношении исследуемых микроорганизмов и не могут быть использованы для оценки функциональных свойств микробных клеток после иммобилизации [1, 2, 3].
Известны способы определения эффективности адсорбционной иммобилизации непосредственно по количеству адсорбированных на носителе микробных клеток. Концентрацию клеток на носителе определяют различными методами, в частности, путем окрашивания иммобилизованных клеток органическими красителями [5], по сухому весу прикрепленных клеток [6], количеству белка [7], оптическими методами [8]. Так, известен способ [8], который заключается в том, что сначала проводят процедуру иммобилизации микробных клеток, при этом в качестве носителя используют специально приготовленные материалы, состоящие из чередующихся участков с высоким и низким сродством к адсорбируемым клеткам, затем поверхность носителя с иммобилизованными клетками сканируют с помощью оптического элемента, состоящего из источника света и детектора световых лучей. При прохождении света через носитель в локусах, содержащих иммобилизованные клетки или их скопления, происходит изменение его интенсивности; карта интенсивности проходящего через носитель света фиксируется детектором и используется для определения количества прикрепленных клеток. Данный способ имеет ряд недостатков: (1) требует использования специально приготовленных носителей, (2) ограничивает выбор носителей оптически прозрачными материалами, (3) не адаптирован для изучения кинетических параметров адсорбционной иммобилизации, (4) не позволяет контролировать жизнеспособность микробных клеток в процессе их иммобилизации и в иммобилизованном состоянии. Недостатки других способов: весовой метод и определение числа прикрепленных клеток по количеству белка требуют обязательного отделения бактериальной биомассы от носителя, что не всегда возможно, например, вследствие необратимой адсорбции бактериальных клеток на носителе; окрашивание зачастую связано с экстракцией окрашивающего вещества из клеток, при этом возникают проблемы с полной экстракцией красителя, который может прочно связываться с материалом носителя, что приводит к искажению результатов анализа. Общим недостатком способов, ориентированных на определение эффективности адсорбционной иммобилизации по числу адсорбированных клеток, является возможность получения только одного из параметров, определяющих эффективность адсорбционной иммобилизации, а именно адсорбционной емкости носителя.
Известен способ определения эффективности адсорбционной иммобилизации и функциональной активности биокатализаторов на основе данных о численности живых иммобилизованных клеток. Данный способ заключается в разрушении оболочки бактериальных клеток для высвобождения содержимого цитоплазмы, экстракции из полученного содержимого аденозинтрифосфатов (АТФ), проведении люциферин-люциферазной реакции и измерении интенсивности люминесценции, возникающей в результате данной реакции [9]. Способ характеризуется высокой степенью совпадения между количеством АТФ и концентрацией клеток, определенной методами прямого подсчета клеток под микроскопом или высевом на твердые питательные среды. Однако данный способ является достаточно трудоемким, предполагает использование дорогостоящих реактивов, таких как люциферин и люцифераза, и также позволяет оценить только один из параметров, определяющих эффективность адсорбционной иммобилизации, а именно количество живых адсорбированных микробных клеток.
Известен способ оценки эффективности адсорбционной иммобилизации бактериальных клеток, предполагающий наблюдение за данным процессом, происходящим в специально сконструированной проточной ячейке с параллельными пластинами (a parallel plate flow chamber system), с помощью фазово-контрастного микроскопа, подробно описанный в [2] и позволяющий решать несколько задач одновременно. Ячейка состоит из покрытой никелем латунной донной части и верхней части, изготовленной из поли(метилметакрилата) (в случае если необходима автоклавируемая ячейка, используют ячейку с металлической плоской верхней пластиной), в которой заключены две параллельно расположенные пластины размером 7,6×5,0×0,2 см, отделенные друг от друга тефлоновыми прокладками. Рабочие размеры камеры 7,6×3,8×0,06 см, хотя высота камеры может варьировать в зависимости от толщины прокладок. Параллельные пластины изготовлены из материала носителя и выступают в качестве адсорбента микробных клеток. Установка для наблюдения за адсорбционным процессом состоит из следующих элементов: (1) микроскоп, к предметному столику микроскопа прочно прикреплена (2) ячейка с параллельными пластинами, ячейка соединена трубками с (3) насосом и (4) колбами с питательной средой и клеточной суспензией, микроскоп оборудован (5) цифровой видеокамерой, которая соединена с (6) компьютером. Суспензия клеток микроорганизмов пропускается через проточную ячейку с контролируемой скоростью потока, при этом на протяжении всего периода адсорбции с помощью цифровой камеры с заданной периодичностью фиксируется изображение поверхности параллельных пластин. Полученные изображения обрабатываются математически с помощью компьютерной программы, которая позволяет определить количество прикрепленных клеток, подсчитать скорости адсорбции и десорбции, вычислить время, необходимое для окончания адсорбционного процесса. Данное техническое решение позволяет вести прямое наблюдение за процессом осаждения клеток без предварительной пробоподготовки, при этом микробные клетки во время анализа находятся в нативном состоянии, полностью сохраняется пространственное расположение клеток относительно друг друга, исключаются любые стрессорные воздействия на клетки. Кроме того, проточная ячейка может быть использована как для оценки конечного равновесного состояния системы клетки/носитель, так и для кинетических исследований.
Недостатки этого способа:
1) использование фазово-контрастного микроскопа ограничивает набор адсорбентов клеток микроорганизмов только прозрачными материалами. Установка для оценки эффективности адсорбционного процесса допускает использование увеличивающих оптических устройств, работающих в отраженном от микропрепарата свете (металлографические или стереомикроскопы). Тогда могут быть использованы и непрозрачные материалы для изготовления носителей, однако это накладывает значительные ограничения на увеличение объектов (не более 400×-600×), и бактериальные клетки, хорошо видимые при увеличении в 1000-1500 раз и более, затруднительно наблюдать с помощью таких устройств.
2) Проточные ячейки с параллельными пластинами изготавливаются самостоятельно, что не удовлетворяет требованиям стандартизации, либо ячейки могут быть приобретены в специализированной фирме. В доступных информационных ресурсах можно найти единственную компанию, которая производит проточные ячейки с параллельными пластинами, - это GlycoTech, США. Официальные дистрибьюторы продукции данной компании в настоящее время на территории Российской Федерации не представлены. Все это значительно усложняет поставку ячеек в страну и массовое использование проточных ячеек с параллельными пластинами в технологиях производства биокатализаторов на основе иммобилизованных клеток микроорганизмов.
3) Отсутствие технических приспособлений для определения жизнеспособности адсорбируемых микроорганизмов и функциональной активности иммобилизованных клеток.
Известен способ определения ферментативной активности биокатализатора на основе иммобилизованных микробных клеток, который включает приготовление эталонного и исследуемого образцов, проведение ферментативной реакции с последним, определение оптической плотности образцов после реакции, оценку ферментативной активности биокатализатора по изменению величины оптической плотности после проведения ферментативной реакции с последующей регистрацией величин оптических плотностей обоих образцов, обеспечивают воздействие на них электрическим полем и во время данного воздействия повторно регистрируют величины оптических плотностей образцов, определяют отношение величин оптических плотностей соответствующих образцов до и во время воздействия электрическим полем, и по сравнению их судят о наличии ферментативной активности биокатализатора [10]. Недостатком данного способа является отсутствие возможности количественного анализа при оценке функциональной активности биокатализатора.
В качестве прототипа способа определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток по совокупности существенных признаков выбран способ изотермической микрокалориметрии. Данный способ основан на измерении количества тепла, которое выделяется в результате метаболических процессов, протекающих в клетках иммобилизованных микроорганизмов. Для измерения величины теплового эффекта носитель с прикрепленными клетками вносят в специальные ампулы с питательной средой, ампулы помещают в микрокалориметр, выдерживают при постоянной температуре в течение 60 мин для достижения теплового равновесия и затем в микрокалориметре на протяжении заданного промежутка времени детектируют тепловое излучение, поступающее от ампул с носителем [11]. Полученные значения тепла выражают в виде единиц мощности (мкВт или мВт) или энергии (Дж), по суммарной величине теплового излучения судят о метаболической активности, жизнеспособности и численности иммобилизованных клеток. Данный способ не требует предварительной пробоподготовки, позволяет изучать иммобилизованные клетки в нативном состоянии, пригоден для исследования функциональной активности готового биокатализатора, обладает высокой степенью чувствительности (порог чувствительности 0,02°С), позволяет анализировать одновременно до 48 образцов.
Недостатками данного способа являются ограничения в точности оценки метаболических процессов, протекающих в клетках иммобилизованных микроорганизмов, а также продолжительность определения, обусловленная методом изотермической микрокалориметрии:
1) требуется длительное время (60 мин) перед измерениями для установления теплового равновесия;
2) нет информации о распределении источников тепла на поверхности носителя, доступна только информация об общем количестве тепла, которое выделяется иммобилизованными клетками;
3) не учитывается тепло, которое выделяется во время контакта клеток с поверхностью носителя.
Техническим результатом является сокращение времени при разработке биокатализаторов, возможность постоянного мониторинга их функционального состояния и получение устойчивых биокаталитических систем для повышения эффективности и рентабельности биологических методов трансформации химических соединений и биологической утилизации опасных веществ.
Описание изобретения.
Известно, что адсорбция микроорганизмов - это экзотермический процесс, который всегда происходит с выделением тепла. Кроме того, присутствие клеток вблизи или на поверхности носителя также создает дополнительный источник тепла, связанный с их метаболической активностью. Таким образом, в процессе адсорбционной иммобилизации и на поверхности биокатализатора с метаболически активными иммобилизованными клетками происходит выделение тепла, что сопровождается увеличением температуры, которое может быть зафиксировано инструментально. Предлагаемый способ определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток основан на детальном анализе тепловых характеристик поверхности носителя в присутствии бактериальных клеток, таких как распределение температур на носителе и увеличение температуры в смеси клетки/носитель в процессе адсорбционной иммобилизации, при этом температурные показатели получают с помощью высокочувствительной (порог чувствительности ≤0,025°С) инфракрасной (ИК) камеры.
Технически способ определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток заключается в том, что биокатализатор и неинокулированный носитель, входящий в состав биокатализатора, термостатируют в помещении с колебаниями температуры менее 1°С/час в течение 20 мин, проводят процедуру инфракрасного сканирования поверхностей биокатализатора и носителя с помощью высокочувствительной ИК камеры, находящейся в рабочем режиме, исключающем систематические ошибки при измерении температур, далее устанавливают распределение температур и вычисляют разницу температур инокулированной и неинокулированной поверхностями носителя. Равномерное распределение температур свидетельствует об однородности распределения иммобилизованных клеток на носителе. Разница температур позволяет судить об интенсивности адсорбции и метаболической активности закрепленных клеток. Статистически достоверной разницей температур, свидетельствующей об адгезивной и метаболической активности микробных клеток, является интервал от +0,320 до
+4,199°С.
Для устранения влияния неприкрепленных микробных клеток и питательной среды на температурные показатели носителя и биокатализатора, а также для устранения эффекта отражения инфракрасного излучения, который возникает при сканировании поверхности с высоким коэффициентом отражения, перед термостатированием биокатализатор и носитель два раза промывают буфером состава Na2HPO4×12H2O - 8,9 г/л, KH2PO4 - 3,4 г/л (рН=6,8-7,0) в объеме, соответствующем соотношению биокатализатор: буфер и носитель: буфер 1:12 по объему, остатки влаги с поверхности биокатализатора и носителя удаляют с помощью фильтровальной бумаги, подсушенный образец используют для инфракрасного анализа.
Наряду со статическими тепловыми показателями поверхности биокатализатора и носителя, ИК камера позволяет определять кинетические параметры процесса адсорбционной иммобилизации микроорганизмов. Для этого носитель и клеточную суспензию термостатируют в тех же условия, что описаны выше, и объединяют. Для увеличения вероятности детекции всего теплового излучения, поступающего от носителя, и снижения величины его поглощения водной средой, в которой находятся микробные клетки и которая обладает низкой теплопроводностью, объем клеточной суспензии должен обеспечивать высоту столба жидкости 2-3 мм. В качестве удобных емкостей для приготовления смеси клетки/носитель могут быть использованы многолуночные иммунологические микропланшеты, при этом сами микропланшеты могут быть изготовлены из материала носителя и использованы в качестве такового. Проводят инфракрасную съемку смеси клетки/носитель с помощью ИК камеры, находящейся в рабочем режиме, исключающем систематические ошибки при измерении температур, при комнатной температуре в течение заданного временного интервала, при этом колебания температуры в помещении должны составлять менее 1°С/час на протяжении всего периода съемки, вычитают первый кадр полученного фильма из всех последующих кадров, строят график относительного приращения температуры от времени и вычисляют величину прироста температуры в смеси клетки/носитель. Статистически достоверным приростом температуры, свидетельствующим об адгезивной и метаболической активности микробных клеток в процессе иммобилизации, является интервал от +0,320 до +4,199°С.
Способ определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток может быть использован в лабораторной практике и в промышленности для решения следующих задач:
1) Подбор оптимальных носителей и условий иммобилизации, обеспечивающих максимальные показатели разницы или прироста температур.
2) Определение времени адсорбционной иммобилизации. По графикам изменения температуры во времени или полученным с помощью математической обработки на их основе графикам изменения количества тепла в смеси клетки/носитель можно вычислить время наиболее активной иммобилизации. После того как скорость изменения температуры становится постоянной (выходит на стационарный уровень, что свидетельствует о прекращении процесса адсорбции), дальнейшее увеличение температуры происходит исключительно в результате метаболических процессов, протекающих в клетках, иммобилизованных на поверхности носителя.
3) Экспресс-оценка функционального состояния биокатализатора. При снижении скорости процесса биотрансформации заявляемый способ позволяет в течение нескольких минут определить, связан ли данный эффект с самим биокатализатором. И, наоборот, при выявлении заметного изменения температуры на поверхности носителя с иммобилизованными клетками по сравнению с исходным состоянием можно прогнозировать снижение или увеличение скорости биотехнологического процесса.
Как и в случае прототипа, иммобилизованные клетки во время тепловизионного анализа находятся в нативном состоянии, при этом не требуется проведения дополнительных процедур для отделения клеток от носителя, их окрашивания или другой пробоподготовки, что значительно сокращает материальные и трудовые затраты при разработке биокатализаторов и мониторинге их функциональной активности. Предлагаемый способ отличается высокой производительностью, позволяет одновременно анализировать от 1 до 16 образцов, при этом производительность может быть повышена путем дальнейших технологических усовершенствований.
Способ определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток имеет следующие преимущества по сравнению с прототипом:
1. Короткое время анализа. Минимальное время, необходимое для анализа одного образца, составляет 30 мин.
2. Возможность использования на различных этапах биотехнологического производства и эксплуатации биокатализаторов: на этапе разработки технологии адсорбционной иммобилизации, на этапе иммобилизации, для мониторинга функциональных свойств готового биокатализатора на этапе проведения биологической трансформации и на этапе хранения биокатализатора. При этом образец биокатализатора, отобранный из биореактора, снова может быть возвращен в реакционную смесь, что позволяет сохранять исходное количество биокатализатора и не влиять на скорость окислительного процесса.
3. Более полная характеристика биокатализатора, включающая не только определение метаболической активности иммобилизованных бактериальных клеток по величине теплового эффекта, но и получение температурных профилей биокатализатора, позволяющих контролировать однородность распределения активности на поверхности биокатализатора. При равномерном распределении бактериальных клеток на поверхности носителя все клетки получают одинаковый доступ к молекулам окисляемого субстрата и проявляют одинаковую ферментативную активность. В результате достигается стабильное функционирование полученной биокаталитической системы и стабильно высокая скорость окислительного процесса.
Важным условием инфракрасного сканирования является отсутствие резких колебаний температуры внешней среды.
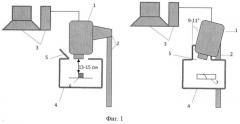
Для реализации заявленного способа разработана установка для определения эффективности и динамики адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализатора. Установка состоит из ИК камеры (1), закрепленной на штативе (2) и соединенной с компьютером (3), и термоизолирующего бокса (4) с отверстием сверху (5), к стенкам которого вплотную прилегает объектив инфракрасной камеры, при этом образец (биокатализатор, носитель или микропланшет со смесью клетки/носитель или клеточной суспензией) (6) помещается внутрь бокса под объектив камеры через отверстие с крышкой (7) в одной из стенок бокса (фиг.1). Термоизолирующий бокс изготавливают из материала, обеспечивающего колебания температуры внутри него ≤1°С/час, в частности, бокс может быть изготовлен из пенопласта толщиной 3 см. Для снижения эффекта отражения объектива ИК камеры в смеси клетки/носитель и детекции максимального количества теплового излучения объектив ИК камеры в установке располагают над образцом на высоте 13-15 см, камеру наклоняют во фронтальной плоскости под углом 10°. Предлагаемая установка проста в изготовлении, позволяет минимизировать колебания температуры окружающей среды до ≤1°С/час, снижает влияние ИК камеры, являющейся дополнительным источником тепла в помещении, на результаты тепловизионного анализа.
Способ и установка для определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток были апробированы при разработке биокатализаторов на основе углеводородокисляющих актинобактерий рода Rhodococcus для деградации гидрофобных поллютантов.
Конкретные примеры осуществления изобретения.
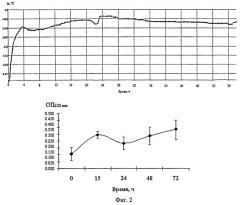
Пример 1. Определение времени иммобилизации актинобактерий рода Rhodococcus на твердой поверхности. Штамм Rhodococcus ruber ВКПМ AC-1900 выращивают в колбах Эрленмейера объемом 250 мл, содержащих 100 мл мясопептонного бульона, на орбитальном шейкере при 160 об/мин, 28°С в течение 24 ч. Полученную культуру центрифугируют при 4000 об/мин в течение 15 мин, супернатант удаляют декантированием, осадок клеток два раза промывают фосфатным буфером и ресуспендируют в этом же буфере до достижения концентрации клеток 108 колониеобразующих единиц (КОЕ)/мл. Суспензию и иммунологический 96-луночный полистирольный микропланшет (Медполимер, Санкт-Петербург) термостатируют в течение 20 мин, затем суспензию вносят в лунки планшета в объеме 100 мкл на одну лунку. Инокулированный планшет помещают в установку для определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток. С помощью ИК камеры, которую включают за 30-40 мин до начала анализа, снимают 96 фильмов подряд протяженностью 30 мин каждый. Получают график изменения температуры, который представлен на фиг.2 (верхний график). Из графика видно, что температура клеточной суспензии в процессе иммобилизации перестает существенно изменяться уже через 6 ч, через 24 ч выходит на стационарный уровень. Как видно из фиг.2, динамика адсорбции клеток родококков, полученная методом ИК термографии, совпадает с таковой, полученной одним из стандартных методов по окрашиванию прикрепленных клеток кристаллическим фиолетовым. Согласно данному методу, иммобилизованные клетки окрашивают 1% водным раствором кристаллического фиолетового в течение 20 мин, краситель экстрагируют из клеток с помощью смеси ацетон:этанол 1:4 по объему, интенсивность окрашивания полученного экстракта измеряют с помощью спектрофотометра при 630 нм (фиг.2, нижний график). По данным спектрофотометрии, адсорбция родококков на поверхности полистирола завершается в течение первых суток эксперимента, и в дальнейшем не происходит статически достоверного изменения числа адсорбированных бактериальных клеток. Таким образом, с применением тепловизионного способа и установки для определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток определено время иммобилизации живых клеток родококков на полистирольном носителе. Полученные данные могут быть использованы при разработке биокатализаторов на основе родококков, иммобилизованных на полистироле.
Пример 2. Определение оптимальной концентрации Rhodococcus-биосурфактанта для гидрофобизации носителей клеток родококков. Суспензию клеток Rhodococcus ruber ВКПМ AC-1900 получают согласно методике, описанной в примере 1. Лунки иммунологического 96-луночного полистирольного микропланшета (Медполимер, Санкт-Петербург) обрабатывают Rhodococcus-биосурфактантом, полученным из клеток R.ruber ИЭГМ 231, выращенных в присутствии н-додекана [12]. Для обработки полистирольного планшета биосурфактант растворяют в изопропаноле в концентрации 0,1, 1,0 или 10,0 мг/мл. Полученный раствор вносят в количестве 100 мкл на одну лунку, планшет подсушивают на воздухе в течение 24-48 ч для полного испарения изопропанола. Суспензию родококков и иммунологический 96-луночный полистирольный микропланшет (Медполимер, Санкт-Петербург) термостатируют в течение 20 мин. Суспензию вносят в лунки гадрофобизованного микропланшета в объеме 100 мкл на одну лунку. В часть лунок, обработанных Rhodococcus-биосурфактантом в концентрации 0,1 мг/мл, вносят по 100 мкл клеточной суспензии, подвергнутой кипячению в течение 10 мин (контроль) и также термостатированной. Контроль характеризуется теми же значениями теплоемкости и теплопроводности, что и суспензия живых клеток, однако в нем отсутствуют дополнительные источники тепла: не происходят процессы адсорбции и жизнедеятельности. Таким образом, это позволяет принимать изменения температуры, полученные в контроле, за фоновые значения. Инокулированный планшет помещают в установку для определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток. Снимают 16 фильмов подряд протяженностью 30 мин каждый, при этом ИК камеру включают за 30-40 мин до начала анализа. Получают динамику изменения температуры в лунках, вычисляют показатель прироста температуры Δt (°C) по сравнению с исходными значениями. Результаты представлены в табл.1. Максимальное значение Δt (3,849°C) и наибольшее количество прикрепленных клеток родококков (2,38·107 КОЕ/см2) выявлено для полистирольной поверхности, гидрофобизованной раствором биосурфактанта 0,1 мг/мл, что соответствует концентрации гидрофобизатора на самой поверхности 0,02 мг/см2. Показатели Δt и числа прикрепленных клеток в 1,5-4,5 раза превышают таковые для необработанной поверхности. При этом избыточное (1 и 10 мг/мл) нанесение Rhodococcus-биосурфактанта, на твердую поверхность приводит к значительному (в 1,6-2,9 раз) снижению числа прикрепленных клеток и их метаболической активности. Контрольный вариант опыта характеризуется минимальным повышением температуры. Таким образом, с помощью способа и установки для определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток найдено оптимальное количество Rhodococcus-биосурфактанта для гидрофобизации полистирольного носителя и усиления адгезивной активности углеводородокисляющих актинобактерий рода Rhodococcus.
Пример 3. Определение оптимальной концентрации бактериальных клеток в суспензии для эффективной иммобилизации родококков на полистироле. Суспензию клеток Rhodococcus ruber ВКПМ AC-1900 получают согласно методике, описанной в примере 1, за исключением того, что клетки ресуспендируют в буфере до достижения концентрации клеток 108, 109 или 1010 КОЕ/мл. Суспензию родококков и иммунологический 96-луночный полистирольный микропланшет (Медполимер, Санкт-Петербург) термостатируют в течение 20 мин. Суспензию вносят в лунки планшета в объеме 100 мкл на одну лунку. Инокулированный планшет помещают в установку для оценки эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток. Снимают 16 фильмов подряд протяженностью 30 мин каждый, при этом ИК камеру включают за 30-40 мин до начала анализа. Получают динамику изменения температуры в лунках, вычисляют показатель прироста температуры по сравнению с исходными значениями, по уравнению теплопроводности температуру переводят в значения количества тепла Q (Дж) и строят график изменения Q от времени. Результаты представлены в табл.2. Из табл.2 видно, что наибольшее (0,5266 Дж) количество тепла выделяется при иммобилизации 109 клеток/мл, при этом концентрация клеток на носителе в конце процесса иммобилизации составляет 2,5·107 КОЕ/см2. При использовании 1010 клеток/мл концентрация прикрепленных клеток достигает 10,5·107 КОЕ/см2, однако при этом выделяется в 2,5 раза меньше тепла. При меньшей (108 КОЕ/мл) концентрации клеток в суспензии на твердой поверхности закрепляется на 24% меньше клеток и выделяется на 10% меньше тепла. Полученные данные свидетельствуют о том, что наиболее эффективно иммобилизация происходит при использовании суспензии с концентрацией клеток родококков 108 или 109 КОЕ/мл.
Пример 4. Подбор режима гидрофобизации носителей на основе опилок древесных пород для иммобилизации родококков-деструкторов н-алканов. Суспензию клеток Rhodococcus ruber ВКПМ AC-1900 получают согласно методике, описанной в примере 1. В качестве адсорбентов клеток родококков используют целлюлозосодержащие материалы на основе древесных опилок, гидрофобизованных с помощью Rhodococcus-биосурфактанта, олифы в разных концентрациях или н-гексадекана. Стерильные опилки древесных пород смешивают с клеточной суспензией или буфером в соотношении 1:25 по весу на орбитальном шейкере при 130 об/мин, комнатной температуре в течение 48 ч. Водную фазу удаляют декантированием, носители с иммобилизованными клетками родококков (биокатализаторы) и неинокулированные носители два раза промывают фосфатным буфером в объеме, соответствующем соотношению носитель:буфер 1:12 по объему, остатки влаги удаляют фильтровальной бумагой, биокатализаторы и неинокулированные носители термостатируют в течение 20 мин и помещают в установку для оценки эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток, при этом ИК камеру включают за 30-40 мин до начала анализа. Проводят инфракрасное сканирование поверхностей биокатализаторов и носителей, получают распределение температур на отсканированных поверхностях и вычисляют разницу температур между поверхностью биокатализатора и неинокулированного носителя. Результаты сравнительного анализа представлены в табл.3. Из табл.3 видно, что наиболее оптимальные условия для иммобилизации живых клеток родококков достигаются при использовании носителей на основе опилок древесных пород, гидрофобизованных с помощью олифы в объемном соотношении опилки:олифа 1:0,2 или Rhodococcus-биосурфактанта. Для данных носителей характерно наиболее равномерное распределение активности, что выражается в однородном распределении температур на твердой поверхности, максимальные (Δt=2,97-3,14°C) показатели прироста температуры и наиболее высокая (11-19 мг окисленного н-додекана/мг сухих клеток) углеводородокисляющая активность иммобилизованных клеток. При этом показано, что оптимальная концентрация клеток на носителе, обеспечивающая их максимальную каталитическую активность, составляет 1,1·107-1,4·107 клеток/см2. Выявлено, что при иммобилизации родококков на поверхности опилок древесных пород, гидрофобизованных н-гексадеканом или олифой в объемном соотношении опилки:олифа 1:1,5, наблюдается неоднородность распределения активности, уменьшение теплового эффекта (Δt=1,38-2,29°С) и снижение функциональной активности иммобилизованных клеток родококков (≤8 мг окисленного н-додекана/мг сухих клеток). Таким образом, с помощью способа и установки для определения эффективности адсорбционной иммобилизации микроорганизмов и мониторинга функционального состояния биокатализаторов на основе иммобилизованных микробных клеток подобран режим гидрофобизации поверхности носителей на основе опилок древесных пород для иммобилизации актинобактерий рода Rhodococcus при разработке биокатализаторов для деградации нефтяных алканов.
Пример 5. Получение эффективного устойчивого биокатализатора для деградации н-гексадекана и биодеградации н-гексадекана. Процедуру иммобилизации, подготовку биокатализатора и носителя, термостатирование и инфракрасное сканирование проводят, как описано в примере 4, за исключением того, что в качестве носителя клеток родококков используют древесные опилки, гидрофобизованные Rhodococcus-биосурфактантом в объемном соотношении опилки:биосурфактант 1:0,1. Разница температур Δt между поверхностью биокатализатора и неинокулированного носителя составляет (2,77±0,73)°С. Биодеградацию н-гексадекана проводят в колбах Эрленмейера, содержащих 100 мл минеральной среды К с 3 об.% н-гексадекана и 2 г биокатализатора, на орбитальном шейкере (160 об/мин) при 28°С в течение 10 сут. Количество остаточного н-гексадекана опреде