Способ определения эндотелиальных микрочастиц в крови человека
Иллюстрации
Показать всеНастоящее изобретение относится к медицине и описывает способ определения эндотелиальных микрочастиц (ЭМЧ) в крови человека, отличающийся тем, что в образцах периферической крови определяют концентрацию эритроцитов в 1 мкл, затем образцы крови окрашивают смесью меченных разными флуорохромами моноклональных антител к CD31 и CD41a, в окрашенные образцы добавляют микросферы стандартного размера, полученную смесь анализируют с помощью проточной цитометрии и выявляют распределение содержащихся элементов смеси, при этом ЭМЧ идентифицируют по иммунофенотипу CD31+CD41a- по величине прямого светорассеяния, пропорционального физическим размерам элементов смеси, выделяют размеры ЭМЧ менее 2 мкм и определяют их концентрацию в 1 мкл крови по соотношению Сэмч=Cэ*R4/R1, где Сэ - концентрация эритроцитов в 1 мкл крови, R4 - количество выявленных ЭМЧ, R1 - количество выявленных эритроцитов. Способ обеспечивает повышение точности определения концентрации ЭМЧ. 2 табл., 3 пр., 4 ил.
Реферат
Изобретение относится к области медицины, точнее, к области лабораторных исследований, конкретно к проточно-цитометрическому способу определения концентрации микрочастиц эндотелиального происхождения в периферической крови человека для оценки риска развития, диагностики и прогнозирования течения сердечно-сосудистых заболеваний (ССЗ).
По данным Всемирной организации здравоохранения ССЗ являются основной причиной смертности населения в мире. В современной кардиологии существует множество способов выявления ССЗ или предрасположенности к ним. Это традиционные электрокардиографические, ультразвуковые, ангиографические методы, различные виды томографии и прочие. Лабораторные методы анализа также имеют существенное значение для оценки риска возникновения, диагностики и прогнозирования течения ССЗ. Один из таких методов заключается в подсчете количества микрочастиц, образующихся при гибели эндотелиальных клеток, что позволяет оценивать поврежденность кровеносных сосудов [1].
Микрочастицы представляют собой мембранные пузырьки диаметром около 1,5 микрометра. Микрочастицы гетерогенны по размеру, а также по фосфолипидному и белковому составу. Они образуются в процессе клеточной активации и (или) апоптоза [2]. Активация, ведущая к образованию микрочастиц, может быть вызвана различными веществами, обладающими сродством к специфическим рецепторам. К таким веществам относят бактериальные липополисахариды, фактор некроза опухоли-α, интерлейкин-1, перекись водорода. В результате воздействия происходит нарушение целостности цитокелета и образование микрочастиц. Апоптоз характеризуется уменьшением размера клетки, фрагментацией ДНК и образованием апоптотических телец, ограниченных плазматической мембраной. Образованные апоптотические тельца являются микрочастицами. Стоит отметить, что такие микрочастицы могут содержать фрагментированную ДНК [15]. Микрочастицы сохраняют некоторые специфические маркеры, которые указывают на те типы клеток, от которых они произошли. Различают несколько разновидностей микрочастиц по происхождению: тромбоцитарные (около 90%), гранулоцитарные (менее 10%), эндотелиальные, эритроцитарные и моноцитарные (менее 5%). Согласно данным литературы [3, 4, 5], именно последние являются маркером многих заболеваний, в том числе и ССЗ. Показана их связь с сосудистыми нарушениями [4], церебральной дисфункцией при малярии [6], гемофилией [7], тромбоцитозом [2], ишемической болезнью сердца [8], острым коронарным синдромом [9], инфарктом миокарда [10, 11].
Известен способ определения эндотелиальных микрочастиц (ЭМЧ) - [4], в соответствии с которым образцы венозной крови объемом 20 мл, взятые из периферической вены, хранились 2 часа. Затем образцы подвергались центрифугированию при 270 g в течение 20 минут с целью отделения плазмы, содержащей тромбоциты и микрочастицы. Затем, образцы центрифугировали 20 минут при 1500 g, что, по утверждению авторов, позволяло получить свободную от тромбоцитов плазму. Далее свободную от тромбоцитов плазму подвергали трехкратному центрифугированию при 21000 g. После стандартных процедур окрашивания с помощью антител, меченных флуорохромами, авторы анализировали образцы на проточном цитометре без предварительного отмывания от несвязавшихся антител. Результаты представляли в виде концентрации микрочастиц на 1 мкл плазмы.
Недостаток способа заключается в том, что необходимо использовать дорогостоящие высокоскоростные центрифуги. Очевидно, что многочисленные этапы центрифугирования ведут к потерям микрочастиц, поэтому можно полагать, что точность определения концентрации микрочастиц невысока. Кроме того, для анализа необходим большой объем крови - 20 мл.
Известен способ определения ЭМЧ - [12], включающий центрифугирование 3 мл крови в течение 10 минут при 1500 g для получения плазмы, хранение образцов (срок не указан), повторное центрифугирование при 1500 g в течение 5 минут непосредственно перед анализом и дальнейшее центрифугирование в течение 20 минут при 100000 g. Затем образцы инкубировали с антителами к CD 144 для выявления эндотелиальных микрочастиц. Стоит также отметить, что при выполнении данного метода после окрашивания применяли отмывку образцов от несвязавшихся антител дважды при 100000 g. Анализ проводили на проточном цитометре строго в течение 1 минуты. Данные представляли в виде концентрации микрочастиц на 1 мл плазмы.
Недостатки способа заключаются в том, что на множестве этапов центрифугирования возможна потеря большого количества микрочастиц. При таких высоких механических нагрузках не исключено разрушение части микрочастиц, что может привести к изменению их количества. Не стоит также забывать, что стоимость центрифуг, рабочий диапазон которых доходит до 100000 g, очень высока, что существенно затрудняет широкое использование способа во многих лабораториях.
Прототипом рассматриваемого изобретения является следующий способ определения ЭМЧ [8]. В прототипе плазму крови (10 мл), подвергали центрифугированию при 13000 g в течение 2 минут с целью удаления большей части тромбоцитов. В результате получали обедненную тромбоцитами плазму. Микрочастицы в обедненной тромбоцитами плазме окрашивали антителами к CD31, меченными фикоэритрином (phycoerythrin - PE), и анексином-V, меченным флуоресцеинизотиоционатом (fluorescein isothyocyanate - FITC). Полученные образцы анализировали на проточном цитометре. Концентрация эндотелиальных микрочастиц, идентифицированных по фенотипу CD31+Аннексин+, была рассчитана на единицу объема обедненной тромбоцитами плазмы.
К недостаткам способа относятся: значительная потеря микрочастиц на этапе центрифугирования и использование большого объема крови, необходимого для анализа.
Таким образом, несмотря на потенциально высокую практическую значимость применения показателя концентрации ЭМЧ, до настоящего времени не разработан точный способ его определения в периферической крови. Об этом свидетельствует тот факт, что концентрация ЭМЧ в крови здоровых лиц различается в несколько тысяч раз по данным цитированных выше авторов. Отсутствие точного метода, большой объем крови, необходимый для анализа, использование высокоскоростных центрифуг сильно затрудняют широкое использование этого показателя.
Технический результат заявленного изобретения заключается в повышении точности определения концентрации ЭМЧ.
Опирясь на собственный опыт в исследовании тромбоцитов и циркулирующих эндотелиальных клеток, было сделано предположение и доказано, что концентрацию ЭМЧ можно определить без использования центрифугирования. Вместо центрифугирования функцию идентификации ЭМЧ выполняют новый способ пробоподготовки и новый алгоритм обработки цифровых данных, полученных на проточном цитометре.
Известно, что белковый маркер CD31 экспрессируется на поверхности тромбоцитов, эндотелиальных клеток и микрочастиц [3, 8, 13, 14], CD41a - на поверхности тромбоцитов [2, 4, 6]. Таким образом, иммунофенотип CD31+CD41- характерен для эндотелиальных микрочастиц. Наличие указанных маркеров может быть выявлено с помощью иммунофлуоресцентной реакции с соответствующими антителами и последующего анализа с использованием проточной цитометрии или флуоресцентной микроскопии.
Сущность изобретения заключается в новом способе подготовки образцов цельной крови человека для анализа с помощью проточной цитометрии, новом алгоритме идентификации и определения концентрации ЭМЧ. В образцах крови, взятой из локтевой вены, определяют концентрацию эритроцитов в 1 мкл. Затем образцы крови окрашивают смесью моноклональных антител к CD31 и CD41a, меченных разными флуорохромами. В окрашенные образцы добавляют микросферы стандартного размера. Полученную смесь анализируют с помощью проточной цитометрии и выявляют распределение содержащихся элементов смеси. ЭМЧ идентифицируют по иммунофенотипу CD31+CD41a-, низкой интенсивности бокового и прямого светорассеяния (меньше, чем у калибровочных микросфер). По величине прямого светорассеяния, пропорционального физическим размерам элементов смеси, выделяют размеры ЭМЧ менее 2 мкм. Эритроциты идентифицируют по высокой интенсивности бокового и прямого светорассеяния. По соотношению эритроцитов (концентрация которых известна) и ЭМЧ определяют концентрацию последних в 1 мкл крови.
Перечень фигур
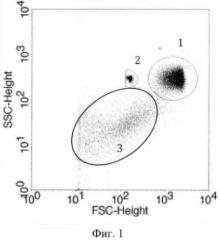
Фиг.1 - график распределения клеток и частиц по интенсивности прямого светорассеяния (forward scatter - FSC) и бокового светорассеяния (side scatter - SSC). 1 - эритроциты - регион R1 (область исследования); 2 - микросферы - регион R2 (область исследования); 3 - тромбоциты и микрочастицы.
Фиг.2 - график распределения клеток и частиц по интенсивности флуоресценции FITC (CD31) и PE (CD41a). 4 - тромбоциты CD31+CD41+; 5 - CD31+CD41- - регион R3 (область исследования).
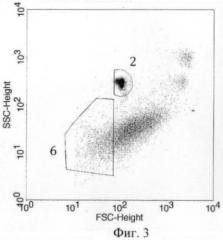
Фиг.3 - график распределения по интенсивности FSC и SSC всех событий из регионов R2 и R3. 2 - микросферы - регион R2, 6 - эндотелиальные микрочастицы - регион R4 (область исследования).
Фиг.4 - фотографии отсортированных микрочастиц, полученные на лазерном сканирующем микроскопе Leica SPE. 7 - флуоресценция микрочастиц в канале FITC (CD31), 8 - флуоресценция микрочастиц в канале PE (CD41a).
Способ осуществляют следующим образом:
1. образцы крови забирают из локтевой вены в стандартные пробирки Becton Dickinson (BD) Vacutainer NH 170 I.U. (USA), содержащие гепарин. Образцы анализируют немедленно или хранят при комнатной температуре не более 2,5 ч;
2. определяют концентрацию эритроцитов в 1 мкл крови при помощи камеры Горяева (Сэ);
3. 5 мкл крови смешивают в пробирке с 1 мкл моноклональных антител к CD31, меченных FITC (BD-Pharmingen), и 1 мкл моноклональных антител к CD41a, меченных PE (BD-Pharmingen);
4. полученную смесь инкубируют в течение 15 минут при комнатной температуре и разбавляют 500 мкл 0,01М фосфатного буферного раствора (phosphate buffer saline - PBS) (pH=7,2-7,4);
5. из разбавленной смеси отбирают 200 мкл и смешивают с 200 мкл PBS в отдельной пробирке;
6. в полученную суспензию добавляют коммерческие микросферы Flow Check High Intensity Green Alignment (Polysciences, Inc., USA) с диаметром 2 мкм в конечной концентрации от 20 до 100 микросфер/мкл;
7. анализ элементов полученной суспензии проводят с помощью проточного цитофлуориметра FACS Vantage (BD, USA), оборудованного 488 нм лазером (Spectra-Physics, USA), или прибора любой другой марки с нужными техническими характеристиками. Анализ клеток и микрочастиц в образце проводят по четырем параметрам: интенсивности FSC и SSC (логарифмическая шкала), флуоресценции FITC и РЕ (логарифмическая шкала). Для измерения флуоресценции РЕ используют узкополосный фильтр 575/26 нм, FITC - 530/30 нм. Полученные результаты записывают в цифровом виде. Для обеспечения достоверности результатов регистрируют от 1,5×106 до 2,0×106 событий в каждом образце;
8. компьютерную обработку зарегистрированных событий начинают с построения графика распределения клеток и частиц по интенсивности FSC и SSC (фиг.1). На графике выделяют области исследования: регион эритроцитов (R1) и регион микросфер (R2). Определяют количество событий в регионе R1;
9. строят график распределения клеток и частиц по интенсивности флуоресценции FITC (CD31) и PE (CD41a). Выделяют события с иммунофенотипом CD31+CD41a- в регионе R3 (фиг.2);
10. для событий из регионов R2 и R3 строят график распределения по интенсивности FSC и SSC (фиг.3). Согласно данным литературы, микрочастицы эндотелиального происхождения имеют диаметр в среднем около 1,5 мкм. Учитывая, что интенсивность FSC соответствует физическим размерам элементов смеси, добавление микросфер диаметром 2 мкм, позволяет разделить события по заданному размеру. На графике (фиг.3) строят регион R4 для событий размером меньше 2 мкм (правая граница региона R4 располагается слева от микросфер). События, попадающие в регион R4, являются эндотелиальными микрочастицами, поскольку имеют характерный иммунофенотип CD31+CD41a- и размеры, соответствующие данным литературы;
11. определяют количество событий в регионе R4. Данное количество соответствует количеству проанализированных эндотелиальных микрочастиц;
12. по соотношению Сэмч=Сэ*R4/R1 определяют концентрацию ЭМЧ (Сэмч) в 1 мкл крови. Здесь Сэ - концентрация эритроцитов в 1 мкл крови, R4 и R1 - количество событий в соответствующих регионах.
Примеры реализации способа
Пример 1
Сравнение количества ЭМЧ, выявляемых в соответствии с методикой заявленного изобретения или прототипа.
Кровь 3-х здоровых доноров забирали из локтевой вены, как описано выше, и разделяли на 2 части - 5 мкл и 1 мл.
В образце объемом 5 мкл определяли концентрацию ЭМЧ в 1 мкл крови в соответствии с заявляемой методикой, подробно описанной выше.
В образце объемом 1 мл определяли концентрацию ЭМЧ в 1 мкл плазмы в соответствии с методикой прототипа, а затем пересчитывали концентрацию на 1 мкл крови.
Полученные результаты представлены в таблице 1.
| Таблица 1 | ||
| № образца | Концентрация ЭМЧ в 1 мкл крови (изобретение) | Концентрация ЭМЧ в 1 мкл крови (прототип) |
| 1 | 2108,7 | 102,2 |
| 2 | 1508,4 | 102,1 |
| 3 | 1178,9 | 86,3 |
| среднее±SЕ | 1597,7±272,1 | 96,9±5,3 |
Как следует из таблицы, заявленный в изобретении способ позволяет избежать значительных потерь микрочастиц и обнаружить ЭМЧ в количестве, превосходящем более чем в 10 раз результаты, получаемые при использовании прототипа.
Пример 2
Результат иммуноморфологического анализа отсортированных микрочастиц ЭМЧ, идентифицированные в соответствии с заявляемой методикой, подробно описанной выше, сортировали с помощью проточного цитофлуориметра FACS Vantage на предметные стекла и анализировали на лазерном сканирующем микроскопе TCS SPE DMI 4000 (Leica, USA). При микроскопировании использовали лазер с длиной волны 488 нм. Для измерения флуоресценции PE оценивали спектр испускания в диапазоне от 550 до 600 нм (в данном диапазоне находится около 90% от всей флуоресценции PE), FITC - от 500 до 550 нм (в данном диапазоне находится около 90% от всей флюоресценции FITC).
Как видно на фиг.4, отсортированные микрочастицы экспрессируют CD31 и не экспрессируют CD41a, а также имеют размер около 1 мкм, что действительно соответствует характеристике ЭМЧ, известной из данных литературы [2, 3, 4, 5, 6].
Пример 3
Сравнение концентрации ЭМЧ у здоровых доноров и больных ССЗ
Проведено сравнительное исследование концентрации ЭМЧ по методике, подробно описанной выше, в группах больных ССЗ и здоровых доноров.
Обследовано 6 мужчин в возрасте от 47 до 60 лет, имеющих заболевания сердечнососудистой системы, такие как ишемическая болезнь сердца, гипертоническая болезнь, мультифокальный атеросклероз. Диагноз выставлен на основании жалоб, анамнеза, данных осмотра, лабораторных и инструментальных исследований (эхокардиография, ультразвуковая допплерография магистральных артерий головы и сосудов нижних конечностей, рентгенография сердца, однофотонная эмиссионная компьютерная томография миокарда).
При комплексном обследовании выявлялось повышение уровня холестерина и липопротеинов низкой плотности; признаки атеросклероза аорты, сонных артерий, сосудов глазного дна; ишемия миокарда при проведении электрокардиографии, тредмил-теста, однофотонной эмиссионной компьютерной томографии миокарда.
Контрольную группу составили 22 здоровых донора сходного возраста.
Полученные результаты свидетельствуют о статистически значимом увеличении концентрации ЭМЧ в крови больных по сравнению с таковой у здоровых лиц (таблица 2).
| Таблица 2 | ||
| Здоровые доноры (N=22) | Больные (N=6) | |
| Медиана концентрации ЭМЧ в 1 мкл крови (квартили) | 2417,9 | 12014,1 |
| (1476,9-5274,7) | (8268,0-27617,1)* | |
| * статистически значимые различия с донорской группой (p=0,001 по U-критерию Манна-Уитни) |
Подтверждение достижения технического результата
Сравнение результатов определения концентрации ЭМЧ по предлагаемому способу и прототипу показывает значительные потери ЭМЧ во втором случае, подтверждая тем самым более высокую точность предлагаемого способа (пример 1). Иммуноморфологическая верификация ЭМЧ, идентифицированных с помощью предлагаемого способа, выполнена в примере 2. Пример 3 доказывает, что концентрация ЭМЧ, определенная предлагаемым способом, значительно выше у больных сердечно-сосудистыми заболеваниями по сравнению со здоровыми лицами.
Способ определения эндотелиальных микрочастиц (ЭМЧ) в крови человека, отличающийся тем, что в образцах периферической крови определяют концентрацию эритроцитов в 1 мкл, затем образцы крови окрашивают смесью меченных разными флуорохромами моноклональных антител к CD31 и CD41a, в окрашенные образцы добавляют микросферы стандартного размера, полученную смесь анализируют с помощью проточной цитометрии и выявляют распределение содержащихся элементов смеси, при этом ЭМЧ идентифицируют по иммунофенотипу CD31+CD41a-, по величине прямого светорассеяния, пропорционального физическим размерам элементов смеси, выделяют размеры ЭМЧ менее 2 мкм и определяют их концентрацию в 1 мкл крови по соотношению Сэмч=Сэ·R4/R1, где Сэ - концентрация эритроцитов в 1 мкл крови, R4 - количество выявленных ЭМЧ, R1 - количество выявленных эритроцитов.