Исследование n-гликанов с использованием экзогликозидаз
Иллюстрации
Показать всеНастоящее изобретение относится к способам анализа структуры и/или композиции гликанов. Способы включают расщепление препарата гликанов с помощью многочисленных экзогликозидаз. В некоторых вариантах осуществления изобретения гликаны обрабатывают с помощью многочисленных экзогликозидаз одновременно и последовательно с дальнейшим сравнением характеристик образованных продуктов расщепления. В некоторых вариантах осуществления способы по настоящему изобретению включают сравнение продуктов расщепления N-гликанов, которые были расщеплены с помощью многочисленных экзогликозидаз одновременно, с N-гликанами, которые были расщеплены многочисленными экзогликозидазами последовательно. 5 н. и 19 з.п. ф-лы, 6 табл., 9 ил., 6 пр.
Реферат
Перекрестная ссылка на связанные заявки
По настоящей заявке испрашивается приоритет предварительной заявки Соединенных Штатов, серийный номер 60/923,688, поданной 16 апреля 2007 года, полное содержание которой включено в настоящий документ в качестве ссылки.
Уровень техники
Характер гликозилирования гликопротеина часто играет важную роль в его функции. При рассмотрении лишь нескольких примеров видно, что характер гликозилирования гликопротеина может влиять на способность его молекул правильно складываться, на его устойчивость (например, устойчивость к протеолитическому и/или другому виду расщепления), каталитическую активность, фармакодинамические и/или фармакокинетические свойства и/или на способность гликопротеина должным образом взаимодействовать с другими молекулами. Альтернативно или дополнительно, характер гликозилирования гликопротеина может влиять на перенос и нацеливание гликопротеина. Например, характер гликозилирования гликопротеина может влиять на то, останется ли гликопротеин внутриклеточным (в том числе, например, правильное нацеливание гликопротеина в надлежащие субклеточный компартмент или компартменты), будет ли он мембранно-связанным и/или секретируемым из клетки.
Современные способы часто не в состоянии обнаружить те виды гликанов, которые присутствуют на низких уровнях популяции гликанов. Основные виды гликанов могут препятствовать обнаружению и идентификации видов тех гликанов, которые присутствуют на низких уровнях. Более того, современные способы обычно не могут дать точное количественное определение относительных уровней отдельных видов гликанов в пределах их популяции. Современные способы могут оказаться не в состоянии обнаружить нестандартные связи в пределах популяции гликанов. Соответственно, существует необходимость в способах обнаружения гликанов, которые присутствуют на низких уровнях популяции гликанов. Нужны способы количественного определения относительных уровней отдельных видов гликанов в их популяции.
Сущность изобретения
В настоящем описании раскрыты способы анализа композиции и/или структуры N-связанных гликанов. Способы, описанные в настоящем изобретении, можно использовать для анализа препарата N-гликанов (например, смеси N-гликанов) и для измерения относительных уровней в препарате специфических структурных групп и/или необычных модификаций (например, коровая или антеннальная фукоза, продукты удлинения фрагментом лактозамина, манноза высокого уровня и гибридные гликаны, продукты сульфатирования и фосфорилирования). Способы, описанные в изобретении, обычно могут включать стадии получения препарата N-гликана; расщепления N-связанных гликанов ферментами экзогликозидазы для отделения особым образом моносахаридов из невосстанавливающихся концевых участков и для анализа продуктов расщепления. Сравнение результатов множественных обработок с использованием ферментов экзогликозидазы (например, одновременные и последовательные различные обработки) может обеспечить получение удивительной информации о структуре гликанов, например, идентифицировать те виды гликанов, которые присутствуют на очень низких уровнях в препарате N-гликанов.
Препарат гликана можно получить любым доступным способом, известным из уровня техники. В общем случае получение препарата N-гликана включает стадии (1) получения препарата гликопротеина или другого гликоконъюгата и (2) получения препарата N-гликана из препарата гликоконъюгата. Препарат гликоконъюгата (например, гликопротеин) может быть получен из любого источника, включая, но ими не ограничиваясь, медицинские препараты, доступные в продаже биологические продукты и биологические образцы.
В некоторых вариантах изобретения препарат N-гликана получают с помощью популяции гликопротеинов и удаления N-гликанов из гликопротеинов, входящих в популяцию гликопротеинов. В некоторых вариантах осуществления изобретения N-гликаны могут быть объединены с обнаруживаемой меткой (например, с флуоресцентным и/или радиоактивным соединением).
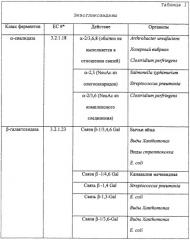
В некоторых вариантах осуществления изобретения популяции N-гликанов расщепляются с использованием одной или нескольких экзогликозидаз, после чего осуществляют анализ структуры и/или композиции продуктов расщепления. В некоторых вариантах осуществления изобретения экзогликозидазы, используемые по настоящему изобретению, распознают и расщепляют только один определенный тип гликозидной связи. В некоторых вариантах осуществления изобретения экзогликозидазы по настоящему изобретению распознают и расщепляют несколько определенных типов гликозидной связи. Показательные типы экзогликозидазы, которые можно использовать в настоящем изобретении, включают, но ими не ограничиваются, салидазу, галактозидазу, гексозаминидазу, фукозидазу и маннозидазу.
Согласно настоящему изобретению популяция N-гликана может расщепляться любой экзогликозидазой. В определенных вариантах осуществления изобретения N-гликаны могут расщепляться при подвергании популяции N-гликанов воздействию множества экзогликозидаз. Например, популяция N-гликанов может быть подвергнута воздействию 2, 3, 4, 5, 6, 7, 8, 9, 10 или более экзогликозидаз. В некоторых вариантах осуществления изобретения множество экзогликозидаз вводят одновременно. В некоторых вариантах осуществления изобретения множество экзогликозидаз вводят последовательно. В некоторых вариантах осуществления изобретения изменение идентичности введенных экзогликозидаз выявляет информацию о структуре и/или композиции N-гликанов. В некоторых вариантах осуществления изобретения изменение последовательности введения множества экзогликозидаз выявляет информацию о структуре и/или композиции N-гликанов.
В некоторых вариантах осуществления изобретения последовательное расщепление с помощью множества экзогликозидаз выявляет информацию о структуре и/или композиции N-гликанов, которая отличается от информации, выявленной в результате расщепления с помощью одновременного введения этого же набора экзогликозидаз. В некоторых вариантах осуществления изобретения последовательное расщепление с помощью множества экзогликозидаз выявляет информацию о структуре и/или композиции N-гликанов, которая оказывается аналогичной информации, выявленной при одновременном расщеплении с помощью того самого набора экзогликозидаз.
В некоторых вариантах осуществления изобретения, если обработка с помощью экзогликозидазы была полностью завершена, то выполняется анализ структуры и/или идентичности расщепленных гликанов. В некоторых вариантах осуществления изобретения по меньшей мере один образец может быть удален из препарата гликана в процессе обработки с помощью экзогликозидазы (например, в любой момент времени до завершения обработки с помощью экзогликозидазы). В некоторых вариантах осуществления изобретения выполняется анализ структур и/или идентичностей расщепленных гликанов по меньшей мере в одном из отделенных образцов. В некоторых вариантах осуществления изобретения стадия анализа включает сравнение структуры и/или функции расщепленных гликанов из одного или нескольких отделенных образцов со структурой и/или функцией расщепленных гликанов из по меньшей мере одного другого отделенного образца. В некоторых вариантах осуществления изобретения стадия проведения анализа включает сравнение структуры и/или функции расщепленных гликанов из одного или нескольких отделенных образцов со структурой и/или функцией расщепленных гликанов эталонного образца.
Структуру и композицию расщепленных N-гликанов можно проанализировать любым доступным способом (например, способами хроматографии, масс-спектрометрии, ядерно-магнитного резонанса, капиллярного электрофореза и т.д.). В некоторых вариантах осуществления изобретения способы, описанные в настоящем описании, позволяют обнаружить виды N-гликана, которые присутствуют на низких уровнях в пределах популяции N-гликанов. Например, согласно настоящему изобретению, способы, описанные в описании, позволяют обнаружить виды N-гликана, уровень которых составляет менее 10%, менее 5%, менее 4%, менее 3%, менее 2%, менее 1,5%, менее 1%, менее 0,75%, менее 0,5%, менее 0,25% или менее чем 0,1% в популяции N-гликанов.
В некоторых вариантах осуществления изобретения описанные способы позволяют обнаружить особые связи, которые присутствуют на низких уровнях в популяции N-гликанов. Например, согласно настоящему изобретению, описанные способы позволяют обнаружить определенные связи, которые присутствуют на уровнях, составляя менее 10%, менее 5%, менее 4%, менее 3%, менее 2%, менее 1,5%, менее 1%, менее 0,75%, менее 0,5%, менее 0,25%, менее 0,1%, менее 0,075%, менее 0,05%, 0,025% или менее чем 0,01% в популяции N-гликанов.
В некоторых вариантах осуществления изобретения описанные способы позволяют обнаружить относительные уровни отдельных видов N-гликана в популяции N-гликанов. Например, область под каждым пиком, полученным на жидкостном хроматографе, может быть измерена и выражена в виде процента от целого. Такой анализ обеспечивает определение относительного процентного количества каждого вида N-гликана в популяции N-гликанов.
В некоторых вариантах осуществления изобретения описанные способы можно использовать для анализа характера гликозилирования гликопротеинов, которые используют в качестве терапевтических средств (например, интерфероны, колоние-стимулирующие факторы, факторы свертывания крови и т.д.). Средним специалистам в данной области следует обратить внимание на тот факт, что характер гликозилирования таких лечебных гликопротеиновых средств потенциально может влиять на их терапевтические свойства. По существу важно в точности исследовать характер гликозилирования представленного и представляющего интерес гликопротеина. В определенных вариантах осуществления изобретения способы по изобретению могут использоваться для точного анализа характера гликозилирования такого терапевтического гликопротеина.
В определенных вариантах осуществления изобретения представляющий интерес лечебный гликопротеин создается в клетке и выделяется из нее после получения. Для прогнозирования характера гликозилирования такого выделенного лечебного гликопротеина можно использовать способы по изобретению.
В некоторых вариантах осуществления изобретения способы по изобретению можно использовать для мониторинга характера гликозилирования гликопротеинов в процессе их образования клетками. Например, получение гликопротеина (например, коммерческое производство) может включать стадии (1) выращивания клеток, которые продуцируют гликопротеин, (2) получение образцов через постоянные или непостоянные промежутки времени в процессе культивирования клеток и (3) анализа характера гликозилирования выращенных гликопротеинов в каждом полученном образце. Кроме того, в некоторых вариантах осуществления изобретения такие способы могут дополнительно включать стадию сравнения характера гликозилирования полученных гликопротеинов для каждого полученного образца с характером другого образца. В некоторых вариантах осуществления изобретения такие способы могут дополнительно включать стадию сравнения характера гликозилирования полученных гликопротеинов для каждого полученного образца с характером гликозилирования эталонного образца.
В определенных вариантах осуществления изобретения представляющим интерес лечебным гликопротеином является доступный на рынке гликопротеин (например, антитела, полипептиды, интерлейкины, аналоги рецепторов, антагонисты рецепторов и т.д., и/или их характерные дозы, которые используются для лечения болезни, укрепления физического состояния или подавления душевного расстройства). Для определения характера гликозилирования таких доступных в продаже гликопротеинов можно использовать способы по изобретению.
Краткое описание фигур
Фигура 1: Иллюстративные структуры N-гликанов.
Фигура 2: Смесь 2AB-меченных N-гликанов подверглась обработке с использованием ферментов сиалидазы, галактозидазы, гексозаминидазы и фукозидазы. Образцы были внесены в колонку с амидной фазой и элюированы с помощью обычной фазовой хроматографии. (A) Смесь N-гликанов разделена в колонке с амидной фазой. (B) Получение N-гликанов после их постадийной обработки ферментами. Как показано на хроматограмме, растянутые лактозамином гликаны не полностью расщепляются до M3N2 в результате этой обработки. Идентичность пиков была подтверждена с помощью масс-спектрометрии с лазерной ионизацией и десорбцией из матрицы (MALDI-MS).
Фигура 3: Хроматограмма смеси N-гликанов после полного расщепления смеси за счет одновременной обработки такими ферментами как сиалидаза, галактозидаза, гексозаминидаза и фукозидаза. Образцы были внесены в колонку с амидной фазой и элюированы с помощью обычной фазовой хроматографии. Вставка: крупный план хроматограммы, на получение которой ушло примерно 30-70 минут, отмасштабирован до визуального отображения пиков меньшего размера.
Фигура 4: Иллюстративная популяция N-гликанов, которая последовательно расщепляется сиалидазой, галактозидазой, гексозаминидазой и фукозидазой широкой специфичности (обработка Rx05-C). Показана популяция различных продуктов расщепления.
Фигура 5: Сравнение продуктов расщепления, полученных в результате последовательного (слева) и одновременного (справа) расщепления популяции гликанов (представленной двумя гликанами, показанными в верхней части фигуры) с помощью α-2/3,6,8,9-сиалидазы, β-1/3,4,6-галактозидазы и β-1,4-гексозаминидазы. Одновременное расщепление приводит к получению того же самого продукта реакции (ядра маннозы) для обоих гликанов из популяции гликанов. Последовательное расщепление приводит к получению двух различных продуктов расщепления. В этом примере показано, как последовательное расщепление может выявить информацию, которую нельзя получить по результатам одновременного расщепления.
Фигура 6: Фукозилирование (представленное треугольником) компонента glcNAc (квадраты) делает гексозаминидазу неспособной к расщеплению конечной glcNAc (нуклеиновой кислоты гликана). На этой фигуре показаны два вида гликанов - один с антеннально фукозилированным компонентом glcNAc (справа), а второй без этого компонента (слева). После расщепления с помощью сиалидазы, галактозидазы и гексозаминидазы виды гликанов, указанные с левой стороны, расщепляются до своего ядра маннозы. В противоположность этому фукозилированный компонент glcNAc не может быть расщеплен в результате идентичной обработки с использованием экзогликозидазы.
Фигура 7: Одновременная и последовательная обработка с использованием экзогликозидазы для выявления гибридных и полилактозаминных структур. Смеси гликанов были обработаны с использованием экзогликозидазы и помечены. Сравнение структур гликанов, которые остаются после сравнительного проведения одновременного и последовательного расщепления, проиллюстрировано с помощью высокоэффективной жидкостной хроматографии - ВЭЖХ (А). Препараты гликанов были одновременно или последовательно обработаны с помощью сиалидазы, галактозидазы (верхний график), сиалидазы, галактозидазы и гексозаминидазы (средний график) или сиалидазы, галактозидазы, гексозаминидазы и фукозидазы (нижний график). Сравнение структур гликанов, которые остаются после сравнительного проведения одновременного и последовательного расщепления, проиллюстрировано с помощью масс-спектрометрии (MS) (В). Полилактозаминные структуры, которые остаются после последовательного расщепления, помечены как на ВЭЖХ-хроматограмме, так и на соответствующей MS-спектрограмме.
Фигура 8: Быстрая идентификация гликанов, содержащих полилактозамин, с помощью непосредственного сравнения хроматограмм, получены в результате последовательной и одновременной обработки ферментами одинакового образца гликана. Для ферментных реакций были использованы сиалидаза, галактозидаза, гексозаминидаза и фукозидаза. Последовательная и одновременная обработки указаны стрелками.
Фигура 9: Быстрая идентификация гликанов, содержащих полилактозамин, с помощью непосредственного сравнения спектров, полученных с помощью MALDI-MS в результате последовательной (верхний график) и одновременной (нижний график) ферментных обработок того же самого образца гликана. Для ферментных реакций были использованы сиалидаза, галактозидаза, гексозаминидаза и фукозидаза.
Определения
Приблизительно, около, примерно: Использованные в описании термины “приблизительно”, “около” или “примерно”, применительно к одному или нескольким представляющим интерес значениям, относятся к значению, которое соответствует установленному контрольному значению. В определенных вариантах осуществления изобретения термины “приблизительно”, “около” или “примерно” ссылаются на диапазон значений, которые оказываются в пределах 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или величины меньше установленного контрольного значения.
Биологический образец: В данном случае термин “биологический образец” относится к любому твердому или жидкому образцу, полученному, выделенному или секретированному любой живой клеткой или организмом, включая, но ими не ограничиваясь, тканевую культуру, образец ферментера, ткань человека или животного, растения, фрукты, овощи, одноклеточные микроорганизмы (такие как бактерии и дрожжи) и многоклеточные организмы. Например, биологический образец может быть биологической жидкостью, полученной, например, из крови, плазмы, сыворотки, мочи, желчи, семенной жидкости, спинномозговой жидкости, водянистой влаги или эндолимфы, либо любой секреции организма человека, отечной жидкости, экссудата (например, жидкости абсцесса или жидкости, полученной из любого другого инфицированного или воспаленного участка тела), или жидкостью сустава (например, здорового сустава или сустава, пораженного такой болезнью, как ревматоидный артрит, остеоартрит, подагра или септический артрит). Биологический образец также может быть, например, образцом, полученным из любого органа или ткани (включая образчики, полученные в результате биопсии или аутопсии), может содержать клетки (либо эмбриональные или культивируемые), быть средой, кондиционированной любой клеткой, тканью либо органом, тканевой культурой.
Гликопротеин клеточной поверхности: Термин “гликопротеин клеточной поверхности”, как используется в настоящем изобретении, относится к гликопротеину, по меньшей мере часть которого присутствует на внешней поверхности клетки. В некоторых вариантах осуществления изобретения гликопротеин клеточной поверхности представляет собой белок, который располагается на поверхности клетки так, что по меньшей мере одна из структур гликанов находится на внешней поверхности клетки.
Гликан клеточной поверхности: “Гликан клеточной поверхности” представляет собой гликан, который присутствует на внешней поверхности клетки. В некоторых вариантах осуществления изобретения гликан клеточной поверхности ковалентно связан с пептидом в качестве части гликопротеина клеточной поверхности. Гликан клеточной поверхности также может быть связан с липидом клеточной мембраны.
Гликан: На основании того, что известно из уровня техники и используется в настоящем описании, «гликаны» являются сахарами. Гликаны могут быть мономерами или полимерами сахарных остатков, однако они обычно содержат по меньшей мере три вида сахаров и могут иметь линейную или разветвленную структуру. Гликан может содержать остатки натурального сахара (например, глюкозу, N-ацетилглюкозамин, N-ацетил нейраминовую кислоту, галактозу, маннозу, фукозу, гексозу, арабинозу, рибозу, ксилозу и т.д.) и/или модицифированные сахара (например, 2'-фторорибозу, 2'-дезоксирибозу, фосфоманнозу, 6'-сульфо-N-ацетилглюкозамин и т.д.). Термин “гликан” включает гомополимеры и гетерополимеры сахарных остатков. Термин “гликан” также включает гликанный компонент гликоконъюгата (например, гликопротеин, гликолипид, протеогликан и т.д.). Этот термин также включает свободные гликаны, в том числе и те гликаны, которые были расщеплены или иным образом освобождены от гликоконъюгата.
Препарат гликана: Термин “препарат гликана”, как используется в настоящем документе, относится к набору гликанов, полученных в соответствии с конкретным способом получения. В некоторых вариантах осуществления изобретения препарат гликана относится к набору гликанов, полученных из препарата гликопротеина (смотрите ниже определение препарата гликопротеина).
Гликоконъюгат: Термин "гликоконъюгат", как используется в настоящем документе, включает все молекулы, в которых по меньшей мере одна составляющая сахара ковалентно связана по меньшей мере с одной другой составляющей. Этот термин конкретно включает все биомолекулы с ковалентно присоединенными составляющими сахара, в том числе, например, N-связанными гликопротеинами, О-связанными гликопротеинами, гликолипидами, протеогликанами и т.д.
Гликоформа: Термин «гликоформа», как используется в настоящем документе, относится к конкретной форме гликоконъюгата. То есть, если составляющая остова (например, полипептида, липида и т.д.), которая является частью гликоконъюгата, может быть связана с другими гликанами или наборами гликанов, то для любого другого варианта гликоконъюгата (то есть, тогда, когда остов связан с конкретным набором гликанов) указана ссылка как на "гликоформу".
Гликолипид: Термин "гликолипид", как используется в настоящем документе, указывает на липид, содержащий один или несколько ковалентно связанных составляющих сахара (то есть гликанов). Составляющая (составляющие) сахара может быть представлена в форме моносахаридов, дисахаридов, олигосахаридов и/или гликанов. Составляющая (составляющие) сахара может включать отдельную неразветвленную цепь сахарных остатков или состоять из одной или нескольких разветвленных цепей. В определенных вариантах осуществления изобретения сахарные составляющие могут содержать группы сульфатов и/или фосфатов. В определенных вариантах осуществления изобретения гликопротеины содержат O-связанные составляющие сахара; а в определенных вариантах осуществления изобретения - N-связанные составляющие сахара.
Гликопротеин: Термин "гликопротеин", как используется в настоящем документе, относится к белку, который содержит пептидный остов, ковалентно связанный с одной или несколькими составляющими сахара (то есть, гликанами). Специалистам в данной области понятно, что пептидный остов обычно состоит из линейной цепи остатков аминокислот. В определенных вариантах осуществления изобретения пептидный остов распространяется в клеточной мембране так, что включает трансмембранную и внеклеточную часть. В определенных вариантах осуществления изобретения пептидный остов гликопротеина пересекает клеточную мембрану так, что включает ее трансмембранную и внеклеточную часть. В определенных вариантах осуществления изобретения способы изобретения включают расщепление гликопротеина клеточной поверхности с помощью протеазы для высвобождения внеклеточной части гликопротеина или ее доли, причем такое воздействие незначительно разрушает клеточную мембрану. Составляющая (составляющие) сахара может быть представлена в форме моносахаридов, дисахаридов, олигосахаридов и/или гликанов. Составляющая (составляющие) сахара может включать отдельную неразветвленную цепь сахарных остатков или состоять из одной или нескольких разветвленных цепей. В определенных вариантах осуществления изобретения сахарные составляющие могут содержать группы сульфатов и/или фосфатов. Альтернативно или дополнительно, составляющие сахара могут содержать ацетил, гликолил, пропил или другие модификации алкильной группы. В определенных вариантах осуществления изобретения гликопротеины содержат О-связанные составляющие сахара; а в определенных вариантах осуществления изобретения - N-связанные составляющие сахара. В определенных вариантах осуществления изобретения способы включают стадию анализа любого или всех гликопротеинов клеточной поверхности высвобожденных фрагментов (например, гликопептидов) гликопротеинов клеточной поверхности, гликанов клеточной поверхности, присоединенных к гликопротеинам клеточной поверхности, пептидных остовов гликопротеинов клеточной поверхности, фрагментов таких гликопротеинов, гликанов и/или пептидных остовов, а также комбинаций этих соединений.
Гликозидаза: Термин "гликозидаза", как используется в настоящем документе, относится к средству, которое расщепляет ковалентную связь между последовательно расположенными сахарами в гликане или между сахаром и составляющей остова (например, между сахаром и пептидным остовом гликопротеина). В некоторых вариантах осуществления изобретения гликозидаза является ферментом. В определенных вариантах осуществления изобретения гликозидаза является белком (например, белковым ферментом), состоящим из одной или нескольких полипептидных цепей. В определенных вариантах осуществления изобретения гликозидаза является средством химического расщепления.
Характер гликозилирования: Термин “характер гликозилирования”, как используется в настоящем документе, относится к набору структур гликанов, присутствующему в конкретном образце. Например, конкретный гликоконъюгат (например, гликопротеин) или набор гликоконъюгатов (например, набор гликопротеинов) может иметь характер гликолизирования. В некоторых вариантах осуществления изобретения делается ссылка на характер гликолизирования гликанов клеточной поверхности. Характер гликозилирования может быть охарактеризован, например, как идентичность гликанов, количеством (в абсолютных или относительных единицах) отдельных гликанов или гликанами конкретного типа, степенью заполнения сайтов гликолизирования и т.д., или комбинациями таких параметров.
Препарат гликопротеина: Термин “препарат гликопротеина”, как используется в настоящем документе, относится к набору отдельных молекул гликопротеина, каждая из которых содержит полипептид, в который входит последовательность конкретных аминокислот (которая включает по меньшей мере один сайт гликолизирования), и по меньшей мере один гликан, ковалентно связанный по меньшей мере с одним сайтом гликозилирования. Отдельные молекулы конкретного гликопротеина в пределах препарата гликопротеина обычно представляют собой идентичные последовательности аминокислот, которые, тем не менее, могут отличаться содержанием по меньшей мере одного сайта гликозилирования и/или идентичностью гликанов, связанных по меньшей мере с одним сайтом гликолизирования. То есть, препарат гликопротеина может содержать только одну гликоформу конкретного гликопротеина, однако в нем обычно содержится множество гликоформ. Различные препараты одного и того же гликопротеина могут отличаться идентичностью присутствующих гликоформ (например, гликоформа, присутствующая в одном препарате, может отсутствовать в другом) и/или относительными количествами различных гликоформ.
N-гликан: Термин “N-гликан”, как используется в настоящем документе, относится к полимеру сахаров, который высвобожден из гликоконъюгата, однако ранее был связан с ним с помощью связывания через азот (ниже смотрите определение N-связанного гликана).
N-связанные гликаны: N-связанные гликаны представляют собой гликаны, которые связаны с гликоконъюгатом с помощью связи через азот. Существует разнообразный набор N-связанных гликанов, однако он обычно основан на типичном пентасахаридном ядре (Man)3(GlcNAc)(GlcNAc).
O-гликан: Термин “O-гликан”, как используется в настоящем документе, относится к полимеру сахаров, который высвобожден из гликоконъюгата, однако ранее был связан с ним с помощью связывания через кислород (ниже смотрите определение O-связанного гликана).
O-связанные гликаны: O-связанные гликаны представляют собой гликаны, которые связаны с гликоконъюгатом с помощью связывания через кислород. O-связанные гликаны обычно присоединяются к гликопротеинам через N-ацетил-D-галактозамин (GalNAc) или же через N-ацетил-D-глюкозамин (GlcNAc), связываясь с гидроксильной группой L-серин (Ser) либо L-треонин (Thr). Некоторые O-связанные гликаны также имеют такие модификации, полученные после ацетилирования и сульфатирования. В некоторых случаях O-связанные гликаны присоединяются к гликопротеинам через фукозу или маннозу, связываясь с гидроксильной группой L-серин (Ser) либо L-треонин (Thr).
Фосфорилирование: Как используется в настоящем документе, термин «фосфорилирование» указывает на процесс ковалентного добавления одной или нескольких фосфатных групп к молекуле (например, к гликану).
Протеаза: Термин “протеаза”, как используется в настоящем документе, указывает на средство, которое расщепляет пептидную связь между последовательными аминокислотами в полипептидной цепи. В некоторых вариантах осуществления изобретения протеаза является ферментом (то есть, протеолитическим ферментом). В определенных вариантах осуществления изобретения протеаза является белком (например, белковым ферментом), состоящим из одной или нескольких полипептидных цепей. В определенных вариантах осуществления изобретения протеаза представляет собой средство химического расщепления.
Белок: В общем случае «белок» представляет собой полипептид (то есть, нить по меньшей мере двух аминокислот, связанных друг с другом пептидными связями). Белки могут включать составляющие, отличные от аминокислот (например, это могут быть гликопротеины), и/или подвергаться иной обработке или модификации. Среднему специалисту в данной области следует обратить внимание на то, что “белок” может быть полностью полипептидной цепью в том виде, в каком его образовала клетка (с сигнальной последовательностью или без нее), или функциональной частью этого. Специалистам в данной области также следует обратить внимание на то, что иногда белок может включать более одной полипептидной цепи, которая, например, присоединяется с помощью одной или нескольких дисульфидных связей или посредством других средств.
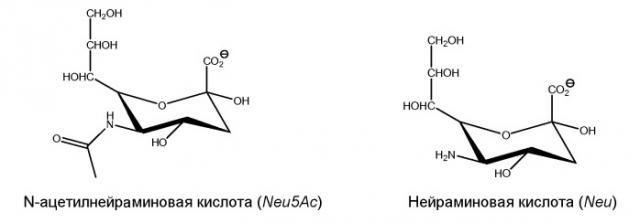
Сиаловая кислота: Термин “сиаловая кислота”, как используется в настоящем документе, является родовым термином N- или O-замещенных производных соединений нейраминовой кислоты, то есть 9-углерод моносахаридом. Аминовая группа нейраминовой кислоты обычно привносит либо ацетиловую или гликолильную группу в сиаловую кислоту. Гидроксильные заместители, которые присутствуют в сиаловой кислоте, могут быть модицированы ацетилированием, метилированием, сульфатированием и фосфорилированием. Доминирующая сиаловая кислота представляет собой N-ацетилнейроминовую кислоту (Neu5Ac). Сиаловые кислоты наделяют гликаны отрицательным зарядом, потому что карбоксильная группа имеет тенденцию диссоциировать протон физиологического водородного показателя pH. Характерные лишенные протонов сиаловые кислоты представлены ниже:
По существу: Как используется в настоящем описании, термин “по существу” указывает на качественное условие проявления в полной или почти полной мере или степени представляющей интерес характеристики или свойства. Среднему специалисту в области биологических технологий будет понятно, что биологические или химические процессы редко, если вообще когда-либо, завершаются полностью и/или продолжаются до полного завершения либо достигают или отклоняются от абсолютного результата. Следовательно, термин “по существу” используется в настоящем описании для того, чтобы учесть возможное отсутствие завершенности, присущее многим биологическим или химическим явлениям. В качестве конкретного примера, а можно указать случай, когда сообщается, что обработка “по существу” не разрушает клеточные мембраны, и это указывает на то, что все или большинство клеточных мембран остаются невредимыми во время и после обработки, вследствие чего, например, внутриклеточные гликопротеины или гликопептиды не высвобождаются из клеток. В определенных вариантах осуществления изобретения термин “по существу” используется в отношении невредимых клеточных мембран, указывает на условие, когда 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или меньшее число клеток, подвергнутых конкретной обработке, демонстрируют измеримое количество поврежденных клеточных мембран. В определенных вариантах осуществления изобретения термин “по существу” относится к невредимым клеточным мембранам, указывает на состояние дел, когда ни одна из клеток, подвергнутых конкретной обработке, не демонстрируют измеримое количество поврежденных клеточных мембран.
Подробное описание определенных вариантов осуществления изобретения
В описании настоящего изобретения раскрыты способы анализа композиции N-связанных гликанов. Согласно настоящему изобретению описанные способы можно использовать для анализа смеси N-гликанов и для измерения относительных уровней в смеси конкретных структурных групп и необычных модификаций (например, фукоза ядра или антеннальная фукоза, продукт удлинения фрагментом лактозамина, манноза высокого уровня и гибридные гликаны, продукты сульфатирования и фосфорилирования и т.д.). Например, на Фигуре 6 показано, как антеннальное фукозилирование предотвращает расщепление glcNAc с помощью гексозаминидазы. Во многих вариантах осуществления изобретения настоящее изобретение относится к способам, включающим стадии получения препарата N-гликанов, расщепления N-связанных гликанов с помощью ферментов экзогликозидазы для выделения особым образом моносахаридов из невосстанавливающихся конечных участков и анализа расщепленных продуктов.
N-связанные гликаны
В общем случае гликаны относятся к углеводной составляющей, которая в некоторых вариантах осуществления изобретения ковалентно подсоединена к гликопротеину. Углеводные составляющие (например, цепочки олигосахаридов) связываются с гликопротеинами в эндоплазматическом ретикулюме и в комплексе Гольджи посредством либо N- или O-связываний. Обычно цепочки N-связанного олигосахарида добавляют к гликопротеинам в полости эндоплазматического ретикулюма (см., Alberts et al., журнал Molecular Biology of the Cell (Молекулярная биология клетки), 1994, приведенную в настоящем описании в качестве ссылки). Углеводные составляющие добавляются в аминогруппу к боковой цепи остатка аспарагина, которая входит в состав целевой консенсусной последовательности Asn-X-Ser/Thr, где X может быть любой аминокислотой, за исключением пролина. Первоначальная цепочка олигосахарида обычно урезается посредством особых ферментов гликозидазы в эндоплазматическом ретикулюме, что приводит к получению олигосахарида с коротким разветвленным ядром, состоящим из двух остатков N-ацетилглюкозамина и трех остатков маннозы.
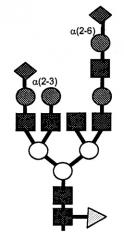
N-гликаны могут быть подразделены на три отдельные группы, названные «маннозным типом высокого уровня», «гибридным типом» и «комплексным типом», с общим ядром пентасахарида (Manp(α1,6)-(Manp(α1,3))-Manp(β1,4)-GlcpNAc(β1,4)-GlcpNAc(β1,N)-Asn), которое встречается во всех трех группах. К модификациям ядра относятся, например, дополнительное гликозилирование, обеспечивающее разделение GlcNAc пополам, присоединение остатка фукозила к самой дальней GlcNAc и образование необычных структур в конце цепи (кэппирование) за счет остатков сиаловой кислоты (Neu). Типичные N-гликаны показаны на Фигуре 1. Как можно заметить, структурное изменение N-гликанов происходит, главным образом, за счет появления (до) 4 антенн, которые расположены на левой стороне N-гликанов, показанных на Фигуре 1. N-связанные гликаны обычно оказываются компонентами пептидов (то есть, гликопептида) и белков (то есть, гликопротеина).
После начальной обраб