Диагностика тромбоэмболических заболеваний вен путем определения содержания d-димеров и растворимого фибрина
Иллюстрации
Показать всеНастоящая заявка на изобретение относится к способу и набору для диагностики активации свертывания крови, в частности, в случаях, когда свертывание крови вызывает тромбоэмболические заболевания вен. Изобретение включает определение содержания растворимого фибрина и D-димеров, образующихся в процессе фибринолиза, активированного в пробе крови. В способе согласно настоящему изобретению сравнивают уровень D-димеров, соответствующий разрушению растворимого фибрина, и уровень D-димеров в пробе с граничным значениями нормы. Тест согласно настоящему изобретению можно применять также для определения того, является ли достаточным противодействие свертыванию крови у пациента. 2 н и 14 з.п. ф-лы, 4 табл., 3 пр., 2 ил.
Реферат
Настоящая заявка относится к способу и тесту для определения активации свертывания крови, в частности, в случае, когда свертывание связано с тромбоэмболическими заболеваниями вен, при помощи анализа содержания D-димеров и растворимого фибрина в процессе активации свертывания крови.
Фибринолиз представляет собой процесс разложения фибрина в крови. Фибринолиз участвует в ряде патофизиологических процессов, его запуск происходит в ситуациях, когда тканевый активатор плазминогена и плазминоген связываются с фибрином, образуя тройной комплекс фибрин-плазминоген, в котором t-PA обладает высокой афинностью к плазминогену, что приводит к образованию плазмина - фермента, который расщепляет фибрин на D-димеры. В отсутствие фибрина аффинность t-PA к плазминогену низка. Этим объясняется тот факт, что фибрин в циркулирующей крови не разрушается.
Разрушение (расщепление) фибрина или фибринолиз приводит к образованию продуктов расщепления, содержащих, в частности, фрагменты, называемые "D-димерами". Указанные D-димеры связываются с Е-фрагментом, образующимся при разрушении другой молекулы мономера фибрина, с образованием комплекса DDE, однако даже в такой форме их обычно называют D-димерами.
Фибрин, подвергающийся процессу фибринолиза, образуется в результате превращения фибриногена под действием фермента свертывания, а именно тромбина. В процессе активации свертывания образующийся тромбин индуцирует образование отложений фибрина, из которых состоит тромб, и образование растворимого фибрина. В результате тромбин воздействует на четыре пептидные связи фибриногена, расположенные, соответственно, в 2 цепях А-альфа и в 2 цепях В-бета, что приводит к высвобождению двух фибринопептидов А из двух цепей А-альфа и высвобождению двух фибринопептидов В из цепей В-бета, что приводит к образованию мономеров фибрина, которые спонтанно полимеризуются с образованием полимера путем смещения водородных связей, образованных в результате взаимодействия между сайтами полимеризации А и В, открывающимися во время высвобождения фибринопептидов А и В, и сайтами а и b, которые находятся на концах цепей гамма и бета, соответственно. Затем полимерный фибрин сразу стабилизирует фактор XIII(a). При проведении опытов in vitro образование тромбина оказывается гораздо более интенсивным, чем in vivo. Таким образом, при активации процесса свертывания крови in vivo образование мономеров фибрина происходит гораздо медленнее, чем образование in vitro, в результате чего часть мономеров, образующихся для полимеризации, образуют нерастворимый фибрин, формирующий тромб, а другая часть указанных мономеров взаимодействует с фибриногеном, содержащим доступные сайты а и b, или с продуктами разложения фибриногена с образованием растворимого фибрина, в котором мономеры фибрина связаны с фибриногеном.
Анализ концентрации растворимого фибрина является важным для выявления активации свертывания крови у пациента. Такой анализ можно осуществить с использованием проб крови или плазмы, полученной из пробы крови, взятой у пациента.
Показано, что анализ растворимого фибрина является полезным дополнением к анализу продуктов разрушения по механизму фибринолиза, поскольку растворимый фибрин может позволить выявить происходящую активацию свертывания крови, в то время как концентрация D-димеров указывает на степень разрушения тромба даже после прекращения процесса активации свертывания.
В общем случае уровень D-димеров в плазме увеличивается при разрушении фибринового тромба in vivo. Таким образом, если тромб существует и подвергается разрушению, уровень D-димеров является высоким независимо от того, продолжается ли свертывание или завершилась. Уровень растворимого фибрина, напротив, повышается, только если свертывание продолжается.
По сравнению с уровнем D-димеров измерение именно уровня растворимого фибрина в плазме позволяет выявить свертывание крови, происходящее у пациента в момент взятия у него пробы для анализа, одновременно с определением баланса свертывания.
Таким образом, уровень D-димеров в пробе, называемый базовым уровнем, является показателем разрушения тромба, происходящего in vivo, а уровень D-димеров, определенный после экзогенного добавления специфического фибринового тромболитического агента, представляет собой сумму базовых D-димеров и D-димеров, образованных в результате разрушения растворимого фибрина, который называют также циркулирующим фибрином.
Заявка WO-A-02/18628 описывает способ проведения анализа растворимого фибрина в пробе крови, который включает осуществление контакта плазмы с активатором плазминогена, имеющим высокое сродство к растворимому фибрину (PA-sFb), с последующим определением уровня продуктов расщепления фибрина (D-димеров): при этом разница между концентрацией D-димеров в пробе, обработанной PA-sFb, и концентрацией базовых D-димеров, определенной в плазме, не обработанной PA-sFb, представляет D-димеры, связанные с разрушением растворимого фибрина. Авторы настоящего изобретения считают, что способ, предложенный в прототипе Международной публикации WO-A-02/18628, можно усовершенствовать для применения в контексте диагностики тромбоэмболических заболеваний вен, а также диагностики и мониторинга рассеянного внутрисосудистого свертывания (ДВС). Он позволяет также определять эффективность лечения антикоагулянтами.
Тромбоэмболические заболевания вен обычно включают тромбозы вен конечностей и эмболию легких, которая является результатом осложнения указанных тромбозов. Тромбозы вен, отличные от тромбозов конечностей, также включены, поскольку тромбоз может возникнуть в венах любой области. В частности, среди сайтов патологий можно указать вены почек и вены брыжейки. Тромбоэмболические заболевания, включая тромбоз глубоких вен (ТГВ) и/или эмболию легких (ЭЛ), являются опасными для жизни болезнями, на которые приходится большая доля инвалидностей и смертей в промышленно развитых странах, и диагностирование этих заболеваний является необходимым для дополнения исследований, проводимых методами визуализации изображения, в частности, ультрасонографии для диагностики тромбозов вен и сцинтографии или ангиографии для диагностики эмболии легких. Указанные методы исследований являются сложными для исполнения, и их не всегда можно реализовать достаточно быстро.
Таким образом, существует постоянная потребность в способе анализа, который позволит быстро диагностировать тромбоэмболическое заболевание у пациента, при этом указанная диагностика заболевания должна исключить необходимость применения дополнительных исследований.
В области диагностики заболеваний, связанных со свертыванием крови, известно, что нормальный уровень D-димеров является отрицательным показателем тромбоза, поскольку согласно общепризнанному принципу образование тромба влечет за собой как активацию свертывания, так и фибринолиз.
Однако известные способы определения уровня только D-димеров не обладают достаточной специфичностью и не позволяют сделать определенного заключения об образовании внутрисосудистого тромба, поскольку D-димеры, присутствующие в циркулирующей крови, могут образовываться и в результате распада внесосудистых отложений фибрина. D-димеры, образующиеся in situ, могут затем поступать в систему циркулирующей крови, что приводит к повышению уровня D-димеров в циркулирующей крови. В контексте настоящего изобретения авторы оценили достоверность диагноза, основанного на анализе уровня D-димеров в сочетании с экспресс-анализом растворимого фибрина, который является показателем активации внутрисосудистого свертывания. Такое сочетание анализов оказалось предпочтительным для диагностики тромбоза глубоких вен (ТГВ) и/или эмболии легких (ЭЛ), а также для диагностики рассеянного внутрисосудистого свертывания (РВС). Анализ растворимого разрушаемого фибрина (РРФ) позволяет определить уровень растворимого фибрина по содержанию продуктов, образующихся при расщеплении тканевым активатором плазминогена (или другим тромболитическим агентом, в частности, активатором плазминогена, специфичным в отношении фибрина), которые экзогенно вводят в пробу.
Таким образом, настоящее изобретение относится к способу, применяемому для in vitro диагностики активации свертывания в пробе крови пациента, при этом указанный способ включает:
а) количественный анализ продуктов разрушения фибрина, содержащихся в исследуемой пробе, включающий определение количества D-димеров, присутствующих в пробе и составляющих базовый уровень D-димеров;
б) обработку пробы путем инкубирования с активатором плазминогена, обладающего высокой аффинностью к фибрину (PA-sFb), в условиях, обеспечивающих разрушение растворимого фибрина, содержащегося в пробе, с образованием продуктов разрушения, без разрушения фибриногена, и количественное определение D-димеров, содержащихся в обработанной пробе;
в) расчет разности между содержанием D-димеров, определенным после активации активатором PA-sFb на стадии б), и содержанием D-димеров перед указанной активацией, определенным на стадии а), при этом полученная разность является показателем степени разложения растворимого фибрина (РРФ);
г) сравнение содержания D-димеров, измеренного на стадии а), с граничным значением нормы, определенным для указанных продуктов разложения, и сравнение уровня РРФ, рассчитанного на стадии в), с граничным значением нормы, определенным для РРФ.
Если анализ указанным способом выполняют, начиная с пробы, можно определить риск возникновения тромбоэмболического заболевания: этот риск существует, если по меньшей мере один из расчетных уровней указанных продуктов разложения фибрина или РРФ (D-димеров) превышает нормальное значение, однако этот риск исключается, если расчетный уровень указанных продуктов разложения фибрина и уровень РРФ ниже, чем соответствующие граничные значения нормы.
Диагностический способ согласно настоящему изобретению применяют для диагностики свертывания крови независимо от того, является ли процесс свертывания локализованным (в частности при тромбозах глубоких вен) или генерализованным (как в случае РВС).
В соответствующих случаях перед добавлением активатора плазминогена на стадии б), описанной выше, в часть пробы, предназначенную для определения продуктов разрушения растворимого фибрина, добавляют смесь лимонной кислоты и цитрата натрия.
Реагент, применяемый для анализа продуктов разрушения, выбирают таким образом, чтобы он обеспечивал определение данной группы продуктов разрушения. Так, например, используют антитела с установленной специфичностью по отношению к определенному типу продуктов разложения фибрина.
Если значение концентрации базовых D-димеров, измеренное на стадии а), превышает пороговое значение 500 нг/мл [нанограмм/миллилитр], уровень D-димеров считается повышенным. Если значение концентрации D-димеров, которое соответствует разрушению растворимого фибрина и которое рассчитывают на стадии в), которая превышает граничное значение 300 нг/мл, определенное у здоровых субъектов, оно считается повышенным.
Указанные граничные значения определяют при помощи реагента, который представляет собой антитело из тестового набора "Lia-test" производства компании Diagnostica Stago или из тестового набора VIDAS производства компании Bio-Merieux. Для других реагентов пороговое значение следует определять путем сравнения с результатами, полученными для указанных реагентов.
Измерение содержания D-димеров с одной стороны и растворимого разрушаемого фибрина с другой позволяют сделать вывод о том, что для пациента, пробу крови которого анализировали, существует риск возникновения тромбоэмболического заболевания, если уровень D-димеров, являющихся результатом разложения базового фибрина, составляет 500 нг/мл или более, или если уровень растворимого фибрина, определенный по разности между уровнем D-димеров, присутствующих в плазме, обработанной специфичным активатором плазминогена фибрина, и базовым уровнем D-димеров, превышает граничное значение, например, 300 нг/мл.
Биологическая проба предпочтительно представляет собой биологическую жидкость, например, плазму или пробу крови, или жидкость, полученную путем пункции, при условии, что уровень плазминогена в этой жидкости идентичен уровню плазминогена в плазме. В случае жидкостей, полученных путем пункции, содержащих малое количество плазминогена, необходимо добавлять Glu-плазминогена, чтобы обеспечить концентрацию плазминогена, близкую к его концентрации в плазме.
Активатор плазминогена с высокой аффинностью к фибрину (т.е. такой, который активирует только плазминоген в фибрине), используемый в способе анализа растворимого фибрина по образованию специфических продуктов разложения, можно выбрать из множества соединений, о которых известно, что они являются активаторами плазминогена. Однако некоторые из них, в частности, стрептокиназа и урокиназа, разрушают как фибриноген, так и фибрин. Эти соединения не пригодны для применения в способе согласно настоящему изобретению, поскольку при разложении фибрина они образуют также продукты разложения фибриногена, которые мешают определению продуктов разложения фибрина.
Другую группу активаторов плазминогена образуют соединения, которые описаны как обладающие высокой специфичностью к расщеплению фибрина по сравнению с фибриногеном. Для реализации способа согласно настоящему изобретению предпочтительно применять эту группу соединений, например:
- тканевый активатор плазминогена (t-PA) или его производные, в частности, TNK-tPA, который представляет собой мутант t-PA, обладающий очень высокой специфичностью по отношению к фибрину (Cannon С.Р. et al. TNK tissue plasminogen activator compared with front loaded altephase in acute myocardial infarction results of the TIMI 10B trial, Thrombolysis in Myocardial Infarction (TIM1) 10B Investigators, Circulation 98 (25), 2805-14, 1998);
- активатор, выделенный из организма Desmodus rotundus (вампир обыкновенный) (bat-tpa или vPA=активатор плазминогена слюны вампира), и его производные: DSPAs=PA слюны Desmondus rotundus, FEKP=DSPA альфа 1 и альфа 2, ЕKР=DSPA бета, KР=DSPA гамма (Bringmann et al. Structural features mediating fibrin selectivity of vampire bat plasminogen activators, J. Biol. Chem. 270, 25596-603, 1995), staphylokinase (SAK), a polypeptide secreted by Staphylococcus aureus (Collen D. Staphylokinase: a potent, uniquely fibrin-selective thrombolytic agent, Nat Med, 4-279-84, 1998; Sakharov D. V. et al. Fibrin specificity of a plasminogen activator affects the efficiency of fibrinolysis and responsiveness to ultrasound: comparison of nine plasminogen activators in vitro. Thromb Haemos, 81, 605-12, 1999) или один из его мутантов (Collen D. et al. Recombinant staphylokinase variants with altered immunoreactivity. I: Construction and characterization. Circulation 94, 197-206, 1996).
Для реализации способа диагностики, описанного выше, применяют антитела к D-димерам, при помощи которых выполняют два анализа (содержание базовых D-димеров и D-димеры после воздействия специфичного активатора плазминогена фибрина) согласно настоящему изобретению. Указанные антитела описаны в литературе и выпускаются серийно, например, компанией Diagnostica Stago под маркой "Lia-test" или компанией Bio-Merieux под маркой "Vidas".
Для корректного сравнения результатов для анализов на операциях а) и б) следует использовать одинаковые антитела к D-димерам.
D-димеры, которые образуются в результате разрушения растворимого фибрина в присутствии PA-sFb, можно анализировать любым известным традиционным методом, в частности, методами ELISA (твердофазный иммуноферментный анализ), чувствительными методами лактексной агглютинации (например, применяемых в Lia-test), методами иммуноокрашивания и т.д. В качестве примеров различных серийно выпускаемых наборов для анализов D-димеров можно указать ASSERACHROM D-Di или STA LIATEST D-Di, которые поставляет компания Diagnostic Stago. Однако в контексте настоящего изобретения режимы проведения анализа методом ELISA с применением ASSERACHROM D-Di были успешно модифицированы, что позволило сократить время анализа (инкубирование в течение 15 минут с иммобилизованным антителом и в течение 15 минут с антителом, меченым пероксидазой).
Способ in vitro диагностики согласно настоящему изобретению предпочтительно включает также обработку положительной контрольной пробы, в частности, положительной контрольной плазмы.
Для получения положительной контрольной плазмы вначале плазму инкубируют с небольшим количеством тромбина в течение определенного периода времени, в результате чего образуется растворимый фибрин без фибринового сгустка. Процесс свертывания, индукция которого при этом происходит, блокируют путем добавления ингибитора тромбина, чтобы предотвратить продолжение реакции. В качестве ингибитора можно использовать, например, гирудин или гепарин.
Время инкубирования плазмы и концентрации тромбина и ингибитора для блокирования предпочтительно выбирают таким образом, чтобы обеспечить активацию свертывания, которая приводит к образованию растворимого фибрина без фибринового сгустка.
Инкубирование в присутствии активатора свертывания (тромбина) предпочтительно проводят в течение 2 минут при температуре окружающей среды. Затем добавляют ингибитор в большом избытке, чтобы надежно блокировать свертывание крови.
- В случае применения гирудина его конечная концентрация предпочтительно составляет 100 мкг/мл для конечной концентрации тромбина 0.18 ед./мл.
- В случае применения гепарина его конечная концентрация составляет 500 ед./мл, если конечная концентрация применяемого тромбина составляет 0.18 ед./мл.
В другом предпочтительном варианте реализации изобретения способ in vitro диагностики согласно настоящему изобретению включает дополнительно обработку отрицательной контрольной пробы, в частности положительной контрольной плазмы. Получение указанных контрольных проб с дополнительными подробностями описано в приведенных далее примерах.
Для определения содержания растворимого фибрина в соответствии с настоящим изобретением вначале применяют расщепление растворимого фибрина под действием РА-sFb, а затем определяют содержание специфических продуктов расщепления под действием PA-sFb.
Для способа согласно настоящему изобретению принципиально важно получать эти результаты как можно быстрее, пока они являются адекватным показателем содержания растворимого фибрина, присутствующего в пробе. Соответственно, условия применения PA-sFb должны быть определены таким образом, чтобы разрушение растворимого фибрина происходило быстро и не сопровождалось "загрязняющим" разрушением фибриногена плазмы циркулирующей крови, которое приводит к увеличению содержания продуктов разрушения и мешает определению растворимого фибрина.
Применяемые дозы PA-sFb и период инкубирования с плазмой выбирают таким образом, чтобы увеличить уровень продуктов разрушения фибрина, который является максимальным в положительных контрольных пробах и имеет практически нулевое увеличение в отрицательных контрольных пробах (т.е. в таких пробах, которые не подвергали обработке активатором свертывания).
В контексте настоящего изобретения можно использовать различные активаторы фибринолиза, обеспечивающие специфичное разложение растворимого фибрина. PA-sFb предпочтительно выбирают из группы, включающей указанные активаторы, а именно: t-РА или его производные, VPA или его производные и стафилокиназу или один из ее мутантов. Предпочтительно используют t-PA или стафилокиназу, более предпочтительно - t-PA.
В условиях, когда пробы инкубируют в течение 15 минут при 37°С, конечная концентрация исследуемой стафилокиназы лежит в пределах от 1 до 12 мкг/мл. Конечная концентрация предпочтительно составляет 10 мкг/мл. Период инкубирования можно варьировать, и его изменение определяют как функцию природы и концентрации применяемого PA-sFb.
t-PA предпочтительно применяют в конечной концентрации в пределах от 1 до 2.5 мкг/мл. t-PA предпочтительно используют в концентрации 2 мкг/мл в случае инкубирования в течение 15 минут при 37°С.
В одном из вариантов реализации изобретения разрушение растворимого фибрина активатором плазминогена без разрушения фибриногена можно блокировать после разрушения растворимого фибрина путем добавления ингибитора плазмина, например, апротинина. Конкретные условия применения апротинина или другого эквивалентного ингибитора плазмина указаны в примерах. Количество применяемого апротинина может быть, например, эквивалентно количеству применяемого активатора плазминогена. Так, например, ингибитор плазмина добавляют после инкубирования в течение 15 минут при 37°С с активатором плазминогена.
В одном из вариантов реализации изобретения перед добавлением активатора плазминогена как в анализируемую пробу, так и в контрольные пробы можно добавлять антикоагулянт, в частности, раствор, содержащий лимонную кислоту и цитрат натрия. Количество и режим добавления лимонной кислоты и цитрата натрия указаны в примерах.
В контексте настоящего изобретения описанный выше способ диагностики применяют для определения образования венозного тромба.
В одном из вариантов реализации способ согласно настоящему изобретению применяют для диагностического исключения тромбоза глубоких вен.
В одном из вариантов реализации изобретения способ согласно настоящему изобретению применяют для диагностического исключения эмболии легкого.
В одном из вариантов реализации изобретения способ осуществляют на пробе крови, взятой у пациента перед проведением лечения антикоагулянтами.
В принципе, анализ растворимого фибрина для диагностического исключения тромбоза вен следует проводить перед любым лечением антикоагулянтами. Если пациент подвергается лечению антикоагулянтами, концентрация растворимого фибрина уменьшается очень быстро и достигает нормальных значений. В случае пациентов, проходящих лечение, концентрация растворимого фибрина в плазме позволяет определить только эффективность антикоагулянта.
В одном из вариантов реализации способа согласно настоящему изобретению анализ растворимого фибрина выполняют с использованием t-PA в качестве активатора плазминогена.
Другие характеристики изобретения станут очевидными из приведенных далее примеров и фигур.
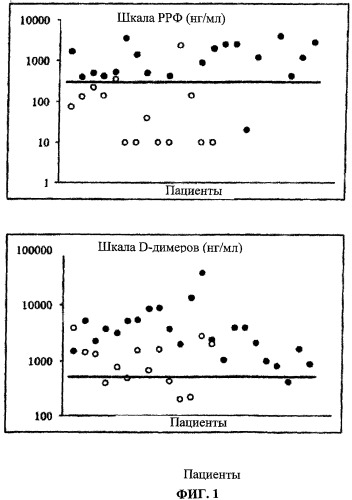
На фигурах 1 и 2, соответственно, показано сравнение D-димеров и РРФ у пациентов с предполагаемой эмболией легких или с предполагаемым тромбозом глубоких вен. Во всех случаях черные кружки соответствуют больным пациентам, а белые кружки - нормальным пациентам. Линия показывает верхнюю границу нормы (граничное значение нормы).
ПРИМЕРЫ
Пример 1
Выбор концентрации тромбина, применяемого для получения положительной контрольной плазмы, содержащей растворимый фибрин:
Положительную контрольную плазму получили, используя следующий протокол:
| Нормальная плазма | 200 мкл |
| Тромбин человека (Stago, №00896), 0.5-1 ед./мл (в зависимости от используемой плазмы) | 20 мкл |
Инкубирование в течение 2 минут при температуре окружающей среды.
| Гирудин (Knoll) | 100 мкг/мл (конечная концентрация) |
или
| гепарин (Choay) 5000 ед. ингибирования/мл (конечная концентрация) | 20 мкл |
Установили, что:
- в пробирке отсутствует образование сгустка и
- серийно выпускаемые реагенты для анализа растворимого фибрина являются положительными пробами (например, тест FS производства Stago Laboratories).
| Положительная контрольная проба | Отрицательная контрольная проба | |
| Плазма | 200 мкл | 200 мкл |
| Тромбин 1 ед./мл или 0.5 ед./мл | 20 мкл | |
| Физиологическая сыворотка | - | 20 мкл |
| 2 минуты (±10 секунд) при температуре окружающей среды | ||
| Гепарин, 5000 ед. ингибирования/мл | 20 мкл | |
| Физиологическая сыворотка | - | 20 мкл |
Пример 2
Определение количества PA-sFb, необходимого для использования в определенных условиях инкубирования
Для реализации способа согласно настоящему изобретению количество активатора, которое необходимо добавлять в анализируемую пробу, должно быть таким, чтобы обеспечить образование множества D-димеров в положительной контрольной плазме, как описано в примере №1, при пренебрежимо малом образовании D-димеров в отрицательной контрольной плазме (т.е. контрольной пробе, не обработанной тромбином).
Проводили инкубирование проб отрицательной контрольной плазмы и положительной контрольной плазмы (n=21) с различными дозами PA-sFb в течение 15 минут при 37°С. В конце периода инкубирования уровень D-димеров определяли при помощи тест-системы Lia-test или ускоренного анализа методом ELISA (D-Di Stago) (инкубирование 15 минут при 37°С с иммобилизованным антителом и 15 минут при 37°С со свободным антителом).
Результаты, представленные в таблице II, получили методом ELISA.
Практически аналогичные результаты получили при использовании Lia-test (n=5).
| Таблица IIРазложение растворимого фибрина путем увеличения количества t-PA и SAK | ||||
| D-димеры (нг/мл) | Растворимый фибрин* (нг/мл) | D-димеры (нг/мл) | Растворимый фибрин* (нг/мл) | |
| Отрицательная контрольная проба | Положительная контрольная проба | |||
| Без добавления Pa-Fb | 375 | 375 | ||
| После стафилокиназы (мкг/мл) | ||||
| 10 | 400 | <50 | 1750 | 1375 |
| 2 | 390 | <50 | 1615 | 1240 |
| 1.5 | 375 | <50 | 1700 | 1325 |
| 1 | 350 | <50 | 1657 | 1282 |
| 0.5 | 410 | <50 | 1125 | 750 |
| После t-PA (мкг/мл) | ||||
| 2 | 350 | <50 | 1790 | 1415 |
| 1 | 360 | <50 | 1420 | 1045 |
| 0.5 | 360 | <50 | 1210 | 835 |
| * Растворимый фибрин = уровень D-димеров после добавления t-PA или стафилокиназы - базовый уровень D-димеров перед добавлением t-PA или стафилокиназы. |
Дозу PA-sFb выбирают таким образом, чтобы обеспечить:
- увеличение <300 мкг/мл в необработанной контрольной плазме (отрицательные контрольные пробы);
- максимальное увеличение в положительной контрольной плазме.
Из этих результатов следует, что предпочтительно использовать конечную концентрацию PA-sFb, равную:
- 2 мкг/мл для t-PA: при таких условиях доза t-PA, которую можно нейтрализовать ингибиторами активатора плазминогена (РO1), является пренебрежимо малой;
- 10 мкг/мл для SAK (меньшие дозы SAK приводили к слабому разрушению растворимого фибрина у некоторых пациентов или в некоторых положительных контрольных пробах, что наиболее вероятно было вызвано присутствием в пробе антистафилокиназы, которая может появляться после инфицирования стафилококками).
Пример 3: Анализ содержания D-димеров и растворимого фибрина***
При проведении исследования уровень D-димеров и растворимого фибрина определяли у 87 последовательно поступивших пациентов, которых консультировали в пунктах оказания неотложной помощи, с подозрением на тромбоз глубоких вен и/или эмболию легких, и которые не получали никакого лечения. Этих пациентов подвергали ультразвуковому исследованию для диагностики тромбозов глубоких вен, и сцинтиграфию или ангиографию легких - для диагностики эмболии легких. Перед началом лечения антикоагулянтами определяли уровни D-димеров и растворимого разрушаемого фибрина (РРФ). Было показано, что чувствительность анализа на растворимый разрушаемый фибрин аналогична чувствительности анализа на D-димеры (96% для D-димеров и для растворимого разрушаемого фибрина). Интересно, что "ложноотрицательные результаты" по уровням D-димеров и растворимого разрушаемого фибрина наблюдали у различных пациентов. Таким образом, комбинация двух анализов позволят увеличить чувствительность диагностики тромбоза (100%). Кроме того, специфичность растворимого разрушаемого фибрина при диагностике тромбоэмболического заболевания вен выше (86% и 87% для эмболии легких и для тромбоза глубоких вен, соответственно), чем специфичность D-димеров (36% и 42% для эмболии легких и для тромбоза глубоких вен, соответственно).
Быструю нормализацию уровня растворимого разрушаемого фибрина наблюдали у пациентов, которые получали лечение в форме терапевтической дозы антикоагулянта. После проведения лечения антикоагулянтом уровень растворимого фибрина снижался. Таким образом, растворимый разрушаемый фибрин невозможно использовать в качестве диагностического теста у пациентов, которые получали лечение антикоагулянтами. Однако растворимый разлагаемый фибрин может быть полезен для мониторинга лечения антикоагулянтами. В заключение следует указать, что уровень растворимого разрушаемого фибрина в сочетании с уровнем D-димеров является полезным клиническим инструментом для прогнозирования или исключения риска эмболии легких и/или тромбоза глубоких вен.
Растворимый фибрин присутствует при активации свертывания крови. Повышение его уровня наблюдают на ранних стадиях активации.
Известно несколько тестов, предназначенных для определения уровня растворимого фибрина у пациентов, страдающих тромбозом, однако из-за вариабельности результатов указанных тестов важность определения уровня растворимого фибрина при диагностике исключения тромбоэмболических заболеваний вен до настоящего момента недооценивали (1-21).
Задачей настоящего исследования является оценка возможности применения нового теста, который основан на определении уровня растворимого разрушаемого фибрина и который является простым, быстрым, чувствительным и высокоспецифичным по отношению к растворимым фибриновым полимерам плазмы.
Этот тест основан на определении уровня D-димеров, которые образуются после инкубирования плазмы с t-PA в условиях, обеспечивающих стимулирование разрушения растворимого фибрина, однако без индуцирования разрушения фибриногена плазмы. Поэтому такой тест называют тестом на растворимый разрушаемый фибрин (РРФ). Фактически, несмотря на небольшое содержание мономеров фибрина в растворимом фибрине, мономеры фибрина связаны друг с другом поперечными связями, поскольку активация фактора XIII совпадает с выделением фибринопептида А, и, кроме того, активация фактора XIII тромбином ускоряется в присутствии фибрина (22). Для образования тромбина in vivo из маркеров выбрали растворимый разлагаемый фибрин, а именно фибринопептид A (FPA, время полужизни 3 минуты (23) или комплекс тромбин-антитромбин (ТАТ, время полужизни 15 минут (24)), поскольку его определение может быть более чувствительным в связи с тем, что оно менее чувствительно к аномалиям.
Целью настоящего исследования было определение эффективности диагностического теста, основанного на сочетании уровней D-димеров и растворимого разрушаемого фибрина у не подвергавшихся лечению пациентов, последовательно поступивших в пункты оказания неотложной помощи в 3 центрах с клиническим подозрением на эмболию легких (n=38) или тромбоз глубоких вен (n=49). В случае подозрения на тромбоз глубоких вен диагноз подтверждали методом компрессионной ультрасонографии, а в случае эмболии легких - методом сцинтиграфии или ангиографии легких. Граничное значение содержания растворимого разрушаемого фибрина для теста, которое считали положительным, составляло 300 нг/мл.
В данном исследовании с целью анализа влияния антикоагулянтов определяли также профили изменения растворимого разрушаемого фибрина и D-димеров у пациентов, страдающих эмболией легких и/или тромбозом глубоких вен, после начала лечения антикоагулянтами, что позволяло проверить эффективность терапии при тромбоэмболическом заболевании.
Материалы и методы
Пробы плазмы: пробы крови отбирали в 0.13 М цитрат (1 часть цитрата на 9 частей крови). После центрифугирования при 2500g в течение 15 минут собирали плазму и замораживали при -20°С до использования.
Однако при очень высоком уровне растворимого разрушаемого фибрина, как в случае внутрисосудистого свертывания (РВС), растворимый разрушаемый фибрин может образовывать нерастворимый комплекс на стадиях замораживания и оттаивания, поэтому такой анализ рекомендуется проводить со свежей отобранной плазмой.
Пробы крови отбирали у здоровых добровольцев или у пациентов в пунктах оказания неотложной помощи. Пациентов, которые получали лечение антикоагулянтом, включали в исследование только в целях мониторинга. Группа пациентов состояла из последовательно поступивших пациентов с признаками эмболии легких или тромбоза глубоких вен. Для подтверждения диагноза пациенты проходили обследование методами ультразвукового анализа компрессии проксимальных вен нижних конечностей, сцинтиграфии или ангиографии легких.
Биологические тесты
Определение уровня D-димеров
Уровень D-димеров определяли методом агглютинации микрочастиц из латекса, моноклональными антителами к D-димерам, с применением Lia-test (Diagnostica Stago) на приборе STA или методом ELISA с использованием VIDAS (Bio-Merieux).
Определение содержания растворимого разрушаемого фибрина: проводили в 3 этапа
1 - Разрушение фибрина: 20 мкл t-PA, 20 мкг/мл (обработанной плазмы) или 20 мкл физиологической сыворотки (необработанной плазмы) добавили в 200 мкл плазмы. После инкубирования в течение 15 минут при 37°С образовавшийся плазмин блокировали добавлением 20 мкл апротинина (Pentapharm), 12.5 ед. ингибирования тромбина/мл.
2 - Затем определили концентрацию D-димеров, с использованием Lia-test для D-димеров производства компании Diagnostica Stago.
3 - Рассчитали уровень растворимого разрушаемого фибрина как разность между концентрацией D-димеров в обработанной и необработанной плазме.
Если уровень D-димеров в плазме превышал 4000 нг/мл, пробу после стадии разрушения разбавляли.
Растворимый фибрин, используемый в качестве положительной контрольной пробы, получили путем инкубирования нормальной плазмы с небольшими дозами тромбина в течение короткого периода времени, по окончании которого тромбин блокировали гепарином.
Плазму из анализируемой пробы, а также положительную и отрицательную контрольные пробы, предназначенные для определения содержания растворимого фибрина, анализировали, как указано в таблице III.
| ТАБЛИЦА III | ||
| Основные D-димеры | РРФ + основные D-димеры | |
| Плазма | 200 мкл | 200 мкл |
| Чистая АС | 20 мкл | 20 мкл |
| Тра | - | 20 мкл |
| Физиологическая сыворотка | 40 мкл | - |
| 15 минут при +37°С | ||
| Апротинин | - | 20 мкл |
Добавление апротинина блокировало плазмин в течение некоторого времени, что приводило к тому, что происходило разрушение исключительно фибрина, но не фибриногена.
- Положительную и отрицательную контрольную пробы приготовили с ACd, т.е. АС с разбавлением 1:5.
Получение АС:
| Лимонная кислота, Н2О | Молекулярная масса = 210.14 0.16 г |
| Трицитрат натрия, 2 H2O | Молекулярная масса = 294.10 0.44 г |
| Н2О | 20 мл |
Результаты
Специфичность измерений
- У нормальных здоровых добровольцев (n=180) уровень растворимого фибрина был очень низким - 300 нг/мл или менее.
- Корреляция между концентрацией растворимого фибрина в плазме и концентрацией D-димеров отсутствовала, поскольку после введения пациентам гепарина концентрация фибрина резко уменьшалась, в то время как концентрация D-димеров снижалась гораздо медленнее, отражая разрушение сгустка, который сохраняется после блокирования активации свертывания крови.
Уровни D-димеров и растворимого фибрина у пациентов с подозрением на тромбоэмболическое заболевание вен или эмболию легких
У нормальных здоровых добровольцев (n=180).
Среднее значение при обследовании 180 добровольцев составляло 80±106 нг/мл, при этом у 140 из них уровень растворимого разрушаемого фибрина не был определен. Граничное значение, принятое в качестве положительной пробы, составляло 300 нг/мл.
Пациенты с подозрением на эмболию легких или тромбоз глубоких вен
Из 38 пациентов с подозрением на эмболию легких 23 имели положительные показатели согласно результатам визуального анализа, а из 49 пациентов с подозрением на тромбоз глубоких вен 25 имели положительные показатели согласно наблюдению аномальной компрессии проксимальных вен нижней конечности в ультразвуке.
Из двух групп пациентов, страдающих эмболией легких (n=23) или тромбозом глубоких вен (25), 2 имели показатели уровня растворимого фиб