Композиция носителя для своевременной доставки нуклеиновых кислот
Иллюстрации
Показать всеГруппа изобретений относится к композиции носителя для доставки нуклеиновой кислоты, содержащей миРНК и носителя, а также к способу ее введения. Носитель для доставки нуклеиновой кислоты содержит (А) диацилфосфатидилхолин, (В) по меньшей мере, один компонент, выбранный из группы, состоящей из холестерина и катионного липида с холестериновым каркасом, и (С) алифатический первичный амин. Заявленная композиция способна эффективно доставлять нуклеиновую кислоту в клетки, а также имеет низкую токсичность и высокую безопасность. 3 н. и 8 з.п. ф-лы, 4 ил., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции носителя для доставки нуклеиновой кислоты, которая способна эффективно доставить нуклеиновую кислоту в клетки при введении нуклеиновой кислоты в клетки, взятые у животного, или организмы, и которая, помимо этого, обладает низкой токсичностью и высокой безопасностью; и к композиции для доставки нуклеиновой кислоты.
Уровень техники
В результате недавних разработок в области биотехнологии были найдены различные типы нуклеиновых кислот, осуществляющие физиологически активную деятельность внутри клеток. Например, известно, что малая интерферирующая РНК (миРНК (siRNA)) вызывает разложение мРНК гена-мишени, существующего внутри клеток, и подавляет экспрессию данного гена-мишени (РНК-интерференция). Ингибирующее действие в отношении экспрессии гена-мишени вследствие РНК-интерференции применимо для облегчения или лечения симптомов заболевания, вызванного нерегулярной экспрессией конкретных генов или групп генов, и ожидается разработка терапевтических агентов с применением миРНК. Для применения нуклеиновых кислот, включая миРНК в качестве терапевтических агентов, важно, чтобы миРНК действовала в клетке-мишени, и, следовательно, необходимо разработать эффективные методики доставки нуклеиновых кислот в клетки-мишени.
В качестве методики доставки молекул экзогенных нуклеиновых кислот или генов в клетки известно об использовании носителя (вектора). Векторы включают вирусные векторы и невирусные векторы. Вирусные векторы обладают высокой эффективностью переноса генов, однако, существуют различные неизвестные аспекты безопасности, включающие патогенность, иммуногенность и цитотоксичность. В связи с этим ожидают разработки более безопасных невирусных векторов.
Например, в качестве невирусного носителя для доставки нуклеиновой кислоты, способствующего доставке нуклеиновой кислоты, такой как миРНК, в клетки, в патентном документе 1 был описан катионный липид с определенной структурой. Однако, у катионного липида, описанного в патентном документе 1, имеется недостаток, заключающийся в том, что он проявляет токсичность при введении в культивируемые клетки или живые организмы. Помимо этого, в патентном документе 2 в качестве композиции носителя, которая обладает сравнительно низкой токсичностью и способна доставить миРНК в клетки, описана композиция, содержащая амфифильное соединение и поликатион. Однако у композиции, описанной в патентном документе 2, также имеется проблема в отношении безопасности, поскольку ее цитотоксичность перестает быть пренебрежимо малой при введении в клетки значительного количества миРНК.
В свете предшествующего уровня техники было желательно разработать композицию носителя для нуклеиновой кислоты, обладающую низкой токсичностью и способную эффективно доставлять в клетки нуклеиновую кислоту, такую как миРНК.
[Патентный документ 1] Японская нерассмотренная патентная публикация № 2002-529439.
[Патентный документ 2] Японская нерассмотренная патентная публикация № 2005-508394.
Раскрытие изобретения
Техническая проблема
Таким образом, задачей настоящего изобретения является решение вышеуказанных проблем предшествующего уровня техники. Более точно, задача настоящего изобретения заключается в предоставлении композиции носителя для доставки нуклеиновой кислоты, которая способна эффективно доставить нуклеиновую кислоту в клетки при введении нуклеиновой кислоты, такой как миРНК, в клетки, взятые у животных, или животным, и которая, кроме того, имеет низкую токсичность и высокую безопасность; и композиции для доставки нуклеиновой кислоты, содержащей композицию носителя и нуклеиновую кислоту. Кроме того, еще одной задачей настоящего изобретения является предоставление способа введения в клетки нуклеиновой кислоты, который позволяет эффективно доставлять в клетки нуклеиновую кислоту с высокой безопасностью.
Способы решения данной проблемы
Авторы настоящего изобретения провели интенсивные исследования для достижения указанной выше задачи и обнаружили, что композиция, содержащая (А) диацилфосфатидилхолин, (В) холестерин и/или его производное и (С) алифатический первичный амин, имеет низкую токсичность и высокую безопасность, способна эффективно доставлять нуклеиновую кислоту в клетки и, следовательно, применима в качестве носителя для доставки нуклеиновой кислоты. Кроме того, ими найдено, что можно придать превосходные свойства безопасности и вводимости нуклеиновой кислоты за счет использования композиции, содержащей компоненты от (А) до (С), после получения на их основе липосомальной формы. Настоящее изобретения было завершено путем осуществления дополнительного улучшения на основе данных открытий.
Конкретнее, в настоящем изобретении предоставлены следующие варианты осуществления.
Абзац 1. Композиция носителя для доставки нуклеиновой кислоты, содержащая (А) диацилфосфатидилхолин, (В) по меньшей мере, один компонент, выбранный из группы, состоящей из холестерина и его производных, и (С) алифатический первичный амин.
Абзац 2. Композиция носителя для доставки нуклеиновой кислоты согласно абзацу 1, в которой компонент (А) представляет собой диацилфосфатидилхолин, в котором ацильная группа содержит от 4 до 23 атомов углерода.
Абзац 3. Композиция носителя для доставки нуклеиновой кислоты согласно абзацу 1, или 2, в которой компонент (В) представляет собой холестерин.
Абзац 4. Композиция носителя для доставки нуклеиновой кислоты согласно абзацу 1, в которой компонент (С) представляет собой алкиламин, содержащий от 10 до 20 атомов углерода.
Абзац 5. Композиция носителя для доставки нуклеиновой кислоты согласно абзацу 1, в которой компонент (А) представляет собой, по меньшей мере, один компонент, выбранный из группы, состоящей из димиристоилфосфатидилхолина, дипальмитоилфосфатидилхолина и дистеароилфосфатидилхолина, компонент (В) представляет собой холестерин, а компонент (С) представляет собой стеариламин.
Абзац 6. Композиция носителя для доставки нуклеиновой кислоты согласно абзацу 1, в которой молярное соотношение компонент (А):компонент (В):компонент (С) составляет 5-9:1-5:1.
Абзац 7. Композиция носителя для доставки нуклеиновой кислоты согласно абзацу 1, которая представляет собой носитель для доставки миРНК.
Абзац 8. Композиция носителя для доставки нуклеиновой кислоты согласно абзацу 1, которая представляет собой липосомальный препарат, в котором липосомальная мембрана образована компонентами от (А) до (С).
Абзац 9. Композиция для доставки нуклеиновой кислоты, содержащая нуклеиновую кислоту и композицию носителя для доставки нуклеиновой кислоты согласно абзацу 1.
Абзац 10. Композиция для доставки нуклеиновой кислоты согласно абзацу 9, в которой нуклеиновая кислота представляет собой миРНК.
Абзац 11. Композиция для доставки нуклеиновой кислоты согласно абзацу 9, которая представляет собой липосомальный препарат.
Абзац 12. Способ введения нуклеиновой кислоты, включающий стадию введения нуклеиновой кислоты в клетки путем приведения композиции для доставки нуклеиновой кислоты согласно абзацу 9 в контакт с клетками.
Абзац 13. Способ введения нуклеиновой кислоты согласно абзацу 12, в котором клетки представляют собой культивируемые клетки, клетки, выделенные из живых организмов, или клетки, существующие в живых организмах.
Абзац 14. Применение композиции, содержащей (А) диацилфосфатидилхолин, (В) по меньшей мере, один компонент, выбранный из группы, состоящей из холестерина и его производных, и (С) алифатический первичный амин, для получения носителя для доставки нуклеиновой кислоты.
Абзац 15. Применение согласно абзацу 14, в котором носитель используют для доставки миРНК.
Результаты изобретения
Преимущество композиции носителя для доставки нуклеиновой кислоты и композиции для доставки нуклеиновой кислоты данного изобретения заключается в том, что они могут эффективно доставлять в клетки нуклеиновую кислоту, обеспечивая, таким образом, полезную функцию данной нуклеиновой кислоты в клетках, и, кроме того, имеют низкую токсичность и высокую безопасность. Следовательно, композиция носителя для доставки нуклеиновой кислоты и композиция для доставки нуклеиновой кислоты применимы для лечения различных заболеваний за счет введения нуклеиновой кислоты, в частности, лечения трудноизлечимых заболеваний, которые с трудом поддаются лечению при помощи низкомолекулярного соединения.
Композиция носителя для доставки нуклеиновой кислоты и композиция для доставки нуклеиновой кислоты данного изобретения особенно предпочтительны для введения в клетки миРНК, поскольку может эффективно подавляться индукция экспрессии интерферона, которая является побочным действием миРНК.
Более того, преимущество композиции для доставки нуклеиновой кислоты данного изобретения состоит также в том, что данная композиция может храниться в лиофилизированном состоянии, поскольку ее можно подвергать обработке лиофильной сушкой.
Краткое описание чертежей
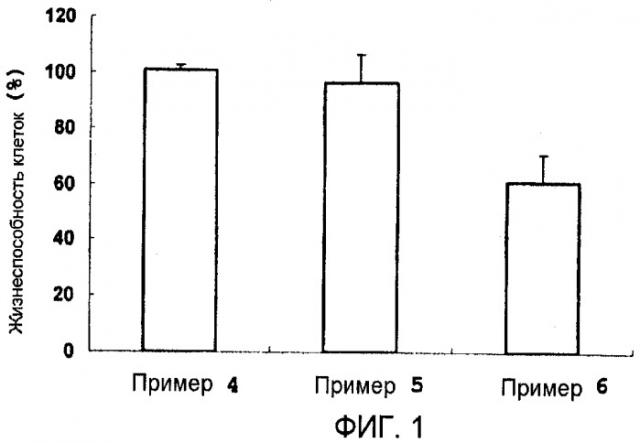
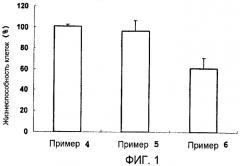
На фиг.1 приведены результаты тестового примера 1, то есть результаты оценки влияния композиции для доставки нуклеиновой кислоты на безопасность для клеток.
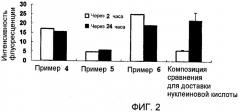
На фиг.2 приведены результаты оценки введения миРНК в клетки при помощи каждой из композиций для доставки нуклеиновой кислоты в тестовом примере 2. По линии ординат на фиг.2 указана средняя интенсивность флуоресценции на одну клетку.
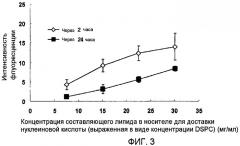
На фиг.3 приведены результаты оценки введения миРНК в клетки, когда концентрация составляющих липидов (DSPC, холестерина и стеариламина) носителя для доставки нуклеиновой кислоты изменяется в композиции для доставки нуклеиновой кислоты в тестовом примере 2.
На фиг.4 приведены результаты ингибирования индукции интерферона при действии миРНК-содержащей композиции для доставки нуклеиновой кислоты в тестовом примере 3.
Наилучший способ осуществления данного изобретения
Теперь настоящее изобретение будет описано подробно.
Носитель для доставки нуклеиновой кислоты
Композиция носителя для доставки нуклеиновой кислоты изобретения содержит (А) диацилфосфатидилхолин, (В) холестерин и/или его производное, и (С) алифатический первичный амин.
Композиция носителя для доставки нуклеиновой кислоты изобретения используется в качестве носителя нуклеиновой кислоты для доставки (введения) в клетки нуклеиновой кислоты.
Тип и структура нуклеиновой кислоты, для которой используется композиция носителя для доставки нуклеиновой кислоты настоящего изобретения, не ограничивается до тех пор, пока требуется ее введение в клетки. Конкретные примеры подобных нуклеиновых кислот включают миРНК, мРНК, тРНК, рРНК, кДНК, miPHK (микроРНК), рибозим, «антисмысловой» олигодеоксинуклеотид, олигонуклеотидную ловушку, плазмидную РНК, пептидонуклеиновую кислоту, триплекс-образующий олигонуклеотид (TFO), аптамер и гены. В частности, композиция носителя для доставки нуклеиновой кислоты настоящего изобретения обладает полезной особенностью подавлять индукцию экспрессии интерферона, которая является побочным действием миРНК и, таким образом, она применима для доставки в клетки миРНК. Нуклеиновые кислоты, для которых используют композицию носителя для доставки нуклеиновой кислоты данного изобретения, могут быть выделены из людей, животных, растений, бактерий и вирусов и, кроме того, ее можно получить химическим синтезом. Помимо этого, данные нуклеиновые кислоты могут быть одно-, двух- или трехнитевыми и их молекулярная масса особенно не ограничена. Кроме того, нуклеиновые кислоты могут быть модифицированы химическими соединениями, ферментами или белками. В данном изобретении данные нуклеиновые кислоты могут быть использованы в отдельности или можно использовать сочетание двух или более их видов.
Диацилфосфатидилхолин (в дальнейшем называемый иногда «компонент А»), используемый в композиции носителя для доставки нуклеиновой кислоты по изобретению, особенно не ограничен до тех пор, пока он является фармакологически приемлемым, и его примеры включают диацилфосфатидилхолин, ацильная группа в котором содержит от 4 до 23 атомов углерода. Количество атомов углерода в двух ацильных группах, являющихся частью диацилфосфатидилхолина, может быть одинаковым или различным.
Конкретные примеры диацилфосфатидилхолина, используемого в настоящем изобретении, включают дилауроилфосфатидилхолин, димиристоилфосфатидилхолин, дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, диолеоилфосфатидилхолин, дилинолеоилфосфатидилхолин, миристоилпальмитоилфосфатидилхолин, миристоилстеароилфосфатидилхолин, пальмитоилстеароилфосфатидилхолин, дибутилоилфосфатидилхолин, дигексаноилфосфатидилхолин, дигептаноилфосфатидилхолин, дидеканоилфосфатидилхолин, дифтаноилфосфатидилхолин, дидодецилфосфатидилхолин, диэйкозеноилфосфатидилхолин, дигеникозаноилфосфатидилхолин, диэрукоилфосфатидилхолин, диарахидоноилфосфатидилхолин и бис(трикозадиноил)фосфатидилхолин. Из числа данных диацилфосфатидилхолинов предпочтительным является диацилфосфатидилхолин, ацильные группы в котором содержат от 12 до 18 атомов углерода; более предпочтителен диацилфосфатидилхолин, ацильные группы в котором содержат от 13 до 17 атомов углерода, такой как димиристоилфосфатидилхолин, дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, миристоилпальмитоилфосфатидилхолин, миристоилстеароилфосфатидилхолин и пальмитоилстеароилфосфатидилхолин; особенно предпочтительны димиристоилфосфатидилхолин, дипальмитоилфосфатидилхолин и дистеароилфосфатидилхолин, а наиболее предпочтителен дистеароилфосфатидилхолин. Данные диацилфосфатидилхолины можно использовать в отдельности или можно использовать сочетание двух или более их видов.
Холестерин и/или его производное (в дальнейшем называемое иногда «компонент (В)»), используемый в композиции носителя для доставки нуклеиновой кислоты настоящего изобретения, особенно не ограничен до тех пор, пока он является фармакологически приемлемым. Производное холестерина представляет собой катионный липид с холестериновым каркасом и его конкретные примеры включают 3β-[N-(N',N'-диметиламиноэтан)карбамоил]холестерин (DC-Chol), йодид 3β-[N',N',N'-триметиламиноэтан]холестерина (TC-Chol), бис(гуанидиум)тренхолестерозу (BGTC), N-холестерилоксикарбонил-3,7-диазанонан-1,9-диамин, β-аланиндиэтаноламинхолестерин, N4-сперминхолестерилкарбамат (GL-67), N-[N4-3-аминопропилспермидин]холестерилкарбамат (GL-78), N4-сперминхолестерилкарбоксамид (GL-90), N1,N8-бис(аргининкарбоксамид)-N4-спермидинхолестерилкарбамат и N-[N1,N4,N8-трис(3-аминопроил)спермидин]холестерилкарбамат (GL-96). В данном изобретении компонент (В) предпочтительно представляет собой холестерин. В данном изобретении в качестве компонента (В) можно использовать холестерин и его производные в отдельности или можно использовать сочетание двух или более их видов.
Алифатический первичный амин (в дальнейшем называемый иногда «компонент (С)»), используемый в композиции носителя для доставки нуклеиновой кислоты данного изобретения, особенно не ограничен до тех пор, пока он является фармакологически приемлемым, и его примеры включают алкиламин, алкильная группа в котором содержит от 10 до 20 атомов углерода.
Конкретные примеры алифатического первичного амина, используемого в настоящем изобретении, включают лауриламин, миристиламин, пальмитоиламин, стеариламин, олеиламин, деканоиламин и фтаноиламин. Из числа данных алифатических первичных аминов предпочтительным является алкиламин, алкильная группа в котором содержит от 12 до 18 атомов углерода; более предпочтительными являются стеариламин, олеиламин и пальмитоиламин, а особенно предпочтителен стеариламин. Данные диалифатические первичные амины можно использовать в отдельности или можно использовать сочетание двух или более их видов.
Композиция носителя для доставки нуклеиновой кислоты настоящего изобретения может содержать сочетание компонентов от (А) до (С). В свете дальнейшего повышения эффективности доставки нуклеиновой кислоты в клетки и низкой токсичности за счет использования следующих сочетаний предпочтительным является сочетание (А) диацилфосфатидилхолина, ацильная группа в котором содержит от 4 до 23 атомов углерода, (В) холестерина и/или его производного и (С) алкиламина, содержащего от 10 до 20 атомов углерода, а более предпочтительным является сочетание (А) димиристоилфосфатидилхолина, дипальмитоилфосфатидилхолина и/или дистеароилфосфатидилхолина, (В) холестерина и (С) стеариламина.
В композиции носителя для доставки нуклеиновой кислоты настоящего изобретения соотношение компонентов от (А) до (С) особенно не ограничено. Например, молярное соотношение компонент (А): компонент (В): компонент (С) составляет 5-9:1-5:1, предпочтительно 6-9:1-4:1, а более предпочтительно 7-8:2-3:1. Эффективность доставки нуклеиновой кислоты в клетки и низкую токсичность можно дополнительно повысить за счет соответствия данному молярному соотношению.
Общее количество компонентов от (А) до (С) из расчета на общее количество композиции носителя для доставки нуклеиновой кислоты настоящего изобретения составляет, например, от 1 до 100 мас.%, предпочтительно, от 20 до 90 мас.%, а более предпочтительно, от 30 до 70 мас.%.
Помимо компонентов от (А) до (С), композиция носителя для доставки нуклеиновой кислоты настоящего изобретения может также содержать другие катионные липиды. Конкретные примеры катионного липида включают катионные липиды, связанные со стероидом, таким как скваламин, 3а,7а,12а-трис(3-аминопропокси)-5β-холан-24-(N,N-бис(3-аминопропил)амин, 3а,7а,12а-трис(3-аминопропокси)-5β-холан-24-(N-(N-(3-аминопропил)-3-аминопропил)амин), 3а,7а,12а-трис(3-азидопропокси)-5β-холан-24-(N,N-бис(2-цианоэтил)амин) и 3а,7а,12а-трис(3-азидопропокси)-5β-холан-24-(N-(бензилоксикарбонил)-N-(3-гидроксипропил)амин)); катионные липиды, связанные с холевой кислотой, такие как зонтичные сперминовые конъюгаты; катионные липиды, связанные со стеролгликозидом; катионные липиды, связанные со стероидсапонином, и катионные липиды типа четвертичной аммониевой соли, такие как диметилдиоктадециламмонийбромид (DDAB), 1,2-димиристоил-3-триметиламмонийпропан, 1,2-диолеоил-3-триметиламмонийпропан (DOTAP), 1,2-диолеоил-3-триметиламмонийпропанметилсульфат, 1,2-дипальмитоил-3-триметиламмонийпропан, 1,2-дистеароил-3-триметиламмонийпропан, гидрохлорид N-(1-(2,3-бис(олеоилокси)пропил)-N,N,N-триметиламмония (DOTMA), димиристоилоксипропилдиметилгидроксиэтиламмонийбромид (DMRIE), диолеоилоксипропилдиметилгидроксиэтиламмонийбромид (DORIE), диметилдидодециламмонийбромид, гидрохлорид N-(а-триметиламмонийацетил)дидодецил-D-глутамина, гидрохлорид N-(а-триметиламмонийацетил)-О,О'-бис(1Н,1Н,2Н,2Н-перфтордецил)-L-глутамина, гидрохлорид О,О'-дидодеканоил-N-(а-триметиламмонийацетил)диэтаноламина, метилаллилдидодециламмонийбромид, гидрохлорид N-{p-(w-триметиламмонийбутилокси)бензоил}дидодецил-L-глутамина, 9-(w-триметиламмонийбутил)-3,6-бис(додеканоил)карбазолбромид, гидрохлорид диметилдиоктадециламмония, N-w-триметиламмонийдеканоилдигексадецил-D-глутаминбромид, N-{p-(w-триметиламмонийгексилокси)бензоил}дитетрадецил-L-глутаминбромид, p-(w-триметиламмонийдецилокси)-p'-октилоксиазобензолбромид (МС-1-0810), p-{w-(b-гидроксиэтил)диметиламмонийдецилокси}-p'-октилоксиазобензолбромид (МС-3-0810), O,O',O''-тридодеканоил-N-(w-триметиламмонийдеканоил)трис(гидроксиметил)аминометанбромид (ТС-1-12), 1,2-дилаурилглицеро-3-этилфосфохолин, 1,2-димиристоилглицеро-3-этилфосфохолин, 1,2-дипальмитоилглицеро-3-этилфосфохолин, 1,2-дистеароилглицеро-3-этилфосфохолин, 1,2-диолеоилглицеро-3-этилфосфохолин и 1-пальмитоил-2-олеоилглицеро-3-этилфосфохолин.
В данном изобретении, в случае содержания катионных липидов, отличающихся от компонентов от (А) до (С), доля данного катионного липида особенно не ограничена до тех пор, пока это не оказывает неблагоприятного влияния на эффекты изобретения. Доля катионного липида составляет от 1 до 10 массовых частей, предпочтительно от 2 до 8 массовых частей, а более предпочтительно от 4 до 6 массовых частей на 100 массовых частей общего количества компонентов от (А) до (С).
Кроме того, композиция носителя для доставки нуклеиновой кислоты данного изобретения в случае необходимости может включать жирное основание. Включение жирного основания и применение его характеристик дает возможность регулировать эффективность нуклеиновой кислоты, которую требуется ввести при помощи композиции носителя для доставки. Например, коррекция удельной массы композиции носителя для доставки нуклеиновой кислоты за счет включения жирного основания регулирует контакт между нуклеиновой кислотой и композицией носителя для доставки нуклеиновой кислоты и дает возможность улучшить эффективность введения in vitro. Кроме того, например, вводя в качестве жирного основания соединения с функцией чувствительности к температуре, можно вызвать флуктуацию на поверхности клетки за счет разрушения ядра композиции носителя нуклеиновой кислоты в данных температурных условиях, вследствие чего можно улучшить эффективность введения нуклеиновой кислоты. Кроме того, например, вводя в качестве жирного основания соединения со свойством внешней стимуляции распада, можно вызвать флуктуацию на поверхности клетки за счет разрушения ядра композиции носителя нуклеиновой кислоты, вызванного внешней стимуляцией, вследствие чего можно улучшить эффективность введения нуклеиновой кислоты.
Примеры жирного основания, вводимого в композицию носителя для доставки нуклеиновой кислоты настоящего изобретения, включают перфторуглерод, перфторпентан, перфтороктилбромид, перфторгексан, перфтортрибутиламин, соевое масло, рафинированное соевое масло, гидрированное соевое масло, неомыленное соевое масло, сквален, касторовое масло, гвоздичное масло, сорбитантриолеат, терпентиновое масло, сафлоровое масло, жирную кислоту из сафлорового масла, олеиновую кислоту, кокосовое масло, рапсовое масло, сивушное масло, оливковое масло, льняное масло, кунжутное масло, хлорофилловое масло, кротоновое масло, бергамотное масло, кедровое масло, апельсиновое масло, фенхелевое масло, эвкалиптовое масло, кукурузное масло, лавандовое масло, сладкое масло майорана, лимонное масло, хлопковое масло, масло яичного желтка, розовое масло, хвойное масло, миндальное масло, арахисовое масло, масло камелии, белое камфарное масло, масло обыкновенной ромашки, коричное масло, масло перечной мяты, этерифицированное кукурузное масло, хлебное масло, масло римской ромашки, змеиное масло, масло кудрявой мяты, подсолнечное масло, масло какао, масло зародышей пшеницы, цинкоксидную пасту, гидрированное масло, гидрированное растительное масло, легкое вазелиновое масло, вазелиновое масло, триглицерид среднецепочечных жирных кислот, норковое масло, масло апельсиновых корок, полиоксиэтиленовое касторовое масло, полиоксиэтиленовое гидрированное касторовое масло, полиоксиэтиленовое гидрированное касторовое масло 10, полиоксиэтиленовое гидрированное касторовое масло 100, полиоксиэтиленовое гидрированное касторовое масло 20, полиоксиэтиленовое гидрированное касторовое масло 40, полиоксиэтиленовое гидрированное касторовое масло 5, полиоксиэтиленовое гидрированное касторовое масло 50, полиоксиэтиленовое гидрированное касторовое масло 60, полиоксил 35 касторового масла и технологическое масло. Из числа данных жирных оснований перфторпентан обладает температурной чувствительностью и, кроме того, имеет свойство переходить в летучее состояние при 29,5°С. Помимо этого, перфторгексан, перфтороктилбромид и перфтортрибутиламин обладают свойством внешнего стимулирования разрушения и обладают свойством вызывать кавитацию на ядре композиции носителя при внешней стимуляции, такой как стимуляция, вызванная облучением ультразвуком, приводя, таким образом, к разрушению ядра.
В том случае, когда композиция носителя для доставки нуклеиновой кислоты содержит жирное основание, доля данного жирного основания особенно не ограничена до тех пор, пока не оказывается неблагоприятного влияния на эффекты изобретения. Доля жирного основания составляет от 0,1 до 50 массовых частей, предпочтительно от 1 до 30 массовых частей, а более предпочтительно от 5 до 20 массовых частей на 100 массовых частей общего количества компонентов от (А) до (С).
Кроме того, в случае необходимости композиция носителя для доставки нуклеиновой кислоты данного изобретения может включать мембранно-фузогенный липид (липид-хелпер). Появляется возможность дополнительно повысить эффективность доставки нуклеиновой кислоты в клетки за счет содержания подобных мембранно-фузогенных липидов. Примеры мембранно-фузогенного липида включают диолеоилфосфатидилэтаноламин, диолеоилфосфатидилхолин, трансфосфатидилфосфатидилэтаноламин, 1,2-бис(10,12-трикозадиноил)фосфоэтаноламин, 1,2-диэлаидоилфосфоэтаноламин, 1,2-дигексадецилфосфоэтаноламин, 1,2-дигексаноилфосфоэтаноламин, 1,2-дилауроилфосфоэтаноламин, 1,2-дилинолеоилфосфоэтаноламин, 1,2-димиристоилфосфоэтаноламин, 1,2-диолеоилфосфоэтаноламин, 1,2-дипальмитоолеоилфосфоэтаноламин, 1,2-дипальмитоилфосфоэтаноламин, 1,2-дифитаноилфосфоэтаноламин, 1,2-дистеароилфосфоэтаноламин, 1-пальмитоил-2-олеоилфосфоэтаноламин, 1-пальмитоил-2-(10,12-трикозадиноил)фосфоэтаноламин, 1,2-диолеоилфосфоэтаноламин-N-капроиламин, 1,2-дипальмитоилфосфоэтаноламин-N-капроиламин, 1,2-диолеоилфосфоэтаноламин-N,N-диметил, 1,2-дипальмитоилфосфоэтаноламин-N,N-диметил, 1,2-дипальмитоилфосфоэтаноламин-N-додеканоил, 1,2-диолеоилфосфоэтаноламин-N-додеканоил, 1,2-диолеоилфосфоэтаноламин-N-додеканиламин, 1,2-дипальмитоилфосфоэтаноламин-N-додеканиламин, 1,2-диолеоилфосфоэтаноламин-N-глутарил, 1,2-дипальмитоилфосфоэтаноламин-N-глутарил, 1,2-диолеоилфосфоэтаноламин-N-лактозу, 1,2-диолеоилфосфоэтаноламин-N-[4-(п-малеимидметил)циклогексан-е-карбоксилат], дипальмитоилфосфоэтаноламин-N-[4-(п-малеимидметил)циклогексан-е-карбоксилат], 1,2-дипальмитоилфосфоэтаноламин-N-[4-(п-малеимидфенил)бутирамид], 1,2-диолеоилфосфоэтаноламин-N-[4-(п-малеимидфенил)бутират], 1,2-диолеоилфосфоэтаноламин-N-метил, дипальмитоилфосфоэтаноламин-N-метил, 1,2-диолеоилфосфоэтаноламин-N-[3-(2-пиридилдитио)пропионат], 1,2-дипальмитоилфосфоэтаноламин-N-[3-(2-пиридилдитио)пропионат], 1,2-диолеоилфосфоэтаноламин-N-(сукцинил) и 1,2-дипальмитоилфосфоэтаноламин-N-(сукцинил). Из числа данных мембранно-фузогенных липидов в композиции носителя для доставки нуклеиновой кислоты изобретения предпочтительно используют диолеоилфосфатидилэтаноламин.
В случае, когда в композиции носителя для доставки нуклеиновой кислоты содержится мембранно-фузогенный липид, доля данного мембранно-фузогенного липида особенно не ограничена до тех пор, пока на эффекты изобретения не оказывается неблагоприятного влияния. Доля мембранно-фузогенного липида составляет от 1 до 500 массовых частей, предпочтительно от 10 до 250 массовых частей, а более предпочтительно от 25 до 100 массовых частей из расчета на общее количество компонентов от (А) до (С).
Композиция носителя для доставки нуклеиновой кислоты данного изобретения может включать различные добавки, такие как изотонизирующие агенты, эксципиенты, разбавители, загустители, стабилизаторы, буферные агенты и консерванты; и водные растворители, такие как очищенная вода, водный раствор сахарида, буферный раствор, физиологический солевой раствор, водный раствор полимера, вода, не содержащая РНКазы, в соответствии со своей формой. Количества добавок и водных растворителей можно установить подходящим образом в соответствии с формой носителя для доставки нуклеиновой кислоты.
Форма композиции носителя для доставки нуклеиновой кислоты данного изобретения особенно не ограничена до тех пор, пока она способна включать целевую нуклеиновую кислоту, которую необходимо доставить в клетки, и данная композиция предпочтительно находится в форме липосомы.
Когда композиция носителя для доставки нуклеиновой кислоты данного изобретения имеет липосомальную форму, компоненты от (А) до (С) и другие липиды, добавленные по выбору, образуют липосомальную мембрану. При образовании липосомы она может представлять собой небольшие однослойные пузырьки (SUV), большие однослойные пузырьки (LUV) или многослойные пузырьки (MLV). Кроме того, диаметр частиц можно подходящим образом установить в соответствии с типом клеток, которые требуется доставить, например, диаметр частиц составляет от 20 до 100 нм для SUV, от 200 до 1000 нм для LUV и от 400 до 3500 нм для MLV. Диаметр частиц определяют методом динамического светорассеяния.
Получение липосомы и регулирование диаметра ее частиц осуществляют в соответствии с методами, которые известны специалисту в данной области. Более конкретно, липосому можно получить при использовании масляной фазы, содержащей компоненты от (А) до (С), и водной фазы (водный растворитель) методом тонкой пленки, методом выпаривания с обращенной фазой, методом введения простого эфира, методом поверхностно-активного вещества и методом нагревания. Кроме того, диаметр частиц можно регулировать методом экструзии, Френч-пресс методом и методом гомогенизации.
Композицию носителя для доставки нуклеиновой кислоты данного изобретения получают, смешивая компоненты (А) и (В), и, в случае необходимости, другие компоненты, и соответствующим образом получая из данной смеси препарат в соответствии с желательной формой.
Композиция для доставки нуклеиновой кислоты
Композиция для доставки нуклеиновой кислоты данного изобретения включает композицию носителя для доставки нуклеиновой кислоты и нуклеиновую кислоту. Таким образом, композицию носителя для доставки нуклеиновой кислоты используют для введения содержащейся в данной композиции нуклеиновой кислоты в клетки, которые становятся мишенью доставки.
В случае, когда композиция носителя для доставки нуклеиновой кислоты представляет собой липосомальную форму, в композиции для доставки нуклеиновой кислоты нуклеиновая кислота может существовать в состоянии включения в водную фазу липосомы, или в состоянии связывания с внешней или внутренней стороной липосомальной мембраны посредством ионной или гидрофобной связи. Помимо этого, если композиция носителя для доставки нуклеиновой кислоты представляет собой не липосомальную форму, в композиции для доставки нуклеиновой кислоты необходимо лишь получить комплекс нуклеиновой кислоты с другими компонентами композиции носителя для доставки нуклеиновой кислоты посредством ионной или гидрофобной связи.
Композицию для доставки нуклеиновой кислоты изобретения получают, смешивая композицию носителя для доставки нуклеиновой кислоты и нуклеиновую кислоту и придавая данной смеси желательную форму, или получают, смешивая нуклеиновую кислоту и компоненты композиции носителя для доставки нуклеиновой кислоты в любом порядке.
В композиции для доставки нуклеиновой кислоты настоящего изобретения соотношение концентраций компонентов смеси нуклеиновой кислоты и композиции носителя для доставки нуклеиновой кислоты изменяется в зависимости от природы нуклеиновой кислоты, используемой композиции носителя для доставки нуклеиновой кислоты и природы клеток в мишени для доставки. Пропорция нуклеиновой кислоты составляет от 1,0×10-5 до 1,0 массовой части, предпочтительно от 1,0×10-4 до 1,0×10-1 массовой части, а более предпочтительно от 1,0×10-3 до 1,0×10-2 массовой части на 100 массовых частей от общего количества компонентов от (А) до (С), содержащихся в композиции носителя для доставки нуклеиновой кислоты.
Кроме того, общее количество компонентов от (А) до (С), содержащихся в композиции для доставки нуклеиновой кислоты, составляет от 10 до 90 мас.%, предпочтительно, от 30 до 80 мас.%, а более предпочтительно, от 40 до 60 мас.% из расчета на общее количество композиции.
Композиция носителя для доставки нуклеиновой кислоты изобретения может включать различные добавки, такие как изотонизирующие агенты, эксципиенты, разбавители, загустители, стабилизаторы, буферный агент и консерванты, и водные растворители, такие как очищенная вода, водный раствор сахарида, буфер, физиологический солевой раствор, в соответствии со своей формой. Количество добавок и водных растворителей можно надлежащим образом установить в соответствии с формой носителя для доставки нуклеиновой кислоты.
В данном изобретении примеры клеток, в которые доставляют нуклеиновую кислоту, включают культивируемые клетки, клетки, полученные из живых организмов (включая устойчивые клеточные линии), и клетки, существующие в живых организмах, таких как человеческий.
Форма композиции для доставки нуклеиновой кислоты особенно не ограничена до тех пор, пока используют надлежащее количество композиции для доставки нуклеиновой кислоты для того, чтобы привести ее в контакт с клетками-мишенями, в которые вводят данную нуклеиновую кислоту. Когда нуклеиновую кислоту доставляют в клетки, существующие в живом организме, таком как человеческий, примеры применения включают непосредственное вливание в ткани; внутривенные, подкожные, внутримышечные, внутрибрюшинные, внутриглазные, дигестивные органические и эндодонтические инъекции; введения путем ингаляции в носовую полость, ротовую полость и легкие; пероральное введение; чрескожное введение через кожу; и мукозальное введение через мембрану слизистой оболочки полости рта, мембрану слизистой оболочки влагалища, мембрану слизистой оболочки глаза, мембрану слизистой оболочки прямой кишки и мембрану слизистой оболочки матки. Альтернативным образом в случае, когда нуклеиновую кислоту доставляют в клетки, выделенные из живых организмов и культивируемых клеток, используют метод выращивания клеток в присутствии соответствующего количества композиции для доставки нуклеиновой кислоты, добавленной до инкубирования. Помимо этого, когда нуклеиновую кислоту доставляют в клетки, выделенные из живых организмов или культивируемых клеток, нуклеиновую кислоту можно также доставить в клетки даже в присутствии сыворотки.
Количество композиции для доставки нуклеиновой кислоты изобретения, применяемой к клеткам-мишеням, определяют в соответствии с типом используемой нуклеиновой кислоты, типом композиции носителя для доставки нуклеиновой кислоты и природой клеток-мишеней. Например, если мишенью для доставки являются клетки в человеческом организме, к пациенту, от которого ожидают получения терапевтической пользы за счет введения данной нуклеиновой кислоты, применяют терапевтически эффективное количество композиции для доставки нуклеиновой кислоты изобретения.
ПРИМЕРЫ
Теперь изобретение будет описано подробно на основании примеров и тому подобного, но данное изобретение этим не ограничивается. В следующих примерах дистеароилфосфатидилхолин имеет сокращение «DSPC», дипальмитоилфосфатидилхолин имеет сокращение «DPPC», а димиристоилфосфатидилхолин имеет сокращение «DMPC». В следующих тестовых примерах 1 и 2 в качестве миРНК использовали GL3-миРНК (миРНК к люциферазе светлячка; Dharmacon Co., Boulder, CO, США; чувствительная молекула: 5'-CUUACGCUGAGUACUUCGAdTdT, нечувствительная молекула: 5'-UCGAAGUACUCAGCGUAAGdTdT). В тестовом примере 3 в качестве миРНК использовали ММР-9-миРНК человека (Samchully Pharm. Co., Ltd, Korea; чувствительная молекула: 5'-CCAACUAUGACCAGGAUAAdTdT-3', нечувствительная молекула: 5'-UUAUCCUGGUCAUAGUUGGdTdT-3').
Пример 1
Получение DSPC-содержащей композиции носителя для доставки нуклеиновой кислоты
DSPC, холестерин и стеариламин взвешивали в молярном соотношении 7:3:1, а затем растворяли в хлороформе с применением улавливающей колбы. Раствор сушили при пониженном давлении при помощи роторного испарителя, получая липидную тонкую мембрану. После прибавления к раствору DEPC-обработанной воды (производимой Ambion Co.: вода, не содержащая РНКазы) таким образом, чтобы концентрация DSPC составляла в ней 30 мг/мл, устанавливали диаметр частиц полученного раствора пропусканием через мембрану с диаметром пор 100 нм при помощи экструдера, получая композицию носителя для доставки нуклеиновой кислоты в катионной липосомальной фо