On01910.na, усиливающий активность химиотерапевтического агента в резистентных к лекарственным средствам опухолях
Иллюстрации
Показать всеПредложены: фармацевтическая композиция, содержащая дезинтегратор митоза/ингибитор биохимического пути polo-подобной киназы (Plk), в частности, ON01910, ON01910-Na или ми-РНК, направленную на Plk1, и химиотерапевтический агент, представляющий собой нуклеотидный аналог, в эффективном количестве, а также приемлемый носитель, для использования в качестве лекарственного средства для предупреждения развития резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у субъекта, страдающего раком, или для использования в качестве лекарственного средства для лечения рака, резистентного к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у нуждающегося в этом пациента и применение по тому же назначению дезинтегратора митоза/ингибитор биохимического пути polo-подобной киназы (Plk), в частности, ON01910, ON01910-Na или ми-РНК, направленной на Plk1, и химиотерапевтического агента, представляющего собой нуклеотидный аналог. Показано достижение синергетического эффекта заявленным сочетанием и преодоление или предотвращение развития резистентности к химиотерапевтическому агенту. 2 н. и 13 з.п. ф-лы, 3 ил., 5 пр.
Реферат
Предшествующий уровень техники
Широкий спектр противораковых химиотерапевтических агентов часто действует посредством ингибирования пролиферации в результате прерывания деления клетки или ингибирования апоптоза в относительно быстро делящихся клетках. Одной из стратегий для ингибирования клеточной пролиферации является применение химиотерапевтических агентов, представляющих собой нуклеотидные аналоги, таких как кладрибин, клофарабин, флударабин, меркаптопурин, пентостатин, тиогуанин, капецитабин, цитарабин, децитабин, фторурацил, флоксуридин, сапацитабин и гемцитабин. Эти соединения являются структурно подобными и типично действуют посредством по меньшей мере вмешательства в репликацию ДНК. Химиотерапевтические агенты, представляющие собой нуклеотидные аналоги, применяют для лечения, либо их исследуют для возможности лечения разнообразных видов рака, включая гематологические злокачественные опухоли, такие как лейкоз и лимфома, колоректальный рак, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичника, базально-клеточную карциному, рак мочевого пузыря, рак печени, рак простаты, рак желудка, рак почки, меланому, глиому, рак пищевода, рак шейки матки и миелодиспластические синдромы.
Лечение химиотерапевтическими агентами часто приводит в результате к развитию резистентности к одному или более чем одному химиотерапевтическому лекарственному средству посредством различных механизмов. Например, резистентность к гемцитабину при раке является широко распространенной проблемой. Большая доля пациентов в некоторый момент лечения прекращает получать гемцитабин, как одобрено при раке легкого, поджелудочной железы, мочевого пузыря, молочной железы и яичника и проходит исследование для лечения по меньшей мере рака печени и поджелудочной железы; и используется экспериментально для лечения лимфом и других видов рака. Хотя он эффективен в трети случаев, для которых это лекарственное средство одобрено, в большинстве ответ отсутствует, и даже в тех случаях, где ответ есть, в конечном счете, развивается резистентность.
Резистентность к гемцитабину является особенно проблематичной при раке поджелудочной железы, для которого нет других одобренных химиотерапевтических режимов. Несмотря на достижения в лечении многих типов рака, рак поджелудочной железы остается трудным для лечения при низкой долгосрочной выживаемости. По оценкам 2004 года распространенность этого заболевания в США составляет 31860 с ожидаемой смертью в 31270 случае. Одним из ограничений разработки новых лекарственных средств является отсутствие соответствующих доклинических моделей.
Всего примерно 5% пациентов с раком экзокринной части поджелудочной железы проживут 5 лет после обнаружения рака. Даже для пациентов с локальным заболеванием относительная доля 5-летнего выживания составляет примерно 20%. Для тех кто страдает регионарным заболеванием, относительная доля 5-летнего выживания составляет примерно 8%. Если присутствуют метастазы, относительная доля 5-летнего выживания составляет 2%. Хотя гемцитабин одобрен для лечения пациентов с раком поджелудочной железы, примерно 75-90% пациентов имеют минимальную пользу от этой терапии. Никаких обоснованных рекомендаций по лечению невозможно дать для пациентов с прогрессирующим раком поджелудочной железы после неудачи лечения первой линии гемцитабином.
За последние несколько лет в значительном числе клинических испытаний исследована активность новых агентов при раке поджелудочной железы отдельно или в комбинации с гемцитабином. Результаты этих исследований, в основном, отрицательны. Несмотря на данные по активности в исследованиях фазы II, ни агент сам по себе, ни комбинированная стратегия не были лучшими, чем один гемцитабин, в проведенных до сих пор исследованиях. Это применимо не только к общепринятым лекарственным средствам, но также к направленным агентам, таким как ингибиторы матриксных металлопротеиназ (ММР) и фарнезилтрансферазы (FTI).
Были проведены исследования для идентификации подходящих терапий для пациентов с раком поджелудочной железы, у которых была неудачной терапия гемцитабином, но результаты были смешанными. В одном исследовании лечение состояло из доцетаксела 65 мг/м2 и иринотекана 160 мг/м2, где тот и другой вводили раз в 21 сутки. Было зарегистрировано четырнадцать пациентов, после чего исследование было закрыто вследствие избыточной токсичности. Наиболее распространенные токсичности степени 3/4 включали нейтропению/лейкопению, тошноту и рвоту и диарею. Полностью половина пациентов получила только один цикл лечения при среднем сроке до неудачи лечения 36 суток. Никаких объективных ответов не наблюдали, хотя у трех пациентов заболевание было стабильным в течение по меньшей мере 6 циклов. Общее выживание для полной когорты составляло 134 суток при доле 6-месячного выживания 36%. В другом исследовании пациентов с раком поджелудочной железы, резистентным к гемцитабину, лечили S-I и цисплатином (CDDP) для определения доли ответа и токсичности. У пяти из семнадцати зарегистрированных пациентов (29,4%) получили частичный ответ, и 2 (11,8%) имели стабильное заболевание. Токсичности лечения были приемлемыми. Средний срок выживания составлял 10 месяцев (диапазон до 20 месяцев), где 63,7% и 31,9% пациентов жили до 6 и 12 месяцев соответственно.
Краткое изложение сущности изобретения
В одном аспекте в настоящем изобретении предложен способ применения дезинтегратора митоза/ингибитора биохимического пути polo-подобной киназы (Plk) в качестве лекарственного средства для лечения рака у субъектов, страдающих раком, поддающимся лечению химиотерапевтическим агентом, представляющим собой нуклеотидный аналог. Такие субъекты включают субъектов, страдающих видами рака, которые исходно поддавались лечению химиотерапевтическими агентами, представляющими собой нуклеотидные аналоги, у которых впоследствии химиотерапия потерпела неудачу вследствие развития резистентности к нуклеотидным химиотерапевтическим агентам (то есть развития резистентной опухоли). Способ применения включает препарат дезинтегратора митоза/ингибитора биохимического пути Plk в качестве лекарственного средства для введения субъекту, идентифицированному как страдающему типом рака, который поддается лечению химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, поддается лечению дезинтегратором митоза/ингибитором биохимического пути Plk. В некоторых воплощениях субъект имеет резистентность, либо у него развилась резистентность к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог. Этот способ дополнительно включает мониторинг субъекта в отношении снижения или стабилизации по меньшей мере одного признака или симптома рака, где лекарственное средство приводит в результате к снижению или стабилизации по меньшей мере одного признака или симптома рака. В одном воплощении дезинтегратор митоза/ингибитор биохимического пути Plk вводят совместно с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог. В одном аспекте способ применения включает реверсирование резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог.
В одном аспекте в настоящем изобретении предложен способ применения дезинтегратора митоза/ингибитора биохимического пути Plk для изготовления лекарственного средства для лечения рака у субъекта, страдающего раком, которому прежде вводили только химиотерапевтический агент, представляющий собой нуклеотидный аналог, где лекарственное средство приготовлено для совместного введения химиотерапевтического агента, представляющего собой нуклеотидный аналог, и субъект восприимчив к лечению комбинацией химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk. Этот способ дополнительно включает мониторинг субъекта в отношении снижения или стабилизации по меньшей мере одного признака или симптома рака. В одном аспекте способ включает предупреждение развития резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог.
В одном аспекте в настоящем изобретении предложен способ применения дезинтегратора митоза/ингибитора биохимического пути Plk для изготовления лекарственного средства для лечения рака у субъекта, восприимчивого к лечению рака с использованием химиотерапевтического агента, представляющего собой нуклеотидный аналог. Этот способ включает изготовление лекарственного средства, включающего дезинтегратор митоза/ингибитор биохимического пути Plk, для введения перед введением лекарственного средства, включающего химиотерапевтический агент, представляющий собой нуклеотидный аналог, возможно при продолжающемся введении дезинтегратора митоза/ингибитора биохимического пути Plk, и мониторинг субъекта в отношении снижения или стабилизации по меньшей мере одного признака или симптома рака. В одном аспекте способ применения этих лекарственных средств включает предупреждение у субъекта резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог.
В одном аспекте изобретение включает совместное введение химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk с получением синергетического эффекта этих соединений, так что эффект совместного введения этих соединений является большим, чем аддитивный эффект соединений, вводимых по отдельности. В одном аспекте изобретение включает изготовление синергетической композиции для применения в качестве лекарственного средства для лечения рака, включающей химиотерапевтический агент, представляющий собой нуклеотидный аналог, и дезинтегратор митоза/ингибитор биохимического пути Plk.
В одном аспекте изобретение включает схему введения химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk субъекту, страдающему раком, поддающимся лечению химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, и/или дезинтегратором митоза/ингибитором биохимического пути Plk. В одном воплощении эта схема включает введение одного химиотерапевтического агента, представляющего собой нуклеотидный аналог, с последующим совместным введением химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk. В одном воплощении эта схема включает введение дезинтегратора митоза/ингибитора биохимического пути Plk с последующим совместным введением дезинтегратора митоза/ингибитора биохимического пути Plk с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог. В одном воплощении эта схема включает совместное введение ингибитора Plk с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, возможно без предварительного отдельного введения любого из агентов. В одном аспекте изобретение возможно дополнительно включает введение дополнительных химиотерапевтических и/или фармацевтических агентов. В одном аспекте изобретение возможно дополнительно включает введение химиотерапевтического агента или дезинтегратора митоза/ингибитора биохимического пути Plk отдельно после совместного введения этих двух агентов.
В одном аспекте изобретение включает изготовление лекарственного средства, включающего дезинтегратор митоза/ингибитор биохимического пути Plk, для совместного введения с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, для лечения рака, резистентного к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у пациента, восприимчивого к лечению этим лекарственным средством.
В одном аспекте изобретение включает изготовление лекарственного средства, включающего дезинтегратор митоза/ингибитор биохимического пути Plk, для совместного введения с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, для предупреждения развития резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, при раке у пациента, восприимчивого к лечению этим лекарственным средством.
В одном аспекте изобретение включает изготовление лекарственного средства, включающего дезинтегратор митоза/ингибитор биохимического пути Plk, для совместного введения с химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, для применения для реверсирования резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, при раке у пациента, ранее восприимчивого к лечению лекарственным средством, представляющим собой дезинтегратор митоза/ингибитор биохимического пути Plk.
В одном воплощении изобретение включает лекарственное средство для совместного введения дезинтегратора митоза/ингибитора биохимического пути Plk и химиотерапевтического агента, представляющего собой нуклеотидный аналог, которое представляет собой смесь, включающую дезинтегратор митоза/ингибитор биохимического пути Plk и химиотерапевтический агент, представляющий собой нуклеотидный аналог. В одном воплощении лекарственное средство для совместного введения дезинтегратора митоза/ингибитора биохимического пути Plk и химиотерапевтического агента, представляющего собой нуклеотидный аналог, включает препарат каждого из химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk в лекарственной форме, которая позволяет или облегчает введение обоих соединений субъекту. В некоторых воплощениях изобретения рак представляет собой рак, поддающийся лечению терапевтическим агентом, представляющим собой нуклеотидный аналог. В некоторых воплощениях изобретения рак представляет собой гематологическую злокачественную опухоль, такую как лейкоз или лимфома, колоректальный рак, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичника, базально-клеточную карциному, рак мочевого пузыря, рак печени, рак простаты, рак желудка, рак почки, меланому, глиому, рак пищевода, рак шейки матки и миелодиспластические синдромы.
В различных воплощениях дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой ингибитор Plk1. В различных воплощениях дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой ON-01910-Na или его производное. В воплощениях изобретения дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой ON-01910-Na. В различных воплощениях дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой терапевтическое средство на основе нуклеиновой кислоты. В различных воплощениях терапевтическое средство на основе нуклеиновой кислоты направлено на Plk1, конкретно Plk1 человека. В различных воплощениях терапевтическое средство на основе нуклеиновой кислоты представляет собой соединение миРНК (малая интерферирующая РНК).
В различных воплощениях изобретения химиотерапевтический агент, представляющий собой нуклеотидный аналог, представляет собой кладрибин, клофарабин, флударабин, меркаптопурин, пентостатин, тиогуанин, капецитабин, цитарабин, децитабин, фторурацил, флоксуридин, сапацитабин или гемцитабин. В различных воплощениях химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, является гемцитабин.
Краткое описание графических материалов
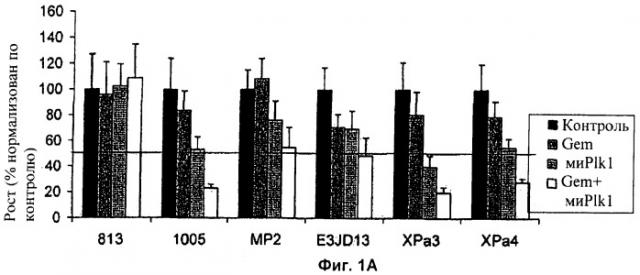
Фиг.1А и Б представляют собой графики, показывающие ингибирование роста шести клеточных линий, резистентных к гемцитабину, в ответ на обработку гемцитабином в присутствии или в отсутствие (А) миРНК-ингибитора и (Б) ON-01910-Na, низкомолекулярного ингибитора Plk1.
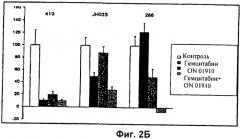
На Фиг.2 показаны результаты двух экспериментов in vivo у мышей с чувствительными и резистентными к гемцитабину опухолями. (А) показывает графики опухолевого роста трех экспериментов in vivo. Мышей, несущих опухоли, распределяли на 4 группы, которые обрабатывали носителем, гемцитабином, ON 01910-Na и комбинацией обоих агентов (при полных дозах). (Б) представляет собой столбиковую диаграмму А. Столбики ошибок представляют собой стандартное отклонение.
На Фиг.3 показаны структуры (A) ON01910 и (Б) химиотерапевтических агентов, представляющих собой нуклеотидные аналоги, кладрибин, клофарабин, флударабин, меркаптопурин, пентостатин, тиогуанин, капецитабин, цитарабин, децитабин, фторурацил, флоксуридин, сапацитабин или гемцитабин, как указано.
Подробное описание изобретения
Настоящее изобретение основано, по меньшей мере частично, на открытии того, что опухоли, чувствительные к гемцитабину, обладают сниженной экспрессией Plk1, и что гемцитабин-резистентные опухоли поддаются лечению дезинтеграторами митоза/ингибиторами биохимического пути Plk, включающими ON-01910-Na и соединение миРНК, направленной на Plk1 человека. Кроме того, ингибирование Plk1 в гемцитабин-резистентных опухолях придает чувствительность к гемцитабину прежде резистентной опухоли. Эта восприимчивость гемцитабин-резистентных опухолей к уничтожению ингибиторами Plk1 была определена с использованием гемцитабин-резистентных клеточных линий опухолей поджелудочной железы in vitro, гемцитабин-резистентных опухолей поджелудочной железы человека ех vivo и в модели ксенотрансплантатов мышей (то есть in vivo).
ON-01910-Na представляет собой малую молекулу, которая прерывает переход клеточного цикла G2/M и индуцирует задержку опухолевых клеток в митозе, характеризующуюся аномалиями веретена, приводящими к апоптозу. Этот эффект по меньшей мере частично связан с его активностью в качестве ингибитора Plk1. Как продемонстрировано в данной заявке, ON 01910 обладает активностью в моделях in vitro и in vivo гемцитабин-резистентного рака поджелудочной железы.
Термин "подлежащий лечению", "процесс лечения" или "лечение" включает снижение или ослабление по меньшей мере одного симптома, обусловленного или вызванного состоянием, расстройством или заболеванием, подлежащим лечению. Например, лечение может представлять собой уменьшение одного или нескольких симптомов расстройства или полное устранение этого расстройства. Лечение может включать объективный ответ ПО (полный ответ), 40 (частичный ответ) или СЗ (стабильное заболевание), как изложено в приведенной ниже таблице.
Ответ солидных опухолей на лечение может быть охарактеризован, например, с использованием критериев Всемирной организации здравоохранения (ВОЗ) или с использованием руководств по одномерному измерению группы Критериев Оценки Ответа при Солидных Опухолях (RECIST, Responsive Evaluation Criteria in Solid Tumors). Эти критерии изложены в приведенной ниже таблице.
| ВОЗ | RECIST | |
| Измеримость | Поддающийся измерению, двумерный | Поддающийся измерению, одномерный; общепринятый способ >20 мм; спиральная КТ >10 мм; целевое или нецелевое повреждение |
| Не поддающийся измерению/поддающийся оценке | Поддающийся измерению | |
| Объективный ответ | ||
| Полный ответ (ПО) | Исчезновение всего(х) известного(ых) повреждения(й); подтвержденное через 4 недели | Исчезновение всего(х) известного(ых) повреждения(й); подтвержденное через 4 недели |
| Частичный ответ (ЧО) | По меньшей мере 50% снижение; подтвержденное через 4 недели | По меньшей 30% снижение; подтвержденное через 4 недели |
| Стабильное заболевание (СЗ) | Не соответствует критериям ни ПО, ни ЧО | Не соответствует критериям ни ПО, ни ЧО |
| Прогрессирующее заболевание (ПЗ) | 25% повышение; ни ПО, ни ЧО, ни СЗ не документированы перед усилением заболевания, или новое(ые) повреждение(я) | 20% повышение; ни ПО, ни ЧО, ни СЗ не документированы перед усилением заболевания, или новое(ые) повреждение(я) |
См. также Park et al., Measuring response in solid tumors: Comparison of RECIST and WHO response criteria. Jpn. J. Clin. Oncolo. 33:533-537, 2003, включенный в данную заявку посредством ссылки. Одномерное измерение в критериях RECIST включает измерение только самого длинного диаметра всех целевых повреждений.
Термин "резистентная к лекарственному средству опухоль" или "резистентный к лекарственному средству рак" и тому подобное понимают как опухоль или рак, при котором критерии прогрессирующего заболевания (ПЗ) выполняются в присутствии или при введении лекарственного средства. В культуре резистентную клетку понимают как клетку, которая продолжает расти в присутствии лекарственного средства. Скорость роста составляет по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% относительно необработанной контрольной клетки в культуре. Резистентность к лекарственному средству может представлять собой резистентность к одному конкретному лекарственному средству или резистентность к многим лекарственным средствам, что распространено при опухолях, экспрессирующих ген множественной лекарственной устойчивости (MDR).
"Опухоль, поддающаяся лечению лекарственным средством", или "рак, поддающийся лечению лекарственным средством", и тому подобное понимают как опухоль или рак, при котором критерии ПО, ЧО или СЗ выполняются в присутствии или при введении лекарственного средства. В клеточной культуре чувствительная клетка представляет собой клетку, которая останавливает рост/деление или погибает в ответ на обработку лекарственным средством. Рак, поддающийся лечению, можно также понимать как тип рака, поддающийся лечению, например, тип рака, одобренный для лечения химиотерапевтическим агентом, представляющим собой нуклеотидный аналог, или тип рака, при котором в исследовании была получена польза для лечения такого рака. Например, типы рака, поддающиеся лечению терапевтическим агентом, представляющим собой нуклеотидный аналог, включают, но не ограничены ими, гематологические злокачественные опухоли, такие как лейкоз и лимфома, колоректальный рак, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичника, базально-клеточную карциному, рак мочевого пузыря, рак печени, рак простаты, рак желудка, рак почки, меланому, глиому, рак пищевода, рак шейки матки и миелодиспластические синдромы.
Рак, поддающийся лечению лекарственным средством, может стать раком, резистентным к лекарственному средству, часто в ответ на лечение лекарственным средством.
Термин "субъект" включает млекопитающих, например людей, собак, коров, лошадей, свиней, овец, коз, кошек, мышей, кроликов, крыс и трансгенных животных, отличных от людей. В некоторых воплощениях субъект представляет собой человека, например человека, страдающего раком, имеющего риск заболевания раком или потенциально способного к заболеванию раком. Субъекта-человека могут называть пациентом.
Термин "рак" включает злокачественные заболевания, характеризующиеся нерегулируемым или неконтролируемым клеточным ростом, например, карциномы, саркомы, лейкозы и лимфомы. Рак включает солидные опухоли или несолидные опухоли. Рак включает рак любого органа, включая поджелудочную железу. Термин "рак" включает первичные злокачественные опухоли, например, опухоли, клетки которых не мигрировали в сайты организма субъекта, иные, чем сайт исходной опухоли, и вторичные злокачественные опухоли, например, возникшие в результате метастаза, миграции опухолевых клеток к вторичным сайтам, отличным от сайта исходной опухоли.
Выражение "терапевтически эффективное количество" соединения, как используют в данной заявке, представляет собой количество соединения, необходимое или достаточное для получения результата ПО, ЧО или СЗ при введении субъекту, как описано в данной заявке. Понятно, что терапевтически эффективное количество каждого химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk для применения в комбинации друг с другом может быть недостаточно для эффективности при отдельном применении. Соединения, которые обладают терапевтическим эффектом, можно называть лекарственными средствами или фармацевтическими агентами.
Выражение "синергетическая комбинация" включает комбинации терапевтических агентов, где терапевтический результат введения комбинации лекарственных средств выше, чем аддитивный эффект, который ожидался бы для комбинации этих лекарственных средств. Например, в клетках или опухолях, которые являются устойчивыми к гемцитабину (то есть лечение гемцитабином не индуцирует ПО, ЧО или СЗ, то есть не оказывает эффекта), введение комбинации гемцитабина и дезинтегратора митоза/ингибитора биохимического пути Plk обладает большим терапевтическим эффектом, чем введение одного дезинтегратора митоза/ингибитора биохимического пути Plk.
Выражение "совместное введение" в данной заявке понимают как введение субъекту двух или более чем двух лекарственных средств для лечения одного заболевания или состояния, такого как рак, так что два лекарственных средства присутствуют и/или обладают активностью у субъекта одновременно. Совместное введение понимают как препарат в виде смеси лекарственных средств, которые нужно вводить вместе, препарат или композицию лекарственных средств в специфичных носителях или в специфичных концентрациях для облегчения смешивания и/или последовательного введения. Лекарственные средства могут быть упакованы вместе в одном и том же флаконе или бутылочке; или в отдельных бутылочках или флаконах в одном контейнере (например, коробке). Лекарственные средства не обязательно готовить особым образом для введения вместе. Понятно, что различные типы лекарственных средств обладают различными фармакокинетическими и фармакодинамическими свойствами, так что режимы введения могут существенно варьировать. Поэтому одновременное введение не требуется. Совместное введение химиотерапевтического агента, представляющего собой нуклеотидный аналог, и дезинтегратора митоза/ингибитора биохимического пути Plk не препятствует введению других химиотерапевтических агентов или других лекарственных средств. Примерные схемы для совместного введения представлены ниже.
Выражение "фармацевтически приемлемый носитель" известно в данной области техники и включает фармацевтически приемлемый материал, композицию или носитель, пригодный для введения соединений, используемых в способах, описанных в данной заявке, субъектам, например, млекопитающим. Носители включают жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, вовлеченный в перенос или транспортировку целевого агента из одного органа или части тела в другой орган или часть тела. Каждый носитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами композиции и безвредности для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и целлюлозы ацетат; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический физиологический раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы и другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях.
Соединения по изобретению
Предпочтительные соединения и способы по изобретению включают применение ингибитора Рlk1 ON-01910-Na ((E)-2,4,6-триметоксистирил-3-(карбоксиметиламино)-4-метоксибензилсульфона (Фиг.3А) и гемцитабина (4-амино-1-[3,3-дифтор-4-гидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил]-1Н-пиримидин-2-она), также известного как Gemzar® (Фиг.3Б).
Термин "дезинтегратор митоза/ингибитор биохимического пути Plk" и тому подобное, как используют в данной заявке, включает любую композицию, которая ингибирует киназную активность Plk (например, Plk1, Plk2, Plk3 или Plk4) или активность Plk в клетке, например, в результате снижения экспрессии Plk, либо ингибирует активность Plk непосредственно или посредством ингибирования компонента биохимического пути передачи сигнала Plk, в частности, Plk1; и обладает активностью в качестве дезинтегратора митоза. В предпочтительном воплощении ингибитор преимущественно ингибирует активность Plk по сравнению с активностью киназ, не представляющих собой Plk. Ингибитор Plk предпочтительно обладает активностью в 2 раза, в 5 раз, в 10 раз или в 20 раз выше при ингибировании киназы Plk по сравнению с ингибированием киназ, не представляющих собой Plk. Ингибитор Plk может быть специфичен для одной или более чем одной изоформы Plk. Альтернативно, активность ингибитора Plk можно измерить путем сравнения киназной активности Plk в присутствии и в отсутствие ингибитора. Ингибитор Plk ингибирует активность киназы Plk по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90% по сравнению с необработанным контролем.
Ингибиторы Plk могут ингибировать активность Plk в клетке посредством ингибирования экспрессии Plk в клетке, например, используя агент, представляющий собой антисмысловую РНК, направленную на Plk или миРНК, направленную на Plk соответствующего вида (например, Plk1 человека имеет №NM_005030 в GenBank, версия 3, обновлена 6 апреля 2008; Plk2 человека имеет №NM_006622 в GenBank, версия 2, обновлена 10 февраля 2008; Plk3 человека имеет №NM004073 в GenBank, версия 2, обновлена 11 февраля 2008; Plk4 человека имеет №Y13115 в GenBank, версия 1, обновлена 17 октября 2006; все номера GenBank включены в данную заявку посредством ссылки). Способ конструирования, синтеза, тестирования и введения антисмысловых олигонуклеотидов и соединений миРНК известны в данной области техники. Например, см. публикации патентов США №№20050107328 и 20070265438, обе из которых включены в данную заявку посредством ссылки.
Активность Plk1 в определенном количестве клеток или клеточного экстракта, обработанных соединением для снижения или ингибирования экспрессии Plk, сравнивают с таким же определенным количеством необработанных клеток или клеточного экстракта. Ингибирование можно измерить, используя любой стандартный анализ киназы, такой как раскрыт здесь или, например, в публикации РСТ WO 03/072062, включенной в данную заявку посредством ссылки. Дезинтеграторы митоза и ингибиторы Plk по изобретению также прерывают митоз, что можно легко наблюдать с помощью микроскопии, флуоресцентной сортировки клеток или другими способами.
Дезинтеграторы митоза предотвращают завершение правильного митоза, например, посредством прерывания распределения центросом, невозможностью цитокинеза, аномальных чисел хромосом и необратимых блоков в контрольных точках клеточного цикла. Дезинтеграторы митоза для применения в способе по изобретению предотвращают завершение митоза по меньшей мере в 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или большем числе клеток по сравнению с необработанным контролем.
В различных воплощениях изобретения дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой малую молекулу. Как используют в данной заявке, термин "малая молекула" относится к органическим соединениям, либо встречающимся в природе, либо искусственно созданным (например, путем химического синтеза), которые имеют относительно низкую молекулярную массу (например, менее чем примерно 7500, менее чем примерно 5000, менее чем примерно 1000 единиц молекулярной массы или менее чем примерно 500 единиц молекулярной массы), и которые не являются белками, полипептидами или нуклеиновыми кислотами. Типично малые молекулы имеют молекулярную массу менее чем примерно 1500 г/моль. Также малые молекулы типично имеют множественные углерод-углеродные связи. В одном воплощении малые молекулы не содержат исключительно пептидные (амидные) связи. В другом воплощении малые молекулы являются не олигомерными. Примерные низкомолекулярные соединения включают, но не ограничены ими, пептидомиметики, малые органические молекулы (например, Cane et al. 1998, Science 282:63; включено в данную заявку посредством ссылки) и библиотеки экстрактов натуральных продуктов. В другом воплощении эти соединения представляют собой малые органические непептидные соединения. В следующем воплощении малая молекула является не биосинтетической. Например, сама малая молекула предпочтительно не является продуктом транскрипции или трансляции.
В различных воплощениях изобретения дезинтегратор митоза/ингибитор биохимического пути Plk представляет собой терапевтическое средство на основе нуклеиновой кислоты. Как используют в данной заявке, термин "терапевтическое средство на основе нуклеиновой кислоты" и тому подобное относится к любому соединению на основе нуклеиновой кислоты, которое содержит нуклеотиды и обладает желаемым эффектом на ген-мишень. Терапевтические средства на основе нуклеиновой кислоты могут быть одно-, дву- или многонитевыми и могут содержать модифицированные или немодифицированные нуклеотиды, либо отличные от нуклеотидов соединения, либо их различные смеси и комбинации. Примеры терапевтических средств на основе нуклеиновой кислоты по изобретению включают, но не ограничены ими, антисмысловые нуклеиновые кислоты, днРНК (двунитевая РНК), миРНК и ферментативные соединения нуклеиновых кислот.
Ингибиторы Plk1 могут включать любое из ряда производных ON-01910-Na, которое ингибирует активность Plk1, преимущественно то, которое специфично ингибирует активность Plk1. Например, ингибиторы Plk1 включают ON01910-Na и его производные, которые понимают как любое соединение формулы (I):
где X выбран из группы, состоящей из (i) и (ii) ниже:
X1 выбран из группы, состоящей из (i), (ii) и (iii) ниже:
где X1 возможно защищен одной или более чем одной химической защитной группой;
g равно 0 или;
каждый M представляет собой двухвалентную соединительную группу, независимо выбранную из группы, состоящей из группы -(C1-C6-алкилен-, -(CH2)a-V-(CH2)b-, -(CH2)d-W-(CH2)e-и-Z-;
каждый у независимо выбран из группы, состоящей из 0 и 1;
каждый V независимо выбран из группы, состоящей из арилена, гетероарилена, -C(=O)-, -C(=S)-, -S(=O)-, -SO2-, -C(=O)O-; группы -C(=O)(C1-C6)перфторалкилен-, -C(=O)NR4-, -C(=S)NR4- и -SO2NR4-;
каждый W независимо выбран из группы, состоящей из -NR4-, -O- и -S-;
каждый a независимо выбран из группы, состоящей из 0, 1, 2 и 3;
каждый b независимо выбран из группы, состоящей из 0, 1, 2 и 3;
каждый d независимо выбран из группы, состоящей из 1, 2 и 3;
каждый e независимо выбран из группы, состоящей из 0, 1, 2 и 3;
-Z - представляет собой
где абсолютной стереохимией -Z- является D или L или смесь D и L;
каждый Ra независимо выбран из группы, состоящей из -Р, -(C1-C6)алкила, -(CH2)3-NH-C(NH2)(=NH), -CH2C(=O)NH2, -СН2СOOH, -CH2SH, -(CH2)2C(=O)-NH2, (СН2)2СОOH, группы CH2-(2-имидазолил), -CH(CH3)-CH2-CH3, -СН2СН(СН3)2, -(CH2)4-NH2, -(CH2)2-S-CH3, фенила, СН2-фенила, -СН2-OH, -СН(OH)-СН3, групп -СН2-(3-индолил), -СН2-(4-гидроксифенил), -СН(СН3)2 и -СН2-СН3; и включает соединения, где Ra и R1 объединены с образованием 5-, 6- или 7-членного гетероциклического кольца;
каждый R1 независимо выбран из группы, состоящей из -H, незамещенного арила, замещен