Кристаллические формы мононатриевой соли d-изоглутамил-d-триптофана
Иллюстрации
Показать всеНастоящее изобретение относится к кристаллическим модификациям: 1 (полиморфная форма F), 2 (полиморфная форма I) и 3 (полиморфная форма X) мононатриевой соли D-изоглутамил-D-триптофана (1:1), характеризующиеся пиками на порошковой рентгенограмме, представленными в материалах заявки, а также к содержащим их фармацевтическим композициям. Изобретение описывает их применение для лечения различных болезней и состояний организма, по меньшей мере, одного аутоиммунного заболевания, которое выбирают из группы, состоящей из псориаза, атопического дерматита и ревматоидного артрита. Также настоящее изобретение раскрывает способы получения завленных кристаллических модификаций мононатриевой соли D-изоглутамил-D-триптофана (1:1), 16 н. и 26 з.п. ф-лы, 4 пр., 9 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к кристаллическим формам мононатриевой соли D-изоглутамил-D-триптофана, способам их получения, фармацевтическим препаратам, содержащим их, а также их применение для лечения различных состояний и заболеваний. Более конкретно, настоящее изобретение относится к кристаллической модификации 1 (полиморфная форма F), кристаллической модификации 2 (полиморфная форма I) и кристаллической модификации 3 (полиморфная форма X) мононатриевой соли D-изоглутамил-D-триптофана.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
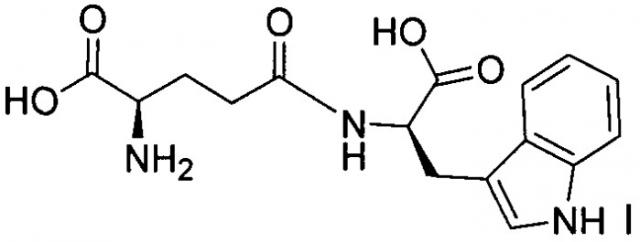
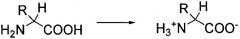
Соединение D-изоглутамил-D-триптофан (известное также, как H-D-γ-Glu-D-Trp-OH или H-D-iGlu-D-Trp-OH, или iDD, или D-(iEW), или тимодепрессин) представляет собой синтетический геморегулирующий дипептид, имеющий следующую химическую структуру:
.
Тимодепрессин относится к свободным дикислотам. Химической реферативной службой (ХРС) ему присвоен регистрационный номер ® 186087-26-3. Он является иммуносупрессантом и селективно ингибирует пролиферацию клеток костного мозга. Его действие эффективно для подавления иммунной системы во время пересадки костного мозга, органов и тканей (Семина О.В. и др. (2001) Бюллетень экспериментальной биологии и медицины, 131(5), 493-495); для защиты клеток костного мозга и иммунной системы от разрушающего действия химиотерапии и облучения (патенты США №№ 5736519, 6103699 и 6410515); а также для лечения аутоиммунных заболеваний, таких как псориаз и атопический дерматит (Сапунцова С.Г. и др. (май 2002), Бюллетень экспериментальной биологии и медицины, 133(5), 488-490).
Способ получения тимодепрессина описан в примере 1 патентов США №№ 5736519, 6103699 и 6410515. Однако производство тимодепрессина в крупных промышленных масштабах на основе экспериментальных деталей этого способа не представляется возможным, поскольку результатом этого способа является смесь D-глутамил-D-триптофана и D-изоглутамил-D-триптофана, которую затем необходимо разделить и очистить посредством ионообменной хроматографии, что дает в итоге очень низкий (12,25%) выход готового тимодепрессина.
Патенты США №№ 5736519, 6103699 и 6410515 показывают, что описанные в них пептиды могут быть преобразованы в кислотно-аддитивные соли путем реакции с неорганическими кислотами, включая хлористоводородную кислоту, серную кислоту, бромистоводородную кислоту, фосфорную кислоту и т.п., или с органическими кислотами, включая муравьиную кислоту, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, молочную кислоту, щавелевую кислоту, янтарную кислоту, яблочную кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, салициловую кислоту, бензолсульфоновую кислоту и толуолосульфоновые кислоты. Однако в этих патентах не описаны ни основно-аддитивные соли тимодепрессина, ни способы получения таких солей.
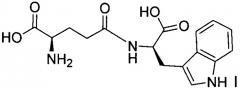
Тимодепрессин не является биодоступным как лекарственное средство для перорального применения в традиционной форме - в виде таблеток или капсул. В настоящее время, являясь твердым, он продается в России в виде динатриевой соли в форме жидкого препарата для инъекций и интраназального введения при лечении псориаза, атопического дерматита и ревматоидного артрита. Твердая форма динатриевой соли D-изоглутамил-D-триптофана представляет собой аморфный порошок, обладающий высокой гигроскопичностью, и обращение с ним весьма затруднено. Динатриевая соль D-изоглутамил-D-триптофана имеет молекулярную формулу C16H17N3Na2O5 и следующую химическую структуру:
Динатриевая соль D-изоглутамил-D-триптофана не была идентифицирована регистрационной системой ХРС, не внесена в регистрационный файл XPCSM и не имеет присвоенного ей регистрационного номера ХРС®. Идентификация и определение структуры динатриевой соли D-изоглутамил-D-триптофана были выполнены посредством инфракрасной (ИК) спектроскопии (Каширин Д.М. и др. (2000), Химико-фармацевтический журнал, 34(11), 619-622). Однако несмотря на то, что динатриевая соль D-изоглутамил-D-триптофана известна, ее получение, выделение и дальнейшая характеристика свойств не описаны.
Путем проведения исследований в своей лаборатории авторы изобретения определили, что лиофилизированная динатриевая соль D-изоглутамил-D-триптофана обладает крайне высокой гигроскопичностью, превращаясь на открытом воздухе в гель за считанные минуты, поэтому обращение с ней весьма затруднено. Использование для фармацевтических потребностей порошковой или аморфной формы соединения может привести к увеличению проблем производства, связанных с вопросами объемной плотности выхода, гигроскопичности и варьирующимся содержанием воды, что не может быть исправлено путем вакуумной сушки. D-изоглутамил-D-триптофан является дипептидом, и высушивание его аморфной формы при повышенной температуре, например, 80-100°C, в вакууме не рекомендуется. Таким образом, способы очистки динатриевой соли D-изоглутамил-D-триптофана и получения чистой динатриевой соли в промышленном масштабе связаны с серьезными трудностями. Кроме того, как уже упоминалось выше, способ ее получения не опубликован.
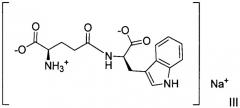
Мононатриевая соль D-изоглутамил-D-триптофана идентифицирована регистрационной системой ХРС, занесена в регистрационный файл XPCSM под регистрационным номером ® 863988-88-9, она имеет следующую химическую структуру:
Однако не существует источников, описывающих мононатриевую соль D-изоглутамил-D-триптофана, а следовательно, нет публикаций о ней, о ее физических и/или химических свойствах, ее характеристике в твердом состоянии или о способе ее получения и выделения. Таким образом, не существует свидетельств, подтверждающих существование мононатриевой соли D-изоглутамил-D-триптофана.
Объемная плотность выхода лиофилизированных порошков мононатриевых и динатриевых солей пептидных лекарственных средств может не поддаваться контролю в диапазонах значений, требуемых для формулирования лекарственных средств, что может потребовать значительных вложений в технологию дисперсии на основе сублимационной сушки.
Поэтому существует потребность в разработке фармацевтически приемлемых солей D-изоглутамил-D-триптофана в кристаллической форме. Такие кристаллические соли в общем случае могут быть очищены значительно легче, чем аморфная форма, и могут обладать другими полезными свойствами, например, связанными с их конкретной кристаллической формой, и/или характеристиками растворимости, и/или отсутствием гигроскопичности у них, и/или их характеристиками стабильности, включая свойства термической стабильности и/или их способность противостоять окислительной деструкции.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ранее авторами данной заявки были изобретены способ получения D-изоглутамил-D-триптофана и кристаллического полиморфа, новая стабильная моноаммониевая соль и способ получения этой моноаммониевой соли. Эти вопросы были предметом заявки на патент Канады № 2569204, поданной 28 ноября 2006 года и включенной в настоящую заявку путем ссылки. Авторами также ранее были изобретены кальциевая, магниевая, калиевая и литиевая соли D-изоглутамил-D-триптофана и способы получения этих солей. Эти вопросы были предметом заявки на патент Канады № 2571645, поданной 19 декабря 2006 года и включенной в настоящую заявку путем ссылки.
Для способов производства дипептидных фармацевтических препаратов часто бывает полезно задействовать карбоксильную группу в виде конкретной натриевой соли, обладающей, например, более предпочтительным значением растворимости, более предпочтительными характеристиками абсорбции, лучшей стабильностью, более предпочтительным значением pH, или, в целом, более предпочтительным набором характеристик.
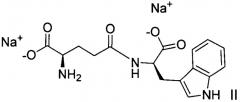
Авторы изобретения установили, что D-изоглутамил-D-триптофан, взаимодействуя с гидроокисью натрия, может образовывать соли, например, мононатриевую соль, в которой атом водорода в карбоновой кислоте замещается ионом натрия, и которая может быть формально представлена формулой III, или динатриевую соль, в которой два атома водорода замещаются двумя атомами натрия, и которая может быть формально представлена формулой II.
Авторами изобретения было проведено исследование видообразования, итоги которого представлены диаграммой на фиг.1. Авторы определили, что для применения в фармацевтических препаратах определенное преимущество имеет мононатриевая соль D-изоглутамил-D-триптофана, которая может быть формально представлена формулой III, и которая представляет собой главным образом фармацевтическую соль с нейтральным pH. Это преимущество определяется тем, что аминокислота является цвиттер-ионом. Авторы установили, что мононатриевая соль, представленная формулой III, является наиболее предпочтительной солью для получения фармацевтических препаратов. Динатриевая соль, представленная формулой II, является предпочтительней при pH около 12 или выше. Раствор динатриевой соли в воде будет иметь значение pH приблизительно равное 12, и поэтому эта соль не пригодна для применения в жидких препаратах. Доведение pH раствора динатриевой соли до значений в диапазоне приблизительно от 7 до 7,4 фактически дает мононатриевую соль в качестве предпочтительной соли в растворе.
Поэтому целью настоящего изобретения является получение мононатриевой соли D-изоглутамил-D-триптофана в форме, удобной для фармацевтического применения, и полученной при помощи способа, пригодного для осуществления в большом промышленном масштабе.
Стабильную кристаллическую мононатриевую соль можно использовать в фармацевтических препаратах соответствующего состава, и способ введения которых обеспечивает лечебное воздействие, требуемое в данном конкретном случае.
Сейчас авторами изобретения было установлено, что мононатриевая соль D-изоглутамил-D-триптофана может быть получена в твердой кристаллической форме, пригодной для фармацевтического применения, путем реакции D-изоглутамил-D-триптофана с основными соединениями натрия, например, с гидроокисью натрия. В качестве явных химических эквивалентов гидроокиси натрия могут рассматриваться гидрид натрия, карбонат натрия, бикарбонат натрия, алкоголяты натрия C1-C4. Неожиданностью оказалось то, что твердая кристаллическая мононатриевая соль D-изоглутамил-D-триптофана может быть получена в виде нескольких различных кристаллических модификаций, т.е. в полиморфных формах, которые имеют отличающиеся физико-химические свойства и которые могут быть получены путем регулирования условий реакции и/или кристаллизации. В целом, эти кристаллические модификации могут отличаться друг от друга такими характеристиками, как, например, растворимость, скорость растворения или поведение в способе получения фармацевтического препарата, что позволяет осуществлять производство фармацевтических препаратов с разными наборами свойств из одного исходного соединения.
В соответствии с одним из аспектов настоящего изобретения представлена мононатриевая соль D-изоглутамил-D-триптофана в кристаллической форме.
В другом воплощении настоящего изобретения кристаллическая форма мононатриевой соли D-изоглутамил-D-триптофана при анализе способом рентгеновской дифракции дает отчетливые пики, имеющие ширину на половине высоты, менее 2º, при измерениях с углом отражения 2θ с использованием CuKα излучения.
В другом воплощении настоящего изобретения кристаллическая форма мононатриевой соли D-изоглутамил-D-триптофана представляет собой кристаллическую модификацию 1 (полиморфную форму F).
В другом воплощении настоящего изобретения картина порошковой рентгеновской дифракции (порошковая рентгенограмма) кристаллической модификации 1 (полиморфной формы F) мононатриевой соли D-изоглутамил-D-триптофана имеет вид, показанный на фиг.2.
Еще в одном воплощении настоящего изобретения кристаллическая модификация 1 (полиморфная форма F) мононатриевой соли D-изоглутамил-D-триптофана характеризуется пиками на порошковой рентгенограмме при следующих значениях 2θ: 9,23±0,20; 9,91±0,20; 12,41±0,20; 13,76±0,20; 14,87±0,20; 15,75±0,20; 17,88±0,20; 18,78±0,20; 19,57±0,20; 19,84±0,20; 20,31±0,20; 21,32±0,20; 21,55±0,20; 22,95±0,20; 23,45±0,20; 24,34±0,20; 24,96±0,20; 27,49±0,20; 27,94±0,20; 29,27±0,20; 30,07±0,20; 30,43±0,20; 31,29±0,20; 32,25±0,20; 34,07±0,20; 34,94±0,20; 35,53±0,20; 36,08±0,20; 37,21±0,20; 38,17±0,20; 39,19±0,20; и 9,23±0,20.
Еще в одном воплощении настоящего изобретения кристаллическая модификация 1 (полиморфная форма F) мононатриевой соли D-изоглутамил-D-триптофана характеризуется пиками на порошковой рентгенограмме при следующих значениях 2θ: 9,23±0,10; 9,91±0,10; 12,41±0,10; 13,76±0,10; 14,87±0,10; 15,75±0,10; 17,88±0,10; 18,78±0,10; 19,57±0,10; 19,84±0,10; 20,31±0,10; 21,32±0,10; 21,55±0,10; 22,95±0,10; 23,45±0,10; 24,34±0,10; 24,96±0,10; 27,49±0,10; 27,94±0,10; 29,27±0,10; 30,07±0,10; 30,43±0,10; 31,29±0,10; 32,25±0,10; 34,07±0,10; 34,94±0,10; 35,53±0,10; 36,08±0,10; 37,21±0,10; 38,17±0,10; 39,19±0,10; и 9,23±0,10.
Еще в одном воплощении настоящего изобретения кристаллическая модификация 1 (полиморфная форма F) мононатриевой соли D-изоглутамил-D-триптофана характеризуется следующей порошковой рентгенограммой, выраженной в терминах межплоскостных расстояний d, углов Брэгга 2θ, и относительной интенсивности (выраженной в процентах по отношению к лучу наибольшей интенсивности):
| 2θ (°) | D-расстояние (ангстрем) | Относительная интенсивность (%) |
| 9,23 | 9,573 | 2 |
| 9,91 | 8,917 | 41,3 |
| 12,41 | 7,126 | 37,6 |
| 13,76 | 6,43 | 0,8 |
| 14,87 | 5,954 | 35,8 |
| 15,75 | 5,622 | 7,6 |
| 17,88 | 4,957 | 5,5 |
| 18,78 | 4,721 | 58,9 |
| 19,57 | 4,532 | 30,9 |
| 19,84 | 4,471 | 28,1 |
| 20,31 | 4,368 | 2,9 |
| 21,32 | 4,165 | 53,5 |
| 21,55 | 4,12 | 30,3 |
| 22,95 | 3,873 | 67,4 |
| 23,45 | 3,79 | 24,5 |
| 24,34 | 3,654 | 19,4 |
| 24,96 | 3,565 | 85,2 |
| 27,49 | 3,242 | 100 |
| 27,94 | 3,19 | 23,3 |
| 29,27 | 3,049 | 19,1 |
| 30,07 | 2,97 | 27,2 |
| 30,43 | 2,935 | 15,2 |
| 31,29 | 2,856 | 39,9 |
| 32,25 | 2,774 | 13 |
| 34,07 | 2,629 | 19,3 |
| 34,94 | 2,566 | 7,8 |
| 35,53 | 2,525 | 5 |
| 36,08 | 2,487 | 8,4 |
| 37,21 | 2,414 | 15,5 |
| 38,17 | 2,356 | 9,1 |
| 39,19 | 2,297 | 3,1 |
В другом воплощении настоящего изобретения кристаллическая форма мононатриевой соли D-изоглутамил-D-триптофана представляет собой кристаллическую модификацию 2 (полиморфную форму I).
В другом воплощении настоящего изобретения порошковая рентгенограмма кристаллической модификации 2 (полиморфной формы I) мононатриевой соли D-изоглутамил-D-триптофана имеет вид, показанный на фиг.3.
В другом воплощении настоящего изобретения кристаллическая модификация 2 (полиморфная форма I) мононатриевой соли D-изоглутамил-D-триптофана характеризуется пиками на порошковой рентгенограмме при следующих значениях 2θ: 9,65±0,20; 10,41±0,20; 11,2±0,20; 11,71±0,20; 13,45±0,20; 13,93±0,20; 14,44±0,20; 15,61±0,20; 17,01±0,20; 18,18±0,20; 18,65±0,20; 20,02±0,20; 20,85±0,20; 21,39±0,20; 21,73±0,20; 22,52±0,20; 23,27±0,20; 24,3±0,20; 25,84±0,20; 26,82±0,20; 28,49±0,20; 30,18±0,20; 30,76±0,20; 31,49±0,20; 33,03±0,20; 34,55±0,20; 34,97±0,20; 35,74±0,20; 37,25±0,20; 37,71±0,20; и 38,79±0,20.
В другом воплощении настоящего изобретения кристаллическая модификация 2 (полиморфная форма I) мононатриевой соли D-изоглутамил-D-триптофана характеризуется пиками на порошковой рентгенограмме при следующих значениях 2θ: 9,65±0,10; 10,41±0,10; 11,2±0,10; 11,71±0,10; 13,45±0,10; 13,93±0,10; 14,44±0,10; 15,61±0,10; 17,01±0,10; 18,18±0,10; 18,65±0,10; 20,02±0,10; 20,85±0,10; 21,39±0,10; 21,73±0,10; 22,52±0,10; 23,27±0,10; 24,3±0,10; 25,84±0,10; 26,82±0,10; 28,49±0,10; 30,18±0,10; 30,76±0,10; 31,49±0,10; 33,03±0,10; 34,55±0,10; 34,97±0,10; 35,74±0,10; 37,25±0,10; 37,71±0,10; и 38,79±0,10.
В другом воплощении настоящего изобретения кристаллическая модификация 2 (полиморфная форма I) мононатриевой соли D-изоглутамил-D-триптофана характеризуется следующей порошковой рентгенограммой, выраженной в терминах межплоскостных расстояний d, углов Брэгга 2θ, и относительной интенсивности (выраженной в процентах по отношению к лучу наибольшей интенсивности):
| 2θ (°) | D-расстояние (ангстрем) | Относительная интенсивность (%) |
| 9,65 | 9,161 | 5,3 |
| 10,41 | 8,492 | 23,7 |
| 11,2 | 7,897 | 40,4 |
| 11,71 | 7,549 | 4,5 |
| 13,45 | 6,58 | 90,2 |
| 13,93 | 6,351 | 15,9 |
| 14,44 | 6,128 | 3,7 |
| 15,61 | 5,672 | 32,4 |
| 17,01 | 5,207 | 9,9 |
| 18,18 | 4,876 | 11,7 |
| 18,65 | 4,755 | 47,8 |
| 20,02 | 4,432 | 59,2 |
| 20,85 | 4,257 | 35,9 |
| 21,39 | 4,15 | 24,1 |
| 21,73 | 4,086 | 27,3 |
| 22,52 | 3,945 | 100 |
| 23,27 | 3,819 | 13,7 |
| 24,3 | 3,66 | 32,4 |
| 25,84 | 3,445 | 69,5 |
| 26,82 | 3,322 | 82,5 |
| 28,49 | 3,13 | 30,1 |
| 30,18 | 2,959 | 58,8 |
| 30,76 | 2,904 | 86,9 |
| 31,49 | 2,839 | 35,3 |
| 33,03 | 2,71 | 8,7 |
| 34,55 | 2,594 | 17,8 |
| 34,97 | 2,564 | 43,4 |
| 35,74 | 2,51 | 8,5 |
| 37,25 | 2,412 | 28,1 |
| 37,71 | 2,383 | 28,5 |
| 38,79 | 2,319 | 16,9 |
Еще в одном воплощении настоящего изобретения кристаллическая форма мононатриевой соли D-изоглутамил-D-триптофана представляет собой кристаллическую модификацию 3 (полиморфную форму X).
В другом воплощении настоящего изобретения порошковая рентгенограмма кристаллической модификации 3 (полиморфной формы X) мононатриевой соли D-изоглутамил-D-триптофана имеет вид, показанный на фиг.4.
Еще в одном воплощении настоящего изобретения кристаллическая модификация 3 (полиморфная форма Х) мононатриевой соли D-изоглутамил-D-триптофана характеризуется пиками на порошковой рентгенограмме при следующих значениях 2θ: 9,187±0,200; 11,058±0,200; 11,713±0,200; 12,239±0,200; 13,785±0,200; 14,806±0,200; 15,763±0,200; 17,126±0,200; 17,693±0,200; 18,268±0,200; 18,562±0,200; 19,261±0,200; 20,033±0,200; 20,63±0,200; 21,006±0,200; 21,778±0,200; 22,268±0,200; 23,054±0,200; 23,361±0,200; 23,851±0,200; 24,626±0,200; 24,981±0,200; 25,507±0,200; 26,257±0,200; 26,963±0,200; 27,329±0,200; 27,807±0,200; 28,243±0,200; 28,975±0,200; 29,264±0,200; 29,687±0,200; 30,409±0,200; 30,798±0,200; 31,193±0,200; 31,724±0,200; 32,505±0,200; 32,985±0,200; 33,645±0,200; 34,249±0,200; 34,587±0,200; 35,048±0,200; 35,41±0,200; 35,933±0,200; 36,833±0,200; 37,276±0,200; 37,937±0,200; 38,467±0,200; и 39±0,200.
Еще в одном воплощении настоящего изобретения кристаллическая модификация 3 (полиморфная форма Х) мононатриевой соли D-изоглутамил-D-триптофана характеризуется пиками на порошковой рентгенограмме при следующих значениях 2θ: 9,187±0,100; 11,058±0,100; 11,713±0,100; 12,239±0,100; 13,785±0,100; 14,806±0,100; 15,763±0,100; 17,126±0,100; 17,693±0,100; 18,268±0,100; 18,562±0,100; 19,261±0,100; 20,033±0,100; 20,63±0,100; 21,006±0,100; 21,778±0,100; 22,268±0,100; 23,054±0,100; 23,361±0,100; 23,851±0,100; 24,626±0,100; 24,981±0,100; 25,507±0,100; 26,257±0,100; 26,963±0,100; 27,329±0,100; 27,807±0,100; 28,243±0,100; 28,975±0,100; 29,264±0,100; 29,687±0,100; 30,409±0,100; 30,798±0,100; 31,193±0,100; 31,724±0,100; 32,505±0,100; 32,985±0,100; 33,645±0,100; 34,249±0,100; 34,587±0,100; 35,048±0,100; 35,41±0,100; 35,933±0,100; 36,833±0,100; 37,276±0,100; 37,937±0,100; 38,467±0,100; и 39±0,100.
В другом воплощении настоящего изобретения кристаллическая модификация 3 (полиморфная форма Х) мононатриевой соли D-изоглутамил-D-триптофана характеризуется следующей порошковой рентгенограммой, выраженной в терминах межплоскостных расстояний d, углов Брэгга 2θ, и относительной интенсивности (выраженной в процентах по отношению к лучу наибольшей интенсивности):
| 2Θ (°) | D-расстояние (Ангстрем) | Относительная интенсивность (%) |
| 9,187 | 9,618 | 25,4 |
| 11,058 | 7,995 | 2,3 |
| 11,713 | 7,549 | 18,7 |
| 12,239 | 7,226 | 34,2 |
| 13,785 | 6,419 | 23,5 |
| 14,806 | 5,978 | 13 |
| 15,763 | 5,618 | 5 |
| 17,126 | 5,173 | 29,3 |
| 17,693 | 5,009 | 8,4 |
| 18,268 | 4,852 | 48,2 |
| 18,562 | 4,776 | 28,2 |
| 19,261 | 4,604 | 14,3 |
| 20,033 | 4,429 | 14,5 |
| 20,63 | 4,302 | 17,2 |
| 21,006 | 4,226 | 12 |
| 21,778 | 4,078 | 2,4 |
| 22,268 | 3,989 | 100 |
| 23,054 | 3,855 | 6,4 |
| 23,361 | 3,805 | 7,4 |
| 23,851 | 3,728 | 1,8 |
| 24,626 | 3,612 | 14,9 |
| 24,981 | 3,562 | 14,7 |
| 25,507 | 3,489 | 11,1 |
| 26,257 | 3,391 | 34,3 |
| 26,963 | 3,304 | 11,1 |
| 27,329 | 3,261 | 20,6 |
| 27,807 | 3,206 | 35 |
| 28,243 | 3,157 | 25,6 |
| 28,975 | 3,079 | 1,1 |
| 29,264 | 3,049 | 2,3 |
| 29,687 | 3,007 | 9,5 |
| 30,409 | 2,937 | 20,9 |
| 30,798 | 2,901 | 6,1 |
| 31,193 | 2,865 | 6,9 |
| 31,724 | 2,818 | 24,7 |
| 32,505 | 2,752 | 8 |
| 32,985 | 2,713 | 12,1 |
| 33,645 | 2,662 | 26,5 |
| 34,249 | 2,616 | 15,2 |
| 34,587 | 2,591 | 8,6 |
| 35,048 | 2,558 | 4,6 |
| 35,41 | 2,533 | 3,3 |
| 35,933 | 2,497 | 15,3 |
| 36,833 | 2,438 | 8 |
| 37,276 | 2,41 | 10,8 |
| 37,937 | 2,37 | 12,7 |
| 38,467 | 2,338 | 14,7 |
| 39 | 2,308 | 2,6 |
В другом воплощении настоящего изобретения кристаллическая форма мононатриевой соли D-изоглутамил-D-триптофана представляет собой смесь кристаллической модификации 1 (полиморфная форма F) и кристаллической модификации 2 (полиморфная форма I) мононатриевой соли D-изоглутамил-D-триптофана.
В другом воплощении настоящего изобретения кристаллическая форма мононатриевой соли D-изоглутамил-D-триптофана представляет собой смесь кристаллической модификации 1 (полиморфная форма F) и кристаллической модификации 3 (полиморфная форма Х) мононатриевой соли Д-изоглутамил-Д-триптофана.
В другом воплощении настоящего изобретения порошковая рентгенограмма смеси кристаллических модификаций 1 (полиморфная форма F) и 3 (полиморфная форма X) мононатриевой соли D-изоглутамил-D-триптофана имеет вид, показанный на фиг.9.
В соответствии с другим аспектом настоящего изобретения представлена фармацевтическая композиция, содержащая любую из описанных выше кристаллических форм мононатриевой соли D-изоглутамил-D-триптофана, а также, по меньшей мере, один фармацевтически приемлемый носитель.
В соответствии с другим аспектом настоящего изобретения представлен способ получения фармацевтической композиции, содержащей любую из описанных кристаллических форм мононатриевой соли D-изоглутамил-D-триптофана, включающий комбинирование любой из описанных выше кристаллических форм мононатриевой соли D-изоглутамил-D-триптофана с, по меньшей мере, одним фармацевтически приемлемым носителем.
В соответствии с другим аспектом настоящего изобретения предлагается применение любой из описанных кристаллических форм мононатриевой соли D-изоглутамил-D-триптофана без хроматографической очистки при получении фармацевтической композиции.
В соответствии с другим аспектом настоящего изобретения предлагается применение любой из описанных кристаллических форм мононатриевой соли D-изоглутамил-D-триптофана в качестве средства против псориаза.
В соответствии с другим аспектом настоящего изобретения предлагается способ получения мононатриевой соли D-изоглутамил-D-триптофана в кристаллической форме, включающий стадии:
(a) получение раствора D-изоглутамил-D-триптофана и гидроокиси натрия в воде при pH приблизительно от 6,5 до 7,2;
(б) фильтрование раствора с целью удаления твердых частиц;
(в) упаривание воды с целью концентрирования фильтрата; и
(г) добавление изопропанола с целью осаждения мононатриевой соли D-изоглутамил-D-триптофана,
или
(д) перемешивание твердого вещества, полученного на стадиях (a), (б), (в) и (г) способа с этилацетатом; и
(е) фильтрование твердого вещества,
или
после описанных выше стадий (a) и (б) выполняются следующие стадии:
(ж) упаривание фильтрата, полученного на стадии (б), с целью получения твердого вещества;
(з) добавление воды с целью получения раствора мононатриевой соли D-изоглутамил-D-триптофана; и
(и) упаривание воды в течение периода времени, превышающего 5 часов для получения мононатриевой соли D-изоглутамил-D-триптофана в кристаллической форме,
или
(к) получение раствора мононатриевой соли D-изоглутамил-D-триптофана в метаноле;
(л) фильтрование раствора с целью удаления твердых частиц; и
(м) добавление изопропанола с целью осаждения мононатриевой соли D-изоглутамил-D-триптофана,
или
(н) получение раствора моноаммониевой соли D-изоглутамил-D-триптофана и гидроокиси натрия в воде,
после чего выполняются описанные выше стадии (б), (в) и (г).
В одном из воплощений настоящего изобретения, когда способ включает стадии (a), (б), (в) и (г), продолжительность перемешивания на стадии (г) составляет приблизительно от 1,5 до 16 часов.
В другом воплощении настоящего изобретения, когда способ включает стадии (a), (б), (в) и (г), продолжительность перемешивания на стадии (г) составляет приблизительно 1 час.
В другом воплощении настоящего изобретения, когда способ включает стадии (a), (б), (в), (г), (д) и (е), продолжительность перемешивания на стадии (г) составляет приблизительно 1 час, а продолжительность перемешивания в этилацетате на стадии (е) составляет приблизительно 2,5 часа.
В другом воплощении настоящего изобретения, когда способ включает стадии (a), (б), (ж), (з) и (и), на стадии (з) добавляют воду из расчета приблизительно от 18 до 22 мл воды на каждый грамм мононатриевой соли D-изоглутамил-D-триптофана, а продолжительность упаривания на стадии (и) составляет приблизительно от 5 до 6 часов при температуре упаривания в диапазоне приблизительно от 30 до 35°C.
В другом воплощении настоящего изобретения, когда способ включает стадии (к), (л) и (м), на стадии (к) берется приблизительно от 11 до 13 мл метанола на каждый 1 г мононатриевой соли D-изоглутамил-D-триптофана, а отношение изопропанола к метанолу на стадии (м) составляет приблизительно 0,4-0,6 мл к 1 мл.
В другом воплощении настоящего изобретения, когда способ включает стадии (н), (б), (в) и (г), продолжительность перемешивания на стадии (г) составляет приблизительно от 12 до 16 часов.
Другие и дальнейшие преимущества и особенности настоящего изобретения станут понятными для специалистов в данной отрасли из последующего подробного описания изобретения, поданного совместно с сопутствующими чертежами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Сопутствующие фигуры представляют собой:
Фиг.1 - диаграмма видообразования дипептида H-D-iGlu-D-Trp-OH и его соли, вычисленная на основе экспериментально определенных значений pKa кислотных и аминных групп.
Фиг.2 - характеристическая порошковая рентгенограмма кристаллической модификации 1 (полиморфной формы F) мононатриевой соли D-изоглутамил-D-триптофана.
Фиг.3 - характеристическая порошковая рентгенограмма кристаллической модификации 2 (полиморфной формы I) мононатриевой соли D-изоглутамил-D-триптофана.
Фиг.4 - характеристическая порошковая рентгенограмма кристаллической модификации 3 (полиморфной формы Х) мононатриевой соли D-изоглутамил-D-триптофана.
Фиг.5 - характеристический спектр инфракрасного (ИК) поглощения кристаллической модификации 1 (полиморфной формы F) мононатриевой соли D-изоглутамил-D-триптофана.
Фиг.6 - характеристический спектр инфракрасного (ИК) поглощения кристаллической модификации 2 (полиморфной формы I) мононатриевой соли D-изоглутамил-D-триптофана.
Фиг.7 - характеристический спектр инфракрасного (ИК) поглощения кристаллической модификации 3 (полиморфной формы Х) мононатриевой соли D-изоглутамил-D-триптофана.
Фиг.8 представляет собой сравнение порошковой рентгенограммы кристаллической модификации 1 (полиморфной формы F), кристаллической модификации 2 (полиморфной формы I) и кристаллической модификации 3 (полиморфной формы Х) мононатриевой соли D-изоглутамил-D-триптофана.
Фиг.9 - характеристическая порошковая рентгенограмма смеси кристаллической модификации 1 (полиморфной формы F) и кристаллической модификации 3 (полиморфной формы Х) мононатриевой соли D-изоглутамил-D-триптофана.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем описании D-изоглутамил-D-триптофан представлен в виде дипептида
Химия аминокислот или простых дипептидов усложняется тем фактом, что группа -NH2 представляет собой основание, а группа -CO2H представляет собой кислоту. Поэтому в водном растворе ион H+ переходит от одного конца молекулы на другой, образуя цвиттер-ионы.
Цвиттер-ионы являются одновременно и электрически заряженными, и электрически нейтральными. Они содержат положительные и отрицательные заряды, однако, общий заряд молекулы равен нулю. Хотя и не в полном соответствии с теоретическим обоснованием, аминокислотная группа iGlu молекулы H-D-iGlu-D-Trp-OH существует в виде цвиттер-иона, и, следовательно, для образования соли остается только одна группа -CO2H, когда только один эквивалент одновалентной гидроокиси натрия используется для доведения pH к нейтральным значениям. Если мононатриевую соль H-D-iGlu-D-Trp-OH согласно формуле III представить в показанном выше формате, то только одна группа CO2H способна принять один атом металла натрия, что дает в результате соль согласно формуле III. В соединении формулы (III) катион натрия замещает один атом водорода в той части соединения формулы (I), которая представляет собой карбоновую кислоту.
Фиг.1 представляет собой диаграмму видообразования дипептида H-D-iGlu-D-Trp-OH и его соли, вычисленную при помощи программы Hyperquad Simulation & Speciation с использованием полученных на основе эксперимента значений pKa кислотных и аминных групп. LH2=H-D-iGlu-D-Trp-OH в дикислотной форме, представленной соединением формулы I, LH=соль монокарбоновой кислоты, такая, как мононатриевая соль, представленная соединением формулы III, L=соль дикарбоновой кислоты, такая, как динатриевая соль, представленная соединением формулы II, LH3=кислотно-аддитивная соль соединения H-D-iGlu-D-Trp-OH, например, такая, как моногидрохлоридная соль соединения формулы I, где к группе NH2 добавляется протон. На оси Х представлены значения pH раствора. По оси Y определяются молярные доли видов соединений, присутствующих при конкретных значениях pH. Следует отметить: доля вида соединения в % по отношению к L представляет собой терминологию программы, принятую по умолчанию. Концентрация 0,5 M используется для того, чтобы отразить эквивалентность 1 г тимодепрессина в 6 мл воды во время способа выделения. Эта фиг.1 показывает, что практически 100% тимодепрессина находится в форме мононатриевой соли в воде при pH в диапазоне приблизительно от 7,0 до 7,4.
Настоящее изобретение направлено на новую мононатриевую соль D-изоглутамил-D-триптофана согласно формуле (III), новые кристаллические формы мононатриевой соли D-изоглутамил-D-триптофана, включая новую кристаллическую модификацию 1 (полиморфную форму F), новую кристаллическую модификацию 2 (полиморфную форму I) и новую кристаллическую модификацию 3 (полиморфную форму Х).
Настоящее изобретение также направлено на способ получения новой кристаллической модификации 1 (полиморфной формы F), новой кристаллической модификации 2 (полиморфной формы I), новой кристаллической модификации 3 (полиморфной формы X), а также смеси новых кристаллических модификаций 1 и 3 мононатриевой соли D-изоглутамил-D-триптофана, причем этот способ включает следующие стадии:
(a) получение раствора D-изоглутамил-D-триптофана и гидроокиси натрия в воде при pH приблизительно от 6,5 до 7,0;
(б) фильтрование раствора с целью удаления твердых частиц;
(в) упаривание воды с целью концентрирования фильтрата;
(г) добавление изопропанола с целью осаждения мононатриевой соли D-изоглутамил-D-триптофана,
или
описанные выше стадии (a), (б), (в) и (г), после которых следуют стадии:
(д) перемешивание твердого вещества, полученного на стадиях (a), (б), (в) и (г) способа, с этилацетатом; и
(е) фильтрование твердого вещества,
или
описанные выше стадии (a) и (б), после которых выполняются стадии:
(ж) упаривание воды из фильтрата, полученного на стадии (б) с целью получения твердого вещества;
(з) добавление воды с целью получения раствора мононатриевой соли D-изоглутамил-D-триптофана; и
(и) упаривание воды в течение периода времени, превышающего 5 часов, для получения мононатриевой соли D-изоглутамил-D-триптофана в кристаллической форме,
или
(к) получение раствора мононатриевой соли D-изоглутамил-D-триптофана в метаноле;
(л) фильтрование раствора с целью удаления твердых частиц;
(м) добавление изопропанола с целью осаждения мононатриевой соли D-изоглутамил-D-триптофана,
или
(н) получение раствора моноаммониевой соли D-изоглутамил-D-триптофана и гидроокиси натрия в воде,
после чего выполняются описанные выше стадии (б), (в) и (г).
В предпочтительном варианте способ, включающий описанные выше стадии (а), (б), (в) и (г), применяется для получения кристаллической модификации 1 (полиморфной формы F) и кристаллической модификации 2 (полиморфной формы I) мононатриевой соли D-изоглутамил-D-триптофана. Этот способ включает следующие стадии:
(а) получение раствора D-изоглутамил-D-триптофана и гидроокиси натрия в воде;
(б) фильтрование раствора с целью удаления твердых частиц;
(в) упаривание воды с целью концентрирования фильтрата;
(г) добавление изопропанола с целью осаждения мононатриевой соли D-изоглутамил-D-триптофана.
В зависимости от отношения объема изопропанола к объему раствора мононатриевой соли D-изоглутамил-D-триптофана, а также от концентрации раствора и времени перемешивания, в результате этого способа могут быть получены чистая кристаллическая модификация 1 или чистая кристаллическая модификация 2. На основании вычисленных данных для диаграммы видообразования, показанной на фиг.1, видно, что значение pH раствора на стадии (a) до перехода к этапу (б) должно находиться в диапазоне приблизительно от 6,5 до 7,2, оптимальным было бы значение 7,0.
Раствор D-изоглутамил-D-триптофана и гидроокиси натрия в воде получают путем добавления твердого D-изоглутамил-D-триптофана в раствор гидроокиси натрия. D-изоглутамил-D-триптофан обладает ограниченной растворимостью в воде (<20 мг на 1 мл воды), однако, натриевая соль прекрасно растворяется в воде. Гидроокись натрия выбрана, исходя из удобства получения раствора гидроокиси натрия, однако, можно применять и другие натриевые основания, такие как гидрид натрия, карбонат натрия, бикарбонат натрия. Эти химические вещества являются очевидными химическими эквивалентами гидроокиси натрия для выполнения стадии (а) способа. На стадии (б) раствор фильтруют для удаления каких-либо твердых частиц до перехода к стадии (в).
В способе получения кристаллической модификации 1 концентрацию фильтрата, полученного на стадии (б), увеличивают на стадии (в) для удаления воды и достижения значения концентрации приблизительно от 1,3 до 3 ммоль/мл растворенного вещества в растворе. Растворенное вещество представляет собой мононатриевую соль D-изоглутамил-D-триптофана. Для осаждения этой мононатриевой соли применяется антирастворитель. В нашем случае антирастворитель представляет собой такой растворитель, который приводит к выпадению в осадок растворенного вещества. Примерами антирастворителей, пригодных для применения в настоящем изобретении, являются изопропанол и алканол C1-C4. В предпочтительном варианте воплощения настоящего изобретения в качестве антирастворителя для осаждения мононатриевой соли используется изопропанол. На стадии (г) на каждый 1 мл натриевой соли D-изоглутамил-D-триптофана в воде добавляют приблизительно от 30 до 40 мл изопропанола для того, чтобы инициировать осаждение кристаллической модификации 1 мононатриевой соли D-изоглутамил-D-триптофана. Длительность перемешивания составляет приблизительно от 1,5 до 16 часов, более предпочтительный диапазон значений - приблизительно от 12 до 16 часов. Твердое вещество отделяют путем фильтрования и высушивают в вакуумной печи в условиях высокого вакуума. Предпочтительная температура сушки составляет приблизительно от 40 до 45°C, а предпочтительное значение вакуума - ниже 8 мм рт.ст. Еще более предпочтительно, чтобы значение применяемого вакуума было ниже 5 мм рт.ст.
В способе получения кристаллической модификации 2 фильтрат, полученный на стадии (б), затем подвергается повышению его концентрирования на стадии (в) для удаления воды и достижения значения концентрации растворенного вещества в растворе приблизительно от 3 до 18 ммоль/мл. Растворенное вещество представляет собой мононатриевую соль D-изоглутамил-D-триптофана. Для осаждения мононатриевой соли применяется изопропанол в кач