Кристаллические антитела против il-12 человека
Иллюстрации
Показать всеИзобретение относится к области кристаллизации антител. Предложен способ серийной кристаллизации антитела АВТ-874, специфичного к hIL-12. Получают водную кристаллизационную смесь антитела с концентрацией от около 0,5 до около 280 мкг/мл и полиалкиленгликоля со средней молекулярной массой около 400-10000 и с концентрацией от 5% до 30% (масс./об.). Инкубируют полученную смесь при pH от около 4 до около 6,5 и при температуре от около 4°C до 37°C до образования кристаллов длиной около 2-500 мкм. Описаны варианты кристаллов к hIL-12, полученные указанным способом. Раскрыты варианты фармацевтической композиции, инъецируемая жидкая композиция, кристаллическая суспензионная композиция, варианты способа лечения hIL-12 опосредованных нарушений, основанные на использовании кристаллов антитела. Предложено применение кристаллов для получения фармацевтической композиции для лечения заболевания, связанного с IL-12. Использование изобретения позволяет получать кристаллы антитела в промышленном масштабе, что может найти применение для промышленного получения кристаллов антител для лечения hIL-12 опосредованных нарушений. 11 н. и 29 з.п. ф-лы, 13 ил., 3 табл., 47 пр.
Реферат
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет предварительной заявки США № 60/920608, поданной 29 марта 2007 года.
Область, к которой относится изобретение
Настоящее изобретение относится к способу серийной кристаллизации для кристаллизации антитела, который позволяет получать антитела в промышленном масштабе; кристаллам антител, в частности, полученным в соответствии с описанным способом; и композициям, содержащим кристаллы, а также способам применения таких кристаллов и композиций.
Предпосылки к созданию изобретения
a) Кристаллы антител
С более 100 моноклональными антителами (mAb), оцениваемыми в настоящее время в клинических испытаниях 2 и 3 фазы, рынок mAb считается одним из наиболее перспективных биофармацевтических рынков. Поскольку эти лекарственные средства доставляются в однократных дозах, зачастую превышающих 100 мг, существует острая необходимость поиска подходящих стратегий технологии получения композиции, которая удовлетворяет требованиям стабильности, безопасности и соблюдения пациентом схемы лечения. Однако высококонцентрированные жидкие составы mAb демонстрируют повышенную вязкость, затрудненное введение шприцем через благоприятные для пациентов тонкие иглы. Более того, тенденция молекул mAb к агрегации при таких высоких концентрациях экспоненциально повышается по сравнению с умеренно концентрированными растворами. Это является неприемлемым с точки зрения требований безопасности и стабильности.
Таким образом, доставка высоких доз mAb является ограниченной для больших объемов, которые в основном должны доставляться путем инфузии. Этот способ дозирования является дорогостоящим и значительно уменьшает согласие пациента соблюдать схему лечения.
Следовательно, фармацевтически применимые низкие объемы кристаллических суспензий mAb для подкожной инъекции были бы крайне желательными. Теоретически, пути разрушения, влияющие на целостность mAb, должны существенно замедляться вследствие жесткости кристаллической решетки, где движения в белковой структуре затруднены. Более того, повышение вязкости было бы существенно снижено, при сравнении высококонцентрированных кристаллических суспензий с жидкими составами. Что касается замедленного высвобождения, может быть возможным получать или изменять кристаллы белка таким образом, чтобы они медленно растворялись при введении в организм пациента. Это было бы очень хорошим путем доставки композиции замедленного высвобождения, поскольку можно было бы избежать широкого применения эксципиентов и процессов, разрушающих структуру mAb.
Несмотря на большой потенциал в применении белковых кристаллов в качестве лекарственного вещества, были предприняты немногочисленные попытки систематически оценить эту стратегию.
Хорошо известным исключением является инсулин, который был с успехом кристаллизован десятилетия назад. Сегодня применение кристаллических суспензий инсулина подробно описано, предлагаемые стабильные составы представляют собой составы длительного действия, традиционно установившиеся на рынке. Различие между разработкой кристаллов инсулина и кристаллизацией всех других белков может быть связано с тем фактом, что упорядоченные агрегаты инсулина естественным образом образуются в поджелудочной железе. Таким образом, кристаллы инсулина легко получить, когда инсулин приводят в контакт с избытком ионов цинка. Большинство других белков имеют тенденцию к формированию неупорядоченных преципитатов, а не кристаллов, и, следовательно, поиск условий кристаллизации для белка является трудоемкой нетривиальной задачей.
Несмотря на большой интерес к получению кристаллов белка для рентгеноструктурного анализа, поиск подходящих условий кристаллизации остается экспериментальной наукой, поскольку в принципе любой белок ведет себя по-разному. К настоящему времени не было найдено общего правила, которое бы надежно прогнозировало условие кристаллизации для выбранного белка. Таким образом, получение кристаллов заданного белка, всегда называемое «горлышком бутылки» любого намеченного применения, планируется позже.
Особенно трудно кристаллизовать антитела вследствие гибкости молекулы. Тем не менее, примеры кристаллов иммуноглобулинов были известны в течение долгого времени. Первый пример кристаллов иммуноглобулинов был описан 150 лет назад английским врачом Генри Бенс Джонсом (Henry Bence Jones); он выделил кристаллы аномального димера легкой цепи Ig из мочи пациента с меланомой (Jones, H. B. (1848) Philosophical Transactions of the Royal Society, London 138: 55-62). Такие аномальные Ig были известны с тех пор как белки Бенс Джонса. В 1938 году была описана спонтанная кристаллизация различных аномальных Ig из сыворотки пациента с миеломой (von Bonsdorf, B. et al. (1938) Folia Haematologia 59: 184-208), по-видимому, олигомер тяжелой цепи Ig (ММ 200 кДа).
Кристаллические иммуноглобулины человека нормальной структуры (две тяжелые цепи, соединенные с двумя легкими цепями) были описаны в течение следующих тридцати лет, снова, главным образом, выделенные от пациентов с миеломой (Putnam, F. W. (1955) Science 122: 275-7). Davies с сотрудниками первыми охарактеризовали структуру интактного миеломного антитела человека, названного «Dob», используя рентгенологическую кристаллографию (Terry, W. D. et al. (1968) Nature 220(164): 239-41), и они определили его трехмерную структуру в 1971 году (Sarma, V. R. et al. (1971) J. Biol. Chem. 246(11): 3753-9). За их новаторской работой последовали другие с получением кристаллических структур IgG «Kol» (Huber, R. et al. (1976) Nature 264(5585): 415-20), IgG «Mcg» (Rajan, S. S. et al. (1983) Mol. Immunol. 20(7): 787-99) и лимфомы собак IgG2a (Harris, L. J. et al. (1992 Nature 360(6402): 369-72).
Кристаллы иммуноглобулинов сохраняют свои различные иммунологические активности при повторном растворении. Nisonoff et al. сообщали в 1968 году о кроличьем анти-п-азобензоатном антителе «X4», которое было без труда кристаллизовано (Nisonoff, A. et al. (1968) Cold Spring Harbor Symposia on Quantitative Biology 32: 89-93). Антитело X4 было тщательно охарактеризовано до кристаллизации, а также после перерастворения кристаллов. Было обнаружено, что [125I]-п-йодобензоат специфически и эффективно связывается с перерастворенным X4; перерастворенные кристаллы также демонстрировали множественные специфичные реакции иммунодиффузии по Оухтерлони, типичные для неочищенной кроличьей сыворотки (Nisonoff et al., 1968). Connell с сотрудниками описали гамма-иммуноглобулин-1 каппа миеломы человека (IgG-κ), названный «Tem», который спонтанно кристаллизуется из сыворотки при низких температурах (Connell, G. E. et al. (1973) Canad. J. Biochem. 51(8): 1137-41). Было обнаружено, что кристаллы Tem являются правильной формы и обладают ромбоэдрической симметрией. Сыворотка, содержащая Tem, была тщательно охарактеризована с помощью методик иммунодиффузии в агарозе. Электрофорез и иммунодиффузия перерастворенного раствора кристаллов Tem показали, что они идентичны веществу, полученному из сыворотки путем криопреципитации, и выделенному миеломному белку (Connell et al., 1973).
Mills с сотрудниками сообщили в 1983 году о необычной кристаллокриоглобулинемии, полученной из моноклональных антител человека к альбумину (Mills, L. E. et al. (1983) Annals of Internal Med 99(5): 601-4). В этой работе очень сходные кубические кристаллы были выделены от двух пациентов. Перерастворение этих кристаллов с последующим электрофорезом и иммуноэлектрофорезом указывало на то, что эти кристаллы состояли из двух белковых компонентов, моноклонального IgG-лямбда и сывороточного альбумина человека в соотношении 1:2 (Jentoft, J. E. et al. (1982) Biochem. 21(2): 289-294). Эти компоненты были разделены в препаративном масштабе путем растворения исходных кристаллов с последующей колоночной хроматографией. Хотя ни один отделенный компонент, кристаллизованный сам по себе, при рекомбинации не образовывал первоначальный состоящий из двух частей комплекс и затем кристаллизовался. Дальнейшее исследование различных характеристик седиментации и иммунологической реактивности перерастворенного отделенного IgG и его Fab фрагмента с сывороточным альбумином человека показало, что реассоциация двух перерастворенных разделенных компонентов была иммунологической по природе, т.е. что кристаллическое антитело, однажды перерастворенное, все еще обладало своими природными высокоспецифичными (для сывороточного альбумина человека) характеристиками связывания (Mills et al. 1983).
Недавно Margolin с сотрудниками сообщили о возможных терапевтических применениях кристаллических антител (Yang, M.X. et al. (2003) Proc. Natl. Acad. Sci. 100(12): 6934-10 6939). Они обнаружили, что терапевтическое моноклональное антитело трастузумаб (Herceptin®) могло быть кристаллизовано (Shenoy, B. et al. (2002) международная заявка PCT WO/2002/072636, (Altus Biologies Inc., USA) 173 pp.). Суспензии кристаллического трастузумаба были терапевтически эффективными в опухолевой модели у мышей, таким образом демонстрируя сохранение биологической активности кристаллическим трастузумабом (Yang et al., 2003).
b) Методики кристаллизации
Кристаллизация различных белков не может быть успешно выполнена с использованием описанных способов или алгоритмов. Несомненно, в последние 20-30 лет были достигнуты большие технические успехи, как отмечается всемирно известным экспертом по кристаллизации белков A. McPherson. McPherson предоставляет подробные сведения по тактике, стратегии, реактивам и устройствам для кристаллизации макромолекул (McPherson, A. (1999) Crystallization of Biological Macromolecules. Cold Spring Harbor, New York, Cold Spring Harbor Laboratory Press, p. 159). Однако он не предоставляет способ, гарантирующий, что любая заданная макромолекула может быть действительно кристаллизована специалистом с обоснованным ожиданием успеха. McPherson утверждает, например, «независимо от способа не должно быть попыток сэкономить на очистке и оптимизации параметров этой системы как растворителя, так и раствора для содействия и активизации специфического связывания между молекулами и для стабилизации их после их формирования. Этот последний аспект проблемы в основном зависит от специфических химических и физических свойств конкретного кристаллизуемого белка или нуклеиновой кислоты».
Специалистами в области кристаллизации белка хорошо известно, что не существует алгоритма для того, чтобы взять интересующий белок, применить описанные стадии способа и тем самым получить желаемые кристаллы.
Коммерчески доступно несколько систем скрининга (например, Hampton 1 и 2, Wizzard I и II), которые позволяют в масштабе микролитра проводить скрининг потенциально подходящих условий кристаллизации для специфического белка. Однако положительные результаты, полученные в такой системе скрининга, необязательно позволяют с успехом проводить кристаллизацию в более крупном промышленно применимом серийном масштабе. Описывается, что преобразование испытаний по кристаллизации в размере микролитра в промышленные объемы является трудной задачей (смотрите Jen., A., Merkle, H. P. (2001) Pharm. Res. 18, 11, 1483).
Baldock et al. сообщали о сравнении микросерий и диффузии пара для начального скрининга условий кристаллизации (Baldock, P. et al. (1996) J. Crystal Growth 168(1-4):170-174. Шесть коммерчески доступных белков подвергали скринингу, используя набор растворов кристаллизации. Скрининги проводили, используя наиболее распространенный способ диффузии пара и три варианта способа микросерийной кристаллизации, в том числе новую методику упаривания. Из 58 идентифицированных условий кристаллизации 43 (74%) было идентифицировано с помощью микросерий, тогда как 41 (71%) было идентифицировано с помощью диффузии пара. Двадцать шесть условий было определено обоими способами и 17 (29%) были бы пропущены, если бы микросерии вообще не использовались. Это показывает, что методика диффузии пара, которая является наиболее используемой в исходных скринингах кристаллизации, не гарантирует положительных результатов.
c) Кристаллы антитела против IL-12 человека
IL-12 человека играет решающую роль в патологии, связанной с некоторыми заболеваниями, вовлекающими иммунные и воспалительные реакции, например, рассеянным склерозом, болезнью Крона и псориазом. Следовательно, существует большая необходимость в подходящих способах лечения таких нарушений, связанных с IL-12 человека. Один многообещающий терапевтический подход включает в себя введение фармацевтически эффективных доз антител против IL-12 человека.
Благодаря роли IL-12 человека в целом ряде нарушений в организме человека были разработаны терапевтические стратегии для ингибирования или противодействия активности IL-12. В частности, велись поиски антител, которые связываются с IL-12 и нейтрализуют его, в качестве средств для ингибирования активности IL-12. Некоторые из наиболее ранних антител представляли собой мышиные моноклональные антитела (mAb), секретируемые гибридомами, полученными из лимфоцитов мышей, иммунизированных IL-12 (смотрите, например, WO 97/15327). Однако эти мышиные антитела к IL-12 ограничены в применении in vivo вследствие проблем, связанных с введением мышиных антител людям, таких как короткий период полужизни в сыворотке, неспособность запускать некоторые эффекторные функции у людей и получение нежелательного иммунного ответа на мышиное антитело у человека (реакция на «человеческое антимышиное антитело» (HAMA)).
В основном попытки преодолеть проблемы, связанные с применением полностью мышиных антител у людей, включали генную инженерию антител для того, чтобы они были более «человекоподобными». Например, были получены химерные антитела, в которых вариабельные области цепей антитела получены от мыши, а константные области цепей антитела получены от человека. Однако, поскольку эти химерные и гуманизированные антитела все еще сохраняют некоторые мышиные последовательности, они все еще могут вызывать нежелательную иммунную реакцию, реакцию на человеческое антихимерное антитело (HACA), особенно при введении в течение длительных периодов времени.
В патенте США № 6914128 описываются антитела человека, предпочтительно рекомбинантные антитела человека, которые специфически связываются с интерлейкином-12 человека (hIL-12). Описанные в этом патенте предпочтительные антитела имеют высокую аффинность в отношении hIL-12 и нейтрализующую активность в отношении hIL-12 in vitro и in vivo. Антитела или части антитела используют для выявления hIL-12 и для ингибирования активности hIL-12, например, у пациента человека, страдающего нарушением, при котором активность hIL-12 наносит вред. Также включены нуклеиновые кислоты, векторы и клетки-хозяева для экспрессии рекомбинантных антител человека по изобретению и способы синтеза рекомбинантных антител человека. Кристаллические формы анти-hIL-12 антител или способы их получения особым образом не описаны в патенте '128.
Проблемой, решаемой в соответствии с настоящим изобретением, следовательно, является разработка подходящих условий кристаллизации, в частности условий для серийной кристаллизации для анти-IL-12 антител, и установление условий процесса кристаллизации, применимых для объемов, относящихся к промышленному получению кристаллических антител. В то же время установлен процесс кристаллизации, в котором не требуется применять токсические агенты, которые могли бы оказывать негативное воздействие на фармацевтическую применимость таких антител.
Краткое изложение сущности изобретения
Указанная выше проблема неожиданно была решена обнаружением того, что можно получить кристаллы целого антитела против IL-12 человека в объемах серийной кристаллизации выше масштаба микролитров путем применения физиологически приемлемых полиалкиленполиолов в качестве агентов, индуцирующих кристаллизацию.
В первом аспекте настоящее изобретение относится к способу серийной кристаллизации для кристаллизации антитела против IL-12 человека, предусматривающему стадии:
(a) получения водного раствора антитела к IL-12 в смеси по меньшей мере с одним агентом кристаллизации типа полиалкиленполиола, более подробно охарактеризованным ниже, например, полиалкиленгликолем; например, путем смешивания водного раствора антитела, где антитело предпочтительно находится в растворенной форме, с водным кристаллизационным раствором, содержащим по меньшей мере один полиалкиленгликоль в качестве агента кристаллизации в растворенной форме, или, альтернативно, путем добавления агента кристаллизации в твердой форме;
(b) и инкубирования водной кристаллизационной смеси, пока не сформируются кристаллы антитела.
В соответствии с дополнительным вариантом осуществления способ по настоящему изобретению также может быть выполнен таким образом, чтобы кристаллизационная смесь, полученная на стадии a), могла быть дополнена соответствующим количеством уже существующих кристаллов антитела против IL-12 человека в качестве кристаллов затравки для инициации или стимуляции кристаллизации.
Способ кристаллизации по изобретению в основном проводят при pH водной кристаллизационной смеси в интервале примерно от pH 4 примерно до 6,5, в частности примерно от 4,5 примерно до 6,0, примерно от 5,0 примерно до 5,8 или примерно от 5,3 примерно до 5,7, так, например, 5,4, 5,5 или 5,6.
Кроме того, водная кристаллизационная смесь может содержать по меньшей мере один буфер.
Буфер может содержать ацетатный компонент в качестве основного компонента, в особенности его соль щелочного металла, например натриевую или калиевую соль, например ацетат натрия. Соль доводят добавлением кислоты, в частности уксусной кислоты, до требуемого pH. В предпочтительном варианте осуществления способа кристаллизации концентрация буфера (суммарный ацетат) в водной кристаллизационной смеси составляет примерно от 0 примерно до 0,5 M или примерно от 0,02 примерно до 0,5 M, как, например, примерно от 0,05 примерно до 0,3 M, или примерно от 0,07 примерно до 0,2 M, или примерно от 0,09 примерно до 0,12 M.
«Агент для кристаллизации типа полиалкиленполиола» определен ниже более подробно.
Специалисту будет понятно, что этот термин следует понимать в широком смысле, и он включает полиалкиленполиолы, а также их производные.
«Полиалкиленполиол», используемый в соответствии с настоящим изоберетением, представляет собой прямую или разветвленную цепь, поли-C2-C6-алкиленполиол. Полиэфир образуется по меньшей мере из одного типа полифункционального алифатического спирта, несущего от 2 до 6, от 2 до 4 и, в частности, 2 или 3 предпочтительно соседние гидроксильные группы и имеющего от 2 до 6, в частности 2, 3 или 4 атома углерода, предпочтительно образующих линейный углеродный скелет. Неограничивающими примерами являются этилен-1,2-диол (гликоль), пропилен-1,2-диол, пропилен-1,3-диол и н-бутилен-1,3-диол и н-бутилен-1,4-диол. Особенно предпочтительным диолом является гликоль.
Полиалкиленполиолы по изобретению могут быть составлены из одного типа полиолов или смесей по меньшей мере двух различных полиолов, которые могут быть полимеризованы произвольно или могут быть представлены в виде блок-сополимеров.
Более того, термин «полиалкиленполиол» также включает их производные. Неограничивающими примерами являются сложные и простые алкильные эфиры, в частности моноалкильные простые эфиры и диалкильные простые эфиры. «Алкил», в частности, определяется как С1-С6-алкильный радикал с прямой или разветвленной цепью, в частности метил, этил, н- или изопропил, н-, изо-, втор- или трет-бутил, н- или изопентил и н-гексил.
Полиалкиленполиолы, в частности полиалкиленгликоли, используемые в соответствии с настоящим изобретением, дополнительно характеризуются широким диапазоном молекулярных масс. Диапазон молекулярных масс, выраженный как число или средняя молекулярная масса, обычно находится в интервале от 400 до 10000, например от 1000 до 8000, или от 2000 до 6000, от 3000 до 6000 или 3200 до 6000, например от 3350 до 6000, от 3350 до 5000 или от 3800 до 4200, в частности примерно 4000.
Конкретными полиалкиленгликолями являются полиэтиленгликоли (ПЭГ) и полипропиленгликоли (ППГ) и соответствующие произвольные или блок-сополимеры. Особыми примерами подходящих полиолов являются ПЭГ 2000, ПЭГ 3000, ПЭГ 3350, ПЭГ 4000, ПЭГ 5000 и ПЭГ 6000.
В частности, концентрация полиалкиленполиола, в частности концентрация полиэтиленгликоля, в кристаллизационной смеси находится в диапазоне примерно от 5 примерно до 30% (масс./об.), например примерно от 7 примерно до 15% (масс./об.), или примерно от 9 примерно до 16% (масс./об.), или примерно от 10 примерно до 14% (масс./об.), или примерно от 11 примерно до 13% (масс./об.). Предпочтительно полиэтиленгликоль со средней молекулярной массой примерно 4000 используется в кристаллизационной смеси в концентрации примерно от 11 примерно до 13% (масс./об.).
В предпочтительном варианте осуществления настоящего изобретения белковый раствор антитела и кристаллизационный раствор объединяют в соотношении примерно 1:1. Таким образом, молярности буферных агентов/кристаллизационных агентов в исходном кристаллизационном растворе почти вдовое выше в кристаллизационной смеси.
Обычно способ кристаллизации осуществляется в объеме партии в диапазоне примерно от 1 мл примерно до 20000 л, или от 1 мл примерно до 15000 л, или от 1 мл примерно до 12000 л, или примерно от 1 мл примерно до 10000 л, или от 1 мл примерно до 6000 л, или от 1 мл примерно до 3000 л, или от 1 мл примерно до 1000 л, или от 1 мл примерно до 100 л, например примерно от 50 мл примерно до 8000 мл, или примерно от 100 мл примерно до 5000 мл, или примерно от 1000 мл примерно до 3000 мл, или примерно от 1 л примерно до 1000 л, или примерно от 10 л примерно до 500 л.
Кроме того, способ кристаллизации по настоящему изобретению может проводиться таким образом, чтобы достигалось по меньшей мере одно из следующих условий кристаллизации:
a) инкубирование проводят в течение примерно от 1 часа примерно до 250 дней, или от 1 до 250 дней, или от 13 до 250 дней, например примерно от 1 примерно до 30 дней, или примерно от 2 до 10 дней;
b) инкубирование проводят при температуре примерно от 0°C примерно до 50°C, например примерно от 4°C примерно до 37°C или примерно от 15°C примерно до 25°C;
c) концентрация антитела (т.е. концентрация белка) в кристаллизационной смеси находится в диапазоне примерно от 0,5 до 280 мг/мл, или примерно от 1 до 200 мг/мл, или от 1 до 100 мг/мл, например от 1,5 до 20 мг/мл, в частности, в диапазоне примерно от 2 до 15 мг/мл или от 5 до 10 мг/мл концентрация белка может быть определена в соответствии со стандартными методиками определения белка.
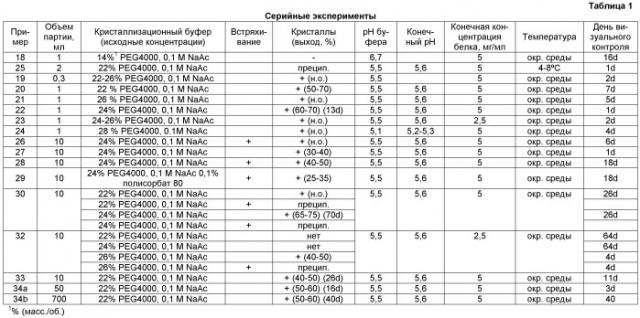
В предпочтительном варианте осуществления способ кристаллизации, например, с полиэтиленгликолем в качестве агента кристаллизации проводят, например, в течение от 13 до 60 дней при температуре примерно 20°C и при концентрации антитела примерно от 5 до 10 мг/мл.
В соответствии с особенно предпочтительным способом кристаллизацию проводят в следующих условиях кристаллизационной смеси:
| Полиалкиленгликоль: | ПЭГ 4000 от 10 до 15% (масс./об.) |
| буфер: | ацетат натрия, от 0 до 0,3 M (суммарный ацетат) |
| рH: | от 5,3 до 5,8 |
| Концентрация анти-hIL-12: | от 3 до 10 мг/мл |
| Температура: | от 18 до 24°C |
| Объем партии: | от 1 до 100 л |
| Встряхивание: | нет |
| Продолжительность: | примерно от 1 до 60 дней |
Описанные выше кристаллизационные смеси обычно получают путем добавления кристаллизационного агента в раствор или в виде твердого вещества в белковый раствор. Оба раствора могут, но не должны, быть забуферены. Концентрация кристаллизационного агента и молярность буфера в исходном кристаллизационном растворе обычно выше, чем в кристаллизационной смеси, поскольку она «разбавлена» раствором белка.
В дополнительном варианте осуществления способ кристаллизации по изобретению может дополнительно включать стадию высушивания полученных кристаллов. Подходящие способы высушивания включают сушку выпариванием, сушку распылением, лиофилизацию, вакуумную сушку, сушку в псевдоожиженном слое, лиофильную распылительную сушку, сушку близко к критическим точкам, суперкритическую сушку и сушку в газообразном азоте.
В дополнительном варианте осуществления способ кристаллизации по настоящему изобретению может дополнительно включать стадию замены кристаллизационной маточной жидкости другой жидкостью или забуференным буфером, например жидкостью или буфером, содержащим полиалкиленполиол, отличный от того, который используется для кристаллизации, с молярной массой в диапазоне примерно от 300 до 8000 дальтон, или смесями таких полиолов, например, путем центрифугирования, диафильтрации, ультрафильтрации или других обычно используемых методик замены буфера. Другая жидкость или буфер также могут быть названы «искусственным маточным раствором», который отличается от «природного» кристаллизационного маточного раствора кристаллов и предотвращает распад образованных кристаллов.
Настоящее изобретение также относится к кристаллу антитела против hIL-12, получаемому с помощью способа кристаллизации, описанного выше, в основном к кристаллам антитела против hIL-12.
Кристаллы по изобретению могут быть различной формы. Форма в основном обозначается как «мечевидная». В частности, этот термин также включает «пластинки», «иглы» или «игольчатые кластеры» (наподобие морского ежа). Например, кристаллы по изобретению могут быть охарактеризованы иглообразной морфологией с максимальной длиной (дл) примерно 2-500 мкм или примерно 100-300 мкм и соотношением длины/диаметра (дл/д) примерно 1 к 100. Высота таких иглообразных кристаллов приблизительно в размере диаметра.
Пластинки по изобретению могут иметь следующие размеры: максимальную длину (дл) примерно 2-500 мкм или примерно 100-300 мкм и соотношение длины/диаметра (дл/д) примерно 1 к 100. Высота таких пластинок гораздо меньше диаметра.
Игольчатые кластеры по изобретению могут иметь следующие размеры. Максимальную длину (дл) примерно 2-200 мкм или примерно 10-100 мкм и соотношение длины/диаметра (дл/д) примерно 1 к 3.
Кристалл может быть получен из поликлонального антитела или, предпочтительно, моноклонального антитела.
В частности, антитело выбрано из группы, состоящей из нехимерных или химерных антител, гуманизированных антител, негликозилированных антител, антител человека и мышиных антител. В частности, кристаллизуемое антитело является нехимерным антителом человека, необязательно дополнительно процессированным для улучшения связывания с антигеном и/или эффективности.
Предпочтительно кристаллы получают из антитела IgG, например, такого как антитело IgG1, IgG2, IgG3 или IgG4. В частности, антитело представляет собой целое антитело против IL-12 человека группы IgG1.
В предпочтительном варианте осуществления кристаллы получают из выделенного антитела человека, которое диссоциирует от hIL-12 с Kd 1×10-10 M или менее и константой скорости koff 1×10-3 с-1 или менее, обе величины определены с помощью поверхностного плазмонного резонанса.
В частности, кристаллы могут быть получены из выделенного антитела человека с вариабельной областью легкой цепи (LCVR), содержащей аминокислотную последовательность SEQ ID NO:2, и вариабельной областью тяжелой цепи (HCVR), содержащей аминокислотную последовательность SEQ ID NO:1.
Предпочтительными антителами человека являются, например, антитела, описанные в патенте США № 6914128.
Наиболее предпочтительными являются кристаллы, полученные из антитела ABT-874.
В дополнительном варианте осуществления настоящее изобретение относится к твердой, жидкой или полутвердой фармацевтической композиции, содержащей: (a) кристаллы анти-hIL-12 антитела, как определено выше, и (b) по меньшей мере один фармацевтически приемлемый эксципиент, стабильно удерживающий кристаллы антитела.
Другой аспект настоящего изобретения относится к твердой, жидкой или полутвердой фармацевтической композиции, содержащей: (a) кристаллы анти-hIL-12 антитела, как определено в настоящем описании, и (b) по меньшей мере один фармацевтически приемлемый эксципиент, в котором инкапсулированы или в который погружены кристаллы антитела. Композиция дополнительно может содержать (c) по меньшей мере один фармацевтически приемлемый эксципиент, стабильно удерживающий кристаллы антитела. Более того, инкапсулирование и погружение могут осуществляться совместно.
В частности, композиции по настоящему изобретению могут иметь концентрацию кристаллов антитела примерно выше 1 мг/мл, в частности примерно 200 мг/мл или более, например примерно от 200 примерно до 600 мг/мл или примерно от 300 примерно до 500 мг/мл.
Эксципиенты могут содержать по меньшей мере один полимерный, необязательно биоразлагаемый, носитель или по меньшей мере один масляный или жидкий носитель.
Полимерный носитель может представлять собой один или несколько полимеров, выбранных из группы, состоящей из: поли(акриловой кислоты), поли(цианоакрилатов), поли(аминокислот), поли(ангидридов), поли(депсипептидов), поли(сложных эфиров), поли(молочной кислоты), поли(молочной-со-гликолевой кислоты) или PLGA, поли(β-гидроксибутирата), поли(капролактона), поли(диоксанона); поли(этиленгликоля), поли(гидроксипропил)метакриламида, поли(органо)фосфазена, поли(ортоэфиров), поли(винилового спирта), поли(винилпирролидона), малеинового ангидрида сополимеров алкилвинилового эфира, плюроновых полиолов, альбумина, альгината, целлюлозы и производных целлюлозы, коллагена, фибрина, желатина, гиалуроновой кислоты, олигосахаридов, гликаминогликанов, сульфатированых полисахаридов, их смесей и сополимеров.
Масло (или масляная жидкость) может представлять собой одно или несколько масел (или масляных жидкостей), выбранных из группы, состоящей из маслянистого миндального масла, кукурузного масла, хлопкового масла, этилолеата, изопропилмиристата, изопропилпальмитата, минерального масла, легкого минерального масла, октилдодеканола, оливкового масла, арахисового масла, масла из абрикосовых косточек, кунжутного масла, соевого масла, сквалана, жидких триглицеридов, жидких восков и высших спиртов.
Жидкий носитель может представлять собой одну или несколько жидкостей, выбранных из группы, состоящей из жирных кислот и солей жирных кислот, жирных спиртов, жирных аминов, моно-, ди- и триглицеридов жирных кислот, фосфолипидов, гликолипидов, стеролов и восков и аналогичных родственных веществ. Воски дополнительно классифицируются на природные и синтетические продукты. Природные вещества включают воски, полученные из растительных, животных или минеральных источников, таких как пчелиный воск, карнаубский воск или горный воск. Хлорированные нафталины и этиленовые полимеры являются примерами синтетических восковых продуктов.
В предпочтительном варианте осуществления композиция представляет собой инъецируемую композицию, содержащую кристаллы анти-hIL-12 антитела, определенные выше, и имеющую концентрацию кристаллов антитела в диапазоне примерно от 10 примерно до 400 мг/мл или примерно от 50 примерно до 300 мг/мл.
В дополнительном аспекте настоящее изобретение относится к кристаллической густой суспензии, содержащей кристаллы анти-hIL-12 антитела, как определено выше, имеющей концентрацию кристаллов антитела примерно выше 100 мг/мл, например примерно от 150 примерно до 600 мг/мл или примерно от 200 примерно до 400 мг/мл.
Настоящее изобретение также относится к способу лечения млекопитающего, предусматривающему стадию введения этому млекопитающему эффективного количества кристаллов целого анти-hIL-12 антитела, как определено выше, или эффективного количества композиции, как определено выше. Предпочтительно, композицию вводят парентеральным путем, пероральным путем или путем инъекции.
Более того, настоящее изобретение относится к способу лечения нарушения, связанного с hIL-12 у пациента, который предусматривает введение терапевтически эффективного количества кристаллов антитела, описанных выше.
В частности, нарушение, связанное с hIL-12, выбрано из: ревматоидного артрита, остеоартрита, юношеского хронического артрита, артрита Лайма, псориатического артрита, реактивного артрита, спондилоартропатии, системной красной волчанки, болезни Крона, язвенного колита, воспалительного заболевания кишечника, инсулинзависимого сахарного диабета, тироидита, астмы, аллергических заболеваний, псориаза, дерматита, склеродермии, атопического дерматита, заболевания трансплантат против хозяина, отторжения органного трансплантата, острого или хронического иммунного заболевания, связанного с трансплантацией органов, саркоидоза, атеросклероза, диссеминированного внутрисосудистого свертывания, болезки Кавасаки, диффузного токсического зоба, нефротического синдрома, синдрома хронической усталости, гранулематоза Вегенера, болезни Шенлейн-Геноха, микроскопического васкулита почек, хронического активного гепатита, увеита, септического шока, синдрома токсического шока, септического синдрома, кахексии, инфекционных заболеваний, паразитарных заболеваний, синдрома приобретенного иммунодефицита, острого поперечного миелита, хореи Хантингтона, болезни Паркинсона, болезни Альцгеймера, инсульта, первичного биллиарного цирроза, гемолитической анемии, злокачественных опухолей, сердечной недостаточности, инфаркта миокарда, болезни Аддисона, спорадической полигландулярной недостаточности I типа и полигландулярной недостаточности II типа, синдрома Шмидта, (острого) респираторного дистресс-синдрома взрослых, алопеции, очаговой алопеции, серонегативной артропатии, артропатии, болезни Рейтера, псориатической артропатии, артропатии при язвенном колите, энтеропатического синовита, хламидийной, иерсиниозной и сальмонелезной артропатии, спондилоартропатии, атероматозной болезни/артериосклероза, атопической аллергии, аутоиммунного буллезного заболевания, обыкновенной пузырчатки, листовидной пузырчатки, пузырчатки, болезни линейных IgA, аутоиммунной гемолитической анемии, гемолитической анемии с положительной пробой Кумбса, приобретенной пернициозной анемии, ювенильной пернициозной анемии, миалгического энцефалита/болезни госпиталя «Royal Free», хронического кандидоза кожи и слизистых, гигантоклеточного артериита, первичного склерозирующего гепатита, криптогенного аутоиммунного гепатита, синдрома приобретенного иммунодефицита, заболеваний, родственных приобретенному иммунодефициту, гепатита С, обычного изменчивого иммунодефицита (обычной вариабельной гипогаммаглобулинемии), дилятационной кардиомиопатии, женского бесплодия, угасания функции яичников, раннего угасания функции яичников, фиброзного заболевания легких, криптогенного фиброзирующего альвеолита, пост-воспалительного интерстициального заболевания легких, интерстициального пневмонита, интерстициального заболевания легких, связанного с заболеванием соединительной ткани, заболевания легких, связанного со смешанным заболеванием соединительной ткани, интерстициального заболевания легких связанного с системным склерозом, интерстициального заболевания легких, связанного с ревматоидным артритом, заболевания легких, связанного с системной красной волчанкой, заболевания легких, связанного с дерматомиозитом/полимиозитом, заболевания легких, связанного с болезнью Шегрена, заболевания легких, связанного с анкилозирующим спондилитом, диффузного заболевания легких, связанного с васкулитом, болезни легких, связанной с гемосидерозом, индуцированного лекарственными средствами интерстициального заболевания легких, лучевого фиброза, облитерирующего бронхиолита, хронической эозинофильной пневмонии, лимфоцитарного инфильтративного заболевания легких, пост-инфекционного интерстициального заболевания легких, подагрического артрита, аутоиммунного гепатита, аутоиммунного гепатита 1 типа (классический аутоиммунный или волчаночный гепатит), аутоиммунного гепатита 2 типа (анти-LKM антительный гепатит), гипогликемии, опосредованной аутоиммунными реациями, резистентности к инсулину типа В с акантокератодермией, гипопаратироидизма, острого иммунного заболевания, связанного с трансплантацией органов, хронического иммунного заболевания, связанного с трансплантацией органов, первичного склерозирующего холангита, идиопатической лейкопении, аутоиммунной нейтропении, NOS почечного заболевания, гломерулонефрита, микроскопического васкулита почек, болезни Лайма, хронической красной волчанки, идиопатического или NOS мужского бесплодия, аутоиммунитета к сперме, рассеянного склероза (всех подтипов), инсулинзависимого сахарного диабета, симпатической офтальмии,