Двухстадийный температурный профиль для культивирования вирусов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и вирусологии. Изобретение представляет способ получения вируса. Способ включает представление клетки-хозяина, которую инфицируют вирусом, и культивирование инфицированной клетки-хозяина при двух различных температурах. Затем собирают вирус, полученный с помощью стадий культивирования. Путем применения двойного температурного процесса культивирования могут быть получены высокий титр и повышенная чистота вируса. Изобретение может быть использовано в медицине и ветеринарии. 24 з.п. ф-лы, 31 ил., 11 табл., 9 пр.
Реферат
Данная заявка испрашивает приоритет предварительной заявки США No. 60/927693, поданной 4 мая 2007, содержание которой во всей полноте включено в описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области культивирования вирусов.
УРОВЕНЬ ТЕХНИКИ
Культивирование вирусов в культурах клеток животных осуществляют в температурных условиях, которые зависят от характеристик вируса и системы-хозяина для культивирования. Выбирают определенные температуры для роста клеток (в клеточной культуре или инкубирования яиц эмбрионов) с последующим выбором температуры для культивирования вирусов. В большинстве случаев температура культивирования вирусов ниже, чем температура культивирования клеток. Культивирование чувствительных к температуре вирусов связано с влиянием на скорость размножения вирусов и образование антигенов в диапазоне температур со средним значением около 20 °C для культур клеток насекомых (при получении, например, бакуловируса) и при температурах около 37°C для получения вирусов в культуре клеток млекопитающих, с конкретными оптимумами для каждой комбинации вирус/клетка-хозяин. Более высокая температура сказывается как на кинетике инфицирования, так и на устойчивости вируса. Если вирусы культивируют при температуре 37°C, во время поздних периодов вирусной репликации часто наблюдается снижение вирусного титра и качества вирусного антигена. Данный эффект может иметь вредные последствия при крупномасштабном культивировании вирусов при производстве вакцин.
Целью настоящего исследования является предоставление улучшенных условий роста, которые не воздействуют на качество антигенов, получаемых в целях вакцинации.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет способ получения вируса, где одну или более клеток-хозяев инфицируют вирусом и затем культивируют при первой температуре (например, при температуре от 31°C до 37°C в течение 1-48 часов) и затем культивируют при второй температуре, которую уменьшают по сравнению с первой температурой (например, на 1°C-6°C). Затем собирают вирус, полученный на указанных стадиях культивирования.
Было обнаружено, что для многих вирусов, включая вирус гриппа (Orthomyxoviridae), вирус Росс-Ривер (Alphaviridae) и вирус лихорадки Западного Нила (Flaviviridae), условия культивирования могут быть значительно улучшены за счет применения двухтемпературного профиля. Более высокую температуру применяют во время первой стадии культивирования вирусов, которая ускоряет образование инфекционных вирусных частиц. Во второй стадии применяют более низкую температуру, чтобы сохранить начальный высокий титр, полученный во время стадии культивирования при высокой температуре, и чтобы обеспечить образование стабильного антигена, который может быть использован для последующего производства иммуногенных вакцин.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
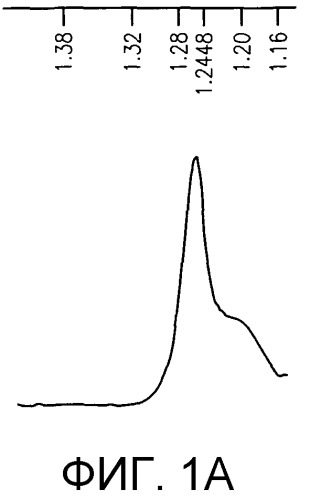
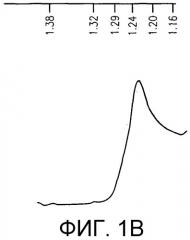
Фигура 1: Образец полос антигенов вируса “Новая Каледония”, культивируемого в клетках Vero при (A) 32°C и при (B) 36°C.
Фигура 2: График анализа с NaBr инфекции вируса Росс-Ривер при 37°C в различные моменты времени после инфицирования.
Фигура 3: График анализа с NaBr инфекции вируса Росс-Ривер при 35°C в различные моменты времени после инфицирования.
Фигура 4: График анализа с NaBr инфекции вируса Росс-Ривер при 32°C в различные моменты времени после инфицирования.
Фигура 5: График анализа с NaBr инфекции вируса Росс-Ривер при 35°C/32°C в различные моменты времени после инфицирования.
Фигура 6: Вестерн-блоттинги инокулята инфекций вируса Росс-Ривер при 37°C и при 35°C /32°C.
Фигура 7: График анализа с NaBr инфекции вируса лихорадки Западного Нила при 35°C в различные моменты времени после инфицирования, с микроскопическими изображениями.
Фигура 8: График анализа с NaBr инфекции вируса лихорадки Западного Нила при 32°C в различные моменты времени после инфицирования, с микроскопическими изображениями.
Фигура 9: График анализа с NaBr инфекции вируса лихорадки Западного Нила при 35°C/32°C в различные моменты времени после инфицирования, с микроскопическими изображениями.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Один аспект изобретения является воплощением, где двухстадийный температурный профиль, который описан в настоящем документе, обеспечивает независимую оптимизацию и контроль (1) образования активного вируса для многофазного инфицирования клеток-хозяев, (2) поддержания высокого титра, полученного в более поздней фазе репликации, и (3) образования антигена в последней фазе процесса получения.
В предпочтительном воплощении настоящего изобретения указанный вирус представляет собой ортомиксовирус, альфавирус или флавивирус.
Предпочтительно вирус представляет собой вирус гриппа, и в определенных воплощениях вирус выбирают из группы, состоящей из вируса гриппа A и B, вируса Росс-Ривер и вируса лихорадки Западного Нила. В то время как примеры, предоставленные в описании, иллюстрируют улучшенное получение антигенов для указанных вирусов с применением патентоспособного двухтемпературного способа, неограничивающие примеры других вирусов, предусмотренные изобретением, включают вирусы, выбранные из группы семейств РНК-вирусов, таких как Reoviridae, Picornaviridae, Caliciviridae, Togaviridae, Arenaviridae, Retroviridae, Flaviviridae, Orthomyxoviridae, Paramyxoviridae, Bunyaviridae, Rhabdoviridae, Filoviridae, Coronaviridae, Astroviridae или Bornaviridae, и семейств ДНК-вирусов, таких как Adenoviridae, Papovaviridae, Parvoviridae, Herpesviridae, Poxviridae или Hepadnaviridae. В определенных воплощениях вирусы выбирают из группы, состоящей из гриппа A/Панама/2007/99, A/Новая Каледония/20/99, B/Шаньдунь/7/97, B/Малайзия/2506/2004, A/Хиросима/52/2005, и A/Соломоновы острова/3/2006.
Вирус может быть получен в любых клетках, подходящих для получения вирусов. Предпочтительно клетки представляют собой культуру клеток животных или клеточную линию. Указанные клетки могут быть клетками специфической ткани или эмбриональными клетками. Животное представляет собой предпочтительно млекопитающее или птицу. Различные воплощения изобретения могут использовать клеточные линии собаки, клеточные линии грызунов, клеточные линии птиц или клеточные линии тканей приматов. Например, в определенных воплощениях клетки могут представлять собой клетки MDCK, клетки CHO, клетки perC6, клетки HEK 293 или другие клетки, обычно применяемые при культивировании вирусов. В некоторых специфических воплощениях клетки представляют собой эпителиальные клетки, в частности эпителиальные клетки почек, такие как клетки Vero африканской зеленой мартышки.
В определенных воплощениях изобретения клетки культивируют в среде, которая не содержит сывороточных белков животных. Указанные среды не включают, например, бычью сыворотку или ее элементы, такие как фетальная телячья сыворотка. Указанные среды относятся к "средам, не содержащим сывороточные белки". Во время стадии культивирования вирусов в среду могут быть добавлены протеазы, которые необходимы для размножения вирусов, например трипсин. В некоторых воплощениях указанные протеазы могут иметь неживотное происхождение, например бактериальное или рекомбинантное происхождение, или могут иметь животное происхождение. Указанные дополненные среды, тем не менее, рассматривают как среды, не содержащие сывороточных белков в значении термина, употребляемого в настоящем документе.
В предпочтительных воплощениях изобретения способы изобретения осуществляют в промышленных масштабах. В некоторых воплощениях изобретения способы осуществляют более чем в 50 литрах клеточной культуры, от 50 до 100 литрах клеточной культуры, от 100 до 500 литрах клеточной культуры, от 500 до 1000 литрах клеточной культуры или более чем 1000 литрах клеточной культуры (например, в 6000-литровых, 10000-литровых или даже больших биореакторах). В некоторых воплощениях изобретения способы изобретения осуществляют в биореакторе с механическим перемешиванием.
В предпочтительных способах изобретения первая температура культивирования вирусов является ниже, чем температура культивирования клеточной культуры для данного типа клеток-хозяев. В некоторых воплощениях первая температура составляет 32°C-37°C, предпочтительно 33°C-36°C, более предпочтительно 34°C - 35,5°C, и в частности 35°C. В других воплощениях первая температура составляет 30°C-36°C, предпочтительно 30°C-35°C, более предпочтительно 31°C-35°C, более предпочтительно 31°C-34°C, более предпочтительно 32°C-34°C, более предпочтительно 32°C - 33,5°C, еще более предпочтительно 33°C-34°C и наиболее предпочтительно 33,5°C или в некоторых воплощениях 33°C. В частности, для больших объемов клеточных культур (1000 литров и более) могут быть предпочтительны более низкие диапазоны первой температуры. Первая температура может составлять по меньшей мере 30°C, 31°C, 32°C, 33 °C, 34°C, 35°C или 36°C или менее чем 38°C, 37,5°C, 37°C, 36°C, 35,5°C или 35°C. Культивирование клеток при первой температуре может быть в течение более чем 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 или 30 часов или в течение менее чем 60, 58, 56, 54, 52, 50, 48, 46, 44, 42, 40, 38, 36, 34, 32, 30, 28, 26, 24, 22, 20, 18, 16, 14 или 12 часов.
В дополнительных воплощениях вторую температуру уменьшают на 1,5°C-5°C, предпочтительно уменьшают от 2°C до 4°C, более предпочтительно от 2,5°C до 3,5°C и наиболее предпочтительно на 3°C по сравнению с первой температурой. Снижение может быть по меньшей мере на 1°C, 2°C, 2,5°C, 3°C, или 4°C или менее чем на 6°C, 5°C, 4°C, 3,5°C, 3°C, 2,5°C или 2°C.
В других воплощениях вторая температура изменяется в пределах от 29°C до 35°C, предпочтительно от 30°C до 34°C, более предпочтительно от 31°C до 33°C, более предпочтительно от 31,5°C до 32,5°C и наиболее предпочтительно составляет 32°C. Вторая температура может быть выше 28°C, 29 °C, 30°C, or 31°C или ниже 35°C, 34°C, 33°C или 32°C.
Указанный способ также может быть применен для получения вирусных антигенов. Следовательно, в другом аспекте настоящее изобретение представляет способ получения вируса или вирусных антигенов, где вирус получают, как описано в настоящем документе, и выделяют вирус или вирусные антигены. Выделение может быть осуществлено с помощью стандартных процедур выделения и по желанию очищения с помощью разрушения клеток или сбора клеточного супернатанта и последующего выделения антигенов (например, центрифугирование или хроматография).
В других воплощениях вирус фрагментируют или инактивируют до или после очистки (например, согласно методам, представленным в международной публикации WO 05/11800). Кроме того, может быть приготовлена вакцина вируса. Вакцина представляет собой иммуногенную композицию антигенной субстанции, где антигенная субстанция может представлять собой неинфекционный вирус, его оболочку, частицы или его антигены. Когда вводят вакцину, она вызывает иммунизацию хозяина (например, млекопитающего, такого как человек, или птицы). Вакцинация может вызывать специфическую реакцию на вакцину и незначительное воспаление, но обычно ответ на вакцинацию значительно ниже, чем ответ на инфекцию, вызванную полностью жизнеспособным вирусом.
Настоящее изобретение далее проиллюстрировано с помощью следующих примеров, которые являются типичными и не предназначены для ограничения изобретения.
ПРИМЕРЫ
Многие белки вирусных мембран требуют посттрансляционной модификации для получения репликационно-компетентных вирусов. У вирусов гриппа протеолитическое расщепление молекулы предшественника (HAO) гемагглютинина (HA) на субъединицы HA1 и HA2, который образует сливающий домен в аминоконцевом участке HA2, является самым важным для проникновения вируса внутрь клеток. Следовательно, инициация инфекционного цикла в клеточной культуре должна быть катализирована добавлением протеазы. В процессе производства вакцин применяют гамма-облученный трипсин свиней.
Общепринятый температурный профиль для роста вируса гриппа в клеточных культурах, например в клетках Vero, представляет собой профиль, где температура является постоянной, например, от 33°C (для B-штаммов) до 37°C (для A-штаммов) [смотреть, например, Govorkava EA et al. Journal of Virology, Vol. 70, №. 8, Aug. 1996, стр. 5519-5524]. Один аспект изобретения является реализацией с помощью мелкомасштабных экспериментов в системах 10-литровых биореакторов того, что повышенные температурные профили во время начальной стадии инфекции могут иметь положительный эффект на общую продолжительность цикла в процессе получения вируса гриппа. Дополнительно может быть получено положительное воздействие на чистоту антигена, измеряемую как отношение белок Vero/SRD. Для подтверждения данной концепции осуществляют эксперименты в масштабе 100 л, как описано в настоящем документе.
Пример 1: получение вируса гриппа A/Новая Каледония/20/99 при 32°C и 36°C
Культуры клеток Vero при режимах работы биореактора 32°C и 36°C инфицируют вирусом A/Новая Каледония/20/99. Заданные параметры pH, pO2, клеточная плотность и количество трипсина, добавляемого в культуру, являются сравнимыми и отражают условия крупномасштабного производства антигена гриппа. Эффект увеличения температуры на количество получаемого вируса и продолжительность цикла сравнивают в таблице 1.
| Таблица 1Сравнение HA и скорости потребления остаточного кислорода ("OUR") по сравнению с днем 0 инфекционного цикла*) | ||||
| Температура | НАДень2(2nHAU/50мкл) | НАДень3(2nHAU/50мкл) | Ост. OUR(%)*день2 | Ост. OUR(%)*день2 |
| 32°C | 6 | 8 | 80 | 50 |
| 36°C | 7 | 8 | 20 | <5 |
Через два дня в культуре 36°C наблюдали скорость потребления остаточного кислорода 20%, которая опускалась ниже 5% в день 3. Культивирование вируса гриппа при 36°C давало в результате высокую инфекционность и, следовательно, уменьшение общего времени культивирования по сравнению с условиями 32°C. Напротив, культура 32°C давала в результате более высокие значения остаточного OUR, 80% и 50%, соответственно, в день 2 и в день 3. Финальные титры HA являлись сравнимыми. Однако в экспериментах по выделению антигенов с помощью ультрацентрифугирования с градиентом NaBr антигеннный сдвиг в характере распределения полос имел место в культуре при условиях 36°C на 3-й день (фигура 1B), тогда как профиль элюции, измеренный с помощью детектора УФ 254 нм, давал в результате аналогично высокий, но более симметричный пик для культуры 32°C (фигура 1A). Соответственно в терминах выхода продукта и особенно чистоты условия 36°C могут иметь несколько недостатков.
В текущем производственном процессе вирусный антиген собирают на градиенте сахарозы. Следовательно, можно сделать заключение, что в эксперименте при 36°C часть антигена перемещается во фракцию с низкой плотностью (Фигура 1B).
Пример 2: получение вируса гриппа A/Панама/2007/99 при 32, 33, и 34°C
Чтобы изучить эффект увеличения температуры культивирования на выход и продолжительность цикла вируса Панама, использовали параллельно три системы биореакторов по 10 л со значениями температур 32°C, 33°C и 34°C соответственно. Все другие заданные значения параметров были сравнимы со значениями в экспериментах, описанных в примере 1. В таблице 2 представлено время рабочего цикла трех систем биореакторов. Культуры останавливали после достижения 20% скорости потребления остаточного кислорода (80% уменьшение метаболического потребления кислорода) и сравнивали кинетику инфекционного цикла. В эксперименте с 34°C может быть достигнуто уменьшение времени цикла на 21 час.
| Таблица 2Сравнение продолжительности процесса, необходимого для достижения OUR 20% (по сравнению с днем 0 инфекционного цикла), как функция температуры процесса | |
| Температура | Продолжительность процесса до достижения OUR 20% (часы) |
| 32°C | 90 |
| 33°C | 79 |
| 34°C | 69 |
Супернатанты культур центрифугировали, обрабатывали бензоазой и формалином в соответствии со стандартными протоколами. Инактивированный собранный вирус (MVHs) очищали с помощью ультрацентрифугирования на градиенте сахарозы (смотреть таблицу 3).
| Таблица 3Сравнение выхода антигенов гриппа A/Панама/2007/99, отношения SRD/белок и примеси белка Vero, полученных для вируса, очищенного на градиенте сахарозы, в температурных экспериментах | |||
| Условия получения | Выход(мг SRD) | отношениеSRD/белок(мг/мг) | отношение белок Vero/ SRD(мг/мг) |
| 32°C | 13,8 | 0,79 | 0,25 |
| 33°C | 12,2 | 0,70 | 0,38 |
| 34°C | 12,4 | 0,67 | 0,45 |
Из таблицы 2 можно сделать заключение, что увеличение температуры давало в результате уменьшение продолжительности цикла. Однако, как показано в таблице 3, увеличение температуры (например, 33°C и 34°C) оказывало отрицательное воздействие на общий выход вирусного антигена и качество очищенного вируса, о чем свидетельствуют отношение SRD/белок и отношение белок Vero/SRD. Поэтому при высоких температурах отмечали уменьшение чистоты вирусного антигена.
Пример 3. Получение вируса гриппа A/Новая Каледония/20/99 с ранней амплификацией вируса при 35°C
Данный пример имеет отношение к культуральным экспериментам при увеличенном значении температуры в течение первых 24 часов процесса получения вируса гриппа. Культуры клеток Vero инфицировали вирусом A/Новая Каледония/20/99 в масштабе 100 литров.
Проводили сравнение общепринятого температурного профиля (т.e. заданное значение температуры 32°C на протяжении всего процесса ферментации) и модифицированной технологии с ранней амплификацией вируса при 35°C. Указанный новый процесс отличался начальной репликацией вируса при 35°C в течение 24 часов постинфекции (p.i.), с последующей инкубацией при 32°C до 91 часов p.i. В таблице 4 представлено сравнение чистоты антигена вируса гриппа A/Новая Каледония/20/99 (отношение SRD/белок) и примеси белка Vero для вируса, очищенного на градиенте сахарозы, из партии масштабом 100 литров.
| Таблица 4Сравнение чистоты антигена вируса гриппа A/Новая Каледония/20/99 (отношение SRD/белок) и примеси белка Vero как функция различных температурных профилей. Вирус, полученный в температурных экспериментах, очищали на градиенте сахарозы | |||
| Условия получения | Выход (мг SRD/л сбора) | ОтношениеSRD/белок (мг/мг) | Отношениебелок Vero/SRD (мг/мг) |
| 32 °C до 95 часов p.i. | 1,4 | 0,24 | 0,59 |
| 35 °C до 24 часов p.i./ 32 °C до 91 часа p.i. | 1,3 | 0,32 | 0,29 |
Представленные данные ясно продемонстрировали, что температурный режим 35°C в течение первых 24 часов процесса ферментации имел положительный эффект не только на отношение SRD/белок, но также и на примесь белка Vero. При сравнимых временах инфицирования могут быть получены сравнимые выходы со значительно улучшенным профилем примесей.
Пример 4. Получение вируса гриппа A/Панама/2007/99 с ранней амплификацией вируса при 35°C
Чтобы подтвердить характер изменения, наблюдаемого в примере 3 для двухтемпературного процесса, применяли аналогичные температурные профили для культивирования вируса гриппа A/Панама/2007/99 в культурах клеток Vero объемом 100 литров. Все другие условия и значения параметров соответствовали примеру 3.
В таблице 5 сравнивают анигенную чистоту вируса гриппа A/Панама/2007/99 (отношение SRD/белок) и примесь белка Vero для вируса, очищенного на градиенте сахарозы, из партии масштабом 100 литров.
| Таблица 5Сравнение чистоты антигена вируса гриппа A/Панама/2007/99 (отношение SRD/белок) и примеси белка Vero. Вирус, полученный в температурных экспериментах, очищали с помощью градиента сахарозы | |||
| Условия получения | Выход (мг SRD/л сбора) | ОтношениеSRD/белок (мг/мг) | Отношениебелок Vero/SRD (мг/мг) |
| 32°C до 88 часов p.i. | 2,3 | 0,31 | 0,84 |
| 35°C до 24 часов p.i./ 32°C до 67 часа p.i. | 1,9 | 0,45 | 0,11 |
Получение вируса A/Панама/2007/99 при 35°C во время первых 24 часов репликации вируса и последующее снижение температуры до 32°C имеет несколько преимуществ по сравнению с принятой в настоящее время технологией получения при постоянной температуре 32°C. В целом качество антигена вируса гриппа может быть улучшено, о чем свидетельствуют отношения SRD/белок и белок Vero /SRD. При существенно сниженном времени инфекции выходы были значительно ниже, но состав примесей особенно для относительного количества белка клеток Vero был значительно лучше.
Чистота антигена вируса гриппа является показателем в производстве вакцин гриппа. Общепризнанно, что для репликации вирусов гриппа в клетках Vero важными факторами являются протеолитические условия для расщепления предшественника гемагглютинина и соответствующие температурные условия. В иллюстративных примерах, представленных в описании, продемонстрировано, что температурный профиль, имеющий возрастание температуры во время ранней стадии репликации вируса, давал в результате улучшенный антиген на этапе выделения на градиенте сахарозы. Кроме того, получение вируса гриппа при 35°C в течение первых 24 часов соответствовало лучшему выполнению процесса в отношении продолжительности цикла. Вирусы гриппа A/Панама/2007/99 и A/Новая Каледония/20/99 применяли в качестве модельных систем для подтверждения полезности двухтемпературного культивирования вирусов. Таким образом, результаты культуральных экспериментов, выполненных в масштабе 10 и 100 литров, показывают преимущества изменения температуры от 32°C до 35°C в течение первых примерно 24 часов процесса культивирования вирусов.
Пример 5: Получение вируса гриппа A/Хиросима/52/2005 с ранней амплификацией вируса при 35°C в течение 18 часов p.i. в сравнении с 36 часами p.i. с последующей температурой 32°C до окончания культивирования вируса
Данный пример показывает эффект варьирования длительности высокотемпературного цикла на выход антигена, отношение SRD/белок и отношение белок Vero /SRD для культур клеток Vero объемом 50 л, инфицированных вирусом гриппа A/Хросима/52/2005. Для двух отдельных образцов поддерживали температуру 35°C в течение 18 часов p.i. и 36 часов p.i., соответственно, перед снижением температуры до 32°C. Собирали супернатанты, содержащие вирусы, инактивировали и очищали с помощью ультрацентрифугирования.
В таблице 6 сравнивают чистоту антигена вируса гриппа A/Хиросима/52/2005 (SRD/белок) и примесь белка Vero вируса, очищенного на градиенте сахарозы, из партий масштабом 50 л.
| Таблица 6Сравнение выхода антигена вируса гриппа A/Хиросима/52/2005, чистоты (отношение SRD/белок) и примеси белка Vero. Вирус, полученный в температурных экспериментах, очищали с помощью градиента сахарозы | |||
| Условия получения | Выход(мг SRD/л сбора) | ОтношениеSRD/белок (мг/мг) | Отношениебелок Vero/SRD (мг/мг) |
| 35°C до 18 ч p.i./32°C до конца (58 ч p.i) | 3,7 | 1,16 | 0,02 |
| 35°C до 24 ч p.i./ 32°C до конца (58 ч p.i.) | 4,8 | 1,12 | 0,02 |
Получение вируса гриппа A/Хиросима/52/2005 при 35°C в течение 18 часов и в течение 36 часов p.i., соответственно, давало в результате сравнимые выходы и профили чистоты (Таблица 6). Из указанных результатов можно сделать заключение, что продолжительность действия повышенной температуры в начале культивирования вируса и продолжительность действия сниженной температуры до сбора вируса могут быть значительно изменены в двойном профиле температуры.
Пример 6. Получение вируса гриппа B/Малайзия/2506/2004 с ранней амплификацией вируса в течение 18 часов p.i. при различных температурах (34°C, 35°C и 36°C) с последующим снижением на 3°C (до 31°C, 32°C и 33°C) до окончания культивирования вируса
Данный пример имеет отношение к применению различных двойных профилей температуры во время культивирования вируса в культурах клеток Vero в масштабе от 32 литров до 80 литров, которые инфицировали вирусом гриппа B/Малайзия/2506/2004. Более высокие температуры 34°C, 35°C и 36°C поддерживали в течение 18 часов p.i. перед снижением на 3°C, соответственно, до 31°C, 32°C и 33°C. Супернатанты, содержащие вирус, собирали, инактивировали и очищали с помощью ультрацентрифугирования.
В таблице 7 сравнивают выход антигена вируса гриппа B/Малайзия/2506/2004, чистоту (отношение SRD/белок) и примесь белка Vero для вируса, полученного при различных температурных профилях, очищенного на градиенте сахарозы, из партий объемом от 32 литров до 80 литров.
| Таблица 7Сравнение выхода антигена вируса гриппа B/Малайзия/2506/2004, чистоты (отношение SRD/белок) и примеси белка Vero. Вирус, полученный в температурных экспериментах, очищали с помощью градиента сахарозы | |||
| Условия получения | Выход(мг SRD/л сбора) | ОтношениеSRD/белок (мг/мг) | Отношениебелок Vero/ SRD (мг/мг) |
| 36°C до 18 ч p.i./33 °C до конца (69 ч p.i)(биореактор 32 л) | 7,3 | 0,31 | 0,06 |
| 35°C до 18 ч p.i./32 °C до конца (70 ч p.i) (биореактор 80 л) | 8,0 | 0,39 | 0,05 |
| 34°C до 18 ч p.i./31 °C до конца (70 ч p.i)(биореактор 32 л) | 7,3 | 0,36 | 0,04 |
Получение вируса гриппа B/Малайзия/2506/2004 при 34°C-36°C в течение 18 часов p.i. с последующим снижением температуры на 3°C до окончания культивирования вируса давало в результате сравнимые выходы и профили чистоты (Таблица 7). Из указанных результатов можно сделать заключение, что диапазон повышенной температуры в начале культивирования вируса и диапазон сниженной температуры до времени сбора вируса могут быть значительно изменены в двойном профиле температуры.
Пример 7. Получение вируса гриппа A/Соломоновы острова/3/2006 с ранней амплификацией вируса в течение 18 часов p.i. при различных температурах (33,5°C, 35°C и 36,5°C) с последующим снижением на 3°C (до 30,5°C, 32°C и 33,5°C) до окончания культивирования вируса
Данный пример имеет отношение к применению различных температурных профилей во время культивирования вируса в культурах клеток Vero в масштабах от 32 литров до 50 литров, инфицированных вирусом гриппа A/Соломоновы острова/3/2006. Более высокие температуры 33,5°C, 35°C и 36,5°C поддерживали в течение 18 часов p.i. перед снижением температуры на 3°C, соответственно, до 30,5°C, 32°C и 33,5°C. Супернатанты, содержащие вирус, собирали, инактивировали и очищали с помощью ультрацентрифугирования.
В таблице 8 сравнивают выход антигена вируса гриппа A/Соломоновы острова/3/2006, чистоту (отношение SRD/белок) и примесь белка Vero для вируса, очищенного на градиенте сахарозы, из партий объемом от 32 литров до 50 литров.
| Таблица 8Сравнение выхода антигена вируса гриппа A/Соломоновы острова/3/2006, чистоты (отношение SRD/белок) и примеси белка Vero. Вирус, полученный в температурных экспериментах, очищали на градиенте сахарозы | |||
| Условия получения | Выход(мг SRD/л сбора) | ОтношениеSRD/белок (мг/мг) | Отношениебелок Vero/SRD (мг/мг) |
| 36,5°C до 18 ч p.i./33,5°C до конца (54 ч p.i)(биореактор 32 л) | 4,0 | 0,53 | 0,05 |
| 35°C до 18 ч p.i./32 °C до конца (55 ч p.i) (биореактор 50 л) | 3,2 | 0,72 | 0,03 |
| 33,5°C до 18 ч p.i./30,5°C до конца (69 ч p.i)(биореактор 50 л) | 3,0 | 0,74 | 0,02 |
Получение вируса гриппа A/Соломоновы острова/3/2006 при 33,5°C, 35°C и 36,5°C в течение 18 часов p.i. с последующим снижением температуры на 3°C, соответственно, до окончания культивирования вируса давало в результате сравнимые выходы и профили чистоты (Таблица 8). Более высокие выходы при увеличенных температурах также приводили в результате к снижению чистоты, однако указанные примеси остаются на относительно низких уровнях при снижении температуры на 3°C в конце культивирования вируса. При использовании двойных температурных профилей, включающих сниженные температуры (например, 33,5°C/30,5°C), могут быть достигнуты сравнимые выходы, однако чтобы достичь указанных сравнимых выходов необходимы более длинные циклы культивирования вируса (которые, тем не менее, составляют меньше 70 часов). Профили чистоты, особенно для специфического белка клеток-хозяев Vero, обычно улучшаются при использовании низкотемпературного диапазона, включая температурный сдвиг на 3°C (смотреть также таблицу 7 для вируса гриппа B/Малайзия при 34°C/31°C). Из указанных результатов можно сделать заключение, что для обоих штаммов вируса гриппа A и B диапазон повышенной температуры в начале культивирования вируса и диапазон сниженной температуры до времени сбора вируса могут быть значительно изменены в двойном профиле температуры.
Пример 8. Получение вируса Росс-Ривер
Вирус Росс-Ривер ("RRV") получали в реакторах объемом 2 л при различных температурах.
Изучаемые температуры составляли 37°C, 35°C, 32 °C и 35°C в течение 30 часов, и 32°C после 30 часов и до окончания инфицирования после 90 часов p.i. Определяли кинетические параметры и собирали образцы в следующие интервалы времени (в часах): 1-18, 1-42, 1-42, 1-54, 1-66, 1-76 и 1-90. Образцы для анализа с NaBr обрабатывали 1,85% формалином, 20 мкл/мл, и инкубировали в течение 48 часов при 37°C. Скорости потребления кислорода (OUR) измеряли во время культивирования вируса для наблюдения за метаболической активностью инфицированных клеток. Скорости отделения клеток определяли количественно с помощью микроскопических изображений культур на микроносителях. Также определяли TCID50 (доза для заражения 50% культуры ткани). Условия представляли собой pH 7,1, PBS и 20% pO2, 1,0 г/л глюкозы перед инфицированием. В интервал времени 1-18 добавляли 1,0 г/л глюкозы и прекращали перфузию. После интервала 1-42 добавляли глюкозу, если концентрация глюкозы опускалась ниже чем 1,0 г/л. Результаты показаны в таблице 9.
Условия центрифугирования:
| 1-18: | 5000 g |
| 1-42 - 1-66: | 10000 g |
| 1-78 - 1-90: | 15000 g |
| Таблица 9 | ||||||||
| RRV37°C | Глюкоза [г/л] | HA [HAU/ 50 мкл] | TCID50 [log/мл] | OD254 нм [нм] | OD610 нм [нм] | Отделение клеток [%] | OUR [%] | Высота пика [1/10 ширины] |
| 1-18 | 2,20 | 5 | 6,68E07 | 11,2 | ||||
| 1-42 | 1,65 | 8 | 1,46E09 | 100 | ||||
| 1-53 | 1,38 | 7 | 1,20E09 | 6,273 | 0,0158 | 100 | 50 (± 10%) | 6,5 |
| 1-66 | 1,21 | 8 | 1,95E09 | 5,993 | 0,0113 | 100 | 15 (± 5%) | 4,5 |
| 1-76 | 1,27 | 7 | 4,12E07 | 5,597 | 0,0260 | 100 | 2 | 5 |
| 1-90 | 1,25 | 7 | 6,68E06 | 5,811 | 0,0136 | 100 | 0 | 7 |
| RRV35°C | Глюкоза [г/л] | HA [HAU/ 50 мкл] | TCID50 [log/мл] | OD254 нм [нм] | OD610 нм [нм] | Отделение клеток[%] | OUR [%] | Высота пика [1/10 ширины] |
| 1-18 | 2,38 | 4 | 1,46E08 | 18 | ||||
| 1-42 | 1,90 | 7 | 1,95E09 | 100 | ||||
| 1-53 | 1,95 | 6 | 4,37E08 | 5,894 | 0,0125 | 100 | 55 (± 10%) | 5,5 |
| 1-66 | 1,63 | 7 | 1,46E08 | 7,187 | 0,0131 | 100 | 30 (± 5%) | 4 |
| 1-76 | 1,72 | 7 | 1,10E08 | 5,942 | 0,0198 | 100 | 6 | 5 |
| 1-90 | 1,71 | 7 | 1,62E07 | 6,570 | 0,0160 | 100 | 0 | 2 |
| RRV32°C | Глюкоза [г/л] | HA [HAU/ 50 мкл] | TCID50 [log/мл] | OD254 нм [нм] | OD610 нм [нм] | Отделение клеток [%] | OUR [%] | Высота пика [1/10 ширины] |
| 1-18 | 2,55 | 2 | 1,20E07 | 2 | ||||
| 1-42 | 2,35 | 8 | 3,12E09 | 14 | ||||
| 1-53 | 1,81 | 7 | 5,18E09 | 5,777 | 0,0118 | 49 | 75 (± 10%) | 7 |
| 1-66 | 1,43 | 8 | 2,68E09 | 5,601 | 0,0107 | 100 | 50 (± 5%) | 3,5 |
| 1-76 | 1,28 | 7 | 1,10E09 | 6,230 | 0,0173 | 100 | 20 | 7,5 |
| 1-90 | 1,13 | 6 | 6,68E08 | 5,042 | 0,0139 | 100 | 6 | 7 |
| RRV35/ 32°C | Глюкоза [г/л] | HA [HAU/ 50uL] | ТСID50 [log/мл] | OD254 нм [нм] | OD610 нм [нм] | Отделение клеток [%] | OUR [%] | Высота пика [1/10 ширины] |
| 1-18 | 2,42 | 5 | 8,86E07 | 7 | ||||
| 1-42 | 2,32 | 8 | 3,08E09 | 25 | ||||
| 1-53 | 1,89 | 8 | 4,37E09 | 5,540 | 0,0138 | 97 | 60 (± 10%) | 8 |
| 1-66 | 1,68 | 8 | 4,12E09 | 5,991 | 0,0109 | 100 | 50 (± 5%) | 5,5 |
| 1-76 | 1,51 | 8 | 2,67E09 | 6,513 | 0,0212 | 100 | 25 | 8 |
| 1-90 | 1,41 | 6 | 8,86E07 | 5,453 | 0,0622 | 100 | 5 | 7 |
График анализа с NaBr для всех четырех инкубаций показан на фигурах 2-5 в 4 интервалах (A: 54 часов, B: 66 часов, C: 78 часов, D: 90 часов).
Анализы вестер-блоттинга выполняли с применением следующих антител: (I)RR (ATCCVR373), гипериммунная асцитическая жидкость, мышь; N.I.H. (1:1000), и (2) антимышиные IgG, Sigma, каталожный №: A-4656, лот №: 63H8830 (1: 5000). Результаты представлены на фигуре 6 в соответствии с таблицей 10.
| Таблица 10 | ||
| Дорожка | Проба | Объем (мкл) |
| 1 | Маркер | 10 |
| 2 | RRV Положительный контроль | 20 |
| 3 | RRV 37°C 1-54 | 20 |
| 4 | RRV 37°C 1-66 | 20 |
| 5 | RRV 37°C 1-78 | 20 |
| 6 | RRV 35°C/32°C 1-54 | 20 |
| 7 | RRV 35°C/32°C 1-66 | 20 |
| 8 | RRV 35°C/32°C 1-78 | 20 |
| 9 | RRV 35°С/32°C 1-90 | 20 |
| 10 | Отрицательный контроль (осадок) | 20 |
В обеих инокуляциях при высоких температурах (37°C и 35 °C) кинетика инфицирования была значительно увеличена со скоростью отсоединения клеток 100% через 42 часов и ca. 50% остаточного O2 через 53 часов. Способы с применением более низких температур (32°C и 35°C/32°C) были сравнительно более медленными. Данный факт также следует из анализа титра для интервала времени 1-18. Однако после 1-42 во всех способах достигали ca. 1E09 TCID50/мл. Способы с применением более низкой температуры показали более стабильный титр (>1E09 TCID50/мл до 1-76) почти до конца инфицирования. В обоих способах OUR, равная 20%, могла быть определена до интервала 1-76. Во всех экспериментах после 1-53 достигалась максимальная высота пика в NaBr-градиенте, в то время как более низкий пик определяли во всех образцах 1-66, а также в образце 1-90 инокуляции при 35°C. Вследствие увеличения температуры уровни глюкозы снижались быстрее в экспериментах, проводимых при 37°C и 35°C. Метаболическая активность была неопределяемой в более поздние моменты времени из-за увеличения кинетики инфицирования. Во всех экспериментах уровни глюкозы были сходными в конце культивирования.
Быстрое размножение вируса в начале и стабильный титр до окончания инфицирования определяли только в эксперименте с двумя температурными стадиями (35°C до 1-30, затем 32°C). При данных условиях измеряли самые высокие пики в эксперименте с градиентом NaBr, которые были стабильными до 1-78. Также более стабильные полосы в анализе вестерн-блоттинг обнаружили в эксперименте с температурами 35°C/32°C.
Пример 9. Эксперименты с вирусом лихорадки Восточного Нила.
Вирус лихорадки Восточного Нила получали в реакторах объемом 2 л при различных температурах. Изучаемые температуры составляли 35°C, 32°C и 35°C в течение 30 часов и 32°C через 30 часов до окончания инфицирования. Кинетические параметры регистрировали в течение 90 часов. Образцы собирали в следующие интервалы времени (в часах): 1-18, 1-30, 1-42, 1-42, 1-52, 1-66, 1-74 и 1-90. Образцы для анализа с NaBr обрабатывали 1,85% формалином, 20 мкл/мл, и инкубировали в течение 48 часов при 37°C. Условия представляли собой pH 7,1, 20% pO2 и 1,0 г/л глюкозы перед инфицированием. В интервал времени 1-18 добавляли 1,0 г/л глюкозы и прекращали перфузию. Результаты представлены в таблице 11, и на фигурах 7-9 показаны графики анализа с NaBr и микроскопические изображения. Скорости отделения клеток определяли количественно с помощью указанных микроскопических изображений культур на микроносителях
| Таблица 11 | ||||
| WN 35,0°C | Глюкоза [г/л] | TCID50 [log/мл] | Остаточный формалин [мкг/мл] | Отделение клеток [%] |
| 1-18 | 2,18 | 8,86E+07 | 14,9 | |
| 1-30 | 2,75 | 1,46E+09 | 116 | 12,9 |
| 1-42 | 0,94 | 1,20E+10 | 137 | 32,9 |
| 1-52 | 0,21 | 6,68E+09 | 119 | 80,6 |
| 1-66 | 0,24 | 8,86E+09 | 127 | 98,4 |
| 1-74 | 0,00 | 3,12E+09 | 125 | 100,0 |
| 1-90 | 0,11 | 6,68E+06 | 130 | 100,0 |
| WN 32°C | Глюкоза [г/л] | TCID50 [log/мл] | Остаточный формалин [мкг/мл] | Отделение клеток [%] |
| 1-18 | 2,37 | 5,16E+06 | 17,9 | |
| 1-30 | 3,37 | 1,62E+08 | 127 | 9,9 |
| 1-42 | 2,34 | 5,18E+09 | 136 | 21,9 |
| 1-52 | 1,43 | 4,12E+09 | 117 | 26,9 |
| 1-66 | 0,22 | 8,86E+09 | 81,6 | |
| 1-74 | 0,00 | 1,20E+10 | 116 | 92,9 |
| 1-90 | 0,37 | 6,38E+09 | 135 | 100,0 |
| WN 35°C/32°C | Глюкоза [г/л] | TCID50 [log/мл] | Остаточный формалин [мкг/мл] | Отделение клеток [%] |
| 1-18 | 2,12 | 5,18E+06 | 20,5 | |
| 1-30 | 2,80 | 1,95E+09 | 118 | 13,9 |
| 1-42 | 1,56 | 1,10E+10 | 141 | 18,9 |
| 1-52 | 0,55 | 8,86E+09 | 118 | 35,0 |
| 1-66 | 0,00 | 8,86E+09 | 127 | 94,9 |
| 1-74 | 0,00 | 6,68E+ |