Многопрофильный промотор, экспрессирующий вектор и способ избирательного убийства раковых клеток с их использованием
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности генной инженерии, и может быть использовано для лечения новообразований различной природы. Описан многопрофильный промотор, обеспечивающий внутри раковых клеток экспрессию гена фермента, способного превращать внутри раковых клеток, но не в нормальных клетках, нетоксичное соединение - пролекарство в токсин, содержащий измененную или расширенную по сравнению с известными промоторами совокупность участков узнавания белков-факторов транскрипции, необходимый набор которых существует в большинстве раковых, но не в нормальных клетках, и представляющий тандемную комбинацию BIRC5 и TERT промоторов. Также описан экспрессирующий вектор, содержащий многофункциональный промотор. Предложен способ убийства раковых клеток, приводящий к синтезу токсинов внутри раковых клеток. Изобретение обеспечивает новые системы транскрипционного контроля экспрессии генов-убийц, позволяющие создавать новые технологии генной терапии рака. 4 н. и 16 з.п. ф-лы, 5 табл., 17 пр., 16 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к биотехнологии, в частности генной инженерии, и может быть использовано для лечения новообразований различной природы.
Рак представляет собой в настоящее время наиболее серьезную проблему медицины. Наиболее обычные типы рака - эпителиальные, в наименьшей степени поддаются традиционному лечению. Даже когда эпителиальная опухоль на начальном периоде поддается лечению, в конечном счете, опухоль возвращается. Открытия различных генетических детерминант рака, происходившие на протяжении многих лет, оказали только незначительное влияние на клиническую эффективность лечения. Болезнь очевидно сложна. Она широко распространена и занимает второе место по смертности в мире и, вероятно, перейдет на первое место в ближайшем будущем. Несмотря на громадные федеральные и индустриальные вложения и громадное число фундаментальных открытий, рак обычно рассматривается, в лучшем случае, как только минимально поддающийся контролю средствами современной медицины, особенно когда его сравнивают с другими распространенными болезнями. Действительно, смертность от рака в 21 веке такая же, как и 50 лет назад, тогда как смертность от сердечных, церебрососудистых и инфекционных болезней уменьшилась за это время на 2/3 (Varmus H (2006) Science 312:1162-5). Недавние статистические исследования показывают, что смертность от рака в США в последнее время снизилась (Winer E and Gralow J et al. (2009) J Clin Oncol 27:812-26) (Jemal A and Siegel R et al. (2009) CA Cancer J Clin 59:225-49); (Malvezzi M and Arfe A et al. (2011) Ann Oncol). Подобное снижение отмечается и в странах ЕС (La Vecchia С and Bosetti С et al. (2010) Ann Oncol 21:1323-60); (Malvezzi M and Arfe A et al. (2011) Ann Oncol); (Gondos A and Bray F et al. (2009) Ann Oncol 20:564-73). Однако причиной этого снижения являются главным образом профилактические мероприятия: резкое снижение курения и потребления алкоголя, улучшение диагностики и увеличения общих осмотров населения. Только незначительную долю в этом снижении играют улучшение терапевтических результатов в лечении отдельных видов рака, особенно рака, возникающего в детском возрасте (Brennan R and Federico S et al. (2010) Oncotarget 1:77-83).
Методы неиммунной противораковой терапии могут быть разделены (Hellerstein MK (2008) Metab Eng 10:1-9) на две очень широкие категории: традиционные методы химиотерапии (XT) и появившиеся относительно недавно методы молекулярной таргетной терапии, в которых действие лекарства направлено на определенную молекулярную мишень - (таргет), которая предположительно является существенной для развития рака. Следует при этом заметить, что каждое лекарство имеет свою мишень, поэтому термин таргетная терапия является неопределенным (Druker BJ (2004) Cell Cycle 3:833-5) (Hait WNHambley TW (2009) Cancer Res 69:1263-7; discussion 1267) и для целей точности в данном описании используются следующие термины (согласующиеся с часто используемыми в литературе): (1) "молекулярная таргетная терапия" (МТТ) и (2) "терапия, нацеленная на пролиферирующие клетки" (ТНПК).
Первый термин относится к новой генерации противораковых средств, нацеленных на a priory идентифицированное молекулярное звено, как правило, белок, который предположительно играет важную роль в росте и прогрессии опухоли. Этот подход противоположен по логике более ранним традиционным подходам, использовавшимся при идентификации цитотоксических средств химиотерапии, которые продолжают оставаться основным средством противораковой терапии. Здесь эти средства определены как ТНПК.
В свою очередь МТТ делится на две субкатегории:
(i) МТТ, направленная на звено, непосредственное повреждение которого служит одной из причин рака. Такая терапия может быть определена как генетическая таргетная (Druker BJ (2004) Cell Cycle 3:833-5) (МТТГ). Наиболее известным агентом такого типа является низкомолекулярный ингибитор протеинкиназ Иматиниб, который ингибирует химерную киназу BCR-ABL, образующуюся при хромосомной перестройке, известной как филадельфийская хромосома (NCI (2010)). BCR-ABL - это единственная молекулярная мутация, которая вызывает клеточную пролиферацию в клетках, содержащих Филадельфийскую хромосому, в хронической миелоидной лейкемии (CML) (NCI (2010)) (Druker BJ (2004) Cell Cycle 3:833-5).
(ii) Молекулярная таргетная терапия, нацеленная на звено, не являющееся непосредственной причиной рака, но расположенное в той же сигнальной цепочке (pathway), что и причинное звено (Sawyers С (2004) Nature 432:294-7) (МТТП).
Поскольку оба подхода МТТ направлены на определенные звенья в клеточных сигнальных системах, то полагали, что они будут менее токсичны и более эффективны для организма, чем ТНПК.
В противоположность агентам МТТ, агенты ТНПК идентифицируют по способности оказывать цитотоксический эффект на линии раковых клеток без предварительного знания мишени (Hait WN and Hambley TW (2009) Cancer Res 69:1263-7). Фактически в существенном большинстве случаев ТНПК агенты действуют на быстро делящиеся клетки (хотя есть исключения). При этом ингибирование нацелено не на отдельное молекулярное звено, а на системы, вовлеченные в репликацию ДНК. Обычные агенты этого типа относятся к нескольким группам:
(i) Алкилирующие агенты вносят повреждения непосредственно в ДНК и ингибируют ее репликацию.
(ii) Ингибиторы топоизомераз, препятствующие расплетанию ДНК.
(iii) Таксаны и винка-алкалоиды, препяствующие образованию микротрубочек, необходимых для митотического деления клеток.
(iv) Антиметаболиты, которые блокируют образование и использование предшественников нуклеиновых кислот, важных для репликации ДНК (Dy GK and Adjei AA (2008) Cancer 113:1857-87) (DeVita VT and Chu E (2008) Cancer Res 68:8643-53); (Morrison WB (2010) J Vet Intern Med 24:1249-62).
Таким образом, мишени в этом походе существуют, но они не являются отдельными молекулами, а представляют собой системы.
Кроме раковых клеток, агенты ТНПК, которые вводят в организм больного, поражают также все относительно быстро делящиеся клетки (например, клетки желудочно-кишечного эпителия, клетки костного мозга и др.) и поэтому эти агенты являются высокотоксичными (Gerber DE (2008) Am Fam Physician 77:311-9; Hait WN and Hambley TW (2009) Cancer Res 69:1263-7; discussion 1267).
В отличие от них агенты МТТ, действуя на определенные молекулярные мишени, являются менее токсичными.
МТТ агенты для терапии солидных опухолей вышли на рынок или в клинически испытания в последние несколько лет (Bria E and Di Maio M et al. (2009) J Exp Clin Cancer Res 28:66).
При использовании этой стратегии были достигнуты некоторые успехи. Часто в качестве ее парадигмы используют Иматиниб (Гливек), низкомолекулярный ингибитор протеин киназы, образующейся в раковых клетках в результате перегруппировки хромосом, приводящей к гибридному белку Bcr:abl с киназной активностью. Этот ингибитор показал хорошие результаты при лечении хронической миелоидной лейкемии и гастроинтестинальных стромальных опухолей. Однако сегодня есть много оснований полагать, что это скорее исключение, чем правило, и что это исключение показывает неверное общее направление в выборе правильных стратегий лечения рака (Hambley TW and Hait WN (2009) Cancer Res 69:1259-62; Murdoch DSager J (2008) Curr Opin Oncol 20:104-11). Другой пример относительно успешного применения таргетного агента представляет собой Герцептин (Trastuzumab) (Hait WN and Hambley TW (2009) Cancer Res 69:1263-7; discussion 1267). Это моноклональное антитело, направленное против рецептора HER-2/Neu, содержание которого повышено на поверхности раковых клеток некоторых пациентов, больных раком молочной железы. Однако он применим только примерно к 20% таких пациентов, имеющих нужный рецептор-мишень на поверхности опухолевых клеток (Ross JS and Slodkowska EA et al. (2009) Oncologist 14:320-68), и приводит к среднему увеличению продолжительности жизни примерно 5 месяцев (Bria E and Di Maio M et al. (2009) J Exp Clin Cancer Res 28:66). Серьезным препятствием перед методами молекулярной таргетной терапии является быстрое возникновение устойчивости к обработке, что наблюдается также и в случае иматиниба. Подавляющее большинство из агентов МТТ оказались малоэффективными (Bria E and Di Maio M et al. (2009) J Exp Clin Cancer Res 28:66; Duenas-Gonzalez A and Garcia-Lopez P et al. (2008) Mol Cancer 7:82; Hambley TW and Hait WN (2009) Cancer Res 69:1259-62; Hellerstein MK (2008) Metab Eng 10:1-9).
Все это привело к определенному кризису в выработке стратегий лечения рака путем молекулярной таргетной терапии, что выражается в замедлении появления новых агентов этого типа (Hambley TW and Hait WN (2009) Cancer Res 69:1259-62). Это вполне ожидаемый кризис ввиду особенностей рака как болезни, которая сочетает в себе сложность клеточной организации, присущую и другим болезням, со сложностью растущей эвольвирующей системы, способной адаптироваться к воздействиям лекарствами путем существования микрогетерогенности внутри опухоли (Merlo LM and Pepper JW et al. (2006) Nat Rev Cancer 6:924-35). Эта гетерогенность вызывается делением раковых клеток при росте опухоли. При каждом делении клетки две дочерние клетки получают мутации так, что они отличаются и друг от друга, и от исходной клетки. Таким образом, в принципе каждая клетка данной раковой опухоли отличается от всех других клеток этой же опухоли, а опухоль одного пациента отличается от опухоли того же типа у другого пациента (Glazier A (2007) www.curecancerproject.org/). В этом отношении опухоль подобна другим сложным многоклеточным эволюционирующим системам (Sverdlov ED (2009) Biochemistry (Mosc) 74:939-44; Veitia RA (2005) J Biosci 30:21-30). Тем более отличаются друг от друга опухоли разных типов. Среди множества клеток в этой микрогетерогенной популяции всегда находятся такие, которые устойчивы к воздействиям, не погибают в результате них и дают рост нового, устойчивого к данному воздействию клона опухоли. Дополнительные сложности в лечение опухолей вносит то, что опухоль активно взаимодействует с окружением, модифицирует его и метастазирует в другие органы организма (Merlo LM and Pepper JW et al. (2006) Nat Rev Cancer 6:924-35).
Процесс эволюции опухоли начинается с первой мутации, которая (придерживаясь гипотезы раковых стволовых клеток - РСК (Bjerkvig R and Tysnes BB et al. (2005) Nat Rev Cancer 5:899-904; Reya Т and Morrison SJ et al. (2001) Nature 414:105-11)) превращает нормальную стволовую клетку в раковую. Вновь образованная раковая стволовая клетка становится таковой не вследствие любой мутации, а тех мутаций (которые получили название драйверов), которые дают ей преимущества в скорости делений, доли симметричных делений, которые увеличивают долю стволовых клеток в популяции, или какие-то еще преимущества и, кроме того, запрещают или затрудняют нормальную дифференцировку стволовых клеток. РСК самообновляется, т.е. постоянно реплицируется, и в силу этого постоянно получает мутации. Большинство этих мутаций безвредно или почти безвредно. Но существует вероятность того, что какая-то из РСК-потомков первичной РСК получит среди массы этих мутаций еще одну, дающую еще большие преимущества в росте, и, кроме того, еще какие-либо преимущества, допустим, способность избегать апоптоза. Это повторяется при каждом клеточном делении. Происходит типичная соматическая эволюция, в процессе которой РСК постепенно накапливают мутации внутри одних и тех же клеток, и РСК с накопленными мутациями становятся все более приспособленными с точки зрения борьбы за ресурсы и за пространство существования. Портрет (т.е. распределение по геному) мутаций отличается для разных клеток данной опухоли на разных этапах ее развития. Естественно, что мутационный портрет метастазов данной опухоли отличается от портрета исходной опухоли, и разные метастазы одной опухоли имеют разные портреты (Park SY and Gonen M et al. (2010) J Clin Invest 120:636-44) (Langley RR and Fidler IJ (2007) Endocr Rev 28:297-321) (Campbell PJ and Yachida S et al. (2010) Nature 467:1109-13); (Li J and Wang К et al. (2010) BMC Res Notes 3:321).
Меж- и внутриопухолевая гетерогенность еще увеличивается благодаря эпигенетической гетерогенности (Jones PA and Baylin SB (2007) Cell 128:683-92).
Практические выводы из существования громадной меж- и внутриопухолевой гетерогенности неблагоприятны для МТТ. Поскольку множество раковых генов участвуют в развитие рака только в малой части клеток раковой опухоли, то их трудно идентифицировать для использования в качестве мишеней (Stratton MR and Campbell PJ et al. (2009) Nature 458:719-24); (Salk J and Fox E et al. (2010) Annu. Rev. Pathol. Mech. Dis. 5:51-75).
Одна из основных гипотез, которая направлена на облегчение поиска таких мишеней, заключается в том, что не все гены вносят равный вклад в прогрессию опухоли. Наиболее важными являются так называемые ведущие (драйверные) мутации, которые придают раковой клетке преимущества в росте. Эти мутации можно рассматривать как причинные в раковом росте и можно ожидать их позитивной селекции в процессе эволюции опухоли (Salk J and Fox E et al. (2010) Annu. Rev. Pathol. Mech. Dis. 5:51-75) (Stratton MR and Campbell PJ et al. (2009) Nature 458:719-24) (Wood LD and Parsons DW et al. (2007) Science 318:1108-13). Все другие мутации являются случайными пассажирами ("passengers") в процессе эволюции и могут не приниматься в расчет при поиске мишени. Предполагалось, что количество таких драйверных мутаций должно быть ограничено (Armitage P and Doll R (2004) Br J Cancer 91:1983-9) и что набор драйверных мутаций затрагивает определенный ограниченный спектр раковых генов (для обзора см. (Salk J and Fox E et al. (2010) Annu. Rev. Pathol. Mech. Dis. 5:51-75) (Stratton MR and Campbell PJ et al. (2009) Nature 458:719-24)). Если это так, то драйверные мутации могли бы быть идентифицированы полногеномным секвенированием нескольких индивидуальных опухолей, как систематически повторяющиеся от опухоли к опухоли мутации (Wood LD and Parsons DW et al. (2007) Science 318:1108-13); (Parmigiani G and Boca S et al. (2009) Genomics 93:17-21) (обзоры (Salk J and Fox E et al. (2010) Annu. Rev. Pathol. Mech. Dis. 5:51-75) (Stratton MR and Campbell PJ et al. (2009) Nature 458:719-24)).
Первый же почти полногеномный анализ подобного рода (Wood LD and Parsons DW et al. (2007) Science 318:1108-13), результаты которого были представлены в виде трехмерного ландшафта, показывающего позиции генов в горизонтальной плоскости и частоты их встречаемости в индивидуальных опухолях в третьем измерении, показал, что мутации только в очень немногих генах появляются с относительно высокими частотами, образуя так называемые горы на ландшафте. Подавляющее большинство генов редко оказывались мутантными даже хотя бы в двух сравниваемых опухолях. Такие редко повторяющиеся гены образовывали на ландшафте так называемые холмы. Вывод заключался в том, что большое число мутаций-холмов (а не только «горы»), каждая с незначительным вкладом в прогрессию опухоли, являются драйверами и движущей силой эволюции опухоли. Позже этот вывод был подтвержден многими полногеномными секвенированиями разных опухолей (Copeland NG and Jenkins NA (2009) Trends Genet 25:455-62) (Salk J and Fox E et al. (2010) Annu. Rev. Pathol. Mech. Dis. 5:51-75) (Stratton MR and Campbell PJ et al. (2009) Nature 458:719-24)).
Такое разнообразие и редкость драйверов делают их обнаружение чрезвычайно трудной задачей. Теоретическое рассмотрение и экспериментальные данные показывают, что трудно, если вообще возможно, получить разумное число лекарств МТТ, которые позволяли бы осуществлять лечение различных видов рака (Salk J and Fox E et al. (2010) Annu. Rev. Pathol. Mech. Dis. 5:51-75).
Положение, возможно, может облегчаться тем, что множество драйверных мутаций располагаются в меньшем числе сигнальных путей, и тогда одно лекарство, направленное на ингибирование сигнального пути, содержащего несколько драйверных мутаций, могло бы подавлять их все. Такой МТТП подход широко обсуждается (см. (Salk J and Fox E et al. (2010) Annu. Rev. Pathol. Mech. Dis. 5:51-75)), однако, хотя определяют шесть основных характерных изменений в физиологии клетки при ее превращении в раковую (которые теперь широко известны как обязательные признаки, hallmarks, раковой клетки (Hanahan D and Weinberg RA (2000) Cell 100:57-70)), за ними стоит громадное разнообразие генотипов раковых клеток, постоянно меняющихся в процессе развития и метастазирования опухолей. Недавние результаты показывают, что в типе рака может быть вовлечено до 12 различных путей передачи информации. К тому же большинство биологических процессов имеет альтернативные пути передачи сигнала, развитые в процессе эволюционных приспособлений. В результате, если удается ингибировать один из них, то другой может активироваться и компенсировать отсутствие сигнала от первого (Hambley TW and Hait WN (2009) Cancer Res 69:1259-62), (Bria E and Di Maio M et al. (2009) J Exp Clin Cancer Res 28:66).
Это сразу ставит вопрос о принципиальной трудности или невозможности развития эффективной молекулярной таргетной терапии, которой сейчас уделяется очень большое внимание как потенциальному средству лечения опухолей (Hait WN and Hambley TW (2009) Cancer Res 69:1263-7) (Hambley TW and Hait WN (2009) Cancer Res 69:1259-62) (Bria E and Di Maio M et al. (2009) J Exp Clin Cancer Res 28:66; Dy GK and Adjei AA (2008) Cancer 113:1857-87). При этом помимо принципиальных проблем существуют еще и труднопреодолимые технические проблемы, а именно проблемы идентификации подходящих молекулярных мишеней (Hambley TW and Hait WN (2009) Cancer Res 69:1259-62).
Общий принцип генной терапии (ГТ) заключается в доставке регулируемого генетического материала в раковые клетки, где в результате производятся продукты, способные к уничтожению раковых клеток. Здесь следует отметить, что подходы ГТ, могут быть разделены на две широкие категории (Sverdlov E (2009) Molecular Genetics, Microbiology and Virology English version 24:93-113). В первой используют стратегию таргетной терапии. При этом в роли таргетного агента выступает продукт гена, вводимого каким-либо способом в клетку опухоли, который является ингибитором того или иного продукта, концентрация которого в раковой клетке повышена, и это является одной из причин ракового процесса. К этой же категории можно отнести обратную технологию - доставка в опухоль гена, продукт которого компенсирует недостаток определенного белка в раковых клетках. В обоих вариантах мишенью воздействия является определенное звено в сигнальных системах клетки, которое меняется при раковом перерождении и способствует ему. Варианты ГТ, основанные на таргетном принципе, страдают от тех же недостатков, что и МТТ. Тем не менее, ГТ расширяет возможности таргетной терапии. Прежде всего, гены, вводимые в клетку, могут придавать этой клетке новые фенотипические признаки. Эта возможность широко используется в таких вариантах генной терапии, как генная иммунотерапия рака (Loisel-Meyer S and Foley R et al. (2008) Front Biosci 13:3202-14; Seth P (2005) Cancer Biol Ther 4:512-7) (Collins SA and Guinn BA et al. (2008) Curr Gene Ther 8:66-78). ГТ позволяет доставлять к клетки гены онкосупрессоров, которые были инактивированы в процессе канцерогенеза, например ген, кодирующий супрессор, который часто инактивирован в раковых клетках (Fang В and Roth JA (2003) Cancer Biol Ther 2:8115-21); (Räty JK (2008) Current Molecular Pharmacology 1:13-23); (Huang CL and Yokomise H et al. (2007) Future Oncol 3:83-93). Возможно вызывать апоптоз в раковых клетках путем доставки про-апоптических генов (Lumniczky К and Safrany G (2006) Pathol Oncol Res 12:118-24; Seth P (2005) Cancer Biol Ther 4:512-7). ГТ позволяет также блокировать одновременно несколько сигнальных путей с помощью РНК интерференции (RNAi) (Wagner E (2007) J Buon 12 Suppl 1:S77-82) (Wang SL and Yao HH et al. (2009) Expert Opin Biol Ther 9:1357-68). Клинические испытания ГТ препаратов показывают их безопасность и положительные клинические отклики (Fang В and Roth JA (2003) Cancer Biol Ther 2:S115-21); (Huang CL and Yokomise H et al. (2007) Future Oncol 3:83-93; Räty JK (2008) Current Molecular Pharmacology 1:13-23; Xue W and Zender L et al. (2007) Nature 445:656-60).
Первый генно-терапевтический вирус для терапии рака головы и шеи был одобрен для клинического применения в Китае в 2003 г. под названием Гендицин (Gendicine). Вирус содержит в качестве терапевтического гена р53 (Peng Z (2005) Hum Gene Ther 16:1016-27); (Wilson JM (2005) Hum Gene Ther 16:1014-5). В сочетании с радиотерапией Гендицин вызывал полную регрессию опухоли у 64% пациентов и частичную - у 29%, тогда как одна радиотерапия давала полную регрессию у 19% и частичную у 60%, что по-видимому показывает заметное улучшение результата при комбинированной терапии (Peng Z (2005) Hum Gene Ther 16:1016-27). Но эти результаты показывают также, что только 64% откликаются на обработку, и дальнейшее поведение их болезни неизвестно. Есть основания ожидать появления вторичного роста опухоли, поскольку было показано, что при введении р53 в опухоли, в которых он исходно поврежден, вызывает появление устойчивых к р53 вариантов (Martins CP and Brown-Swigart L et al. (2006) Cell 127:1323-34). Полученные данные с использованием ГТ в качестве молекулярной таргетной терапии предполагают, что также как и классическая МТТ и вследствие тех же причин, она едва ли будет высокоэффективной или универсальной.
В последнее время широко обсуждаются так называемые онколитические вирусы (OB), которые, обладая способностью селективно экспрессироваться в опухолевых клетках и лизировать их, заражают и лизируют также соседние опухолевые клетки (Hall К and Blair Zajdel ME et al. (2010) Biochem J 431:321-36; Liu TC and Kim D (2008) Gene Ther 15:877-84). Этот подход обладает целым рядом преимуществ, главным из которых является цепная реакция распространения вируса в опухоли и связанное с этим быстрое уничтожение тех опухолевых клеток, которые чувствительны к вирусу. Однако при этом остаются клетки, резистентные к вирусу, которые с высокой вероятностью присутствуют в гетерогенной опухолевой популяции, в результате чего после периода уменьшения размеров опухоли наступает ее вторичный рост. Вновь образуемая опухоль устойчива к обработке вирусом. В целом онколитические вирусы также представляют собой варианты МТТ. Но, кроме того, они дороги в производстве и иммуногенны, что затрудняет повторное их введение в организм.
Вторая стратегия генной терапии, направленная на уничтожение опухолевых клеток, как таковых, путем использования их свойств, которые характерны для всех раковых клеток, например повышенная скорость митотических делений, в этом отношении подобна хемотерапии, или ТНПК. Однако, в отличие от последней, токсин, убивающий раковые клетки путем ингибирования систем репликации, образуется внутри них, так что свойственная ТНПК токсичность в данном случае резко снижается. Этот подход известен, как ген-направленная энзиматическая пролекарственная терапия, ГНЭПТ (Gene-directed enzyme prodrug therapy, GDEPT) или генная терапия с использованием генов самоубийства опухоли (suicide gene therapy) (Altaner С (2008) Cancer Lett 270:191-201; Fillat С and Carrio M et al. (2003) Curr Gene Ther 3:13-26; Portsmouth D and Hlavaty J et al. (2007) Mol Aspects Med 28:4-41; Seth P (2005) Cancer Biol Ther 4:512-7). Подход не является молекулярно таргетированным и потому избегает всех недостатков МТТ. Он основан на введении в опухолевые клетки гена, превращающего внутри них нетоксичный про-агент в токсичный агент.
Все клетки опухоли и ее метастаз, как бы гетерогенны они ни были, имеют одно общее фундаментальное свойство - они все непрерывно пролиферируют, реплицируя ДНК. Это же общее свойство клеток разных опухолей. Вот то общее, что может быть универсальной мишенью в любой опухоли и в ее метастазах. В версии ГНЭПТ, которая использована авторами, заложены два фундаментальных принципа:
1. Терапевтическое воздействие должно осуществляться на реплицирующуюся ДНК, наиболее универсальный и главный элементу репликации клеток, или на системы, непосредственно участвующие в репликации.
2. Клетка, где осуществляется воздействие, должна распространять его на окружающие клетки.
Схематически этот подход изображен на фиг.4 на примере системы, включающей ген, кодирующий фермент тимидинкиназу вируса простого герпеса (HSV-tk) и пролекарство - известный малотоксичный противогерпетический препарат ганцикловир (GCV). Ген HSV-tk вводят в раковые клетки, где он работает и синтезирует фермент - вирусную тимидинкиназу. Затем пациент системно получает GCV. Вирусная тимидинкиназа, в отличие от клеточных ферментов, фосфорилирует GCV, превращая его в монофосфат, который затем последовательно превращается клеточными киназами в ди- и трифосфаты ганцикловира. Трифосфат включается в реплицирующуюся ДНК и обрывает синтез растущих цепей. Раковая клетка погибает. Превращение нетоксичного GCV в токсичный трифосфат происходит внутри раковой клетки и поэтому не оказывает токсичного эффекта на здоровые клетки. Таким образом, осуществляется принцип 1, сформулированный выше.
Принцип 2 осуществляется за счет так называемого эффекта байстэндер. Фосфорилированный ганцикловир выходит из клеток опухоли и проникает в соседние клетки. Там он превращается в трифосфат и, если это реплицирующиеся клетки, то включается в ДНК и обрывает ее синтез. Соседние клетки погибают, хотя в них может не быть гена HSV-tk. По имеющимся данным, достаточно, чтобы ген попал всего в 10% опухолевых клеток, чтобы были уничтожены все клетки опухоли (Mesnil MYamasaki H (2000) Cancer Res 60:3989-99). Это чрезвычайно важно, поскольку практически невозможно доставить ген во все опухолевые клетки. Таким образом, антиметаболит, ингибирующий репликацию ДНК, образуется внутри клетки и не может проявлять токсичность на клетках, удаленных от опухоли.
Аналогичная система использует ген цитозиндезаминазы бактерий или дрожжей. Это иллюстрируется фиг.5. В данном случае внутри клетки из нетоксичного фторцитозина образуется антиметаболит фторурацил.
Использование генов убийц является одним из наиболее перспективных направлений, оно приводит к сочетанию сильных свойств хемотерапии с сильными свойствами и низкой токсичностью таргетной терапии.
В настоящее время проводятся клинические испытания, которые позволяют надеяться, что этот принцип будет доведен до реального способа лечения рака (www.wiley.co.uk/genetherapy/clinical/), (Portsmouth D and Hlavaty J et al. (2007) Mol Aspects Med 28:4-41).
Однако результаты клинических испытаний на пациентах дают пока значительно худшие результаты, чем удается получить на животных. В значительной степени это связано с недостаточно высокой специфичностью экспрессии терапевтических генов в раковых клетках и с недостаточно эффективным эффектом байстэндер при проведении экспериментов на пациентах в клинике.
Специфичность экспрессии в раковых клетках может задаваться либо путем его специфичной доставки в эти клетки, либо путем создания условий специфичности экспрессии трансгена в заданной ткани. Последний метод ввиду его простоты используется чаще под названием траскрипционного таргетинга. Для этого при конструировании векторов используют промоторы и энхансеры, специфично работающие в опухолях данной ткани (Robson THirst DG (2003) J Biomed Biotechnol 2003:110-13 7); (Saukkonen KHemminki A (2004) Expert Opin Biol Ther 4:683-96).
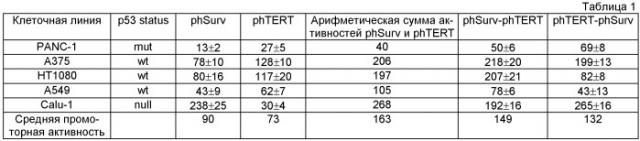
Правильный выбор промотора для транскрипционного таргетинга в ГНЭПТ представляет собой одну из самых важных проблем. Такие промоторы должны сочетать способность обеспечивать сильную и специфичную экспрессию трансгенов. Однако обычно используемые для этих целей природные раковоспецифичные промоторы значительно слабее по сравнению с сильными конститутивными промоторами, такими как CMV или SV40 (Lu В and Makhija SK et al. (2005) Gene Ther 12:330-8); (Rein DT and Breidenbach M et al. (2004) J Gene Med 6:1281-9); (Van Houdt WJ and Haviv YS et al. (2006) J Neurosurg 104:583-92). Кроме того, они обычно активны в ограниченном числе типов раковых клеток (Adachi Y and Reynolds PN et al. (2001) Cancer Res 61:7882-8); (Lee SE and Jin RJ et al. (2000) Anticancer Res 20:417-22); (Yamamoto M and Alemany R et al. (2001) Mol Ther 3:385-94). Даже относительно сильные широко используемые раковые промоторы, такие как промотор phSurv гена BIRC5, кодирующего игнгибитор апоптоза сурвивин, или промотор гена hTERT (phTERT), кодирующий каталитическую субъединицу теломеразы, существенно слабее упомянутых конститутивных промоторов CMV или SV40 (Hsu CP and Miaw J et al. (2003) Eur J Surg Oncol 29:594-9). Вдобавок, активность промоторов сильно варьирует в разных опухолях, затрудняя подбор доз пролекарства для получения терапевтического эффекта и меняя терапевтический индекс препарата от опухоли к опухоли. Например, активность phSurv промотора в разных опухолях варьирует от 0.3 до 16% относительно промотора CMV (Chen JS and Liu JC et al. (2004) Cancer Gene Ther 11:740-7); (Konopka К and Spain С et al. (2009) Cell Mol Biol Lett 14:70-89), активность phTERT промотора варьирует в 20 раз в различных клеточных линиях (Gu J and Fang В (2003) Cancer Biol Ther 2:S64-70).
Использовали два принципиальных подхода для увеличения эффективности раковоспецифической экспрессии терапевтических генов:
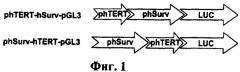
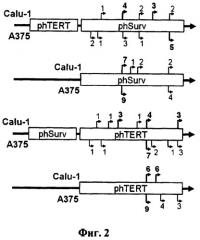
1. Бимодальные терапевтические системы. В одной из таких систем, общий принцип которой демонстрируется фиг.1Б, в клетку вводятся два вектора. В одном из них (активационном) находится ген, кодирующий трансактиватор транскрипции, например Tat белок вируса иммунодефицита под контролем раково-специфического промотора, тогда как в другом (терапевтическом), терапевтический трансген под контролем промотора, содержащего TAR элемент этого вируса. При совместной экспрессии Таt белок связывается с TAR элементом и активирует промотор, который содержит этот элемент. Таким образом, удается в десятки раз повысить уровень экспрессии терапевтического трансгена (Mingaleeva RN and Chernov IP et al. (2010) Mol Biol (Mosk) 44:507-14). В другой системе также используют два вектора (Фиг.14В). Первый содержит ген рекомбиназы Cre бактериофога P1 (Kuzmin DV and Vinogradova TV et al. (2010) The Open Gene Therapy Journal 3:31-39) под контролем раково-специфичного промотора. Второй - терапевтический ген, соединенный с конститутивным сильным промотором, который изолирован от гена транскрипционным терминатором, расположенным между сайтами рекомбиназы Cre. При помещении двух векторов в одну и ту же клетку рекомбиназа вырезает терминатор транскрипции, промотор второго вектора соединяется с трансгеном и начинается активная транскрипция последнего, уровень которой определяется силой конститутивного промотора, соединенного с трансгеном. Обе системы увеличивают эффективность транскрипции, но ее специфичность определяется раковым промотором, используемым в активационном векторе. И если этот промотор ограничен в своей активности узким спектром раковых опухолей, то активация происходит только в них. Кроме того, такая двойная система удорожает и делает менее удобным терапевтическое использование.
1. Использование комбинированных и двойных (химерных) промоторов.
Химерные промоторы могут включать в себя комбинации известных промоторов друг с другом или с отдельными гетерологичными регуляторными элементами с целью увеличить силу и специфичность экспрессии в раковых клетках (Wu С and Lin J et al. (2009) Mol Ther 17:2058-66). Примером химерного промотора может служить комбинация phTERT с минимальным промотором цитомегаловируса (phTERT-CMV) (Davis JJ and Wang L et al. (2006) Cancer Gene Ther 13:720-3) или с ТАТА боксом, который отсутствует в нативном phTERT. Как правило, авторы различных исследований, направленных на эффективное использование гибридных промоторов, идут по пути максимального увеличения эффективности и специфичности экспрессии в определенном виде рака. Примером такого подхода служит работа Poulsen et al. (Poulsen TT and Pedersen N et al. (2008) Cancer Gene Ther 15:563-75). В этой работе были идентифицированы два гена высокоэкспрессируемых в мелкоклеточном раке легких. Один из них кодирует фактор транскрипции hASH1, а другой, EZH2 относится к члену семейства Поликомб. Когда промоторы этих генов были соединены в одну конструкцию, то образующийся химерный промотор был способен вызывать сильную экспрессию трансгена специфично в клетках SCLC. Такой промотор способен инициировать экспрессию генов убийц в SCLC, но не в других видах рака.
Такая идеология максимальной спецификации активности промотора в определенном типе рака является распространенной (см., например (Farokhimanesh S and Rahbarizadeh F et al. (2010) Biotechnol Prog 26:505-11). Использование строго специфичных к данной опухоли промоторов и других регуляторных элементов имеет в качестве преимущества максимальное снижение побочных эффектов за счет понижения экспрессии трансгенов в нормальных тканях. Однако недостатком таких подходов является их неуниверсальный характер и связанное с этим неизбежное увеличение стоимости препаратов, основанных на таких промоторах. Компромиссным вариантом является использование более универсальных раковоспецифических промоторов, способных работать в широком спектре опухолей, но не в нормальных клетках. Несколько увеличивая риск поражения нормальных тканей, такой подход является более экономически оправданным: одни и те же конструкции могут использоваться в лечении широкого спектра опухолей. Существует и еще одно важное соображение в пользу использования промоторов более широкого спектра действия. Оно связано с плохо изученной специфичностью экспрессии генов в метастазах данной опухоли. Нет строгой гарантии, что узкоспецифический промотор, хорошо работающий в первичной опухоли, сохранит эту способность во всех ее метастазах. Использование универсальных промоторов снижает вероятность инактивации промотора в метастазах.
Авторы разработали новые системы транскрипционного контроля экспрессии генов-убийц, позволяющие создание новых технологий генной терапии рака. Авторы открыли, что комбинированные промоторы, состоящие из двух промоторов, в отличие от предыдущих работ, активных в широком спектре раковых опухолей, функционально не являются механической суммой двух составляющих промоторов, а образуют новый функциональный многопрофильный промотор, отличающийся от всех известных промоторов как по точке начала транскрипции, так и по повышенной активности в широком спектре опухолей. Авторы также обнаружили, что искусственный мутантный вариант BIRC5 промотора обладает расширенным спектром опухолей, в которых он активен, и также является многопрофильным промотором. Способы, основанные на транскрипционном контроле генов убийц открытыми авторами промоторами и их производными в отличие от технологий молекулярной таргетной терапии, не требуют специфического знания мишеней в раковых клетках и обеспечивают их убийство за счет образования внутри последних токсинов, убивающих раковую клетку. Токсины, также как хемиотерапевтические агенты, направлены на ингибирование систем репликации раковой клетки, но, в отличие от хемиотерапевтических средств, поставляются в раковую клетку не извне, а образуются внутри нее, таким образом, резко снижая токсичность лечения и повышая терапевтический индекс препаратов. Способы, использующие такие промоторы и их производные, в отличие от предыдущих предлагавшихся технологий, позволяют использовать одну и ту же генно-терапевтическую систему для лечения не одного типа опухолей, а широкого спектра опухолей, что делает такую систему более универсальной и экономически целесообразной. Широкая опухолевая специфичность, в отличие от предлагавшихся ранее узко специфичных терапий, значительно повышает вероятность убийства метастаз опухоли при системном введении препарата.
Раскрытие изобретения
Изобретение относится к многопрофильным промоторам, обеспечивающим внутри раковой клетки экспрессию гена фермента, способного превращать внутри раковой клетки нетоксическое соединение (пролекарство) в токсин в большинстве раковых, но не в нормальных клетках. Это приводит к превращению поставляемого извне пролекарства внутри раковой клетки в токсин, вызывающий убийство расширенного по сравнению с известными аналогами спектра опухолей, а синтезируемый внутри раковой клетки токсин диффундирует в окружающие раковые клетки.
Более конкретно изобретение относится к многопрофильным промоторам, содержащим расширенную по сравнению с известными промоторами совокупность участков узнавания белков-факторов транскрипции, необходимый набор которых существует в большинстве раковых, но не в нормальных клетках, и совокупность которых, связываясь с участками узнавания промотора, обеспечивает синергетическую активацию промотора в более широком спектре опухолевых клеток, чем известные промоторы. Также это относится к многопрофильным промоторам, содержащим измененную, по сравнению с известными промоторами, совокупность участков узнавания белков-факторов транскрипции, необходимый набор которых существует в большинстве раковых, но не в нормальных клетках, и совокупность которых, связываясь с участками узнавания промотора, обеспечивает синергетическую активацию промотора в более широком спектре опухолевых клеток, чем известные промоторы.
Еще более конкретно изобретение относится к многопрофильным промоторам, являющимся тандемной комбинацией BIRC5 и TERT промоторов или производным тандемной комбинации BIRC5 и TERT промоторов, образованной в результате делеции, замены, инсерции или иной мутации. Или к многопрофильным промоторам, являющимся искусственными мутантами промотора сурвивина мыши или искусственными мутантами промотора обратной транскриптазы теломеразы мыши или человека, или искусственными мутантами любого опухолеспецифичного промотора высших эукариот, в частности человека и мыши, или промоторами гена высших эукариот, участвующего в репликации ДНК, или искусственными мутантами BIRC5 промотора с пониженным ингибированием активности посредством фактора р53. И где в качестве активатора выступает ТАТ белок вируса иммунодефицита человека, и где в качестве сайта связывания активатора выступает TAR последовательность вируса иммунодефицита человека.
В другом аспекте изобретение относится к экспрессирующему вектору, содержащему описанный многофункциональный промотор. Конкретнее экспрессирующий вектор представляет собой вирусный вектор или экспрессирующий вектор представляет собой невирусный вектор.
В другом аспекте изобретение относится к способу избирательного убийства раковых, но не нормальных клеток, заключающемуся в синтезе токсинов внутри раковых клеток, включающ