Анализы т-клеток
Иллюстрации
Показать всеНастоящее изобретение относится к новым способам анализа Т-клеток, в частности, где Т-клеточные ответы на тестируемые антигены увеличивают путем удаления регуляторных Т-клеток. Способ включает следующие стадии: (а) выделение антигенпредставляющих клеток (АПК) и Т-клеток из образца, полученного из организма; (б) истощение регуляторных Т-клеток из этих выделенных клеток; (в) инкубирование указанных АПК и полученных на стадии (б) клеток, истощенных по регуляторным Т-клеткам, с тестируемым антигеном; и (г) измерение Т-клеточных ответов на тестируемый антиген. Данное изобретение имеет конкретное применение для измерения Т-клеточных ответов человека на фармацевтические препараты, аллергены, раздражающие вещества или другие вещества. 3 н. и 27 з.п. ф-лы, 5 пр., 5 ил.
Реферат
Настоящее изобретение относится к новым способам анализа Т-клеток, в частности, когда ответы Т-клеток на тестируемые антигены увеличивают путем удаления регуляторных Т-клеток. Настоящее изобретение также относится к новым анализам, при которых время инкубации с антигенами или другими образцами варьируют с целью оптимизации детекции Т-клеточных ответов. В частности, данное изобретение относится к анализам Т-клеток с белковыми образцами, где оптимальной детекции Т-клеточных эпитопов достигают при использовании измерений пролиферации Т-клеток или высвобождения цитокинов во многих временных точках. Кроме того, данное изобретение относится к анализам Т-клеток, где время инкубации с антигеном, с антигенпредставляющими клетками (АПК) или Т-клетками, или и с АПК, и с Т-клетками варьируют с целью оптимизации детекции Т-клеточных эпитопов. Данное изобретение, в частности, относится к анализам Т-клеток с использованием иммуномодулирующих или токсичных образцов, которые непосредственно воздействуют либо на АПК, либо на Т-клетки или как на АПК, так и на Т-клетки. Данное изобретение имеет конкретное применение для измерения ответов человеческих Т-клеток на фармацевтические препараты, аллергены, раздражающие вещества или другие вещества, с которыми контактирует человек.
Анализы Т-клеток обеспечивают эффективный способ измерения Т-клеточных ответов на антигены и другие образцы, особенно у людей. Такие анализы считают анализами "ex vivo", где образцы крови берут от доноров и обрабатывают их так, что в таких анализах используют непосредственно первичные культуры клеток крови. Для пептидных и белковых образцов анализы ex vivo человеческих Т-клеток используют для детекции человеческих Т-клеточных эпитопов для нескольких целей, включающих оценку потенциальной иммуногенности таких образцов у человека (Jones et al., J. Interferon Cytokine Res., vol.24 (2004) p.560 - 572), определения Т-клеточных эпитопов в последовательности белка для последующего включения в вакцины и определения Т-клеточных эпитопов в последовательности белка для последующего удаления во избежание иммуногенности (Jones et al., J.Interferon Cytokine Res., vol.24 (2004) p.560-572; Jones et al, J. Thromb. Haemost, vol.3 (2005) p 1-10). Существующие в настоящее время способы анализа Т-клеток часто включают либо инкубирование пептидных или белковых образцов со смесью АПК и Т-клеток перед измерением Т-клеточных ответов, либо инкубирование пептидных или белковых образцов с АПК и затем добавление Т-клеток перед измерением Т-клеточных ответов. В обоих типах анализа многочисленные образцы крови используют по отдельности для параллельного тестирования каждого индивидуального пептидного или белкового образца, и затем Т-клеточные ответы измеряют обычно в одной временной точке. Т-клеточные ответы типично измеряют либо по включению импульса радиоактивной метки, такой как меченный тритием тимидин (3HTdR), в пролиферирующие Т-клетки ("пролиферация Т-клеток"), либо по высвобождению цитокинов, таких как интерлейкин-2 (IL-2), из активированных Т-клеток ("высвобождение цитокина").
Существующие в настоящее время способы анализа Т-клеток для детекции Т-клеточных эпитопов ограничены низкой чувствительностью и/или вмешательством иммуномодулирующих или токсичных образцов, которые ингибируют, стимулируют или иным образом модифицируют АПК, Т-клетки или и АПК и Т-клетки. Сами по себе существующие в настоящее время способы анализа Т-клеток могут не детектировать некоторые или все Т-клеточные эпитопы в некоторых пептидных и белковых образцах и могут не использоваться для измерения Т-клеточных ответов на иммуномодулирующие или токсичные образцы, включающие пептидные и белковые образцы, небелковые образцы, включающие органические молекулы, и препараты белковых и небелковых образцов, где сам препарат может быть иммуномодулирующим или токсичным.
Что касается чувствительности, то основная причина низкой чувствительности в анализах Т-клеток ex vivo может иметь отношение к факторам в анализируемой смеси, которые снижают Т-клеточные ответы на тестируемые антигены, включающие типы клеток или факторы в культуре для анализа или сами тестируемые антигены или тестируемые образцы. Другая причина низкой чувствительности в анализах Т-клеток ex vivo может иметь отношение к кинетике Т-клеточных ответов на Т-клеточные эпитопы в пептидных или белковых образцах, при которой индивидуальные Т-клеточные эпитопы могут индуцировать Т-клеточные ответы в разное время. С одной стороны, в случае пролиферации Т-клеток, когда используют одну временную точку, пролиферация Т-клеток при добавлении некоторых образцов может быть исходно быстрой, но затем замедляться ко времени, когда добавляют импульс радиоактивной метки, так что значительный пролиферативный ответ не детектируется. С другой стороны, пролиферация Т-клеток при добавлении некоторых других образцов может быть исходно медленной в то время, когда добавляют импульс радиоактивной метки, так что значительный пролиферативный ответ не детектируется, даже если последующая пролиферация становится значительной. В случае высвобождения цитокинов, когда используют одну временную точку, продукция цитокинов при добавлении некоторых образцов может быть, с одной стороны, исходно быстрой, но эти цитокины могут затем потребляться клетками в смеси для анализа, так что при анализе в одной временной точке значительный уровень цитокинов не детектируется. С другой стороны, высвобождение цитокинов может быть исходно медленным, так что при анализе в одной временной точке значительный пролиферативный ответ не детектируется, даже если последующее высвобождение цитокина становится значительным. Кинетика пролиферации или высвобождения цитокина может находиться под влиянием ряда факторов, таких как аллотипическое варьирование Т-клеточных ответов на разные образцы крови, эффективность и кинетика поглощения и процессинга в АПК, эффективность протеолиза пептидных или белковых образцов в АПК, сила и частота Т-клеточных эпитопов в пептидном или белковом образце, аффинность связывания Т-клеточных эпитопов со специфическими аллотипами МНС (главного комплекса гистосовместимости) класса II, эффективность распознавания комплексов пептид-МНС класса II Т-клеточными рецепторами, частота и концентрация ко-стимулирующих молекул на клеточной поверхности, концентрации ко-стимулирующих цитокинов, стимуляция других клеток в смеси для анализа, таких как CD8+Т-клетки или супрессорные Т-клетки, присутствие Т-клеток памяти и способность некоторых образцов, таких как малые пептиды, непосредственно взаимодействовать с молекулами МНС класса ΙΙ, экспрессирующимися на поверхности АПК.
Что касается вмешательства иммуномодулирующих или токсичных образцов в анализ Т-клеток, то такие образцы могут непосредственно связываться или поглощаться АПК, Т-клетками или как АПК, так и Т-клетками. Такие образцы могут подавлять или активировать нормальные иммунологические функции АПК и/или Т-клеток, так что Т-клеточные эпитопы или Т-клеточные ответы на образцы не детектируются. Другой причиной вмешательства иммуномодулирующих образцов в анализ Т-клеток является токсичность в отношении АПК, Т-клеток или как АПК, так и Т-клеток. Другие причины вмешательства иммуномодулирующих образцов в анализ Т-клеток включают в себя подавление или активацию подгрупп АПК или Т-клеток, такие как активация CD8+ Т-клеток или супрессорных Т-клеток.
Для того чтобы с пользой применять анализы Т-клеток для целого ряда применений, особенно в отношении фармацевтических средств для человека, существует необходимость в более чувствительных способах анализа Т-клеток для оптимальной детекции Т-клеточных эпитопов, а также необходимость в анализах Т-клеток, которые могут быть использованы с иммуномодулирующими или токсичными образцами.
Настоящее изобретение частично основано на открытии, что удаление регуляторных Т-клеток из смесей для анализа Т-клеток приводит к значительному увеличению ответов хелперных Т-клеток на тестируемые антигены. Таким образом, в настоящем изобретении предложены новые способы анализа Т-клеток для оптимальной детекции Т-клеточных эпитопов, где супрессорные Т-клетки удаляют из культур, что приводит к увеличению Т-клеточных ответов на тестируемые антигены. Кроме того, в настоящем изобретении предложены новые способы анализа Т-клеток для оптимальной детекции иммуногенности белков, которые модулируют Т-клетки и/или АПК, или белков, которые оказывают токсичное действие на Т-клетки и/или АПК. Настоящее изобретение также может быть использовано для детекции небелковых соединений, которые могут стимулировать Т-клетки либо непосредственно через Т-клеточный рецептор, либо путем ковалентного связывания с белками или путем связывания непосредственно с пептидами, связанными с молекулами МНС класса ΙΙ, либо через связывание непосредственно с молекулами МНС класса ΙΙ. В частности, в этом изобретении предложены способы, в которых регуляторные Т-клетки, которые в норме должны снижать эффекторные Т-клеточные ответы, удаляют из культур перед измерением ответов на тестируемые антигены. Кроме того, в этом изобретении предложены способы с использованием множества временных точек измерения, причем временные точки после инкубации с антигенами или другими образцами оптимизированы для детекции Т-клеточных ответов.
В первом аспекте в настоящем изобретении предложен способ измерения ответа хелперных Т-клеток на тестируемое вещество, включающий следующие стадии:
(a) выделение антигенпредставляющих клеток (АПК) и Т-клеток из образца, полученного из организма;
(б) истощение регуляторных Т-клеток из выделенных клеток;
(в) инкубирование указанных АПК и полученных на стадии (б) клеток, истощенных по регуляторным Т-клеткам, с тестируемым веществом; и
(г) анализ Т-клеточных ответов на тестируемое вещество.
АПК и Т-клетки в норме получают из образца крови. Однако в данном изобретении могут быть использованы разные источники Т-клеток и/или АПК, включая клетки, происходящие из миндалин, пейеровых бляшек, опухолей и клеточных линий. В одном предпочтительном воплощении этот способ осуществляют с использованием мононуклеарных клеток периферической крови человека (МКПК).
Как использовано здесь, термин "истощение" означает элиминацию некоторых регуляторных Т-клеток. Это может быть осуществлено путем физического удаления клеток или путем ингибирования или модулирования действия этих Т-клеток. Таким образом, активность нацеленных Т-клеток снижается. Предпочтительно, в процессе истощения удаляют 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% активности целевых Т-клеток.
Специалистам будет понятно, что в качестве части настоящего изобретения, ряд способов истощения регуляторных Т-клеток или направленного воздействия на них можно использовать в качестве альтернативы истощению регуляторных Т-клеток с помощью CD25hi. Также следует понимать, что настоящее изобретение также будет включать способы модулирования эффектов регуляторных Т-клеток в анализах Т-клеток. Для истощения или направленного воздействия могут быть использованы молекулы, экспрессирующиеся на поверхности регуляторных Т-клеток, в сочетании с CD25 или в качестве альтернативы CD25 для истощения этих клеток. Такие молекулы могут включать, но не ограничиваются этим, GITR, CTLA-4, CD103, рецептор-4 хемокинов СС, CD62L и CD45RA и могут также включать ассоциированные с поверхностью цитокины или поверхностные формы цитокинов, таких как IL-10 и TGFβ (трансформирующий ростовой фактор-бета). Истощения можно достичь несколькими способами, включающими связывание со специфическими антителами для адсорбции регуляторных Т-клеток на твердой фазе, или для индукции разрушения или ингибирования таких регуляторных Т-клеток, или для отделения иным способом регуляторных Т-клеток от других Т-клеток для Т-клеточных анализов. Для модуляции можно предотвращать секрецию молекул, секретируемых регуляторными Т-клетками, или можно блокировать/ингибировать/разрушать их после секреции. Такие молекулы могут включать цитокины, такие как IL-10, IL-4, IL-5 и TGFβ, и такие молекулы могут быть блокированы с использованием органических или неорганических молекул, которые связываются с такими молекулами, например, антител или растворимых рецепторов, или с помощью ингибиторных нуклеиновых кислот, таких как миРНК (малые интерферирующие РНК), антисмысловые олигонуклеотиды или другие нуклеиновые кислоты, доставляемые в регуляторные Т-клетки или индуцируемые в таких клетках. Модуляцию активности регуляторных Т-клеток можно осуществлять также путем воздействия на рецепторы или другие поверхностные молекулы на регуляторных Т-клетках, включающие, но не ограничивающиеся этим, GITR, CTLA-4, CD103, рецептор-4 хемокинов СС, CD62L и CD45RA, таким образом, что это нарушает супрессивную функцию этих клеток. Такое ингибирование функции можно осуществлять, например, с помощью специфических антител, которые обладают агонистической функцией, или которые могут блокировать взаимодействия лиганда с мишенью, так что регуляторные Т-клетки не удаляются, но становятся нефункциональными.
Модуляция активности регуляторных Т-клеток может быть также достигнута путем блокирования целевых рецепторов молекул, секретируемых регуляторными Т-клетками, или путем блокирования путей, активируемых или подавляемых такими секретируемыми молекулами. Также для модуляции регуляторные Т-клетки можно непосредственно ингибировать, например, путем блокирования транскрипционных факторов, таких как foxp3, или путем блокирования других функций или путей, относящихся к регуляторным Т-клеткам. Такое ингибирование или блокирование может быть достигнуто с помощью органических или неорганических молекул или ингибиторных нуклеиновых кислот, таких как миРНК, антисмысловые олигонуклеотиды или другие нуклеиновые кислоты, доставляемые в регуляторные Т-клетки или индуцируемые в таких клетках. Во всех случаях, когда органические и неорганические молекулы или молекулы нуклеиновой кислоты используют для ингибирования действия или осуществляемого иным образом модулирования регуляторных Т-клеток, где такие молекулы сами являются препятствием в анализах Т-клеток, такие молекулы следует предпочтительно удалять из таких анализов или модифицировать в форму, которая не будет препятствовать таким анализам. Например, специфичные антитела или белки, используемые для удаления молекул, секретируемых регуляторными Т-клетками, следует либо селективно удалять перед анализом Т-клеток, либо использовать в специфической форме, которая не будет препятствовать анализу Т-клеток. Например, в случае анализа Т-клеток человека, будут использовать человеческую форму антитела или белка во избежание Т-клеточных ответов на сам(o) антитело или белок.
В анализе Т-клеток по настоящему изобретению с тестируемыми антигенами, которые не модулируют Т-клетки и/или АПК (типично белки или пептиды, а также небелковые соединения), ключевыми стадиями являются следующие:
(1) выделяют МКПК из образцов крови человека;
(2) возможно удаляют CD8+ Т-клетки;
(3) истощают CD25hi+ Т-клетки;
(4) инкубируют культуры с тестируемыми антигенами в одной или более концентрациях и тестируют в одной или более временных точках в отношении пролиферации Т-клеток и/или высвобождения цитокинов.
Ключевыми стадиями в анализе Т-клеток по настоящему изобретению, где тестируемые антигены модулируют Т-клетки и/или АПК, являются следующие:
(1) выделяют МКПК из образцов крови человека;
(2) выделяют АПК типично путем прикрепления к пластику, индуцируют дифференцировку АПК с использованием цитокинов и добавляют к АПК тестируемый антиген;
(3) аутологичные МКПК, обработанные предварительным истощением CD25hi+ Т-клеток и возможно CD8+ Т-клеток, смешивают с АПК;
(4) инкубируют культуры с тестируемыми антигенами в одной или более концентрациях и тестируют в одной или более временных точках в отношении пролиферации Т-клеток и/или высвобождения цитокинов.
В тех случаях, когда тестируемые вещества представляют собой пептидные или белковые образцы или небелковые образцы, которые не являются иммуномодулирующими или токсичными для АПК или Т-клеток, в качестве источника CD4+ Т-клеток и АПК (в форме моноцитов и дендритных клеток) может быть использована кровь. Типично когорту доноров выбирают так, что она наилучшим образом представляла число и частоту аллотипов HLA-DR, экспрессирующихся в мировой популяции или в исследуемой популяции. Аллотипы, экспрессирующиеся в этой когорте, типично представляют более 80% аллотипов, экспрессирующихся в этой популяции, где хорошо представлены все основные аллели HLA-DR (индивидуальные аллотипы с частотой экспрессии в мировой популяции более 5%). Альтернативно, аллотипы, экспрессирующиеся в данной когорте, выбраны так, что они с избытком представляют или содержат аллотипы HLA, которые считаются ассоциированными с конкретным исследуемым заболеванием. В предпочтительном воплощении настоящего изобретения МКПК получены из образцов крови путем фракционирования в градиентах плотности и затем истощены по CD8+ Т-клеткам и CD25hi Т-клеткам, так что оставшиеся МКПК содержат в основном CD4+ Т-клетки (примерно 70%) и АПК (10-20% моноцитов и 1-3% дендритных клеток). Такие МКПК, истощенные по CD8+CD25hi, адаптируют к клеточной культуре и добавляют один или более пептидных или белковых образцов или небелковых образцов и инкубируют эти культуры.
Измерение Т-клеточных ответов затем может быть осуществлено в одной фиксированной временной точке или во многих временных точках. Эти временные точки могут быть предварительно определены путем измерения кинетики Т-клеточных ответов на аналогичные образцы или оптимизирующее вещество.
Оптимальные условия анализа могут быть определены путем использования оптимизирующего вещества. "Оптимизирующее вещество", как использовано здесь, представляет собой соединение, которое, как известно, индуцирует Т-клеточные ответы, например, индивидуальные иммуномодулирующие/токсичные пептиды/цельные белки, которые имеют размер и структуру, аналогичные образцам, подлежащим тестированию, или свойства, аналогичные тестируемому веществу. В случае пептидных или белковых образцов или небелковых образцов можно использовать в качестве оптимизирующего вещества один или более пептидов (типично длиной 9-40 аминокислот) или цельных белков или небелковых соединений, имеющих такой же размер и структуру, как и образцы, подлежащие тестированию. Оптимизирующие вещества анализируют и результаты используют для определения кинетики типичных Т-клеточных ответов. Например, Т-клеточные ответы измеряют в различные временные точки, чаще всего между 4 и 9 сутками после добавления образца, используя один или более чем один из целого ряда различных альтернативных анализов. Когда кинетика Т-клеточных ответов на оптимизирующее вещество установлена, может быть определена совокупность временных точек анализа для последующего тестирования образцов. Таким образом, Т-клеточные ответы на тестируемые образцы могут быть проанализированы в одной или более подходящих временных точках. Альтернативно или в дополнение, для установления кинетики Т-клеточных ответов на оптимизирующее вещество могут быть использованы две или более концентраций, и образцы затем могут быть протестированы в этих концентрациях.
Т-клеточный ответ может быть измерен с использованием множества различных анализов, таких как пролиферация Т-клеток путем включения импульса 3HTdR (или других радиоактивных, флуоресцентных или хемолюминесцентных соединений, поглощаемых пролиферирующими Т-клетками), высвобождение цитокинов, таких как IL-2 или IFNγ, изменения транскрипции мРНК, повышенная транскрипция маркера активации мРНК, поток Сa2+ и изменения фенотипических маркеров, особенно маркеров активированных Т-клеток. Типично, для пептидных или белковых образцов Т-клеточные ответы будут измерены либо по включению импульса 3HTdR на 5-е, 6-е, 7-е и 8-е сутки после добавления образца, либо путем измерения высвобождения цитокина (конкретно IL-2) на 8-е сутки после добавления образца (или измерениями как включения 3HTdR, так и высвобождения цитокина). В качестве альтернативы, особенно для пептидов с сильно перекрывающимися последовательностями (например, для 15-меров из белковой последовательности с 12-аминокислотными перекрываниями) можно использовать включение импульса 3HTdR и/или измерение высвобождения цитокина в одной временной точке, типично на 7-е сутки после добавления тестируемого пептида. Соседние перекрывающиеся пептиды, вероятно, содержат Т-клеточные эпитопы, которые вместе усиливают чувствительность детекции Т-клеточного эпитопа.
В тех случаях, когда пептидные или белковые образцы являются иммуномодулирующими или токсичными для АПК или Т-клеток, образец, полученный из организма, обрабатывают, и АПК отделяют от других клеток. Это типично осуществляют путем прикрепления к пластику, и пептидный или белковый образец затем инкубируют с этими АПК. АПК можно инкубировать с цитокинами, такими как интерлейкин-4, фактор стимуляции роста колоний гранулоцитов-макрофагов, фактор некроза опухолей-альфа и интерлейкин-1 альфа, для индукции зрелого фенотипа АПК. Образцы в стандартных анализах Т-клеток с предварительно фракционированными АПК будут обычно требовать времени инкубации образцов с АПК вплоть до 48 часов. Предпочтительно, полузрелые АПК генерируют путем инкубации в ростовой среде, содержащей интерлейкин 4 и фактор стимуляции роста колоний гранулоцитов-макрофагов, вплоть до 4 суток. Затем к полузрелым АПК добавляют образцы, включающие иммуномодулирующие или токсичные образцы, и инкубируют в течение короткого периода времени. В зависимости от токсичности или иммуномодулирующей функции образца время инкубации с полузрелыми АПК может варьировать от 3 до 10 часов. После инкубации образца с АПК экзогенный образец удаляют многократной промывкой полузрелых АПК. Затем получают зрелые нагруженные образцом АПК путем инкубации с провоспалительным стимулом, таким как фактор некроза опухолей, или интерлейкин-1, или лиганд для CD40, или липополисахарид. К зрелым нагруженным образцом АПК добавляют аутологичные Т-клетки, типично Т-клетки, истощенные по CD4+CD8- - CD25hi, полученные из МКПК, как указано выше. Т-клетки, истощенные по CD4+CD8- и CD25hi, инкубируют со зрелыми нагруженными образцом АПК в течение диапазона дополнительных временных точек инкубации. Оптимизирующее вещество, описанное выше, может быть использовано для определения кинетики ответов с разными временными точками инкубации АПК и/или разными временными точками инкубации Т-клеток. Результаты, полученные с оптимизирующим веществом, могут быть использованы для определения совокупности временных точек инкубации АПК и/или инкубации Т-клеток для последующего тестирования образцов. Таким образом, Т-клеточные ответы на тестируемые образцы детектируют в одной или более временных точках анализа. Альтернативно или в дополнение могут быть использованы две или более концентраций для определения кинетики Т-клеточных ответов на оптимизирующее вещество, и образцы затем могут быть протестированы в этих концентрациях.
В тех случаях, когда образец, подлежащий тестированию, является небелковым, любой вышеуказанный способ (то есть способ для пептидных или белковых образцов с иммуномодулирующими или токсичными свойствами или без них) может быть использован в зависимости оттого, является ли небелковый образец иммуномодулирующим или токсичным для АПК, для Т-клеток или и для тех, и для других.
Для белковых или небелковых образцов, которые являются иммуномодулирующими для АПК, для Т-клеток или и для тех, и для других, возможная дополнительная стадия представляет собой прямое тестирование в отношении активации или подавления фенотипических маркеров, например, активации Т-клеток или дифференцировки АПК. Типичные маркеры активации Т-клеток включают изменения в экспрессии CD69, CD25, CTLA4, GITR и измерение внутриклеточного потока Сa2+. Обычные фенотипические маркеры, используемые для оценки дифференцировки АПК, включают МНС класса ΙΙ, CD80 и CD86, которые все в высокой степени экспрессируются на зрелых АПК. Эти дополнительные стадии могут дать информацию о кинетике Т-клеточных ответов на тестируемые образцы, что помогает в определении временной точки анализа для оптимального тестирования Т-клеточных ответов на тестируемые образцы.
Новые способы анализа Т-клеток ex vivo по настоящему изобретению имеют ряд применений, особенно в связи с фармацевтическими препаратами для использования у человека. Для белков с предполагаемым применением в качестве фармацевтических средств анализы Т-клеток по настоящему изобретению могут быть использованы для идентификации Т-клеточных эпитопов в белковой последовательности путем тестирования перекрывающихся пептидов из данной белковой последовательности. Местоположение и сила таких Т-клеточных эпитопов может быть затем использована для оценки потенциальной иммуногенности белка у человека. Альтернативно, Т-клеточные эпитопы в белке могут быть затем удалены посредством мутации белковой последовательности перед применением у человека. Т-клеточные эпитопы в некоторых белках могут быть также идентифицированы способами по настоящему изобретению и затем включены в вакцины либо путем включения последовательности Т-клеточного эпитопа (или его варианта) в белковую вакцину или путем добавления к другим компонентам в качестве части вакцины.
Новые анализы Т-клеток по настоящему изобретению могут быть использованы для оценки потенциальной иммуногенности ряда типов молекул, включающих пептиды, белки и не-белки, включающие органические молекулы, липиды, углеводы или молекулы, состоящие из двух или более различных группировок, включающих конъюгаты, смеси и препараты. Анализы Т-клеток по настоящему изобретению имеют широкое применение как в исследовании, разработке, производстве, так и в клиническом тестировании фармацевтических средств. Например, в исследовании могут быть использованы Т-клеточные ответы на различные аналоги активных молекул для оценки потенциальной иммуногенности этих аналогов у человека. Таким образом такие Т-клеточные ответы могут быть использованы в качестве критериев для отбора лидирующих фармацевтических средств для дальнейшей разработки. Например, при разработке могут быть определены Т-клеточные ответы на различные препараты одной и той же молекулы для оценки потенциальной иммуногенности этих препаратов у человека. Таким образом, такие Т-клеточные ответы могут быть использованы в качестве критериев для отбора оптимального препарата для клинических испытаний. Например, при производстве могут быть определены Т-клеточные ответы на изготовленные партии одной и той же молекулы для оценки потенциальной иммуногенности этих партий, а также для оценки любых изменений в молекулах между партиями. Такие Т-клеточные ответы могут быть использованы в производстве в качестве качественного анализа. В клиническом тестировании, например, Т-клеточные ответы могут быть определены при использовании крови пациента для оценки, например, иммуногенности фармацевтического препарата, который проходит испытания. Анализы Т-клеток по настоящему изобретению могут быть также использованы в клинических испытаниях для определения любого МНС ограничения Т-клеточных ответов на фармацевтический препарат.
В качестве альтернативы применению в детекции Т-клеточных эпитопов способы анализа Т-клеток по настоящему изобретению могут быть использованы для оценки потенциальных нежелательных ответов на фармацевтические препараты, предпочтительно для применения у человека. Эти нежелательные ответы включают в себя гиперчувствительность, аллергию, раздражение, иммуносупрессию, гипериммунную стимуляцию и реакции в месте инъекции. Способы анализа Т-клеток по настоящему изобретению могут быть также использованы для оценки потенциальных нежелательных ответов на нефармацевтические способы лечения, такие как трансплантация, на факторы окружающей среды, такие как аллергены пыльцы растений, на пищевые продукты, на косметику и на ряд промышленно производимых реагентов, таких как детергенты и ферменты.
Специалистам в данной области техники будет понятно, что в способах Т-клеточного анализа по настоящему изобретению могут быть использованы различные вариации, но что эти вариации будут входить в объем данного изобретения, например, в анализе Т-клеточных ответов при использовании множества временных точек для анализа. Например, следует понимать, что в этот объем входят различные способы, известные в данной области техники для анализа Т-клеточных ответов, включающие такие способы, как связывание пептида с МНС, которое определяет индивидуальные стадии, ведущие к Т-клеточному ответу. В качестве альтернативы фракционированию Т-клеток и АПК, описанному выше, для применения в анализах Т-клеток по настоящему изобретению могут быть фракционированы другие клетки. Анализы Т-клеток можно осуществлять с использованием АПК, обогащенных клетками Лангерганса, разными подгруппами макрофагов или разными подгруппами АПК, и/или с использованием разных подгрупп Т-клеток или обогащением ими. Также следует понимать, что цитокины могут быть добавлены к аналитическим смесям (или удалены из них) в анализах Т-клеток по настоящему изобретению, например, для усиления чувствительности или подавления или активации специфических АПК или Т-клеток. В этом изобретении могут быть использованы различные форматы анализов Т-клеток, например, выбраны форматы анализа, в которых Т-клетки примируют путем АПК презентации белка или пептида и затем подвергают повторной стимуляции тем же или родственным белком или пептидом.
Следующее примеры даны для иллюстрации изобретения и не должны рассматриваться как ограничивающие объем данного изобретения.
Пример 1: Влияние истощения по CD25+ Т-клеткам на Т-клеточные ответы
Мононуклеарные клетки периферической крови выделяли из лейкоцитарных слоев крови здоровых доноров (из крови, взятой в пределах 24 часов), полученных из Национальной службы переливания крови (Addenbrooke′s Hospital, Cambridge, UK) в соответствии с одобрением местного Комитета по этике (Addenbrooke′s Hospital Local Research Ethics Committee). МКПК выделяли из лейкоцитарных слоев путем центрифугирования в градиенте плотности фиколла (GE Healthcare, Chalfont St Giles, UK) и CD8+ Т-клетки удаляли, используя CD8+ RossetteSe™ (StemCell Technologies, Vancouver, Канада). Доноров характеризовали путем идентификации гаплотипов HLA-DR с использованием набора для гистотипирования Allset™ на основе ПЦР с одним специфическим праймером (Dynal, Wirral, UK), а также определением Т-клеточных ответов на контрольный антиген гемоцианин лимфы улитки (KLH) (Pierce, Cramlington, UK), столбнячный анатоксин (Aventis Pasteur, Lyon, France) и контрольный пептидный эпитоп из вируса гриппа НА (С32, а.к. 307-319).
Истощение по CD25hi Т-клеткам осуществляли с использованием анти-СР25 микрогранул от Miltenyi Biotech (Guildford, UK), используя стандартный протокол от поставщика и магнит. 10 виал от каждого донора оттаивали, и клетки ресуспендировали в 30 мл 2%-ной инактивированной человеческой сыворотки в PBS (забуференный фосфатами физиологический раствор) (Autogen Bioclear, Came, Wiltshire, UK). 5×107 клеток переносили в 3 пробирки по 15 мл с оставшимися клетками, сохраняемыми в виде цельных МКПК. Смесь разбавленных анти-СР25 микрогранул получали с использованием 300 мкл гранул +4200 мкл буфера для разделения (0,5% человеческой сыворотки/2 мМ ЭДТА/PBS). Пробирки 15 мл центрифугировали и ресуспендировали в 500 мкл смеси для разбавления микрогранул. Пробирки затем выдерживали при 4°C в течение 5, 10 или 20 минут перед разделением на колонке. Колонки устанавливали, помещая колонки в магнит, закрепленный на штативе, добавляя в колонку 2 мл буфера для разделения и позволяя ему прокапать через колонку. После инкубации с гранулами добавляли 10 мл буфера для разделения и пробирки центрифугировали при 1500 об/мин в течение 7 минут. Клетки затем ресуспендировали в 500 мкл буфера для разделения и наносили на колонку с последующими 2×1 мл промывками буфером для разделения. Жидкость с колонки собирали в 15 мл пробирки, и она содержала истощенную по CD25hi Т-клеткам фракцию. Эти клетки осаждали центрифугированием при 1500 об/мин в течение 7 минут и ресуспендировали в 3 мл среды AIMV (Invitrogen, Paisley, UK) и затем подсчитывали.
Клетки окрашивали на CD4 и CD25 и количества клеток определяли с помощью FACS (флуоресценцентно-активируемая сортировка клеток). 5-10×105 клеток каждой клеточной популяции вносили в одну лунку 96-луночного U-образного планшета (Greiner Bio-One, Frickenhausen, Германия). Планшет центрифугировали при 1200 об/мин в течение 4 минут. Супернатант отбрасывали и клетки ресуспендировали в 50 мкл разбавления антител. Разбавление антител состояло из FIТС (флуоресцинизотиоцианат)-меченого антитела против CD4 в разведении 1/50 (R&D Systems, Minneapolis, США)+РЕ (фикоэритрин)-меченого антитела против CD25 в разведении 1/25 (R&D Systems, Minneapolis, США) в буфере для FACS (1% человеческой сыворотки/0,01% азида натрия/PBS). Контрольные лунки также были неокрашенными, окрашенными изотипическими контролями или окрашенными только меченым антителом.
Планшеты инкубировали на льду в течение 30 минут в темноте. Планшеты затем центрифугировали при 1200 об/мин в течение 4 минут. Супернатант отбрасывали и клетки ресуспендировали в 200 мкл буфера для FACS. Процедуру повторяли дважды, и клетки затем переносили в пробирки для FACS. Клетки прогоняли через FACS Calibur (Becton Dickinson, Oxford, UK), и данные собирали и анализировали на основании размера, гранулярности и флуоресцентных меток.
Анализы пролиферации осуществляли следующим образом. Цельные МКПК, истощенные по CD8+ Т-клеткам, и МКПК, истощенные по CD8+CD25hi-клеткам, добавляли в концентрации 2×105 на лунку в 100 мкл AIMV. При использовании плоскодонных 96-луночных планшетов культуры в трех повторностях адаптировали для каждого условия тестирования. К культурам клеток добавляли по 100 мкл каждого пептида с получением конечной концентрации 5 мкМ. Клетки инкубировали с пептидными и белковыми антигенами в течение 7 суток до импульсного внесения 1 мКи/мл 3HTdR (GE Healthcare, Chalfont St Giles, UK) в каждую лунку на 18 часов.
Для анализа пролиферации использовали пороговое значение индекса стимуляции, равное или больше 2 (SI≥2), причем пептиды, индуцирующие пролиферативные ответы выше этого порога (пунктирная линия), считались положительными. Все данные анализировали для определения коэффициента вариации (CV), стандартного отклонения (SD) и значимости (p<0,05) с использованием одностороннего непарного Т-критерия Стьюдента. Все ответы с SI≥2 значимо (p<0,05) отличались от контролей с необработанной средой.
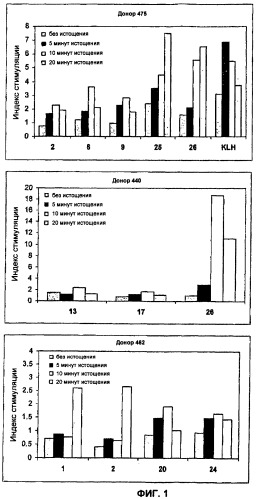
Результаты показаны на Фиг.1, которая представляет пролиферативные ответы Т-клеток в МКПК от трех человек доноров (475, 440 и 462) на ряд пограничных или слабых Т-клеточных эпитопов (пептиды: 1 (PGQTATITCSGHALG), 2 (GDKFVSWYQQGSGQS), 6 (IKPEAPGCDASPEELNRYYASLRHYLNLVTRQRY), 9 (QSISNWLNWYQQKPG), 13 (KGLEWLWIWSDGSS), 17 (AASGFTFSSFGMSWV), 20 (DTAVYYCAAAGVRAEDGRVRTLPSEYTFWGQGTQV), 24 (HQSLVIKLMPNITLL)) и на пару сильных Т-клеточных эпитопов (пептиды: 25 (PKYRNMQPLNSLKIAT) и 26 (TVFYNIPPMPL) и на антиген KLH. Эти результаты показывают увеличение Т-клеточных ответов на все пептиды после истощения CD25hi Т-клеток. Максимальные ответы определяли на все пептиды после 10- или 20-минутного истощения CD25hi Т-клеток. Эти результаты продемонстрировали сильное увеличение Т-клеточных ответов после истощения CD25hi Т-клеток, которое в случаях таких пептидов, как пептиды 1 и 2, делало возможным детекцию таких Т-клеточных эпитопов в пептидах, которые раньше считались пограничными или отрицательными в отношении Т-клеточных ответов.
Пример 2 - Динамические Т-клеточные анализы пептидов
Пептиды дикого типа (WT) и пептиды, лишенные Т-клеточного эпитопа (HLRHCLSCSKCRKEM и HARHCLSCSKCRKEM соответственно), являющиеся производными последовательности sTNFR1 человека (растворимый рецептор-1 фактора некроза опухолей), синтезировали (Pepscan Systems, Leystad, Нидерланды) и тестировали с использованием способа из Примера 1, в котором использовали МКПК, истощенные по CD8+CD25hi Т-клеткам, для сравнения пептидов, происходящих из sTNFR - 1, в отношении их способности стимулирова