Получение квартернизованных производных усниновой кислоты и их биологические свойства
Иллюстрации
Показать всеИзобретение относится к области медицины и фармацевтики и касается ингибиторов роста патогенных грамположительных микроорганизмов, представляющих собой (+) и (-)-энантиомеры производных усниновой кислоты, содержащих квартернизованный атом азота. Ингибиторы обладают высокой биологической активностью. Изобретение позволяет эффективно воздействовать на микобактерии и, тем самым, повысить лечение туберкулеза. 8 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к фармацевтической химии и касается производных усниновой кислоты, содержащих кватернизованный атом азота. Указанные соединения могут быть использованы в качестве веществ, активных в отношении патогенных грамположительных бактерий, включая микобактерии.
Уровень техники
Повышение эффективности лечения больных туберкулезом - важнейшая социальная задача в России и мире. Ежегодно эти заболевания уносят более 2 миллионов жизней. Улучшение результатов лечения туберкулеза зависит от развития современной фармацевтики, главным в котором является разработка новых технологических подходов к созданию новых лекарственных средств путем воздействия на мишени, важные для жизнедеятельности возбудителя туберкулеза - Mycobacterium tuberculosis. Одной из причин трудности лечения туберкулеза является массовое возникновение множественной лекарственной устойчивости (МЛУ или MDR - Multiple Drug Resistance) у возбудителя туберкулеза, как к традиционным противотуберкулезным лекарствам так называемого первого ряда (особенно к рифампицину и изониазиду), так и к препаратам второго ряда (фторхинолонам и аминогликозидам) (Edlin et al. An outbreak of multidrug-resistant tuberculosis among hospitalized patients with the acquired immunodeficiency syndrome. N Engl J Med: 1992; 326(23):1514-1521; Fischl et al., An outbreak of tuberculosis caused by multiple-drug-resistant tubercle bacilli among patients with HIV infection. Ann Intern Med: 1992; 117(3):177-183). Среди устойчивых штаммов особенно опасны штаммы с широкой лекарственной устойчивостью (ШЛУ или XDR - Extensively Drug-Resistant); они устойчивы к 4-9 препаратам первого и второго ряда. Поэтому преодоление проблем, стоящих перед фтизиатрией в связи с появлением MDR, является задачей первостепенной важности (Tomioka Н. Prospects for the development of new antituberculous drugs putting our hopes on new drug targets. Kekkaku. 2010; 85(11):815-22, Shi R, Sugawara I. Development of new anti-tuberculosis drug candidates.Tohoku J Exp Med. 2010; 221(2):97-106; Koul A, Arnoult E, Lounis N, Guillemont J, Andries K The challenge of new drug discovery for tuberculosis. Nature. 2011; 469(7331):483-90). Сформулирована необходимость разработки новых кандидатов в лекарства в первую очередь, полусинтетических, на базе природных веществ новых классов, показавших в предыдущих исследованиях новый механизм действия и прошедших исследования на безопасность для человека. Полусинтетические производные усниновой кислоты относятся к такому классу соединений. Недостатком природной усниновой кислоты, как ранее используемого противотуберкулезного препарата, является относительно низкая эффективность по сравнению с существующими препаратами первого ряда и низкая водорастворимость. Предлагаемые полусинтетические квартернизованные производные усниновой кислоты являются растворимыми и более эффективными.
Решаемая проблема: Поиск антибактериальных средств нового механизма действия, в том числе противотуберкулезных, активных в отношении штаммов с множественной лекарственной устойчивостью.
Соединения, раскрываемые в настоящем изобретении, являются производными (R)- и (S)-усниновой кислоты, содержащими кватернизованный атом азота, синтез соединений 3-6 описан в работе [A.A.Tazetdinova, O.A.Luzina, M.P.Polovinka, N.F.Salakhutdinov and G.A.Tolstikov. Amino-derivatives of usninic acid. Chemistry of Natural Compounds, 2009, 45, 800], соединения 7 и 8 являются новыми, не описанными ранее.
Раскрытие изобретения
Задача изобретения - использование в качестве антибактериальных (в том числе противотуберкулезных) средств впервые синтезированных производных усниновой кислоты.
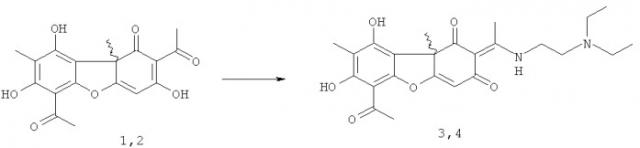
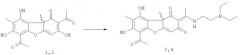
(S)-Усниновую кислоту 1 выделяли из лишайника Cladonia stellaris, (R)-усниновую кислоту 2 из смеси лишайников рода Usnea по методике [Н.Ф.Салахутдинов, М.П.Половинка, М.Ю.Панченко, Пат. РФ №2317076 C1; Бюл. Изобр. 2008, №5]. Соединения 3 и 4 могут быть получены взаимодействием соответственно соединений 1 и 2 с диэтиламиноэтиламином. Соединения 5 и 6 могут быть получены взаимодействием соответственно соединений 3 и 4 с йодистым метилом. Обе реакции осуществляются по ранее предложенным методикам [A.A.Tazetdinova, O.A.Luzina, M.P.Polovinka, N.F.Salakhutdinov and G.A.Tolstikov. Amino-derivatives of usninic acid. Chemistry of Natural Compounds, 2009, 45, 800] в соответствии со схемой:
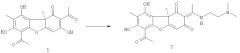
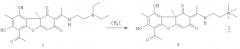
Соединение 7 может быть получено взаимодействием соответственно соединения 1 с диметиламиноэтиламином. Соединение 8 может быть получено взаимодействием соединения 7 с йодистым метилом. Обе реакции осуществляются по описанным ниже методикам в соответствии со схемой:
Изобретение иллюстрируется следующими примерами:
Пример 1.
Синтез (E)-6-ацетил-2-(1-(2-(диэтиламино)этилиден)-7,9-дигидрокси-8,9b-диметилдибензо[b,d]фуран-1,3(2Н,9bH)-дионов 3,4
К 1 ммоль соединения 1 или 2 добавили 1.1 ммоль диэтиламиноэтиламина и растворили смесь в 12 мл этилового спирта. Кипятили на водяной бане 3 часа. Охладили, добавили 10 мл дистиллированной воды. Выпадает светлый осадок, осадок отфильтровали, промыли водой, сушили на воздухе. Выделяли соединения 3 или 4 соответственно с выходом 88%.
(R,E)-6-ацетил-2-(1-(2-(диэтиламино)этилиден)-7,9-дигидрокси-8,9b-диметилдибензо[b,d]фуран-1,3(2Н,9bH)-дион 3. Выход 88%, т.пл. 68°C. ЯМР 1H (CDCl3, δ, м.д., J Гц): 1.16 (6Н, т, J=7.1, 3H-19 и 3H-21), 1.73 (3H, с, H-15), 2.13 (3H, с, H-10), 2.67 (6Н, с, 3H-12 и 3H-14), 2.69 (4Н; кв, J=7.1, 2Н-18 и 2Н-20), 2.86 (2Н, т, J=6.0, H-17), 3.66 (2Н, д.т, J=5.7, J=6.0, H-16), 5.82 (1Н, с, H-4), 12.01 (1Н, ш.с, OH-9), 13.36 и 13.39 (1H, с и 1H, с, NH и OH-7). ЯМР 13C (CDCl3, δ, м.д.): 7.3 (C-10), 11.5 (C-19 и C-21), 18.7 (C-12), 31.8 (C-14), 31.9 (C-15), 42.3 (C-16), 46.7 (C-18 и C-20), 50.8 (C-17), 59.0 (C-9b), 102.5 (C-4), 101.2 (C-6), 105.0 (C-2), 105.1 (C-9а), 107.7 (C-8), 155.8 (С-5а), 158.2 (C-9), 163.7 (C-7), 173.7 (C-11), 174.3 (С-4а), 191.5 (C-3), 197.9 (C-1), 200.6 (C-13). ИК спектр (ν, см-1): 841, 1061, 1287, 1370, 1555, 1627, 1701, 2926, 3387. Найдено: m/z 442.2110 [M]+ C24H30O6N2. Вычислено: M=442.2098. [α]D+366° (с 0.390; CHCl3).
(S,E)-6-ацетил-2-(1-(2-(диэтиламино)этилиден)-7,9-дигидрокси-8,9b-диметилдибензо[b,d]фуран-1,3(2Н,9bH)-дион 4. Спектральные данные те же, что и для соединения 3 [α]D-370° (с 0.340; CHCl3).
Пример 2.
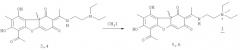
Синтез (E)-2-(1-(6-ацетил-7,9-дигидрокси-8,9b-диметил-1,3-диоксо-1,9b-дигидродибензо[b,d]фуран-2(3H)-илиден)этиламино)-N,N-диэтил-N-метилэтанаммония иодидов 5,6
К 1.1 ммоль аминов 3 или 4 в 10 мл хлористого метилена добавили 3 ммоль йодистого метила. Реакционную смесь выдерживали 3 суток, выпадает желтоватый осадок. Образующийся осадок отфильтровывали, промывали хлороформом, после чего высушивали на воздухе. Выделяли соединения 5 или 6 соответственно.
(R,E)-2-(1-(6-ацетил-7,9-дигидрокси-8,9b-диметил-1,3-диоксо-1,9b-дигидродибензо[b,d]фуран-2(3H)-илиден)этиламино)-N,N-диэтил-N-метилэтанаммония иодид 5. Выход 64%. т.пл. 125°C. ЯМР 1H (DMSO-d6, δ, м.д., J Гц): 1.22 (6Н, т, J=7.1, 3H-19 и 3H-21), 1.60 (3H, с, H-15), 1.90 (3H, с, H-10), 2.57 (3H, с, H-12), 2.64 (3H, с, H-14), 3.05 (3H, с, H-22), 3.38 (4Н, кв, J=7.1, 2Н-18 и 2Н-20), 3.59 (2Н, т, J=6.0,H-17), 4.04 (2Н, д.т, J=5.7 и J-6.0, H-16), 5.83 (1Н, с, H-4), 12.06 (1H, с, OH-9), 12.97 и 13.32 (1Н, с, NH и 1Н, с, OH-7). ЯМР 13С (CDCl3, δ, м.д.): 7.6 (C-10), 7.7 (C-19 и C-21), 18.6 (C-12), 31.2 и 31.8 (C-14 и C-15), 37.2 (C-16), 47.1 (C-22), 56.4, 56.6, 57.5 (C-17, C-18, C-20), 59.0 (C-9b), 100.1 (C-6), 102.4 (C-4), 102.4 (C-2), 105.4 (C-9a), 106.6 (C-8), 155.8 (C-5a), 157.6 (C-9), 162.6 (C-7), 173.3 (C-11), 176.2 (C-4a), 189.0 (C-3), 197.7 (C-1), 201.1 (C-13). ИК спектр (ν, см-1): 846, 1060, 1288, 1369, 1556, 1629, 1700, 2976, 3440. Элементный анализ: Найдено, %: C 52.48, H 6.13, N 4.78, I 21.00. Вычислено, %: C 51.38, H 5.69, N 4.79,I 21.71. C25H33IO6N2. [α]D+198° (с 0.164; CH3OH).
(S,E)-2-(1-(6-ацетил-7,9-дигидрокси-8,9b-диметил-1,3-диоксо-1,9b-дигидродибензо[b,d]фуран-2(3H)-илиден)этиламино)-N,N-диэтил-N-метилэтанаммония иодид 6. Спектральные данные те же, что и для соединения 5. [α]D-201° (с 0.146; CH3OH).
Пример 3.
Синтез (R,E)-6-ацетил-2-(1-(2-(диметиламино)этилиден)-7,9-дигидрокси-8,9b-диметилдибензо[b,d]фуран-1,3(2Н,9bH)-диона 7
К 1 ммоль соединения 1 добавили 1.1 ммоль диметиламиноэтиламина и растворили смесь в 12 мл этилового спирта. Кипятили на водяной бане 3 часа. Охладили, добавили 10 мл дистиллированной воды. Выпадает светлый осадок, осадок отфильтровали, промыли водой, сушили на воздухе. Выделяли соединение 7 с выходом 86%.
(R,E)-6-ацетил-2-(1-(2-(диметиламино)этилиден)-7,9-дигидрокси-8,9b-диметилдибензо[b,d]фуран-1,3(2Н,9bH)-дион 7. Выход 86%, т.пл. 84°C. ЯМР 1H (CDCl3, δ, м.д., J Гц): 1.67 (3H, с, H-15), 2.06 (3H, с, Н-10), 2.31 (6Н, с, 3H-18 и 3H-19), 2.61 и 2.64 (6Н, с, 3H-12 и 3H-14), 2.60 (2Н, т, J=6.0, Н-17), 3.50 (2Н, д.т, J=5.7, J=6.0, H-16), 5.75 (1Н, с, Н-4), 12.02 (1Н, ш.с, OH-9), 13.33 (1H, ш.с и 1H, ш.с, NH и OH-7). ЯМР 13C (CDCl3, δ, м.д.): 7.0 (C-10), 18.3 (C-12), 30.8 (C-14), 31.5 (C-15), 41.6 (C-16), 44.9 (C-18 и C-19), 56.7 (C-17), 59.0 (С-9b), 102.1 (C-4), 100.9 (C-6), 101.2 (C-2), 104.7 (С-9а), 107.4 (C-8), 155.5 (С-5а), 157.9 (C-9), 163.0 (С-7), 173.5 (C-11), 174.0 (С-4а), 192.1 (C-3), 197.5 (C-1), 200.2 (C-13). ИК спектр (ν, см-1): 1059, 1288, 1371, 1556, 1626, 1701, 2773, 2922, 3437. Найдено: m/z 414.1796 [M]+ C22H26O6N2. Вычислено: M=414.1791. [α]D+290° (с 0.685; CHCl3).
Пример 4.
Синтез (R,E)-2-(1-(6-ацетил-7,9-дигидрокси-8,9b-диметил-1,3-диоксо-1,9b-дигидродибензо[b,d]фуран-2(3H)-илиден)этиламино)-N,N-диметил-N-метилэтанаммония иодида 8
К 1.1 ммоль амина 7 в 10 мл хлористого метилена добавили 3 ммоль йодистого метила. Реакционную смесь выдерживали 3 суток, выпадает белый осадок. Образующийся осадок отфильтровывали, промывали хлороформом, после чего высушивали на воздухе. Выделяли соединение 8 с выходом 88%.
(R,Е)-2-(1-(6-ацетил-7,9-дигидрокси-8,9b-диметил-1,3-диоксо-1,9b-дигидродибензо[b,d]фуран-2(3H)-илиден)этиламино)-N,N-диметил-N-метилэтанаммония иодид 8. Выход 88%. т.пл. 240°C. ЯМР 1H (DMSO-d6, δ, м.д., J Гц): 1.67 (3H, с, Н-15), 1.98 (3H, с, H-10), 2.64 (3H, с, H-12), 2.66 (3H, с, H-14), 3.17 (9Н, с, 3H-18, 3H-19, 3H-20), 3.69 (2Н, т, J=6.0, H-17), 4.08 (2Н, д.т, J=5.5 и J=6.0, H-16), 5.93 (1Н, с, H-4), 12.15 (1Н, с, OH-9), 13.07 (1Н, т, J=5.5, NH), 13.41 (1H, с, OH-7). ЯМР 13C (CDCl3, δ, м.д.): 7.5 (C-10), 18.5 (C-12), 31.1 и 31.6 (C-14 и C-15), 37.6 (C-16), 52.8, (C-18, С-19, C-20), 56.5 (C-17), 62.8 (С-9b), 100.9 (C-6), 102.2 (C-2), 102.4 (C-4), 105.0 (С-9а), 106.4 (C-8), 155.8 (С-5а), 157.6 (C-9), 162.6 (C-7), 173.2 (C-11), 176.0 (С-4а), 188.9 (C-3), 197.6 (C-1), 201.0 (C-13). ИК спектр (ν, см-1): 1055, 1191, 1288, 1373, 1556, 1628, 1699, 2787, 2954, 3439. Элементный анализ: Найдено, %: C 45.33, H 5.06, N 3.70, I 20.45. Вычислено, %: C 49.65, H 5.25, N 5.03,I 22.81. C23H29IO6N2. [α]D+203° (с 0.310; CH3OH).
Пример 5.
Антибактериальная активность вещества 5 в отношении патогенных грамм-положительных микроорганизмов, определенная методом определения минимальных ингибирующих концентраций в жидкой среде.
Раствор испытуемого соединения готовили в концентрации 1000 мкг/мл в ДМСО, затем разводили водой до концентрации 128 мкг/мл.
Для приготовления инокулята использовали суточную культуру грамположительных микроорганизмов Staphylococcus, Streptococcus и Enterococcus, выращенных на плотной питательной среде, соответствующей каждому типу микроорганизмов. В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулята до 0,5 по стандарту МакФарланда (1,5×108 КОЕ/мл). Затем полученный инокулят разводили до концентрации 5×105 КОЕ/мл бульоном Мюллера-Хинтон.
В работе использовали микрометод определения минимальной ингибирующей концентрации (МИК) методом серийных разведений в бульоне Мюллера-Хинтон с использованием 96-луночных стерильных планшетов.
За МИК принимали минимальную концентрацию исследуемых соединений, обеспечивающую полное подавление видимого роста исследуемых штаммов микроорганизмов.
| Бактериальные штаммы | МИК в мкг/мл |
| Staphylococcus aureus 25923 ATCC | 16.0 |
| Staphylococcus epidermidis 12228 ATCC | 32.0 |
| Streptococcus pneumoniae 49619 ATCC | 64.0 |
| Enterococcus faecalis 29212 ATCC | 32.0 |
Вещество активно в отношении всех испытуемых грамположительных микроорганизмов: Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pneumoniae, Enterococcus faecalis.
Пример 6.
Антибактериальная активность 5 в отношении анаэробных грамположительных микроорганизмов.
Для определения активности вещества использовался метод бумажных дисков. Метод заключается в определении величины зоны подавления роста штамма, засеянного газоном на агаризованной среде, вокруг бумажных дисков, содержащих вещество в различных концентрациях.
| Бактериальные штаммы | МИК в мкг/диск |
| Lactobacillus casei 20011 | 6.0 |
| Lactobacillus rhamnosus 421-2 | 5.0 |
| Bifidobacterium bifidum 791wt | 5.5 |
Представители родов Lactobacillus и Bifidobacterium чувствительны к 5.0-6.0 мкг/диск вещества.
Пример 7.
Антибактериальная активность вещества 5, 6, 7, 8 в тест-системе Mycobacterium smegmatis АТСС-607.
Mycobacterium smegmatis - модельная тест-система, используемая на первой стадии скрининга потенциальных противотуберкулезных средств (К.Е.А.Lougheed, S.А.Osborne, В.Saxty, et al. Effective inhibitors of the essential kinase PknB and their potential as anti-mycobacterial agents. Tuberculosis (Edinb). 2011 July; 91(4):277-286). Определение активности вещества проводилось методом бумажных дисков. Метод заключается в определении величины зоны подавления роста штамма, засеянного газоном на агаризованной среде, вокруг бумажных дисков, содержащих вещество в различных концентрациях.
| Штамм | Mycobacterium smegmatis АТСС-607 | ||
| Вещество | 5 | 6 | 8 |
| МИК в мкг/диск | 5.8 | 6.5 | 5.7 |
Штамм Mycobacterium smegmatis ATCC-607 чувствителен к 5.8 мкг/диск вещества 5, к 6.0 мкг/диск вещества 6, к 5.7 мкг/диск вещества 8.
Пример 8.
Определение острой токсичности вещества 5.
Определение полулетальной дозы вещества (LD50) проводилось при помощи уравнения линейной регрессии. Вещество, растворенное в ДМСО в различных концентрациях, вводилось инбредным мышам линии Balb/C по 0,3 мл перорально через зонд. В течение 30 дней наблюдалась динамика гибели животных. На основании полученных данных было построено уравнение линейной регрессии и определена полулетальная доза вещества. LD50=975 мг/кг.
Ингибитор роста патогенных грамположительных микроорганизмов, производные усниновой кислоты, представляющие собой выбранных из группы (R,Е)-2-(1-(6-ацетил-7,9-дигидрокси-8,9b-диметил-1,3-диоксо-1,9b-дигидродибензо[b,d]фуран-2(3Н)-илиден)этиламино)-N,N-диэтил-N-метилэтанаммония иодид 5 и (S,Е)-2-(1-(6-ацетил-7,9-дигидрокси-8,9b-диметил-1,3-диоксо-1,9b-дигидродибензо[b,d]фуран-2(3Н)-илиден)этиламино)-N,N-диэтил-N-метилэтанаммония иодид 6, (R,E)-2-(1-(6-ацетил-7,9-дигидрокси-8,9b-диметил-1,3-диоксо-1,9b-дигидродибензо[b,d]фуран-2(3Н)-илиден)этиламино)-N,N-диметил-N-метилэтанаммония иодид 8.