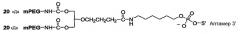Связывающие комплемент аптамеры и средства против с5, пригодные для лечения глазных нарушений
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к офтальмологии, и может быть использовано для лечения, стабилизации и/или профилактики дегенерации желтого пятна. Лечение включает введение терапевтически эффективного количества средства против С5 в комбинации со средством против VEGF субъекту, нуждающемуся в этом. При этом средство против С5 связывается с С5 комплементом и имеет последовательность SEQ ID NO:4 или SEQ ID NO:67. Изобретение обеспечивает аддитивный и синергетический эффект указанных средств за счет из комбинирования, что ведет к улучшению остроты зрения, особенно у пациентов с возрастной дегенерацией желтого пятна (AMD) «влажного» типа по сравнению с монотерапией против VEGF. 14 з.п. ф-лы, 67 ил., 8 пр.
Реферат
СВЯЗАННЫЕ ЗАЯВКИ
По данной патентной заявке испрашивается приоритет по условным патентным заявкам США с серийными номерами № 60/780905, поданной 8 марта 2006 года, и 60/848274, поданной 29 сентября 2006 года, все из которых включены в настоящий документ в качестве ссылок в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, главным образом, к области нуклеиновых кислот и, более конкретно, к аптамерам, способным связываться с белками системы комплемента, пригодным в качестве лекарственных средств и диагностических средств при связанных с комплементом глазных, сердечных, воспалительных, астматических и аутоиммунных нарушениях, ишемическом реперфузионном повреждении и/или других заболеваниях или нарушениях, в которые, в частности, вовлечена опосредуемая C5 активация комплемента. В предпочтительных вариантах осуществления, настоящее изобретение, более конкретно, относится к способам и материалам для лечения и выявления глазных нарушений, включая, но не ограничиваясь этим, лечение и выявление опосредуемых C5 нарушений, таких как опосредуемые C5 глазные нарушения. Кроме того, настоящее изобретение относится к материалам и способам для введения аптамеров, способных связывать белки системы комплемента, включая белки C5.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Аптамер по определению представляет собой выделенную молекулу нуклеиновой кислоты, которая связывается с высокой специфичностью и аффинностью с определенной мишенью, такой как белок, посредством взаимодействий, отличных от образования пар по принципу Уотсона-Крика. Несмотря на то, что аптамеры представляют собой молекулы на основе нуклеиновых кислот, существует фундаментальное отличие между аптамерами и другими молекулами нуклеиновых кислот, такими как гены и мРНК. В последних структура нуклеиновой кислоты кодирует информацию через ее линейную последовательность оснований и, таким образом, эта последовательность важна для функции хранения информации. В противоположность этому, функция аптамера, которая основана на специфичном связывании молекулы-мишени, не зависит от консервативной линейной последовательности оснований, а зависит от конкретной вторичной/третичной структуры. Значит, аптамеры представляют собой некодирующие последовательности. Любой потенциал в отношении кодирования, которым может обладать аптамер, является полностью случайным и абсолютно не участвует в связывании аптамера с его собственной мишенью. Таким образом, несмотря на то, что возможно, чтобы аптамеры, которые связываются с одной мишенью и даже с одним участком на этой мишени, обладали сходной линейной последовательностью оснований, большинство из них не обладают ей.
Также аптамеры необходимо отличать от встречающихся в природе последовательностей нуклеиновых кислот, которые связываются с определенными белками. Эти последние последовательности представляют собой встречающиеся в природе последовательности, заключенные в геном организма, которые связываются со специализированной подгруппой белков, которые вовлечены в транскрипцию, трансляцию и транспорт встречающихся в природе нуклеиновых кислот, т.е. связывающих нуклеиновые кислоты белков. С другой стороны, аптамеры представляют собой короткие, выделенные, не встречающиеся в природе молекулы нуклеиновых кислот. Несмотря на то, что могут быть идентифицированы аптамеры, которые связывают связывающие нуклеиновые кислоты белки, в большинстве случаев такие аптамеры обладают небольшой идентичностью с последовательностями, распознаваемыми связывающими нуклеиновую кислоту белками в природе, или не обладают ей. Более важным является то, что аптамеры могут связываться практически с любым белком (не только со связывающими нуклеиновые кислоты белками), а также практически с любой представляющей интерес мишенью, включая низкомолекулярные соединения, углеводы, пептиды и т.д. Для большинства мишеней, даже белков, встречающаяся в природе последовательность нуклеиновой кислоты, с которой они связываются, не существует; для тех мишеней, которые имеют такую последовательность, т.е. связывающих нуклеиновую кислоту белков, такие последовательности будут отличаться от аптамеров в результате относительно низкой аффинности связывания, используемой в природе по сравнению с сильно связывающимися аптамерами.
Аптамеры, подобно пептидам, полученным посредством фагового дисплея, или антителам, способны специфично связывать выбранные мишени и модулировать активность или связывающие взаимодействия мишени, например, связывающие аптамеры могут блокировать способность их мишени к функционированию. Как и в случае антител, это функциональное свойство специфичного связывания с мишенью представляет собой присущее им свойство. Так же, как в случае антител, несмотря на то, что квалифицированный специалист может не знать, какими точно структурными свойствами будет обладать аптамер к мишени, квалифицированному специалисту известно, как идентифицировать, создавать и применять такую молекулу в отсутствие точной структурной определенности.
Также аптамеры аналогичны низкомолекулярным лекарственным средствам в том, что единичное структурное изменение, каким бы незначительным оно ни казалось, может значительно влиять (на несколько порядков величины) на связывание и/или другой вид активности (или виды активности) аптамера. С другой стороны, некоторые структурные изменения будут оказывать небольшой эффект или не оказать никакого эффекта. Это является следствием важности вторичной/третичной структуры аптамеров. Иными словами, аптамер представляет собой трехмерную структуру, находящуюся в фиксированной конформации, которая обеспечивает химические контакты для специфичного связывания данной его мишени. Следовательно: (1) некоторые области или конкретные последовательности являются существенными в качестве (a) специфичных точек контакта с мишенью, и/или в качестве (b) последовательностей, которые обеспечивают контакт молекул с мишенью; (2) некоторые области или конкретные последовательности обладают диапазоном вариабельности, например нуклеотид X должен быть пиримидином, или нуклеотид Y должен быть пурином, или нуклеотиды X и Y должны быть комплементарными; и (3) некоторые области или конкретные последовательности могут быть любыми, т.е. по существу они представляют собой промежуточные элементы, например, они могут представлять собой любую цепь нуклеотидов данной длины или даже ненуклеотидный спейсер, такой как молекула PEG.
Открытые посредством процесса селекции in vitro из пулов олигонуклеотидов со случайной последовательностью, аптамеры были получены свыше чем для 130 белков, включая факторы роста, транскрипционные факторы, ферменты, иммуноглобулины и рецепторы. Типичный аптамер обладает размером 10-15 кДа (20-45 нуклеотидов), связывает его мишень с от наномолярной до субнаномолярной аффинностью, и отличает высокосходные мишени (например, аптамеры, как правило, не связывают другие белки из того же семейства генов). В ряде структурных исследований было показано, что аптамеры способны использовать те же типы связывающих взаимодействий (например, образование водородных связей, электростатическую комплементарность, гидрофобные взаимодействия, пространственное вытеснение), которые определяют аффинность и специфичность в комплексах антитело-антиген.
Аптамеры обладают рядом свойств, желательных для применения в качестве средств для диагностики и лечения, включая высокую специфичность и аффинность, биологическую эффективность и превосходные фармакокинетические свойства. Кроме того, они обладают определенными преимуществами, обеспечивающими конкурентоспособность, над антителами и другими белковыми биологическими веществами, например:
1) Скорость и контроль. Аптамеры полностью получают в процессе in vitro, что обеспечивает быстрое получение исходных цепей, включая терапевтические цепи. Отбор in vitro обеспечивает строгий контроль специфичности и аффинности и обеспечивает возможность получения цепей, включающих цепи против как токсичных, так и неиммуногенных мишеней.
2) Токсичность и иммуногенность. Было показано, что аптамеры как класс обладают терапевтически приемлемой токсичностью и отсутствием иммуногенности. В то время как эффективность множества моноклональных антител может быть значительно ограничена иммунным ответом на сами антитела, крайне трудно вызвать образование антител к аптамерам, наиболее вероятно, вследствие того, что аптамеры не могут быть представлены T-клетками посредством MHC, и иммунный ответ, главным образом, не направлен на распознавание фрагментов нуклеиновых кислот.
3) Введение. В то время как большинство одобренных к настоящему времени лекарственных средств на основе антител вводят посредством внутривенной инфузии (как правило, в течение 2-4 час), аптамеры можно вводить подкожной инъекцией (биодоступность аптамеров при подкожном введении в исследованиях на обезьянах составляет >80% (Tucker et al, J. Chromatography B. 732: 203-212, 1999)). Это отличие, главным образом, является следствием сравнительно низкой растворимости и, таким образом, для большинства терапевтических mAb необходимы большие объемы. При хорошей растворимости (>150 мг/мл) и сравнительно низкой молекулярной массе (аптамер: 10-50 кДа антитела: 150 кДа), недельная доза аптамера может быть доставлена инъекцией объемом менее 0,5 мл. Кроме того, небольшой размер аптамеров позволяет им проникать в области конформационных сужений, в которые не могут проникать антитела или фрагменты антител, что представляет собой дополнительное преимущество средств для лечения и профилактики на основе аптамеров.
4) Возможность увеличения масштаба продукции и стоимость. Терапевтические аптамеры химически синтезируют, и, таким образом, масштаб синтеза может быть легко увеличен для удовлетворения производственных потребностей по мере необходимости. В то время как сложность масштабного изготовления в настоящее время ограничивает доступность некоторых биологических препаратов, и затраты капитала на продуцирующие белки растения являются очень большими, с помощью отдельного устройства для крупномасштабного синтеза олигонуклеотидов можно получать свыше 100 кг/год и для этого требуется относительно небольшое первоначальное капиталовложение. Текущая стоимость материалов для синтеза аптамеров на килограммовом уровне оценивается как $500/г, что сравнимо со стоимостью высокооптимизированных антител. Ожидается, что продолжающиеся усовершенствования в развитии производственного процесса снизят стоимость материалов до <$100/г в течение пяти лет.
5) Стабильность. Терапевтические аптамеры являются химически устойчивыми. Они по своей природе адаптированы для восстановления активности после воздействия факторов, таких как нагревание и денатурирующие вещества, и в виде лиофилизированных порошков могут храниться в течение длительного периода времени (>1 года) при комнатной температуре. Напротив, антитела необходимо хранить замороженными.
Система комплемента. Система комплемента содержит набор по меньшей мере из 20-30 белков плазмы и мембранных белков, которые действуют совместно в регулируемой каскадной системе для атаки на внеклеточные формы патогенов (например, бактерии). Система комплемента включает три различных каскада активации ферментов: классический, лектиновый и альтернативный каскады (Фиг.1), которые сходятся на активации C5 и приводят к неферментативному каскаду, известному как мембраноатакующий каскад.
Первый ферментативно активируемый каскад, известный как классический каскад, включает несколько компонентов, C1, C4, C2, C3 и C5 (перечисленные по порядку в каскаде). Инициация классического каскада системы комплемента происходит после связывания и активации первого компонента комплемента (C1) как иммунными, так и неиммунными активаторами. C1 включает кальций-зависимый комплекс компонентов C1q, C1r и C1s и активируется посредством связывания компонента C1q. C1q содержит шесть идентичных субъединиц, и каждая субъединица содержит три цепи (цепи A, B и C). Каждая цепь обладает глобулярной областью головки, которая соединена с коллаген-подобным хвостом. Связывание и активация C1q комплексами антиген-антитело происходит через область головки C1q. Множество не являющихся антителами активаторов C1q, включая белки, липиды и нуклеиновые кислоты, связывают и активируют C1q через отдаленную область на коллаген-подобной области стебля. Молекулярное распознавание активаторов комплемента посредством C1q индуцирует изменение конформации, которое стимулирует аутоактивацию профермента C1r, который, в свою очередь, катализирует протеолитическую активацию C1s. Затем Cs катализирует активацию компонентов комплемента C4 и C2, образующих комплекс C4bC2a, который функционирует в качестве конвертазы C3.
Второй ферментативно активируемый каскад, известный как лектиновый каскад, является сходным с первым, за исключением того, что вместо комплекса C1 находится MBL/MASP-2. Маннан-связывающий лектин (MBL) прямо распознает содержащие маннозу полисахариды на поверхностях бактерий и является структурно и функционально гомологичным компоненту C1q из C1. Связывание MBL с активатором индуцирует активацию ассоциированной с MBL протеазы 2 (MASP-2). MASP-2, в свою очередь, катализирует активацию C4 и C2 способом, гомологичным функции C1s, что приводит к образованию конвертазы C3.
Третий ферментативно активный каскад, известный как альтернативный каскад, представляет собой быстрый, независимый от антител путь активации и усиления системы комплемента. Альтернативный каскад включает несколько компонентов: C3, фактор B и фактор D (приведенные по порядку в каскаде). Активация альтернативного каскада происходит, когда C3b, протеолитически расщепленная форма C3, связывается с активирующим поверхностным агентом, таким как бактерия. Затем с C3b связывается фактор B, и он расщепляется фактором D с образованием C3-конвертазы C3bBb. Усиление активности конвертазы C3 происходит по мере образования и накопления дополнительного C3b. Кроме того, усиленному ответу способствует связывание положительного регуляторного белка пропердина (P), который стабилизирует конвертазу против деградации, продлевая ее время полужизни от 1-2 минут до 18 минут.
Таким образом, все три каскада приводят к образованию конвертаз C3, которые расщепляют фактор C3 на C3a и C3b. В это время обе конвертазы C3 (классическая/лектиновая и альтернативная) далее собираются в конвертазы C5 (C4b2a3b и C3b3bBb). Эти комплексы впоследствии расщепляют компонент комплемента C5 на два компонента: полипептид C5a (9 кДа) и полипептид C5b (170 кДа). Полипептид C5a связывается с 7-кратно трансмембранным сопряженным с G-белком рецептором, который исходно ассоциировали с лейкоцитами и о котором в настоящее время известно, что он экспрессируется в различных тканях, включая гепатоциты и нейроны. Молекула C5a представляет собой первичный хемотактический компонент системы комплемента человека и может запускать различные биологические ответы, включая хемотаксис лейкоцитов, сокращение гладких мышц, активацию внутриклеточных каскадов передачи сигнала, нейтрофил-эндотелиальную адгезию, высвобождение цитокинов и липидных медиаторов и образование окисляющих веществ.
Более крупный фрагмент C5b последовательно связывается с последующими компонентами каскада комплемента, C6, C7, C8 и C9, с образованием мембраноатакующего комплекса ("MAC") C5b-9. MAC C5b-9 может непосредственно лизировать эритроциты, и в больших количествах он является литическим для лейкоцитов и повреждает ткани, такие как мышечные, эпителиальные и эндотелиальные клетки. В сублитических количествах MAC может стимулировать активацию молекул адгезии, повышение внутриклеточного содержания кальция и высвобождение цитокинов. Кроме того, MAC C5b-9 может стимулировать клетки, такие как эндотелиальные клетки и тромбоциты, не вызывая лизис клеток. Нелитические эффекты C5a и MAC C5b-9 иногда являются высокосходными.
Несмотря на то, что система комплемента играет важную роль в поддержании состояния здоровья, она может вызывать или участвовать в заболевании. Например, система комплемента вовлечена в побочные эффекты, связанные с хирургической операцией по аортокоронарному шунтированию ("CABG"), множеством почечных, ревматологических, неврологических, дерматологических, гематологических, сосудистых/легочных, аллергических, инфекционных и связанных с биологической совместимостью/шоком заболеваний и/или состояний. Система комплемента необязательно является единственной причиной болезненного состояния, однако она может представлять собой один из нескольких факторов, которые участвуют в патогенезе.
Недавно данные подтвердили, что комплемент также вовлечен в заболевания глаз. Таким образом, может быть полезным наличие новых ингибиторов системы комплемента для применения в качестве лекарственных и диагностических средств для лечения связанных с комплементом глазных нарушений.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На Фиг.1 представлена иллюстрация классического и альтернативного каскадов системы комплемента.
На Фиг.2 представлена схема процесса отбора аптамеров in vitro (SELEXTM) из наборов олигонуклеотидов со случайной последовательностью.
На Фиг.3A представлена иллюстрация, на которой изображена нуклеотидная последовательность и вторичная структура аптамера против C5 (SEQ ID NO:1), в котором подчеркнутые остатки представляют собой либо остатки 2'-H-пиримидина, либо остатки 2'-фторпиримидина, заключенные в рамку остатки представляют собой либо остатки 2'-фторпиримидина, либо остатки 2'-OMe-пиримидина, и остатки, указанные стрелкой (→), представляют собой остатки, которые должны сдержать модификацию 2'-фтор.
На Фиг.3B представлена иллюстрация, на которой изображена нуклеотидная последовательность и вторичная структура аптамера против C5 ARC330 (SEQ ID NO:2), в котором обведенные кружком остатки представляют собой 2'-H-остатки, остатки пиримидина являются 2'-фтор-замещенными, и большинство остатков пурина являются 2'-OMe-замещенными, за исключением остатков 2'-OH-пурина, показанных контурным изображением.
На Фиг.3C представлена иллюстрация, на которой изображена нуклеотидная последовательность и вторичная структура аптамера против C5 ARC186 (SEQ ID NO:4), в котором все 21 остатка пиримидина обладают 2'-фтор-модификациями, и большинство пуринов (14 остатков) обладают 2'-OMe-модификациями, за исключением трех остатков 2'-OH-пуринов, показанных контурным изображением.
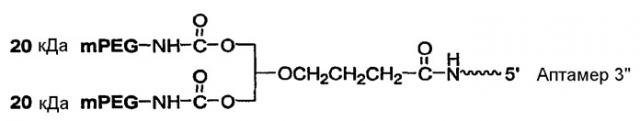
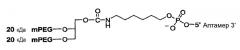
На Фиг.4 представлена иллюстрация разветвленного PEG массой 40 кДа (1,3-бис(mPEG-[20 кДа])-пропил-2-(4'-бутамид)).
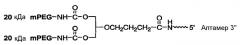
На Фиг.5 представлена иллюстрация разветвленного PEG массой 40 кДа (1,3-бис(mPEG-[20 кДа])-пропил-2-(4'-бутамид), присоединенного к 5'-концу аптамера.
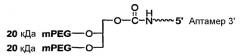
На Фиг.6 представлена иллюстрация, на которой изображены различные стратегии синтеза конъюгатов высокомолекулярный PEG-нуклеиновая кислота.
На Фиг.7A представлен график, на котором приведено сравнение зависимого от дозы ингибирования гемолиза посредством пегилированных аптамеров против C5 (ARC657 (SEQ ID NO:61), ARC658 (SEQ ID NO:62) и ARC187 (SEQ ID NO:5)), и непегилированного аптамера против C5 (ARC186 (SEQ ID NO:4)); на Фиг.7B представлена таблица значений IC50 для аптамеров, применяемых для анализа гемолиза, изображенного на Фиг.7A; На Фиг.7C представлен график для сравнения зависимого от дозы ингибирования гемолиза пегилированными аптамерами против С5 ARC187 (SEQ ID NO:5), ARC1537 (SEQ ID NO:65), ARC1730 (SEQ ID NO:66) и ARC1905 (SEQ ID NO:67); на Фиг.7D представлена таблица значений IC50 для аптамеров, применяемых для анализа гемолиза, представленного на Фиг.7C.
На Фиг.8 представлен график процентного ингибирования гемолиза аптамером против C5, ARC658 (SEQ ID NO:62), комплемента сыворотки яванских макак против комплемента сыворотки человека.
На Фиг.9 представлен график, на котором изображено связывание ARC186 (SEQ ID NO:4) с очищенным белком C5 как при 37°С, так и при комнатной температуре (23°С) после инкубации в течение 15 минут.
На Фиг.10 представлен другой график, на котором изображено связывание ARC186 (SEQ ID NO:4) с очищенным белком C5 как при 37°С, так и при комнатной температуре (23°С) после инкубации в течение 4 часов.
На Фиг.11 представлен график, на котором показан ход диссоциации комплекса C5-ARC186 при 23°С.
На Фиг.12 представлен график, на котором представлен ход уравновешивания образования комплекса C5-ARC186 комплекс при 23°С.
На Фиг.13 представлен график, на котором изображено связывание ARC186 (SEQ ID NO:4) с белком C5 относительно предшествующих и последующих белковых компонентов каскада комплемента.
На Фиг.14 представлен график, на котором изображено процентное количество меченного радиоактивно меткой ARC186 (SEQ ID NO:4), который связывает C5 в присутствии немеченого конкурента ARC186 (SEQ ID NO:4), ARC657 (SEQ ID NO:61), ARC658 (SEQ ID NO:62) или ARC187 (SEQ TD NO:5).
На Фиг.15 представлен график, на котором изображено количество белка комплемента C5b, образованного в образцах крови, инкубированных в течение 5 часов при 25°С и 37°С в присутствии варьирующих концентраций аптамера ARC186 (SEQ ID NO:4).
На Фиг.16 представлен график, на котором изображено процентное ингибирование комплемента посредством ARC187 (SEQ ID NO:5) в присутствии зимозана в неразбавленной сыворотке человека, цитратной крови человека или в сыворотке яванской макаки.
На Фиг.17 представлен график, на котором показано, что ARC658 (SEQ ID NO:62) полностью ингибирует активацию комплемента (C5a) в модели с петлей трубки, описанной в примере 1D.
На Фиг.18 представлен график, на котором изображены константы диссоциации пулов C5 для 10 раунда селекции. Константы диссоциации (Kd) оценивали подстановкой данных в уравнение: фракция связанной РНК = амплитуда*Kd/(Kd + [C5]). "ARC520" (SEQ ID NO:70) относится к интактному не подвергнутому селекции пулу dRmY и "+" указывает на наличие конкурента (0,1 мг/мл тРНК, 0,1 мг/мл ДНК спермы лосося).
На Фиг.19 представлен график, на котором изображены кривые констант диссоциации клонов C5. Константы диссоциации (Kd) оценивали подстановкой данных в уравнение: фракция связанной РНК = амплитуда*Kd/(Kd + [C5]).
На Фиг.20 представлен график, на котором изображена кривая IC50, которая иллюстрирует ингибиторный эффект гемолитической активности различных концентраций аптамера против C5 отдельно ARC913 (SEQ ID NO:75) по сравнению с ARC186 (SEQ ID NO:4).
На Фиг.21 представлена иллюстрация структуры ARC187 (SEQ ID NO:5).
На Фиг.22 представлена иллюстрация структуры ARC1905 (SEQ ID NO:67).
На Фиг.23 представлена таблица, в которой приведена схема эксперимента первого исследования с изолированным перфузируемым сердцем.
На Фиг.24 представлен график для сравнения кривой давления для внутрижелудочкого давления в левом желудочке (LV) изолированного сердца, подвергнутого воздействию плазмы человека (A), с кривой давления LVP изолированного сердца, подвергнутого воздействию контрольного раствора аптамера (B).
На Фиг.25 представлен график для сравнения кривых давления для внутрижелудочкого давления в левом желудочке (LV) изолированных сердец, подвергнутых воздействию молярно эквивалентного, 10X и 50X растворов аптамер/C5 (где в нормальной неразбавленной плазме допустима концентрация C5 приблизительно 500 нМ).
На Фиг.26 представлен график для сравнения изменений частоты сердечных сокращений в ударах в минуту (bpm) в изолированных мышиных сердцах после воздействия плазмы человека и различных растворов плазма/аптамер.
На Фиг.27 представлен график для сравнения изменений массы сердца изолированных мышиных сердец до и после воздействия плазмы человека, содержащей ARC186 (SEQ ID NO:4) с 0-1X молярной концентрацией (остановившиеся сердца), или с 10-50X молярной концентрацией (сердца, защищенные аптамером против C5).
На Фиг.28 представлен график для сравнения относительной продукции C5a в плазме человека, содержащей различные концентрации аптамера, после перфузии через изолированные мышиные сердца. Относительные концентрации C5a нанесены на график в качестве единиц поглощения (Abs), где более высокие данные отражают наличие более высоких уровней C5a.
На Фиг.29 представлен график для сравнения относительной продукции растворимого C5b-9 в плазме человека, содержащей различные концентрации аптамера, после перфузии изолированных мышиных сердец.
На Фиг.30 представлен график, на котором показан эффект ARC186 (SEQ ID NO:4) на расщепление C3 в вытекающей из мышиных сердец жидкости.
На Фиг.31 представлена таблица, на которой показаны результаты иммуногистохимического окрашивания в исследовании с изолированным перфузируемым сердцем мыши.
На Фиг.32 представлена таблица, на которой показана молярная концентрация ARC658 (SEQ ID NO:62), необходимая для защиты сердца от опосредуемого C5b повреждения в сыворотке человека или примата.
На Фиг.33 представлено изображение, на котором показан логарифмически-линейный график остающегося процентного количества полноразмерного ARC186 в зависимости от времени инкубации в плазме как у крыс, так и яванских макак.
На Фиг.34 представлена таблица, в которой показана схема эксперимента для фармакологического исследования, проведенного на крысах Sprague-Dawley, как описано в примере 5.
На Фиг.35 представлена таблица, в которой показана средняя концентрация ARC657 (SEQ ED NO:61), ARC658 (SEQ ED NO:62) или ARC187 (SEQ ID NO:5) в плазме в зависимости от периода времени у крыс Sprague-Dawley.
На Фиг.36 представлен график, на котором изображена средняя концентрация в плазме ARC657 (SEQ ID NO:61), ARC658 (SEQ ID NO:62) и ARC187 (SEQ ED NO:5) с течением времени после внутривенного введения аптамера у крыс.
На Фиг.37 представлена таблица, на которой показан некомпартментный анализ концентрации против временных данных, представленных на Фиг.35 и 36.
На Фиг.38A представлена таблица, на которой показана схема фармакокинетического исследования ARC187 (SEQ ED NO:5) и ARC1905 (SEQ ED NO:67) у мышей; на Фиг.38B представлен график, на котором изображен фармакокинетический профиль ARC187 (SEQ ID NO:5) и ARC1905 (SEQ ID NO:67) у мышей CD-1 после однократного внутривенного болюсного введения; на Фиг.38C представлена таблица, в которой показан некомпартментный анализ концентрации против временных данных, представленных на Фиг.38B.
На Фиг.39 представлена таблица, в которой показана детекция приведенных аптамеров в ткани сердца мыши после внутривенного введения.
На Фиг.40 представлена таблица, в которой показана экспериментальная схема исследования 1 на животных, описанного в примере 5E.
На Фиг.41 представлена таблица, в которой показана концентрация аптамера в плазме относительно времени после внутривенного болюсного введения аптамера яванским макакам.
На Фиг.42 представлена таблица, в которой перечислены фармакокинетические параметры ARC657 (SEQ ED NO:61), ARC658 (SEQ ID NO:62) и ARC187 (SEQ ED NO:5), вводимых внутривенно яванской макаке в исследовании 1.
На Фиг.43(a) и 43(c) представлены графики, на которых изображены концентрации sC5b-9 и C5a в плазме с течением времени после внутривенного введения аптамеров против C5 ARC657 (SEQ ID NO:61), ARC658 (SEQ ID NO:62) или ARC187 (SEQ ID NO:5) яванским макакам; На Фиг.43(b) и 43(d) представлены графики, на которых изображены концентрации sC5b-9 и C5a в плазме против концентрации аптамеров против C5, ARC657 (SEQ ID NO:61), ARC658 (SEQ ID NO:62) или ARC187 (SEQ ID NO:5).
На Фиг.44 представлена таблица, в которой показана экспериментальная схема исследования 2, описанного в примере 5F.
На Фиг.45 представлен график, в котором показана средняя концентрация аптамера в плазме в различные моменты времени после внутривенного введения ARC658 (SEQ ID NO:62) или ARC187 (SEQ ID NO:5) яванским макакам.
На Фиг.46 представлена таблица, в которой показан двухкомпартментный анализ концентрации относительно временных данных после внутривенного болюсного введения аптамера яванской макаке.
На Фиг.47 представлен график, на котором изображена концентрация C5b-9 относительно концентрации ARC187 (SEQ ID NO:5) или ARC658 (SEQ ID NO:62) в присутствии зимозана в плазме яванских макак.
На Фиг.48 представлен график, на котором изображена концентрация C5a относительно концентрации ARC187 (SEQ ID NO:5) или ARC658 (SEQ ID NO:62) в присутствии зимозана в плазме яванских макак.
На Фиг.49 представлена таблица, обобщающая исследование PK-PD ARC187 (SEQ ID NO:5) в процессе и после введения внутривенной болюсной инфузией яванским макакам.
На Фиг.50 представлена таблица, в которой обобщены фармакокинетические параметры для ARC187 (SEQ ID NO:5) у яванских макак после внутривенного болюсного введения.
На Фиг.51 представлен график, на котором изображены вычисленные и истинные фармакокинетические профили ARC187 (SEQ ID NO:5) в процессе и после введения яванским макакам посредством внутривенного болюса плюс инфузия.
На Фиг.52 представлен график, на котором показаны уровни активного ARC187 (SEQ ID NO:5) в плазме, остающиеся постоянными в процессе и после введения яванским макакам посредством внутривенного болюса плюс инфузия.
На Фиг.53 представлена таблица, в которой показано предсказанное необходимое дозирование аптамеров против C5 при хирургической операции CABG.
На Фиг.54 представлен график, на котором изображено, что ARC187 (SEQ ID NO:5) относительно не оказывает эффекта in vitro на коагуляцию, измеренную посредством протромбинового времени (PT) и активированного частичного тромбопластинового времени (APTT).
На Фиг.55 представлена таблица, в которой обобщены эффекты in vitro ARC187 (SEQ ID NO:5) на противосвертывающую активность гепарина и прокоагулянтную активность протамина.
На Фиг.56 представлен график, на котором показано, что ARC187 (SEQ ID NO:5) не влияет на реверсию антикоагуляции посредством гепарина in vivo.
На Фиг.57 представлен график, на котором показано, что как гепарин, так и протамин не оказывают эффекта на направленную против комплемента функцию ARC187 (SEQ ID NO:5), измеренную по ингибированию активации комплементом зимозана.
На Фиг.58 представлен график, на котором изображено процентное ингибирование гемолиза эритроцитов овцы в присутствии сыворотки человека в зависимости от концентрации аптамеров против C5 ARC1905 (SEQ ID NO:67) или ARC672 (SEQ ID NO:63).
На Фиг.59A представлен график, на котором изображено процентное ингибирование гемолиза в присутствии сыворотки человека, яванской макаки и крысы посредством ARC1905 (SEQ ID NO:67); На Фиг.59B представлена таблица, в которой обобщены средние значения IC50 для ингибирования активации комплемента в сыворотке человека, яванской макаки и крысы посредством ARC1905, аптамера против C5 или ARC127, постороннего аптамера, который не связывает C5 (отрицательный контроль).
На Фиг.60 представлен график, на котором изображено значение IC50 для ингибирования меченного радиоактивной меткой ARC186 (SEQ ID NO:4) (вертикальная ось) в зависимости от концентрации немеченого конкурента ARC1905 (SEQ ID NO:67) или ARC672 (SEQ ID NO:63) (горизонтальная ось), в конкурентном анализе связывания.
На Фиг.61 представлен график, на котором изображено значение IC50 для ингибирования меченного радиоактивной меткой ARC186 (SEQ ID NO:4) (вертикальная ось) в зависимости от концентрации немеченого конкурента ARC1905 (SEQ ID NO:67) (горизонтальная ось) при 37°C и 25°C в конкурентном анализе связывания.
На Фиг.62 представлен график, на котором изображены стандартные кривые для C5a (hC5a) человека и C5a яванской макаки (hC5a экв.).
На Фиг.63 представлена таблица, в которой обобщены значения IC50, IC90 и IC99 для ингибирования активации C5 в сыворотке человека и яванской макаки посредством ARC1905 (SEQ ID NO:67), при измерении в анализе индуцируемой зимозаном активации комплемента.
На Фиг.64 представлен график, на котором изображено процентное ингибирование образования C5a в зависимости от концентрации ARC1905 (SEQ ID NO:67) в сыворотках человека и яванской макаки, измеренное в анализе индуцируемой зимозаном активации комплемента.
На Фиг.65 представлен график, на котором изображен эффект ARC1905 (SEQ ID NO:67) на образование C3a в сыворотке человека или яванской макаки, при измерении в анализе индуцируемой зимозаном активации комплемента.
На Фиг.66 представлена таблица, в которой обобщены средние значения IC50, IC90 и IC99 для ингибирования посредством ARC1905 активации комплемента (SEQ ID NO:67) в сыворотке человека от 5 доноров, при измерении в модели активации комплемента с помощью петли трубки.
На Фиг.67 представлен график, на котором изображено процентное ингибирование образования C5a и C3a в зависимости от концентрации ARC1905, аптамера против C5, или ARC127, постороннего аптамера, который не связывает C5 (отрицательный контроль) в модели активации комплемента с помощью петли трубки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к материалам и способам для лечения, профилактики и/или стабилизации связанного с комплементом заболевания глаз (также называемого в настоящем документе глазными нарушениями).
В некоторых вариантах осуществления этого изобретения, аптамер против комплемента модулирует функцию компонента комплемента или его варианта. В особенно предпочтительных вариантах осуществления, аптамер против комплемента ингибирует или снижает функцию компонента комплемента или его варианта, предпочтительно in vivo, предпочтительно у позвоночного, предпочтительно млекопитающего, более предпочтительно in vivo у человека. В некоторых вариантах осуществления этого изобретения, например, где компонент комплемента-мишень представляет собой C2, C3, C4, C5 и/или фактор B, функция, модулируемая, предпочтительно ингибируемая, аптамером, представляет собой расщепление белка комплемента. В некоторых вариантах осуществления этого изобретения, например, где компонент комплемента-мишень представляет собой C2b, C5b, C6, C7, C8, C9, фактор B и/или пропердин, функция, модулируемая, предпочтительно ингибируемая аптамером, представляет собой сборку активного комплекса компонентов комплемента, такого как конвертазный или мембраноатакующий комплекс. В некоторых вариантах осуществления этого изобретения, например, где C3b, фактор D, C1 (включая C1r и/или C1s) и/или ассоциированную с маннозой сериновую протеазу ("MASP") представляет собой компонент комплемента-мишень, функция, модулируемая, предпочтительно ингибируемая аптамером, представляет собой ферментативную активность. В некоторых вариантах осуществления этого изобретения, например, где C3a, C5a, рецептор для C3a или рецептор для C5a представляет собой компонент комплемента-мишень, функция, модулируемая, предпочтительно ингибируемая, аптамером, представляет собой связывание лиганд/рецептор.
В одном варианте осуществления, предусмотрен способ стабилизации, лечения и/или профилактики опосредуемого C5, C5a и/или C5b-9 глазного нарушения, при этом способ включает стадию введения средства против C5 субъекту, нуждающемуся в этом, в количестве, достаточном для стабилизации, лечения и/или профилактики глазного нарушения. В некоторых вариантах осуществления, глазное нарушение, подлежащее стабилизации, лечению и/или профилактике, представляет глазное нарушение, связанное с неоваскуляризацией. В некоторых вариантах осуществления, глазное нарушение, подлежащее стабилизации, лечению и/или профилактике, представляет собой диабетическую ретинопатию или дегенерацию желтого пятна, в частности, связанную со старением дегенерацию желтого пятна ("AMD). В некоторых вариантах осуществления, AMD, подлежащая стабилизации, лечению и/или профилактике, представляет собой AMD экссудативного типа. В некоторых вариантах осуществления, AMD, подлежащая стабилизации, лечению и/или профилактике, является неэкссудативной.
В некоторых вариантах осуществления, предусмотрен способ стабилизации, лечения и/или профилактики опосредуемого комплементом глазного нарушения, при этом способ включает стадию введения терапевтически эффективного количества аптамера против комплемента субъекту, нуждающемуся в этом. В некоторых вариантах осуществления, терапевтически эффективное количество аптамера против комплемента представляет собой количество, достаточное для стабилизации, лечения и/или профилактики глазного нарушения. В некоторых вариантах осуществления этого изобретения, субъект является позвоночным, в некоторых вариантах осуществления млекопитающим и, в некоторых вариантах осуществления, человеком. В некоторых вариантах осуществления, опосредуемое комплементом глазное нарушение, подлежащее стабилизации, лечению и/или профилактике, представляет собой острое или хроническое воспалительное и/или опосредуемое иммунной системой глазное нарушение. В некоторых вариантах осуществления, опосредуемое комплементом глазное нарушение, подлежащее стабилиз