Способ получения наночастиц металлов
Иллюстрации
Показать всеИзобретение относится к области биохимии. Представлен способ получения наночастиц серебра, характеризующийся тем, что приготавливают экстракт из каллуса путем растирания каллусной массы в воде с дальнейшим центрифугированием, смешивают экстракт каллуса с нитратом серебра, инкубируют раствор на шейкере с последующим центрифугированием, промывают полученный продукт, культуру клеток растения перед получением экстракта каллуса предварительно трансформируют агробактериальным вектором Agrobacterium tumefaciens GV3101/pMP90RK/pPCV002/35S-LoSilA1-nos, содержащим ген силикатеина LoSilA1, который обеспечивает биосинтез мономорфных наночастиц серебра. Изобретение позволяет получать наночастицы серебра размером 20-80 нм. 6 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к бионанотехнологии и может быть использовано в медицинской и косметической промышленности, бытовой химии, производстве биосенсоров, а также в электронной промышленности.
Наночастицы металлов, таких как серебра и золота, нашли широкое применение в различных отраслях промышленности [Shankar S.S. et al. Biological Synthesis of Triangular Gold Nanoprisms. Nature Materials. 2004. 3: 482-488; Mohanpuria P. et al. Biosynthesis of nanoparticles: technological concepts and future applications. J Nanopart Res. 2008. 10: 507-517]. В частности, они используются в фильтрах для очистки воды, для получения препарата антивирусного действия, для лечения хронической лейкемии, в лечебных кремах, медицинских устройствах и имплантах, для пропитки биополимеров и тканевых материалов, в качестве покрытий поверхностей (технология Silver-NANO) холодильников, стиральных машинах и спортивного оборудования. Композитные наночастицы Ag-Au используются для конструирования энзимных электродов. Золотые и серебряные наночастицы нашли применение в романовской спектроскопии [Mohanpuria P. et al. Biosynthesis of nanoparticles: technological concepts and future applications. J Nanopart Res. 2008. 10: 507-517].
Получение наночастиц металлов является активно развивающейся отраслью нанотехнологий и направлено на получение частиц различных размеров, формы и химического состава. Возможно получение наночастиц методом эрозионно-взрывного диспергирования металлов, но он имеет определенные недостатки, такие как полиморфность получаемых частиц, дороговизна и вредное влияние на окружающую среду.
В последние годы предложены новые экологически чистые способы получения наночастиц металлов с применением экстрактов растений и культур клеток растений («Фитосинтез»). Наиболее часто используемое английское названием этого метода «Green Synthesis of Metal Nanoparticles».
Для фитосинтеза наночастиц металлов использовались такие растения, как Pelargonium graveolens, Cymbopogon flexuosus, Cinnamommum camphora, Azadirachta indica). Aloe vera, Tamarindus indica и Emblica officinalis [Kumar V., Yadav S.K. Plant-mediated synthesis of silver and gold nanoparticles and their applications. J Chem Technol Biotechnol. 2009. 84: 151-157]. Они с различной эффективностью восстанавливали Au(III) до наночастиц, содержащих Au(0) и Ag(I) до наночастиц, содержащих Ag(0). Для фитосинтеза сплава наночастиц Ag-Au-Cu использовались растения Medicago sativa и Brassica juncea. В результате экспериментов определенные размер и форма синтезируемых частиц достигалась редко. Частицы имели чаще триангулярную, гексагональную и декаэдрическую форму, иногда образовывали стержни или были полидисперсными. Размеры варьировались от единиц нанометров до сотен нанометров. Какой-либо закономерности в этом процессе пока выявить не удалось из-за непостоянства химического состава растений, связанного с почвенными, климатическими и сезонными условиями культивирования. Неясность механизмов восстановления металлов растительными экстрактами является основным препятствием для получения частиц определенного размера и формы [Mohanpuria P. et al. Biosynthesis of nanoparticles: technological concepts and future applications. J Nanopart Res. 2008. 10: 507-517]. Эффективность фитосинтеза определяется показателем оптической плотности (OD) взвеси наночастиц, которая изменяется от 0 (соли металлов не поглощают свет) до определенных единиц оптической плотности, обычно 0,5-0,7 OD (металлические наночастицы поглощают свет определенных длин волн).
Недавно, для получения воспроизводимых результатов, т.е. стандартизации условий проведения фитосинтеза, стали использовать экстракты клеточных культур растений [Nabikhan A. et al. Synthesis of antimicrobial silver nanoparticles by callus and leaf extracts from saltmarsh plant, Sesuvium portulacastrum L. Colloids Surf В Biointerfaces. 2010. 79(2): 488-93]. Клетки растений выращивают в контролируемых условиях состава среды, температуры, влажности, не зависят от климатических условий и имеют постоянный химический состав. Поэтому экстракты из каллусов растений при получении наночастиц металлов имеют существенные технологические преимущества перед экстрактами природных растений. Однако и этот способ, как и вышеизложенные, имеет те же недостатки, а именно, он не обеспечивает получение частиц определенного размера и формы.
Важным параметром использования наночастиц металлов в промышленных нанотехнологиях является их размер [Ai J. et al. Nanotoxicology and nanoparticle safety in biomedical designs. Inter. J Nanomedicine. 2011. 6: 1117-1127]. Крупные наночастицы, размером более 100 нм практически не используются, поскольку активно вымываются из всех видов поверхностей. Частицы размером до 20 нм нашли широкое техническое применение, однако с уменьшением размеров частиц повышается их токсичность для живых организмов. Чем мельче частицы, тем выше их противомикробная активность. Однако частицы серебра менее 15 нм способны вызывать окислительный взрыв, что приводит к деструктивным изменениям клеток [Carlson С. et al. Unique cellular interaction of silver nanoparticles: size-dependent generation of reactive oxygen species. J Phys Chem B. 2008. 112(43): 13608-19, Liu W. et al. Impact of silver nanoparticles on human cells: effect of particle size. Nanotoxicology. 2010. 4(3): 319-30]. Более мелкие частицы размером в единицы нанометров трудно выводятся из организма. В последнее время наночастицы серебра массово используются для доставки лекарств, а также в виде кремов и спреев для глаз, откуда они могут поступать в организм. Также, они могут поступать в организм через кожу и органы дыхания [Ai J. et al. Nanotoxicology and nanoparticle safety in biomedical designs. Inter. J Nanomedicine. 2011. 6: 1117-1127], поэтому биобезопасности нанообъектов в настоящее время уделяется повышенное внимание. Для эффективного промышленного использования без нанесения вреда человеку и окружающей биоте наиболее подходят наночастицы серебра размером 20-80 нм (в идеале 20-40 нм), как обеспечивающие «золотую середину» между активностью и безопасностью.
В настоящее время нет эффективного способа получения частиц металлов определенного размера, поэтому поиск нового способа является актуальной проблемой. Применение биотехнологического приема, заключающегося в культивировании трансформированных клеток с целью получения мономорфных наночастиц, позволяет решить эту проблему. Управление размерами наночастиц металлов в результате экспрессии рекомбинантного белка, описанный в данной заявке на примере наночастиц серебра, на сегодня является первым примером биоинженерии такого рода.
Известно, что белок силикатеин отвечает за способность губок использовать кремний, растворенный в морской воде, для формирование кремниевых спикул (игл) [Schröder, H. et al. Biofabrication of biosilica-glass by living organisms. Nat Prod Rep. 2008. 25: 455-74]. Силикатеины разных видов губок способны к поликонденсации TiO2 и ZrO2 [Tahir M.N. et al. Formation of layered titania and zirconia catalysed by surface-bound silicatein. Chem. Commun. 2005. P.5533-5535] и к восстановлению металлов из растворов с образованием наночастиц металлов [Пат. 102006001759, Германия, МПК C07H 21/00, C07K 14/435, C09C 1/62. Synthesis of metal nanoparticles and nanocrystals, useful particularly for silver disinfection of e.g. medical instruments, uses a silicatein protein, also new silicateins and nucleic acid encoding them / W.Tremel et al. - №0001759; заявлено 13.01.2006; опубл. 19.07.2007].
Известно, что рекомбинантные силикатеины, также как и природные силикатеины, способны к поликонденсации кремния [Tahir M.N. et al. Monitoring the formation of biosilica catalysed by histidine-tagged silicatein. Chem. Commun. 2004. P.2848-2849]. Потребность в рекомбинантном силикатеине электронной и лазерной промышленности высокая. В настоящее время рекомбинантный силикатеин экспрессируют только в прокариотных клетках (в бактериях) [Schröder H. et al. Biofabrication of biosilica-glass by living organisms. Nat Prod Rep. 2008. 25: 455-74]. Применение этой экспрессионной системы для промышленного получения рекомбинантного силикатеина возможно, но имеет существенные недостатки: перенесенный ген в бактериях нестабилен, что приводит к выбросу его из бактерий. Вторым ограничением является то, что эукариотические белки не собираются в третичную структуру в прокариотных (бактериальных) экспрессионных системах и не обеспечивают активности целевого белка.
В качестве прототипа выбран способ получения наночастиц серебра методом фитосинтеза с применением каллусной культуры клеток растения сезувиум портулаковидный Sesuvium portulacastrum L., [Nabikhan A. Et al. Synthesis of antimicrobial silver nanoparticles by callus and leaf extracts from saltmarsh plant, Sesuvium portulacastrum L. Colloids Surf В Biointerfaces. 2010. 79(2): 488-93]. По этому способу готовят экстракт из каллусов путем растирания 20 г свежей каллусной биомассы в 100 мл дистилированной воды при дальнейшем кипячении в течение 5 мин и центрифугировании при 3000 rpm. Затем 5 мл каллусного экстракта добавляют к 45 мл 1 мМ водного раствора нитрата серебра (AgNO3) и выдерживают смесь 24 часа в темноте при температуре 25°С. Затем смесь центрифугируют при 10000 rpm в течение 15 мин. Для очистки наночастиц осадок промывают трижды в дистиллированной воде, используя те же параметры центрифугирования. Количество наночастиц в суспензии определяют спектрофотометрическим методом по величине максимума поглощения наночастиц серебра. При синтезе наночастиц серебра с помощью экстракта каллусной культуры S. portulacastrum происходило образование наночастиц в количестве, эквивалентном оптической плотности OD=0,5-0,7 при максимуме поглощения 420 нм. Получены наночастицы серебра размером от 5 до 20 нм.
Недостатком этого способа является получение мелких наночастиц с размером от 5 до 20 нм, что представляет опасность при их использовании человеком. Частицы получены неоднородные, поскольку разница их размеров достигает четырехкратной величины. Эффективность фитосинтеза невысокая. На сегодняшний день управлять размером наночастиц при любом методе фитосинтеза, даже с использованием клеточных культур растений, как в описанном прототипе, пока не удается.
Задачей изобретения является создание нового способа получения наночастиц металлов определенного размера.
Технический результат, обеспечиваемый изобретением, заключается в получении наночастиц размером 20-50 нм и в увеличении производительности фитосинтеза в 2,6-4,4 раза.
Поставленная задача решена тем, что в известном способе получения наночастиц металлов с применением клеточной культуры сезувиума портулаковидного (S. portulacastrum), согласно изобретению клеточную культуру табака Nicotiana tabacum L. трансформируют агробактериальным вектором, содержащим ген силикатеина, который обеспечивает изменение размеров наночастиц металлов в процессе фитосинтеза, с последующим выделением наночастиц.
Наночастицы металлов выделяют из полученной трансгенной культуры клеток растения стандартным методом [Nabikhan A. et al. Synthesis of antimicrobial silver nanoparticles by callus and leaf extracts from saltmarsh plant, Sesuvium portulacastrum L. Colloids Surf В Biointerfaces. 2010. 79(2): 488-93].
Ген силикатеина LoSilA1 (GenBank Ace. No. ACG63793) получен заявителем ранее из морских губок [Kozhemyako V.B. et al. Silicatein genes in spicule-forming and non-spicule-forming Pacific Demosponges. Marine Biotechnology (NY). 2010. 12: 403-409]. Ген LoSilA1 впервые встроен заявителем под контроль растительного промотора и растительного терминатора транскрипции. Ген LoSilA1 кодирует полноразмерный белок LoSilA1 и используется для обеспечения изменения размеров наночастиц металлов в процессе фитосинтеза и увеличения эффективности фитосинтеза.
Заявителем впервые ген рекомбинантного силикатеина экспрессирован в эукариотических клетках. Синтез белка силикатеина обеспечивают путем встройки гена силикатеина в ДНК обычной нетрансгенной культуры каллусов табака. Для этого в ДНК каллусов табака переносят ген силикатеина путем агробактериальной трансформации.
Неожиданным эффектом введения гена силикатеина в каллусную культуру Nicotiana tabacum L. был эффект влияния на размеры частиц серебра в процессе фитосинтеза с использованием экстракта трансгенной культуры. Поэтому не являлось очевидным то, что генная трансформация клеточных культур растений рекомбинантным белком приведет к изменению размеров наночастиц серебра.
Культуру каллусов растения N. tabacum, экспрессирующих ген силикатеина, получают следующим образом. Кодирующую часть гена силикатеина LoSilA1 клонируют под контроль 35S промотора вируса мозаики цветной капусты и NOS терминатора по стандартной методике [Д.Дрейпер и др. Генная инженерия растений. М.: Мир. 1991. 458 с.]. Полученную конструкцию 35S-LoSilA1-nos переносят в растительный кассетный вектор pPCV002 [Spena A. et al. 1987. Independent and synergistic activity of rolA, B and C loci in stimulating abnormal growth in plants. EMBO J. 6: 3891-3899]. Кассетный вектор pPCN002/35S-LoSilA1-nos переносят в агробактериальный трансформирующий вектор Agrobacterium tumefaciens GV3101/pMP90RK [Spena A. et al. 1987. Independent and synergistic activity of rolA, B and C loci in stimulating abnormal growth in plants. EMBO J. 6: 3891-3899] по методике, опубликованной ранее [Bulgakov V.P. et al. Engineering high yields of secondary metabolites in Rubia cell cultures through transformation with rol genes. Methods Mol Biol. 2010. 643, 229-42]. Получают агробактериальный трансформирующий вектор Agrobacterium tumefaciens GV3101/pMP90RK/pPCV002/35S-LoSilA1-nos, содержащий ген силикатеина.
Каллусы табака Nicotiana tabacum трансформируют полученным агробактериальным вектором по известной методике [Bulgakov V.P. et al. Engineering high yields of secondary metabolites in Rubia cell cultures through transformation with rol genes. Methods Mol Biol. 2010. 643, 229-42] и получают трансгенную культуру каллусов табака Nt-S. Эту каллусную культуру табака используют для получения наночастиц серебра.
В другом варианте кодирующую часть гена силикатеина LoSilA1 сшивают с геном зеленого флуоресцирующего белка GFP кораллов. Далее поступают, как описано выше и получают агробактериальный трансформирующий вектор Agrobacterium tumefaciens GV3101/pMP90RK/pPCV002/35S-LoSilA1-GFP-nos. Каллусы табака Nicotiana tabacum трансформируют полученным агробактериальным вектором по известной методике [Bulgakov V.P. et al. Engineering high yields of secondary metabolites in Rubia cell cultures through transformation with rol genes. Methods Mol Biol. 2010. 643, 229-42] и получают трансгенную культуру каллусов табака Nt-SG. Эту каллусную культуру табака используют для доказательства биосинтеза белка силикатеина в трансгенных клетках табака.
В третьем варианте получают контрольную трансгенную культуру клеток табака, не содержащую ген силикатеина. По описанному в первом варианте методу получают агробактериальный трансформирующий вектор Agrobacterium tumefaciens GV3101/pMP90RK/pPCV002/35S-nos. Каллусы табака Nicotiana tabacum трансформируют полученным агробактериальным вектором и получают трансгенную культуру каллусов табака Nt. Эту каллусную культуру табака используют в качестве контроля, чтобы показать, что именно ген силикатеина, а не сам процесс агробактериальной трансформации приводит к желаемому эффекту.
Используемые агробактериальные векторы поддерживаются в коллекции микроорганизмов группы биоинженерии Биолого-почвенного института ДВО РАН.
Наличие встройки гена силикатеина LoSilA и LoSilA1-GFP в ДНК клеток табака и экспрессия гена проверяются стандартным методом, т.е. при помощи обратно-транскриптазной полимеразной цепной реакции [Bulgakov V.P. et al. Engineering high yields of secondary metabolites in Rubia cell cultures through transformation with rol genes. Methods Mol Biol. 2010. 643, 229-42].
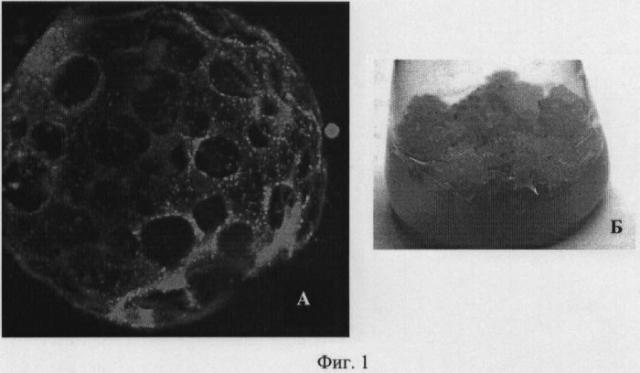
Доказательство наличия белка силикатеина в трансформированных клетках табака получают методом лазерной конфокальной микроскопии (фиг.1). Для этого трансгенную культуру каллусов табака Nt-SG выращивают на питательной среде WB/A в темноте при относительной влажности воздуха 50-70% и температуре 23-26°С в течение 14-90 суток. Затем клетки исследуют методом лазерной конфокальной микроскопии и наблюдают наличие и локализацию зеленых зон свечения GFP стандартным методом [Berg RH, Beachy RN. Fluorescent protein applications in plants. Methods Cell Biol. 2008; 85: 153-177], которые свидетельствуют о наличии белка силикатеина (фиг.1).
После получения трансгенных культур Nt-S и Nt их выращивают на питательной среде WB/A в темноте при относительной влажности воздуха 50-70% и температуре 23-26°С в течение 14-90 суток. После указанного периода каллусы извлекают из культуральных сосудов для получения водного экстракта. Экстракт из Nt-S готовят путем растирания выращенных каллусов с дистиллированной водой в соотношении 1:1-1:100 (вес/объем). Экстракт центрифугируют для очистки от клеточного дебриса при 1000-50000 g в течение 1-60 минут при температуре 0-25°С и получают очищенный экстракт. Полученный экстракт является компонентом реакционной смеси для получения наночастиц. Точно так же готовят экстракт из культуры Nt.
Целевой продукт, т.е. наночастицы металлов, получают следующим способом. Полученный очищенный экстракт из Nt-S фильтруют, после чего переносят в сосуд, содержащий 0,1-10 мМ водный раствор соли металла в соотношении 1:1-1:100 (объем/объем). Готовый раствор инкубируют при 50-500 об/мин в течение 5-48 часов при температуре 10-30°С. Взвесь полученных наночастиц центрифугируют при 1000-50000 g в течение 1-60 минут при температуре 10-30°С. Для отмывки наночастиц от растительных остатков осадок растворяют в 0.1-100 мл дистиллированной воды и центрифугируют при 1000-50000 g в течение 1-60 минут при 10-30°С.
Для доказательства, что синтез мономорфных наночастиц металлов (серебра) в Nt-S культуре является действием гена силикатеина LoSilA, так же поступают с экстрактом из культуры Nt.
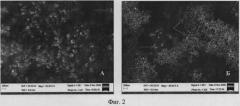
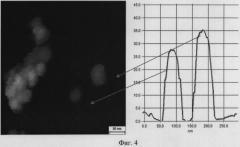
Экстракт культуры Nt в процессе фитосинтеза позволяет получить лишь гетерогенные частицы серебра, с преобладанием частиц большого размера (фиг.2, табл.1). Исходная нетрангсгенная культура табака показывает такие же результаты. В тоже время, как экстракт из Nt-S, содержащий ген силикатеина, в процессе фитосинтеза обеспечивает образование мономорфных частиц с преобладающим размером 20-50 нм. Частицы состоят из металлического серебра (фиг.3). Точные размеры наночастиц серебра определяют с помощью атомной силовой микроскопии (фиг.4). Эффективность фотосинтеза определяют спектрофотометрически при длине волны 440 нм (фиг.5). Для этого используют стандартные условия фитосинтеза, по ранее описанной методике [Nabikhan et al. Synthesis of antimicrobial silver nanoparticles by callus and leaf extracts from saltmarsh plant, Sesuvium portulacastrum L. Colloids Surf В Biointerfaces. 2010. 79(2): 488-93]. Оптическая плотность (OD) раствора наночастиц в прототипе составляла 0,5-0,7, в процессе фитосинтеза при использовании экстракта культуры Nt составила 0,5-0,7, а в процессе фитосинтеза при использовании экстракта культуры Nt-S повысилась до 1,8-2,2, т.е. увеличение эффективности образования наночастиц произошло в 2,6-4,4 раза.
Таким образом, перенос гена силикатеина LoSilA в культуру клеток табака и его экспрессия вызвали образование мономорфных частиц и увеличение эффективности фитосинтеза.
На фиг.1 представлена экспрессионная система силикатеина в эукариотических клетках.
А - трехмерное изображение клетки табака Nt-SG, построенное при помощи программы Z-stack, конфокальная микроскопия. Рекомбинантный силикатеин слит с зеленым флуоресцирующим белком GFP. Конгломераты силикатеина видны как зеленые точки;
Б - культура клеток табака Nt-S, содержащая ген силикатеина.
На фиг.2 представлено исследование процесса формирования наночастиц серебра методом фитосинтеза, сканирующая электронная микроскопия, линейка 200 нм.
А - экстракт контрольной культуры клеток табака Nt;
Б - экстракт трансгенной культуры клеток табака Nt-S, продуцирующей рекомбинантный силикатеин. Формирование наночастиц серебра в присутствии силикатеина приводит к уменьшению размеров частиц. Стрелками показаны крупные и мелкие частицы.
На фиг.3 представлен энергодисперсионный анализ наночастиц серебра в трансгенной культуре клеток табака Nt-S. Наночастицы состоят из металлического серебра. Следовые количества кислорода и кремния определены из состава материала подложки.
На фиг.4 представлен пример точного определения размеров наночастиц серебра в трансгенной культуре клеток табака Nt-S с помощью атомной силовой микроскопии. Размеры наночастиц серебра 27,5 и 35 нм.
На фиг.5 представлен спектр поглощения суспензии наночастиц, полученных при помощи экстрактов: А - обычной каллусной культуры табака Nt; Б - культуры табака с геном силикатеина Nt-S.
На фиг.6 представлен внешний вид водных суспензий наночастиц серебра, полученных описанным методом с помощью экстракта обычной каллусной культуры табака Nt и культуры табака с геном силикатеина Nt-S.
Способ иллюстрируется следующим примером.
Пример 1. В примере описывается способ получения наночастиц серебра на основе экстракта клеток табака Nicotiana tabacum L. сорт Xanthi, в которых экспрессирован ген силикатеина.
Каллусы табака массой 1 г помещают в 250 мл колбы с 60 мл жидкой питательной среды WB/A [Bulgakov et al. CDPK-driven changes in the intracellular ROS level and plant secondary metabolism. Bioengineered Bugs. 2011. 2(6): 1-4]. Суспензию каллусов культивируют в темноте при температуре 25°С, относительной влажности воздуха 70% и перемешивании 100 об/мин. Через 7 суток (экспоненциальная стадия роста клеток) в колбы добавляют по 100 мкл агробактерий Agrobacterium tumefaciens (штамм GV3101/pMP90RK/pPCV002-LoSilA) в суспензионной среде LB (NaCI - 10 г/л, пептон - 10 г/л, дрожжевой экстракт - 5 г/л, рН 7,5), оптическая плотность бактерий OD600=0,5. Клетки Nicotiana tabacum L. инкубируют с агробактериями 2 суток, затем добавляют антибиотик цефотаксим в концентрации 250 мг/л для удаления агробактерий. Спустя 2 недели после добавления цефотаксима суспензию растительных клеток высаживают на твердую питательную среду WB/A, содержащую антибиотики: цефотаксим 250 мг/л и канамицин 30 мг/л, для отбора трансгенных клеток. Через месяц активно растущие агрегаты пересаживают на свежие питательные среды с содержанием канамицина 50 мг/л и цефотоксима 250 мг/л. Таким путем отбор трансгенных клеток осуществляют с помощью селекции в присутствии канамицина в концентрации 50 мг/л в течение 4 месяцев. Далее отбирают активно растущие канамицин-устойчивые агрегаты, из которых получают пассируемые линии, которые далее культивируют на агаризованной среде без антибиотиков с 30 дневным интервалом. Получают 10-20 г сырых каллусов с одной колбы. По истечении периода культивирования каллусы извлекают из культуральных сосудов, взвешивают и используют для получения наночастиц металлов.
Наночастицы серебра получают при помощи водного экстракта трансгенных клеток Nicotiana tabacum L., путем смешивания с раствором нитрата серебра. Для этого образец сырых каллусов (2 г) растирают с дистиллированной водой в соотношении 1:5 (вес/объем). Экстракт центрифугируют для отделения клеточного дебриса при 20000 g в течение 20 минут при температуре 4°С. Жидкую фракцию экстракта фильтруют через мембранный фильтр (Millipore, 0,45 мкм). Отфильтрованный экстракт (10 мл) смешивают с 1 мМ водным раствором нитрата серебра (AgNO3, марка х.ч.) в соотношении 1:10 (объем/объем). Для синтеза наночастиц полученный раствор инкубируют на шейкере при 150 об/мин при температуре 22°С, в течение 24 часов с последующим центрифугированием при 20000 g, в течение 20 минут, при температуре 22°С. Для удаления возможных остатков непрореагировавшего нитрата серебра осадок наночастиц диспергируют в 1 мл дистиллированной воды и центрифугируют при 20000 g, в течение 20 минут, при температуре 22°С. Процедуру промывки повторяют. Полученный очищенный осадок наночастиц диспергируют в 2 мл дистиллированной воды и получают коллоидную суспензию, содержащую наночастицы серебра. Полученные суспензии наночастиц имеют характерную для наночастиц серебра желтую или желто-оранжевую окраску (фиг.6).
Содержание наночастиц серебра определяют спектрофотометрически с помощью прибора BioSpec-nano (Shimadzu) сканированием 1 мкл раствора наночастиц при длинах волн от 200 до 800 нм. Величина максимума при длине волны 440 нм является характеристикой содержания наночастиц серебра в растворе. Целевой продукт в виде коллоидной суспензии наночастиц серебра имеет концентрацию 100 мг/л и оптическую плотность OD440=2,0. В случае, если используется экстракт обычных каллусов табака Nt, OD440=0,6 (фиг.6). Таким образом, выход наночастиц серебра составляет 5 мг на 1 г использованной сырой биомассы клеток для культуры Nt-S и 1,5 мг на 1 г использованной сырой биомассы клеток для культуры Nt, т.е. эффективность фитосинтеза выросла в 3,3 раза.
| Таблица 1 | ||
| Размеры наночастиц серебра по данным сканирующей электронной микроскопии | ||
| Размеры частиц серебра, нм | Содержание наночастиц в суспензии, % | |
| Экстракт культуры калусов табака Nt | Экстракт культуры калусов табака Nt-S | |
| менее 20 | 0-1 | 0-1 |
| 20-40 | 10-14 | 75-85 |
| 40-80 | 20-28 | 16-20 |
| более 80 нм | 57-66 | 1-2 |
Способ получения наночастиц серебра, характеризующийся тем, что приготавливают экстракт из каллуса путем растирания каллусной массы в воде с дальнейшим центрифугированием, смешивают экстракт каллуса с нитратом серебра, инкубируют раствор на шейкере с последующим центрифугированием, промывают полученный продукт, отличающийся тем, что культуру клеток растения перед получением экстракта каллуса предварительно трансформируют агробактериальным вектором Agrobacterium tumefaciens GV3101/pMP90RK/pPCV002/35S-LoSilA1-nos, содержащим ген силикатеина LoSilA1, который обеспечивает биосинтез мономорфных наночастиц серебра.