Способ деацетилирования -аминоацеталей
Иллюстрации
Показать всеИзобретение относится к способу получения N-защищенных α-аминоальдегидов в рацемической или оптически активной форме, включающему следующие стадии: (а) защиту аминной функциональной группы соответствующих α-аминоацеталей введением арилалкилоксикарбонильной группы общей формулы (I), в которой R представляет собой водород, фенильную группу или линейную или разветвленную C1-С6 алкильную группу, Ar представляет собой фенильную группу, нафтильную группу или антрильную группу, необязательно замещенную одним или несколькими атомами галогена, одной или несколькими фенильными группами, линейными или разветвленными C1-С6 алкильными группами линейными или разветвленными C1-С6 алкоксигруппами, нитро, циано или метилсульфинильными группами; (b) деацетилирование ацетальной функциональной группы указанных N-защищенных α-аминоацеталей с помощью муравьиной кислоты. Также изобретение относится к соединению формулы (II), (R)-(II) или (S)-(II), где- R1 и R2, одинаковые или разные, представляют собой линейную или разветвленную C1-C12 алкильную группу; -R3 представляет собой циклоалкилалкильную группу, в которой циклоалкильная группа представляет собой С3-С10 циклоалкильную группу, а линейная или разветвленная алкильная группа представляет собой C1-C12 алкильную группу; Р представляет собой бензилоксикарбонильную группу и символ (*) означает, что атом углерода представляет собой асимметрический атом. Технический результат - получение N-защищенных α-аминоальдегидов с сохранением защиты аминной функциональной группы, подходящий для промышленных масштабов. 2 н. и 6 з.п. ф-лы, 1 табл., 11 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к способу получения N-защищенных α-аминоальдегидов деацетилированием ацетальной функциональной группы соответствующих N-защищенных α-аминоацеталей.
Уровень техники
Конкретно изобретение относится к способу деацетилирования ацетальной функциональной группы оптически активных α-аминоацеталей без существенной потери энантиомерного избытка с целью получения соответствующих оптически активных α-аминоальдегидов, при сохранении оптической стабильности.
α-Аминоацетали и конкретно оптически активные α-аминоацетали представляют собой соединения, которые чрезвычайно выгодны в качестве непосредственных предшественников оптически активных α-аминоальдегидов, получаемых деацетилированием ацетальной функциональной группы оптически активных α-аминоальдегидов.
Оптически активные α-аминоальдегиды представляют собой соединения, которые обычно используются в качестве хиральных реагентов в полных синтезах биологически активных продуктов. Однако указанное семейство продуктов не является легко доступным с коммерческой точки зрения.
Это, с одной стороны, обусловлено тем, что α-аминоальдегиды являются соединениями с ограниченной оптической и химической стабильностью, и это затрудняет их синтез. Стабильность этих продуктов определенно зависит от природы реакционной среды и от температуры хранения, но конкретно от природы защитной группы для аминной функциональной группы. Рассматриваемые соединения доступны для использования только в N-защищенной форме с целью увеличения их стабильности в ходе синтеза и реакций, в которых они участвуют. При этом существенным является выбор природы защитной группы.
С другой стороны, в наиболее часто описываемых синтетических способах получения α-аминоальдегидов используют α-аминокислоты в качестве исходных реактантов (промежуточное образование амида Вайнреба, селективное частичное восстановление функциональной группы карбоновой кислоты или соответствующих сложных эфиров или полное восстановление в β-аминоспирты и частичное реокисление). Указанные способы получения имеют различные недостатки, такие, как условия реакции, которые ограничивают промышленное применение, дорогие реактанты и т.п. Основное ограничение упомянутых синтезов состоит в ограниченной доступности исходных реактантов, а именно природных α-аминокислот.
Использование N-защищенных α-аминоацеталей в виде рацемической или оптически активной формы в качестве предшественников N-защищенных α-аминоальдегидов позволило бы преодолеть большое число вышеупомянутых проблем.
Стадия деацетилирования ацетальной функциональной группы в N-Boc-α-аминоацеталях действием 3 молярных эквивалентов триметилсилилйодида описана в (S.Е.Denmark et al., Synlett, 1993, 5, 359-361). Однако для большинства испытываемых продуктов наблюдалась потеря оптической активности.
Подобным образом (K.R.Muralidharan et al., Tetrahedron Lett., 1994, 35, 7489-7492) была деацетилирована ацетальная функциональная группа хиральных N-бензилоксикарбонил-α-аминоацеталей в водном ДМСО с целью доступа к оптически активным N-бензилоксикарбонил-α-аминоальдегидам. Деацетилирование происходит без рацемизации, но в ограниченных рабочих условиях (кипячение в водном ДМСО, очистка на флэш-колонке).
Рабочие условия, описанные ранее в известном уровне техники для доступа к оптически активным α-аминоальдегидам путем деацетилирования ацетальной функциональной группы оптически активных α-аминоацеталей, следовательно, не являются удовлетворительными для получения указанных продуктов в промышленных масштабах.
Техническая задача, которая должна быть решена, таким образом, состоит в создании способа получения N-защищенных α-аминоальдегидов, в рацемической форме или в оптически активной форме из соответствующих α-аминоацеталей с сохранением защиты аминной функциональной группы и в соответствующих случаях с сохранением оптической активности в случае оптически активных α-аминоацеталей, который может использоваться в промышленности.
Раскрытие изобретения
К настоящему времени показано, что путем комбинирования специфической защитной группы для аминной функциональной группы и выбора соответствующего деацетилирующего агента можно осуществить деацетилирование ацетальной функциональной группы в мягких условиях, с одной стороны, и без значительной потери энантиомерного избытка, а с другой стороны, без снятия защиты с функциональной аминной функциональной группы, что позволяет получать стабильные соединения.
Более того, было показано, что применение других защитных групп для защиты аминной функциональной группы, таких, например, как бензильная или трет-бутоксикарбонильная (t-Вос) группы, не позволяет получить вышеупомянутый результат.
Таким образом, объектом изобретения согласно первому аспекту является способ получения N-защищенных α-аминоальдегидов в рацемической или оптически активной форме, включающий стадии, состоящие в:
- защите аминной функциональной группы соответствующих α-аминоацеталей арилалкоксикарбонильной группой общей формулы (I):
в которой:
- R представляет собой водород, фенильную группу или линейную или разветвленную C1-C6 алкильную группу,
- Ar представляет собой фенильную группу, нафтильную группу или антрильную группу, необязательно замещенную одним или несколькими атомами галогена, одной или несколькими фенильными группами, линейными или разветвленными C1-C6 алкильными группами, линейными или разветвленными C1-C6 алкоксигруппами, нитро, циано или метилсульфинильными группами; и
- деацетилировании ацетальной функциональной группы указанных N-защищенных α-аминоацеталей с помощью муравьиной кислоты.
Предпочтительно Ar представляет собой фенильную группу, а R представляет собой водород.
Подразумевается, что термин «линейный или разветвленный алкил» обозначает, например, метальную, этильную, пропильную, изопропильную, н-бутильную, трет-бутильную, изобутильную, пентильную или гексильную группу.
Подразумевается, что термин «линейный или разветвленный алкокси» обозначает, например, метокси, этокси, пропокси, изопропокси, н-бутокси, трет-бутокси, изобутокси, пентокси или гексокси группу.
Подразумевается, что термин «галоген» обозначает атомы фтора, хлора, брома или йода.
В качестве примеров арилалкилоксикарбонильной группы общей формулы (I) можно упомянуть бензилоксикарбонильную, 4-фенилбензилоксикарбонильную, 2-метилбензилоксикарбонильную, 4-метоксибензилоксикарбонильную, 4-этоксибензилоксикарбонильную, 4-фторбензилоксикарбонильную, 4-хлорбензилоксикарбонильную, 3-хлорбензилоксикарбонильную, 2-хлорбензилоксикарбонильную, 2,4-дихлорбензилоксикарбонильную, 4-бромбензилоксикарбонильную, 3-бромбензилоксикарбонильную, 4-нитробензилоксикарбонильную, 4-цианобензилоксикарбонильную, 4-метилсульфинилбензилоксикарбонильную, 9-антрилметилоксикарбонильную или дифенилметилооксикарбонильную.
Согласно предпочтительному аспекту, арилалкилоксикарбонильная группа общей формулы (I) представляет собой бензилоксикарбонильную группу (Cbz).
Согласно первой альтернативе способа по изобретению, осуществляют применение N-замещенных α-аминоацеталей в рацемической форме формулы (II):
где:
R1 и R2, одинаковые или разные, представляют собой линейную или разветвленную C1-C12 алкильную группу или же R1 и R2 связаны, образуя 1,3-диоксолан-2-ильную группу, которая не замещена или замещена в положениях 4 и/или 5 одним или несколькими линейными или разветвленными C1-C6 алкильными заместителями, или 1,3-диоксан-2-ильную группу, которая не замещена или замещена в положениях 4 и/или 5 и/или 6 одним или несколькими линейными или разветвленными C1-C6 алкильными заместителями;
R3 представляет собой водород; линейную или разветвленную C1-C12 алкильную группу, C2-C12 алкенильную группу; C2-C12 алкинильную группу; C3-C10 циклоалкильную группу; C3-C10 циклоалкенильную группу; циклоалкилалкильную группу, в которой циклоалкильная и алкильная группы такие, как определено выше; гетероциклоалкильную группу, содержащую 3-10 атомов, гетероциклоалкилалкильную группу, в которой гетероциклоалкильная и алкильная группы такие, как определено выше; моноциклическую, бициклическую или трициклическую C6-C14 арильную группу; гетероарильную группу, содержащую 5-14 атомов; арилалкильную группу или гетероарилалкильную группу, в которой арильная, гетероарильная и алкильная группы такие, как определено выше; группу C(=O)R4, в которой R4 представляет собой линейную или разветвленную С1-С12 алкильную группу, циклоалкильную группу, циклоалкенильную группу, гетероциклоалкильную группу, арильную группу или гетероарильную группу, как определено выше, или R4 представляет собой группу OR5, в которой R5 представляет собой водород, C1-С12 алкильную группу, C3-C10 циклоалкильную группу, C3-C10 циклоалкенильную группу, гетероциклоалкильную группу, арильную группу или гетероарильную группу, как определено выше, или R4 представляет собой группу NHR6, в которой R6 представляет собой водород, линейную или разветвленную C1-C12 алкильную группу, C3-C10 циклоалкильную группу, C3-C10 циклоалкенильную группу, гетероциклоалкильную группу, арильную группу или гетероарильную группу, как определено выше; причем все указанные выше алкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, циклоалкилалкильные, гетероциклоалкильные, гетероциклоалкилалкильные, арильные, гетероарильные, арилалкильные или гетероарилалюильные радикалы являются незамещенными или замещенными;
- Р представляет собой группу формулы (I), как определено выше, а
ацетальную функциональную группу деацетилируют с помощью муравьиной кислоты для получения N-защищенных α-аминоальдегидов в рацемической форме формулы (III):
где R3 и Р такие, как определено выше.
Предпочтительно будут осуществлять применение соединений формулы (II),
в которых:
- R1 и R2, одинаковые или разные, представляют собой линейную или разветвленную C1-C6 алкильную группу, конкретно метил или этил;
- R3 представляет собой линейную или разветвленную C1-C6 алкильную группу, которая является замещенной или незамещенной; моноциклическую, бициклическую или трициклическую С6-С14 арильную группу, предпочтительно фенильную группу, которая является замещенной или незамещенной; арилалкильную группу, в которой арильная и алкильная группы такие, как определено выше, предпочтительно бензильную группу, которая является замещенной или незамещенной; C3-C10 циклоалкильную группу, предпочтительно циклогексильную группу, которая является замещенной или незамещенной; циклоалкилалкильную группу, в которой циклоалкильная группа и алкильная группа такие, как определено выше, предпочтительно циклобутилметильную группу;
- Р представляет собой Cbz.
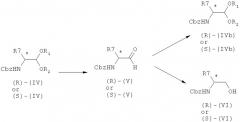
Альтернативно способ по изобретению может быть использован для получения оптически активных N-защищенных α-аминоальдегидов формул (R)-(III) и (S)-(III) с хорошим выходом и хорошей оптической чистотой из соответствующих оптически активных N-защищенных α-аминоацеталей формул (R)-(II) и (S)-(II).
В соответствии с указанной альтернативой осуществляют применение N-защищенных α-аминоацеталей в оптически активной форме формул (R)-(II) или (S)-(II):
(R)-(II) или (S)-(II) где:
символ (*) означает, что атом углерода представляет собой асимметрический атом,
- R1, R2 и Р такие, как определено выше, для формулы (II),
- R3 представляет собой те же группы, которые указаны выше, за исключением Н,
а ацетальную функциональную группу деацетилируют с помощью муравьиной кислоты для получения N-защищенных α-аминоальдегидов в оптически активной форме формулы (R)-(III) или (S)-(III):
(R)-(III) или (S)-(III):
где:
символ (*) означает, что атом углерода представляет собой асимметрический атом,
- R3 и Р такие, как определено выше.
Предпочтительно будут осуществлять применение соединений формулы (R)-(II) или (S)-(II),
в которых:
- R1 и R2, одинаковые или разные, представляют собой линейную или разветвленную C1-C6 алкильную группу, конкретно метил или этил;
R3 представляет собой линейную или разветвленную C1-C6 алкильную группу, которая является замещенной или незамещенной; моноциклическую, бициклическую или трициклическую С6-С14 арильную группу, предпочтительно фенильную группу, которая является замещенной или незамещенной; арилалкильную группу, в которой арильная и алкильная группы такие, как определено выше, предпочтительно бензильную группу, которая является замещенной или незамещенной; C3-C10 циклоалкильную группу, предпочтительно циклогексильную группу, которая является замещенной или незамещенной; циклоалкилалкильную группу, в которой циклоалкильная группа и алкильная группа такие, как определено выше, предпочтительно циклобутилметильную группу;
- Р представляет собой Cbz.
В соответствии с еще одной альтернативой, способ по изобретению может быть использован для получения оптически активных N-защищенных α-аминоальдегидов формул (R)-(V) и (S)-(V) с хорошим выходом и хорошей оптической чистотой из соответствующих оптически активных N-защищенных α-аминоацеталей формул (R)-(IV) и (S)-(IV), оптическая активность которых сохраняется.
В соответствии с указанной альтернативой осуществляют применение N-защищенных α-аминоацеталей в оптически активной форме формул (R)-(IV) или (S)-(IV):
(R)-(IV) или (S)-(IV)
где:
- символ (*) означает, что атом углерода представляет собой асимметрический атом,
- R1, R2 и Р такие, как определено выше для формулы (II),
- R7 представляет собой линейную или разветвленную C1-С12 алкильную группу; C2-C12 алкенильную группу; C2-C12 алкинильную группу; C3-C10 циклоалкильную группу; C3-C10 циклоалкенильную группу; циклоалкилалкильную группу, в которой циклоалкильная и алкильная группы такие, как определено выше; гетероциклоалкильную группу, содержащую 3-10 атомов; гетероциклоалкилалкильную группу, в которой гетероциклоалкильная и алкильная группы такие, как определено выше; арилалкильную группу, в которой моноциклическая, бициклическая или трициклическая арильная группа представляет собой С6-С14 арильную группу, а алкильная группа такая, как определено выше; гетероарилалкильную группу в которой гетероарильная группа содержит 5-14 атомов, а алкильная группа такая, как определено выше; причем все указанные выше алкильные, алкенильные, алкинильные, циклоалкильные, циклоалкенильные, циклоалкилалкильные, гетероциклоалкильные, гетероциклоалкилалкильные, арилалкильные или гетероарилалкильные радикалы являются незамещенными или замещенными;
а ацетальную функциональную группу деацетилируют с помощью муравьиной кислоты для получения N-защищенных α-аминоальдегидов в оптически активной форме формул (R)-(V) или (S)-(V):
R-(V) или S-(V)
где:
- символ (*) означает, что атом углерода представляет собой асимметрический атом,
- R7 и Р такие, как определено выше.
Предпочтительно будут осуществлять применение соединений формул (R)-(IV) или (S)-(IV),
в которых:
- R1 и R2, одинаковые или разные, представляют собой линейную или разветвленную C1-C6 алкильную группу, конкретно метальную или этильную группу;
- R3 представляет собой линейную или разветвленную C1-C6 алкильную группу, которая является замещенной или незамещенной; арилалкильную группу, в которой арильная и алкильная группы такие, как определено выше, предпочтительно бензильную группу, которая является замещенной или незамещенной; C3-C10 циклоалкильную группу, предпочтительно циклогексильную группу, которая является замещенной или незамещенной; циклоалкилалкильную группу, в которой циклоалкильная группа и алкильная группа такие, как определено выше, предпочтительно циклобутилметильную группу;
Р представляет собой Cbz.
В настоящем изобретении выражение «сохраненная оптическая стабильность» означает - без значительной потери энантиомерного избытка, конкретно потери приблизительно до 5%, и более конкретно без какой-либо потери энантиомерного избытка (в пределах ошибки измерений) на атоме углерода, отмеченном символом (*).
Возможные заместители групп R3, R4, R5, R6 и R7 могут быть выбраны независимо из галогена, ОН, NO2, NH2, SH, CO2H, CN, SO3H, CF3, алкоксикарбонильной (или алкил-O-СО-), амидной, алкил-N-CO-, алкилендиокси (или -О-алкилен-O-), алкилсульфинильной (или алкил-SO-), алкилсульфонильной (или алкил-SO2-), алкилсульфонилкарбамоильной (или алкил-SO2-NH-С(=O)-), алкилтио (или алкил-S-), -O-циклоалкильной, ацильной (или r-CO-), ацилокси, ациламино, алкиламино, диалкиламино, ариламино, диариламино, арилалкиламино, оксо (необязательно защищенной в виде циклического или нециклического кеталя), формильной (необязательно защищенной в виде циклического или нециклического ацеталя), арилокси, арилтио, гетероарилтио, алкильной, циклоалкильной, циклоалкенильной, арильной, арилалкильной, гетероарильной, алкенильной, алкинильной и алкоксигрупп.
Указанные группы в продуктах формулы (II), (III), (IV) или (V), а также в составе заместителей имеют следующие значения:
- галоген обозначает атомы фтора, хлора, брома или йода; алкильная группа обозначает линейную или разветвленную C1-C12 группу, такую как метильная, этильная, пропильная, изопропильная, бутильная, изобутильная, втор-бутильная, трет-бутильная, пентильная, изопентильная, втор-пентильная, трет-пентильная, неопентильная, гексильная, изогексильная, втор-гексильная, трет-гексильная, гептильная, октильная, нонильная, децильная, ундецильная или додецильная группы, причем линейные или разветвленные C1-C6 алкильные группы предпочтительны,
- алкенильная группа обозначает линейную или разветвленную C2-C12 группу, такую как этенильная или винильная, пропенильная или аллильная, 1-пропенильная, н-бутенильная, изобутенильная, 3-метилбут-2-енильная, н-пентенильная, гексенильная, гептенильная, октенильная или деценильная группы, причем линейные или разветвленные С2-С4 алкенильные группы предпочтительны;
- алкинильная группа обозначает линейную или разветвленную С2-С12 группу, такую как этинильная, пропинильная или пропаргильная, бутинильная, н-бутинильная, изобутинильная, изобутинильная, 3-метилбут-2-инильная, пентинильная или гексинильная группы, причем линейные или разветвленные С2-С4 алкинильные группы предпочтительны;
- алкоксигруппа обозначает линейную или разветвленную С1-С12 группу, такую как метокси, этокси, пропокси, изопропокси, бутокси (линейная, вторичная или третичная), пентокси, гексокси или гептокси группы, причем линейные или разветвленные C1-C6 алкоксигруппы предпочтительны;
- циклоалкильная группа обозначает моноциклическую или бициклическую C3-C10 карбоциклическую группу, такую как циклопропильная, циклобутильная, циклопентильная или циклогексильная группы;
- циклоалкенильная группа обозначает моноциклическую или бициклическую C3-C10 карбоциклическую группу, содержащую, по меньшей мере, одну двойную связь, такую как циклобутенильная, циклопентенильная или циклогексенильная группы;
- циклоалкилалкильная группа обозначает группу, в которой циклоалкильный и алкильный остатки имеют значения, указанные выше, такую как циклопропилметильная, циклобутилметильная, циклопентилметильная, циклогексилметильная, циклогептилметильная, циклопропилэтильная или циклогексилэтильная группы;
- арильная группа обозначает ненасыщенную моноциклическую, бициклическую или трициклическую, С6-С4 карбоциклическую группу, такую как фенильная, нафтильная, инденильная или антраценильная группы, и более конкретно фенильную группу;
- арилалкильная группа обозначает группу, в которой арильный и алкильный остатки имеют значения, упомянутые выше, такие, как бензильная, фенилэтильная, 2-фенилэтильная или нафтилметильная группы;
- гетероциклоалкильная группа обозначает моноциклическую или бициклическую карбоциклическую группу, содержащую от 3 до 10 атомов, с включением одного или нескольких одинаковых или разных гетероатомов, выбранных из кислорода, азота и серы, такую как диоксоланильная, диоксанильная, дитиоланильная, тиоксоланильная, оксиранильная, пиперазинильная, пиперидинильная, пирролидинильная, имидазолидинильная, пиразолидинильная, морфолинильная, тетрагидрофурильная, тетрагидротиенильная или тиазолидинильная группы;
- гетероциклоалкилалкильная группа обозначает группу, в которой гетероциклоалкильный и алкильный остатки имеют значения, упомянутые выше;
- гетероарильная группа обозначает ненасыщенную или частично ненасыщенную моноциклическую, бициклическую или трициклическую карбоциклическую группу, прерываемую одним или несколькими одинаковыми или разными гетероатомами, выбранными из кислорода, азота и серы, которая содержит 5-14 атомов, такую как фурильная (например, 2-фурильная), тиенильная (например, 2-тиенильная или 3-тиенильная), пирролильная, диазолильная, тиазолильная, изотиазолильная, оксазолильная, оксадиазолильная, 3- или 4-изоксазолильная, имидазолильная, пиразолильная, изоксазолильная, пиридильная (например, 2-, или 3- или 4-пиридильная), пиримидильная, пиримидинильная, пиридазинильная, пиразинильная, тетразолильная, бензотиенильная (например, 3-бензотиенильная), бензофуранильная, индолильная, пуринильная, хинолильная, изохинолильная, хроманильная или нафтиридинильная группы;
- гетероарилалкильная группа обозначает группу, в которой гетероарильный и алкильный остатки имеют значения, указанные выше;
- алкил-O-СО- группа обозначает линейную или разветвленную C2-С12 группу, в которой алкильная группа имеет значение, указанное выше;
- алкиленовая группа обозначает линейную или разветвленную двухвалентную C1-C6 углеводородную группу, такую как метиленовая, этиленовая, пропиленовая и изопропиленовая;
- -О-алкилен-O- группа обозначает линейную или разветвленную C1-C6 группу, в которой алкиленовая группа имеет значение, указанное выше;
- алкил-SO- группа обозначает линейную или разветвленную C1-C12 группу, в которой алкильная группа имеет значение, указанное выше;
- алкил-SO2- группа обозначает линейную или разветвленную C1-C12 группу, в которой алкильная группа имеет значение, указанное выше;
- алкилсульфонилкарбамоильная группа обозначает линейную или разветвленную С2-С12 группу, в которой алкильная группа имеет значение, указанное выше;
- алкилтиогруппа обозначает линейную или разветвленную С1-С12 группу, в которой алкильная группа имеет значение, указанное выше, такую как метилтио, этилтио, изопропилтио и гептилтио;
- O-циклоалкильная группа обозначает группу, в которой циклоалкильная группа имеет значение, указанное выше;
- r-СО- группа обозначает линейную или разветвленную С2-С12 группу, в которой r представляет собой алкильную, алкенильную, циклоалкильную, циклоалкенильную, гетероциклоалкильную, арильную или гетероарильную группу, причем эти группы имеют значения, упомянутые выше, такую, как ацетильная, пропионильная, бутирильная, бензоильная, валерильная, гексаноильная, акрилоильная и кротоноильная группы;
- ацилоксигруппа обозначает ацил-O-группу, в которой ацильная группа имеет значение, указанное выше, такую как ацетокси и пропионилокси;
- ациламиногруппа обозначает ацил-N-группу, в которой ацильная группа имеет значение, указанное выше, такую как ацетамидо;
- алкил-N-CO-группа обозначает группу, в которой алкильная группа имеет значение, указанное выше;
- алкиламино, диалкиламино, ариламино, диариламино или арилалкиламино группы обозначают группы, в которых алкильная и арильная группы имеют значения, указанные выше;
- арилокси группа обозначает арил-O-группу, в которой арильная группа имеет значение, указанное выше, такую как феноксигруппа или нафтилоксигруппа;
- арилтио группа обозначает арил-S-группу, в которой арильная группа имеет значение, указанное выше, такую как фенилтио или нафтилтио;
- гетероарилтио группа обозначает гетероарил-S-группу, в которой гетероарильная группа имеет значение, указанное выше, такую как тиофентио группу.
Стадию защиты аминной функциональной группы группой Р, и более конкретно бензилоксикарбонильной группой (Cbz), можно проводить, применяя или адаптируя способы, описанные в литературе, например, в книге (Protective Groups in Organic Synthesis, 3 rd edition, John Wiley & Sons, pages 531-540). Рассматриваемая реакция обычно происходит в присутствии хлорформиата, например бензилхлорформиата в количестве от 1 до 1,5 молярных эквивалентов, предпочтительно в эквимолярном количестве, и основания, такого как гидроксид натрия, триэтиламин, бикарбонат натрия или карбонат калия, в количестве от 1 до 1,5 молярных эквивалентов, предпочтительно в количестве 1,2 молярных эквивалента основания, в инертном растворителе или в смеси инертных растворителей, предпочтительно в двухфазной среде, такой как толуол/вода или метил-трет-бутиловый эфир (МТВЕ)/вода, при температуре от -15°С и до комнатной температуры в течение 1-24 часов.
Стадию деацетилирования муравьиной кислотой можно проводить в следующих предпочтительных условиях:
- муравьиную кислоту используют в количестве от 1 до 30 молярных эквивалентов, предпочтительно от 20 до 25 молярных эквивалентов,
- деацетилирование необязательно проводят в присутствии воды в количестве от 0,01 до 0,1 (массовых) эквивалентов по отношению к муравьиной кислоте, предпочтительно 0,05 (массовых) эквивалента.
- температура составляет от 0 до 50°С, предпочтительно от комнатной температуры до 40°С,
- давление используют в интервале от атмосферного до 40 кПа,
- время реакции составляет от 1 до 24 часов.
Рацемические α-аминоацетали, используемые в качестве исходных веществ в способе по изобретению можно получать, адаптируя способы, описанные в литературе, например, из онгалогенированных ацеталей с последующим аминированием, как описано, в виде указания в (Heterocyclic Compounds, (1962), 3425, J.Chem. Soc, 1957, 2146-2158, J.Med. Chem., 1987, 30(1), 150-156) и J.Org. Chem., 1981, 46(8), 1575-1585). Указанные α-аминоацетали можно также получать из α-аминокислот с последующим образованием амида Вайнреба, восстановлением и ацетилированием, как описано в Bioorganic & Medicinal Chemistry Letters, 2002, 12(4), 701-704 и WO 9822496.
В патенте FR 2 843 112 описано присоединение металлоорганических соединений к производным аминотриазола, что позволяет получать рацемические или оптически активные α-аминоацетали.
Восстановление оксимных производных α-кетоацеталей, описанное в Journal of Heterocyclic Chemistry, 1978, 15 (4), 665-670 и ЕР 367242 делает возможным также получение рацемических α-аминоацеталей.
Оптически активные α-аминоацетали можно также получать путем адаптации методов, известных в литературе, например, из α-аминокислот с последующим образованием амида Вайнреба, восстановлением гидридом и ацетилированием, как описано в (Tetrahedron Lett., 2000, 41 (32), 6131-6135, WO 9822496 и WO 9614857), или восстановлением с получением спирта, реокислением с образованием альдегида и ацетилированием, как описано в (Tetrahedron Lett., 2000, 41 (32), 6131-6135, ЕР 291234 и ЕР 249349).
Применение может быть также осуществлено асимметричным восстановлением оптически активных иминов, описанным в ЕР 374647. Другие пути асимметричной индукции также описаны, такие, как метод SAMP/RAMP (Angew. Chem.Int. Ed. Engl., (1993), 32 (3), 418-421) или применение хиральных аминотриазолов (FR 2843112).
Вообще любой известный способ получения оптически активного α-аминоацеталя приемлем для изобретения, такой как способ восстановления по Розенмунду, описанный, в частности в (Tetrahedron (1974), 30 (23/24), 4233-4237).
Соединения формул (II), R-(II), S-(II), (III), R-(III) или S-(III) можно использовать для получения продуктов, обладающих фармакологической активностью. Указанные соединения конкретно применяются для получения ингибитора SCH-503034 протеазы, описанного, например в WO 2005087721, и особенно для получения интермедиатов 10.10 (трет-бутилового эфира 2-карбамоил-1-циклобутилметил-2-гидроксиэтилкарбаминовой кислоты) или 10.11 (гидрохлорида 3-амино-4-циклобутил-2-гидроксибутирамида).
Применение N-защищенных α-аминоацеталей формулы (II) в рацемической или оптически активной форме - (R)-(II) или (S)-(II), как определено выше,
и применение N-защищенных α-аминоальдегидов формулы (III) в рацемической или в оптически активной форме формул (R)-(III) или (S)-(III), как определено выше, за исключением циклоалкилалкильной группы в определении R3,
для получения продуктов, обладающих фармакологической активностью представляет собой следующий аспект изобретения.
Таким образом, согласно еще одному следующему объекту, изобретение также относится к соединениям формулы (II), (R)-(II) или (S)-(II), как определено выше, в которых R1 и R2, одинаковые или разные, представляют собой линейную или разветвленную C1-С12 алкильную группу, предпочтительно метальную группу, Р представляет собой бензилоксикарбонильную (Cbz) группу и R3 представляет собой циклоалкилалкильную группу, в которой циклоалкильная группа представляет собой C3-C10 циклоалкильную группу, а алкильная группа представляет собой линейную или разветвленную C1-C12 алкильную группу, предпочтительно циклобутилметильную группу.
Изобретение иллюстрируется следующими ниже примерами, не ограничивающими его.
Анализ методом ядерного магнитного резонанса (ЯМР) проводят на приборе «Büer АС200» в стандартных дейтерированных растворителях (CDCl3, d6-ДМСО и т.п.). Газохроматографический анализ (ГХ) проводят на приборе «Varian 3900» (детектор пламенно-ионизационный) на колонке Chrompack (30 м/CP-SIL 8 CB-low bleed MS/1 мкм/0,25 мм) и в качестве метода анализа: Т°инжектор 250°C/T°детектор 300°С/программирование нагрева печи: 80°/мин 1 мин, затем 15°С/мин до 300°С, и выдерживание при 300°С.
Осуществление изобретения
Пример 1
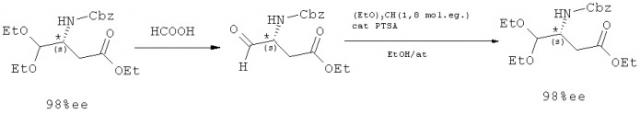
Бензил-1-изобутил-2,2-диметоксиэтилкарбамат
(Формула II: R1=R2 = метил; R3 = изобутил; Р=Cbz)
1-Изобутил-2,2-диметоксиэтиламин (5 г, 31 ммоль, 1 мол. экв.) растворяют в смеси МТВЕ (25 г)/Н2О (15 г) в присутствии карбоната калия (2,6 г, 18 ммоль, 0,6 мол. экв.) в трехгорлой колбе объемом 100 мл, снабженной обратным холодильником, капельной воронкой, магнитной мешалкой и термометром, и охлаждают до температуры от 0°С до 5°С. К полученной реакционной смеси прибавляют по каплям раствор бензилхлорформиата (5,29 г, 31 ммоль, 1 мол. экв.) в МТВЕ (10 г). В конце прибавления температуру реакционной смеси поддерживают в интервале температур от 0°С до 5°С в течение 30 мин, затем медленно повышают температуру до 20-25°С. Реакционную смесь перемешивают при этой температуре, контролируя изменения в ходе реакции с помощью ГХ анализа.
Реакционную среду разделяют на фазы путем отстаивания и органическую фазу концентрируют. Получают 8,85 г бензил-1-изобутил-2,2-диметоксиэтилкарбамата (бесцветное масло, выход неочищенного продукта=97%).
Эмпирическая формула: C16H25NO4
Молекулярная масса: 295,38 г моль-1
ГХ анализ: tr=18,1 мин
ЯМР (200 МГц/CDCl3):
1Н ЯМР: δ 0,84 (м, 6Н, СН3), 1,27 (м, 2Н, CH2), 1,59 (м, 1Н, СН), 3,34 (с, 6Н, СН3), 3,8 (м, 1Н, СН), 4,1 (искаженный с, 1Н, СН), 4,75 (д, 1Н, NH), 5,03 (с, 2Н, СН2) и 7,1-7,3 (м, 5Н, Наром.с) м.д.
13С ЯМР: δ 21,82 (СН3), 23,6 (СН3), 24,59 (СН), 38,5 (СН2), 50,8 (СН), 56,01 (СН3), 56,16 (СН3), 66,73 (СН2), 106,63 (СН), 128,05-128,54-128,79 (СНаром.), 136,72 (Саром.) и 156,37 (С=O) м.д.
Пример 2
Получение соединений формулы (II), где
R1=R2 = метил или этил,
R3 = бензил, изобутил, фенил, 4-метилбензил, 2-фенилэтил, циклогексил или -CH2-CO2Et, Р=Cbz
α-Аминоацеталь, соответствующий N-защищенному α-аминоацеталю формулы (II) (0,005 моль, 1 мол. экв.) растворяют в толуоле или смеси МТВЕ (4 г)/H2O (3 г) в присутствии карбоната калия (0,003 моль, 0,6 мол.экв.) в трехгорлой колбе объемом 50 мл, снабженной обратным холодильником, капельной воронкой, магнитной мешалкой и термометром, и охлаждают до температуры от 0°С до 5°С. К полученной реакционной смеси прибавляют по каплям раствор бензилхлорформиата (0,005 моль, 1 мол.экв.) в толуоле или МТВЕ (1 г). В конце прибавления температуру реакционной смеси поддерживают в интервале температур от 0°С до 5°С в течение 30 мин, затем медленно повышают температуру до 20-25°С и продолжают перемешивание при этой температуре.
Реакционную среду разделяют на фазы путем отстаивания и органическую фазу концентрируют. Получают целевой продукт, выход неочищенного продукта составляет от 70% до количественного.
Бензил-1-бензил-2,2-диметоксиэтилкарбамат (белое твердое вещество)
Эмпирическая формула: C19H23NO4
Молекулярная масса: 329,40 г моль-1
ГХ анализ: tr=25,1 мин
ЯМР (200 МГц/CDCl3): 1Н ЯМР: δ 2,8 (м, 2Н, СН2), 3,31 (с, 3Н, СН3), 3,35 (с, 3Н, СН3), 4,05 (м, 2Н, СН), 4,95 (м, 3Н, СН2 и NH), 5,03 (с, 2Н, СН2) и 7,0-7,35 (м, 10Н, Наром.) м.д.
13С ЯМР: δ 36,13 (СН2), 53,5 (СН), 55,69 (СН3), 55,8 (СН3), 66,67 (СН2), 104,9 (СН), 126,45-129,39 (СНаром.), 136,7-137,9 (Саром., с) и 156,13 (С=O) м.д.
Бензил-1-фенил-2,2-диметоксиэтилкарбамат (белое твердое вещество)
Эмпирическая формула: C18H21NO
Молекулярная масса: 315,37 г мол-1
ГХ анализ: tr=22,8 мин
ЯМР (200 МГц/CDCl3): 1H ЯМР: δ 3,25 (с, 3Н, СН3), 3,32 (с, 3Н, СН3), 4,3 (distorted d, 1H, СН), 4,8 (искаженный д, 1Н, СН), 5 (с, 2Н, СН2), 5,6 (искаженный д, 1Н, NH) и 7,0-7.25 (м, 10Н, Наром.) м.д.
13С ЯМР: δ 55,5 (СН3), 57 (СН), 67 (СН2), 106 (СН), 127-129 (СНаром.), 136-138 (Саром.) и 156 (С=O)м.д.
Температура плавления: Т.пл.=71°С
Бензил-1-(4-метилбензил)-2,2-диметоксиэтилкарбамат (белое твердое вещество)
Эмпирическая формула: C20H25NO4
Молекулярная масса: 343,43 г моль-1
ГХ анализ: tr=26,4 мин
ЯМР (200 МГц/CDCl3):
1Н ЯМР: δ 2,2 (с, 3Н, СН3), 2,77 (м, 2Н, СН2), 3,28 (с, 3Н, СН3), 3,32 (с, 3Н, СН3), 4 (м, 1Н, СН), 4,08 (искаженный д, 1Н, СН), 4,58 (с, 1Н, NH), 4,95 (с, 2Н, СН2) и 7,1-7,3 (м, 9Н, Наром. с) м.д.
13С ЯМР (DEPT 135): δ 20,88 (СН3), 35,5 (СН2), 53,4 (СН), 55,4 (СН3), 55,5 (СН3), 66,4 (СН2), 104,6 (СН) и 126,8-129,1 (СНаром.) м.д.
Температура плавления: Т.пл.=80°С
Бензил-1-(2-фенилэтил)-2,2-диметоксиэтилкарбамат (белое твердое вещество)
Эмпирическая формула: C20H25NO4
Молекулярная масса: 343,43 г моль-1
ГХ анализ: tr=27,4 мин
ЯМР (200 МГц/CDCl3):
1Н ЯМР: δ 1,7 (м, 1 Н, АВ-сист., СН2), 1,9 (м, 1 Н, АВ-сист., СН2), 2,7 (м, 2Н, СН2), 3,4 (с, 6Н, СН3), 3,85 (м, 1Н, СН), 4,21 (д, 1Н, J=3,2 Гц, СН), 5 (д, 1Н, NH), 5,15 (с, 2Н, CH2) и 7,1-7,5 (м, 10Н, Наром.) м.д.
13С ЯМР: δ 31,55 (СН2), 32,2 (СН2), 52,5 (СН), 55,9 (СН3), 56,07 (СН3), 66,9 (СН2), 106,2 (СН), 125,9-128,7 (СНаром.), 136,6 и 141,9 (Саром.) и 156.4 (С=O) м.д.
Температура плавления: Т.пл.=73°С
Бензил-1-циклогексил-2,2-диметоксиэтилкарбамат (бесцветное масло)
Эмпирическая формула: C18H27NO4
Молекулярная масса: 321,42 г мол-1
ГХ анализ: tr=22,7 мин
ЯМР (200 МГц/CDCl3):
1Н ЯМР: δ 0,9-1,6 (м, 11Н, СН+СН2), 3,3 (с, 3Н, СН3), 3,32 (с, 3Н, СН3), 3,6 (м, 1Н, СН), 4,21 (д, 1Н, J=2,2 Гц, СН), 4,86 (д, 1Н, NH), 5,0 (м, 2Н, СН2) и 7,1-7,4 (