Аналоги глюкагона, обладающие повышенной растворимостью в буферах с физиологическим значением ph
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению аналогов глюкагона, и может быть использовано в медицине. Аминокислотная последовательность пептида включает отрицательно заряженную аминокислоту в положении 28 и отрицательно заряженную аминокислоту в положении 29 или 30 последовательности нативного глюкагона (SEQ ID NO: 1). Также аминокислотная последовательность может включать до 7 дополнительных аминокислотных модификаций по отношению к SEQ ID NO: 1, которые позволяют пептиду глюкагона сохранить активность глюкагона и улучшенную растворимость или стабильность. Полученный пептид используют для лечения гипогликемии и для временного пареза кишечного тракта. Изобретение позволяет получить пептид глюкагона с улучшенной растворимостью или стабильностью по отношению к нативному глюкагону. 7 н. и 8 з.п. ф-лы, 10 ил., 4 табл., 15 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Гипогликемия встречается, когда уровень глюкозы в крови падает до слишком низкого значения, чтобы обеспечить достаточно энергии для жизнедеятельности организма. Для взрослых или детей в возрасте старше 10 лет гипогликемия является нетипичной за исключением побочных эффектов лечения диабета, но она также может быть результатом действия других лекарственных средств или заболеваний, результатом недостаточности гормонов или ферментов или результатом опухолей. Когда уровень глюкозы начинает падать, глюкагон, гормон, продуцируемый поджелудочной железой, посылает в печень сигнал разрушения гликогена и высвобождения глюкозы, что вызывает повышение уровня глюкозы в крови до нормального уровня. Однако для диабетиков эта реакция глюкагона на гипогликемию может быть нарушена, что затрудняет возвращение уровня глюкозы к нормальным значениям.
Гипогликемия представляет собой опасное для жизни событие, которое требует немедленного медицинского вмешательства. Введение глюкагона представляет собой проверенный способ лечения острой гипогликемии, и он может восстанавливать нормальный уровень глюкозы в считанные минуты после введения. При использовании глюкагона в случае неотложного медицинского лечения гипогликемии кристаллическую форму глюкагона растворяют с помощью кислого буфера для разведения и раствор инъецируют внутримышечно. Несмотря на то что это лечение является эффективным, методология является трудоемкой и опасной для того, кто уже находится в полубессознательном состоянии. Соответственно, существует потребность в аналоге глюкагона, который будет поддерживать биологические характеристики родительской молекулы, но будет достаточно растворимым и стабильным при соответствующих физиологических условиях, так что он может быть заранее приготовлен в форме раствора, готового для инъекции.
Кроме того, у диабетиков стараются поддерживать близкий к нормальному уровень глюкозы в крови для задержки или предотвращения микрососудистых осложнений. Достижение этой цели обычно требует применения интенсивной инсулиновой терапии. Стремясь достичь этой цели, медики столкнулись с существенным увеличением частоты и тяжести гипогликемии у обследованных пациентов-диабетиков. Соответственно, для лечения диабета необходима разработка улучшенных лекарственных средств и методологий, которые с меньшей вероятностью индуцируют гипогликемию, чем используемые в настоящее время инсулиновые терапии.
Как описано в настоящем документе, предлагаются высокоэффективные агонисты глюкагона, которые проявляют повышенную биофизическую стабильность и водорастворимость при физиологических значениях pH в фармацевтических композициях, подходящих для коммерческого использования. Нативный глюкагон не является ни растворимым, ни стабильным в диапазоне значений pH, соответствующих физиологическим значениям pH, и, таким образом, должен быть получен в виде сухого продукта, который требует восстановления и немедленного использования. Аналоги глюкагона, описанные в настоящем документе, обладают усиленными физическими свойствами, которые дают им преимущество для использования в текущих медицинских целях, где в настоящий момент применяется нативный гормон. Эти соединения могут использоваться в соответствии с одним вариантом осуществления для получения предварительно приготовленных растворов, готовых для инъекции с целью лечения гипогликемии. Альтернативно, агонисты глюкагона могут вводиться совместно с инсулином для забуферирования эффектов инсулина для обеспечения более стабильного поддержания уровня глюкозы в крови. Кроме того, ниже подробно описаны другие преимущества использования композиций, включающих модифицированные пептиды глюкагона, описанные в настоящем документе.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном варианте осуществления изобретения предлагаются пептиды глюкагона, которые сохраняют активность рецептора глюкагона и проявляют улучшенную растворимость по сравнению с нативным пептидом глюкагона (SEQ ID NO: 1). Нативный глюкагон проявляет слабую растворимость в водном растворе, особенно при физиологическом значении pH, с тенденцией к агрегации и осаждению с течением времени. Напротив, пептиды глюкагона по одному из вариантов осуществления изобретения проявляют, по меньшей мере, двухкратную, пятикратную или еще большую растворимость по сравнению с нативным глюкагоном при значении pH в интервале от 6 до 8, например при pH 7 через 24 часа при 25°C.
В одном варианте осуществления пептиды глюкагона сохраняют по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75% активности, 80% активности, 85% активности или 90% активности нативного глюкагона. В одном варианте осуществления пептиды глюкагона по настоящему изобретению обладают большей эффективностью, чем глюкагон. Любой из пептидов глюкагона по изобретению может дополнительно обладать улучшенной стабильностью и/или сниженной деградацией, например, с сохранением по меньшей мере 95% исходного пептида через 24 часа при 25°С.
В соответствии с одним вариантом осуществления предлагается пептид глюкагона, где пептид модифицирован с помощью аминокислотных замен и/или вставок, которые вводят заряженную аминокислоту в C-концевую область пептида и в одном варианте осуществления в положение, которое является C-концевым относительно положения 27 последовательности SEQ ID NO: 1. Необязательно, одна, две или три заряженные аминокислоты могут вводиться в C-концевую область и в одном варианте осуществления в C-концевую область относительно положения 27. В соответствии с одним вариантом осуществления нативную аминокислоту (аминокислоты) в положении 28 и/или 29 заменяют на заряженную аминокислоту и/или аминокислоты в количестве от одной до трех присоединяют к С-концу пептида. В иллюстративных вариантах осуществления одна, две или все заряженные аминокислоты являются отрицательно заряженными. С пептидом глюкагона могут быть произведены дополнительные модификации, например консервативные замены, которые обеспечат сохранение активности глюкагона.
Согласно одному иллюстративному варианту осуществления пептид глюкагона включает аминокислотную последовательность SEQ ID NO: 11 или ее аналог, которые содержат 1-3 дополнительных аминокислотных модификаций по отношению к нативному глюкагону или аналогу агониста глюкагона на его основе. SEQ ID NO: 11 представляет собой модифицированный пептид глюкагона, где остаток аспарагина в положении 28 нативного белка заменен на аспарагиновую кислоту. В другом иллюстративном варианте осуществления пептид глюкагона включает последовательность SEQ ID NO: 38, где остаток аспарагина в положении 28 нативного белка заменен на глутаминовую кислоту. Другие иллюстративные варианты осуществления включают пептиды глюкагона SEQ ID NO: 24, 25, 26, 33, 35, 36 и 37.
Растворимость любого из вышеуказанных соединений может быть дополнительно улучшена путем присоединения к пептиду гидрофильного компонента. В одном варианте осуществления гидрофильный компонент представляет собой цепь полиэтиленгликоля или другой водорастворимый полимер, который ковалентно связан с боковой цепью аминокислотного остатка в положении 16, 17, 21 или 24 указанного пептида глюкагона. Цепь полиэтиленгликоля согласно одному варианту осуществления имеет молекулярную массу, выбранную из диапазона от примерно 500 до примерно 40000 дальтон. Настоящее изобретение дополнительно охватывает фармацевтически приемлемые соли указанных агонистов глюкагона.
В других иллюстративных вариантах осуществления любое из вышеуказанных соединений может быть дополнительно модифицировано с изменением его фармацевтических свойств путем присоединения второго пептида к карбоксильному концу пептида глюкагона. В одном варианте осуществления пептид глюкагона ковалентно связан посредством пептидной связи со вторым пептидом, где второй пептид включает последовательность, выбранную из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22.
В других иллюстративных вариантах осуществления любое из вышеуказанных соединений может быть дополнительно модифицировано с улучшением стабильности путем модификации аминокислоты в положении 15 последовательности SEQ ID NO: 1 для уменьшения деградации пептида с течением времени, особенно в кислых или щелочных буферах.
Согласно одному варианту осуществления предлагается фармацевтическая композиция, включающая любой из новых пептидов глюкагона, описанных в настоящем документе, предпочтительно, с уровнем чистоты, соответствующим, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, и фармацевтически приемлемый разбавитель, носитель или вспомогательное вещество. Такие композиции могут содержать пептид глюкагона в концентрации, составляющей, по меньшей мере, 0,5 мг/мл, 1 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл или выше. В одном варианте осуществления фармацевтические композиции включают водные растворы, которые стерильны и необязательно хранятся внутри различных контейнеров. В других вариантах осуществления фармацевтические композиции включают лиофилизованный порошок. Фармацевтические композиции могут быть дополнительно упакованы в виде части набора реагентов, который включает одноразовое устройство для введения композиции пациенту. На контейнерах или наборах реагентов могут быть маркировки, указывающие на хранение при температуре окружающей среды или при пониженной температуре.
Согласно одному варианту осуществления предлагается способ быстрого увеличения уровня глюкозы или способ лечения гипогликемии с применением предварительно приготовленного водного раствора. Способ включает стадию введения эффективного количества водного раствора, включающего новый модифицированный пептид глюкагона по настоящему изобретению. В другом варианте осуществления предлагается способ для индуцирования временного пареза кишечного тракта. Способ включает стадию введения одного или более пептидов глюкагона, описанных в настоящем документе, нуждающемуся в этом пациенту.
В еще в одном варианте осуществления предлагается способ снижения прибавления веса или способ индуцирования потери веса, который включает введение эффективного количества водного раствора, включающего пептид глюкагона по изобретению. В других вариантах осуществления предлагаются способы лечения диабета, включающие совместное введение инсулина и пептида глюкагона по изобретению.
Иллюстративные пептиды глюкагона выбраны из группы, состоящей из последовательностей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 33, где аминокислота 29 пептида глюкагона связана со вторым пептидом посредством пептидной связи, и указанный второй пептид включает последовательность SEQ ID NO: 20, SEQ ID NO: 21 или SEQ ID NO: 22. В одном варианте осуществления пептид глюкагона является пэгилированным. В одном варианте осуществления способ включает стадию введения пептида, включающего последовательность SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26, где полиэтиленовая цепь ковалентно связана с аминокислотой в положении 21 или в положении 24.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
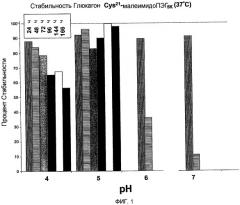
Фиг. 1 представляет собой гистограмму, характеризующую стабильность Глюкагон-Cys21малеимидоПЭГ5K при 37°C, инкубированного в течение 24, 48, 72, 96, 144 и 166 часов соответственно.
На фиг. 2 представлены данные, полученные из HPLC-анализа Глюкагон-Cys21малеимидоПЭГ5K при pH 5, инкубированного при 37°C в течение 24, 72 или 144 часов соответственно.
На фиг. 3 представлены данные, демонстрирующие растворимость аналогов глюкагона (D28, E29, E30) по сравнению с нативным глюкагоном через 60 часов при 25°C при pH 2, 4, 5,5, 7 и 8 соответственно.
На фиг. 4 представлены данные, демонстрирующие растворимость аналогов глюкагона (E15D28, D28E29 и D28E30) по сравнению с нативным глюкагоном через 24 часа при 25°C, и затем через 24 часа при 4°C при pH 2, 4, 5,5 и 7 соответственно.
На фиг. 5 представлена максимальная растворимость аналогов глюкагона D28, D28E30 и E15,D28 через 24 часа, pH 7 при 4°C.
На фиг. 6 представлены данные, демонстрирующие опосредованную рецептором глюкагона индукцию cAMP с помощью аналогов глюкагона (K29 ▲, K30 ▼ и K29K30 ◆), по сравнению с нативным глюкагоном ■.
На фиг. 7 представлены данные, демонстрирующие опосредованную рецептором глюкагона индукцию cAMP с помощью аналогов глюкагона (D28 □, E29 ∆, E30 ∇, K30K31 ◇ и K30 ▼) по сравнению с нативным глюкагоном ■.
На фиг. 8 представлены данные, демонстрирующие опосредованную рецептором глюкагона индукцию cAMP с помощью аналогов глюкагона (D28 □, E28 и K29 ▲) по сравнению с нативным глюкагоном ■.
На фиг. 9 представлены данные, демонстрирующие опосредованную рецептором глюкагона индукцию cAMP с помощью аналогов глюкагона (D28E29 +, D28E30 X, E15D28 * и E29 ∆) по сравнению с нативным глюкагоном ■.
На фиг. 10 представлены данные, демонстрирующие изменение концентрации глюкозы в сыворотке у собак бигль после внутримышечного введения глюкагона и аналогов глюкагона. Животным вводили дозу 0,005 мг/кг или глюкагона, или аналога глюкагона, включающего глюкагон с последовательностью SEQ ID NO: 31, связанной с карбокси-концевой областью глюкагона (глюкагон-CEX), или аналога глюкагона, включающего замену на аспарагиновую кислоту в положении аминокислоты 28 (глюкагон-Asp28) SEQ ID NO: 11.
ПОДРОБНОЕ ОПИСАНИЕ
ОПРЕДЕЛЕНИЯ
В описании и пунктах формулы изобретения используется следующая терминология согласно определениям, представленным ниже.
При использовании в настоящем документе в настоящем документе "фармацевтически приемлемый носитель" включает любой из стандартных фармацевтических носителей, таких как солевой раствор с фосфатным буфером, вода, эмульсии, такие как масло/вода или вода/масло, и различные типы увлажняющих агентов. Термин также охватывает любой из агентов, которые одобрены регулятивным органом Федерального Правительства США или приведены в Фармакопее США для использования у животных, включая людей.
При использовании в настоящем документе термин "фармацевтически приемлемая соль" обозначает соли соединений, которые сохраняют биологическую активность родительского соединения и которые не являются неприемлемыми биологически или иным образом. Многие из соединений, описанных в настоящем документе, способны образовывать кислоту и/или основание в присутствии амино- и/или карбоксильных групп или им подобных групп.
Фармацевтически приемлемые аддитивные соли основания могут быть получены из неорганических и органических оснований. Соли, полученные из неорганических оснований, включают, исключительно в качестве примера, соли натрия, калия, лития, аммония, кальция и магния. Соли, полученные из неорганических оснований, включают, но не ограничены ими, соли первичных, вторичных и третичных аминов.
Фармацевтически приемлемые аддитивные соли кислот могут быть получены из неорганических и органических кислот. Соли, полученные из неорганических кислот, включают хлороводородную кислоту, бромоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и им подобные. Соли, полученные из органических кислот, включают уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфокислоту, этансульфокислоту, p-толуолсульфокислоту, салициловую кислоту и им подобные.
При использовании в настоящем документе термин "лечение" включает профилактику определенного нарушения или состояния, или улучшение симптомов, ассоциированных с определенным нарушением или состоянием, и/или предотвращение или устранение указанных симптомов.
При использовании в настоящем документе "эффективное" количество или "терапевтически эффективное количество" пептида глюкагона обозначает нетоксичное, но достаточное количество пептида, обеспечивающего целевой эффект. Например, один целевой эффект мог бы представлять собой предотвращение или лечение гипогликемии с помощью измерений, например, увеличения уровня глюкозы в крови. Количество, которое является "эффективным", варьируется от субъекта к субъекту в зависимости от возраста и общего состояния индивидуума, способа введения и подобных факторов. Таким образом, не всегда возможно определить точное "эффективное количество". Однако подходящее "эффективное" количество в любом индивидуальном случае может быть определено специалистом в данной области с использованием обычной процедуры эксперимента.
Термин "парентеральный" обозначает введение не через алиментарный канал, а введение каким-то другим путем, таким как подкожный, внутримышечный, интраспинальный или внутривенный.
При использовании в настоящем документе термин "очищенный" и подобные термины относятся к выделению молекулы или соединения в форме, которая по существу не содержит примесей, обычно ассоциированных с молекулой или соединением в нативном или естественном окружении. При использовании в настоящем документе термин "очищенный" не требует абсолютной чистоты; предпочтительнее он подразумевается в качестве относительного определения. Термин "очищенный полипептид" используется в настоящем документе для описания полипептида, который был отделен от других соединений, включающих, но не ограниченных ими, молекулы нуклеиновой кислоты, липиды и углеводы.
Термин "выделенный" требует, чтобы материал, к которому он относится, был удален из его исходного окружения (например, естественного окружения, если он существует в природе). Например, природный полинуклеотид, присутствующий в живом животном, не является выделенным, но тот же полинуклеотид, отделенный от некоторой части или от всего сопутствующего ему в естественной системе материала, является выделенным.
При использовании в настоящем документе "пептид глюкагона" включает любой пептид, включающий или аминокислотную последовательность SEQ ID NO: 1, или любой аналог аминокислотной последовательности SEQ ID NO: 1, включающий аминокислотные замены, вставки или делеции или пост-трансляционные модификации (например, метилирование, ацилирование, убиквитинирование и им подобные) пептида, которые стимулируют активность рецептора глюкагона или рецептора GLP-I, измеренную с помощью продуцирования cAMP с использованием анализа, описанного в Примере 13.
Термин "агонист глюкагона" обозначает комплекс, включающий пептид глюкагона, который стимулирует активность рецептора глюкагона, измеренную с помощью продуцирования cAMP с использованием анализа, описанного в Примере 13.
При использовании в настоящем документе "аналог агониста глюкагона" представляет собой пептид глюкагона, включающий последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, или аналог такой последовательности, которая была модифицирована с включением одной или более консервативных аминокислотных замен в положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29.
При использовании в настоящем документе аминокислотная "модификация" обозначает замену, вставку или делецию аминокислоты и включает замену на любую из 20 аминокислот, обычно встречающихся в белках человека, а также нетипичных или неприродных аминокислот или их вставку. По всему содержанию заявки все ссылки на конкретное положение аминокислоты с помощью номера (например, положение 28) обозначают аминокислоту в этом положении у нативного глюкагона (SEQ ID NO: 1) или соответствующее положение аминокислоты в любых его аналогах. Например, ссылка в настоящем документе на "положение 28" будет обозначать соответствующее положение 27 для аналога глюкагона, в котором первая аминокислота в последовательности SEQ ID NO: 1 была делетирована. Подобным образом, ссылка в настоящем документе на "положение 28" будет обозначать соответствующее положение 29 для аналога глюкагона, в котором одна аминокислота была добавлена с N-конца последовательности SEQ ID NO: 1.
При использовании в настоящем документе аминокислотная "замена" обозначает замену одного аминокислотного остатка на другой аминокислотный остаток.
При использовании в настоящем документе термин "консервативная аминокислотная замена" определяется в настоящем документе как обмен в пределах одной из следующих пяти групп:
I. Небольшие алифатические, неполярные или незначительно полярные остатки:
Ala, Ser, Thr, Pro, GIy;
II. Полярные, отрицательно заряженные остатки и их амиды:
Asp, Asn, Glu, Gln, цистеиновая кислота и гомоцистеиновая кислота;
III. Полярные, положительно заряженные остатки:
His, Arg, Lys; Орнитин (Orn);
IV. Крупные, алифатические, неполярные остатки:
Met, Leu, Ile, Val, Cys, Норлейцин (Nle), гомоцистеин;
V. Крупные, ароматические остатки:
Phe, Tyr, Trp, ацетилфенилаланин
При использовании в настоящем документе общий термин "полиэтиленгликоль" или "ПЭГ" обозначает смеси конденсированных полимеров этиленоксида и воды в виде разветвленной и прямой цепи, характеризующихся общей формулой H(OCH2CH2)nOH, где n представляет собой, по меньшей мере, 9. В отсутствие любой дополнительной характеристики подразумевается, что термин включает полимеры этиленгликоля со средней общей молекулярной массой, выбранной из диапазона от 500 до 40000 дальтон. "Полиэтиленгликоль" или "ПЭГ" используется в комбинации с числовым индексом для указания его приблизительной средней молекулярной массы. Например, ПЭГ-5000 обозначает полиэтиленгликоль, имеющий общую молекулярную массу, составляющую в среднем примерно 5000.
При использовании в настоящем документе термин "пэгилированный" и подобные обозначает соединение, которое было модифицировано из его нативного состояния путем присоединения полимера полиэтиленгликоля к соединению. "Пэгилированный пептид глюкагона" представляет собой пептид глюкагона, который имеет цепь ПЭГ, ковалентно связанную с пептидом глюкагона.
При использовании в настоящем документе подразумевается, что общая ссылка на пептид охватывает пептиды, которые имеют мидифицированные амино- или карбокси-концевые области. Например, подразумевается, что аминокислотная цепь, включающая амидогруппу вместо концевой карбоновой кислоты, охватывается аминокислотной последовательностью, обозначающей стандартные аминокислоты. При использовании в настоящем документе "линкер" представляет собой связь, молекулу или группу молекул, которые связывают два отдельных компонента друг с другом. Линкеры могут обеспечивать оптимальное разделение двух компонентов или могут дополнительно обеспечивать лабильную связь, которая дает возможность двум компонентам быть отделенными друг от друга. Лабильные связи включают фото-отщепляемые группы, компоненты, отщепляемые кислотой, компоненты, отщепляемые основанием, и группы, отщепляемые ферментом.
При использовании в настоящем документе "димер" представляет собой комплекс, включающий две субъединицы, ковалентно связанные друг с другом посредством линкера. Термин димер, при использовании в отсутствие любого уточняющего определения охватывает одновременно гомодимеры и гетеродимеры. Гомодимер включает две идентичные субъединицы, тогда как гетеродимер включает две субъединицы, которые отличаются друг от друга, хотя, по существу, подобны друг другу.
При использовании в настоящем документе термин "pH-стабилизированный пептид глюкагона" обозначает аналог агониста глюкагона, который проявляет по сравнению с нативным глюкагоном повышенную стабильность и растворимость в водных буферах в самом широком интервале pH, которые используются в фармакологических целях.
При использовании в настоящем документе термин "заряженная аминокислота" обозначает аминокислоту, которая включает боковую цепь, которая отрицательно заряжена (т.е. депротонирована) или положительно заряжена (т.е. протонирована) в водном растворе при физиологическом значении pH. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту, глутаминовую кислоту, цистеиновую кислоту, гомоцистеиновую кислоту и гомоглутаминовую кислоту, тогда как положительно заряженные аминокислоты включают аргинин, лизин и гистидин. Заряженные аминокислоты включают заряженные аминокислоты из 20 аминокислот, широко встречающихся в белках человека, а также среди нетипичных или неприродных аминокислот.
При использовании в настоящем документе термин "кислая аминокислота" обозначает аминокислоту, которая включает второй кислый компонент, включающий, например, карбоновую кислоту или группу сульфоновой кислоты.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Авторы настоящего изобретения обнаружили, что нативный глюкагон может быть модифицирован путем введения заряда в его карбокси-концевую область для повышения растворимости пептида, но с сохранением у пептида свойств агониста. Повышенная растворимость позволяет получение и хранение растворов глюкагона при значениях pH, близких к нейтральному. Состав растворов глюкагона при относительно нейтральных значениях pH (например, pH со значением примерно 6-8) улучшает стабильность пептидов глюкагона в течение длительного срока. Соответственно, один вариант осуществления настоящего изобретения относится к агонисту глюкагона, который был модифицирован по отношению к пептиду дикого типа His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (SEQ ID NO: 1), для улучшения растворимости пептида в водных растворах, конкретно при значениях pH в интервале примерно от 5,5 примерно до 8, с сохранением при этом биологической активности нативного пептида. В одном варианте осуществления заряд вносят в пептид путем замены нативных незаряженных аминокислот на заряженные аминокислоты, выбранные из группы, состоящей из лизина, аргинина, гистидина, аспарагиновой кислоты и глутаминовой кислоты, или путем добавления заряженных аминокислот к амино- или карбокси-концу пептида. Неожиданно авторы изобретения обнаружили, что замена природной аминокислоты в положении 28 и/или 29 на заряженные аминокислоты и/или присоединение заряженных аминокислот в количестве от одной до двух к карбокси-концу пептида глюкагона повышает растворимость и стабильность пептидов глюкагона в водных растворах при соответствующих физиологических значениях pH (т.е., при значениях pH примерно 6,5-7,5), по меньшей мере, в 5 раз, вплоть до 30 раз.
Соответственно, пептиды глюкагона по одному варианту осуществления изобретения сохраняют активность глюкагона и проявляют растворимость, по меньшей мере, в 2 раза выше, в 5 раз, в 10 раз, в 15 раз, в 25 раз, в 30 раз или более по сравнению с нативным глюкагоном при данном значении pH в интервале между примерно 5,5 и 8, например при pH 7, по измерениям через 24 часа при 25ºC. Любой из пептидов глюкагона, описанных в настоящем документе, может дополнительно демонстрировать улучшенную стабильность при значениях pH в интервале 5,5-8, например сохранение, по меньшей мере, 75%, 80%, 90%, 95%, 96%, 97%, 98% или 99% исходного пептида через 24 часа при 25ºC. Пептиды глюкагона могут включать дополнительные модификации, которые изменяют его фармацевтические свойства, например увеличение эффективности, увеличение периода полужизни в кровотоке, увеличение срока хранения, уменьшение осаждения или агрегации и/или уменьшение деградации, например уменьшение случаев расщепления или химической модификации во время хранения.
В одном варианте осуществления пептид глюкагона с улучшенной растворимостью может быть получен, например, путем введения одной, двух, трех или более заряженных аминокислот в C-концевую область нативного глюкагона и в одном варианте осуществления в положение, являющееся С-концевым по отношению к положению 27. Такая заряженная аминокислота может быть введена, например, путем замены нативной аминокислоты на заряженную аминокислоту, например, в положениях 28 или 29, или, альтернативно, путем вставки заряженной аминокислоты, например, после положения 27, 28 или 29. В иллюстративных вариантах осуществления одна, две, три или все заряженные аминокислоты являются отрицательно заряженными. В других вариантах осуществления одна, две, три или все заряженные аминокислоты являются положительно заряженными. В определенных иллюстративных вариантах осуществления пептид глюкагона может включать любую одну или две из следующих модификаций: замену N28 на E; замену N28 на D; замену T29 на D; замену T29 на E; вставку E после положения 27, 28 или 29; вставку D после положения 27, 28 или 29. Например, E28E30, D28E30.
Дополнительные модификации могут быть произведены с пептидом глюкагона, которые могут дополнительно увеличивать растворимость и/или стабильность и/или активность глюкагона. Пептид глюкагона может альтернативно включать другие модификации, которые, по существу, не влияют на растворимость или стабильность и которые, по существу, не уменьшают активности глюкагона. В иллюстративных вариантах осуществления пептид глюкагона может включать аминокислотные модификации общим количеством от 1 до 2, до 3, до 4, до 5, до 6, до 7, до 8 до 9 или до 10 аминокислотных модификаций по отношению к последовательности нативного глюкагона.
Типичные модификации включают, но не ограничены ими: консервативные замены, например консервативные замены в одном или более из следующих положений: 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27, 28 или 29;
модификацию, которая может уменьшать деградацию, т.е. модификацию аспарагиновой кислоты в положении 15, например, путем замены на глутаминовую кислоту, гомоглутаминовую кислоту, цистеиновую кислоту или гомоцистеиновую кислоту;
вставку гидрофильного компонента, такого как водорастворимый полимер полиэтиленгликоль, описанный в настоящем документе, например, в положение 16, 17, 20, 21, 24 или 29, которая может увеличивать растворимость и/или период полужизни;
модификацию аминокислоты в положении 27, например, путем замены на метионин, лейцин или норлейцин;
модификации в положении 1 или 2, как описано в настоящем документе;
C-концевые удлинения, как описано в настоящем документе;
гомодимеризацию или гетеродимеризацию, как описано в настоящем документе;
комбинации вышеуказанных модификаций.
Согласно одному варианту осуществления пептид нативного глюкагона с последовательностью SEQ ID NO: 1 модифицируют путем замены нативной аминокислоты в положении 28 и/или 29 на отрицательно заряженную аминокислоту (например, аспарагиновую кислоту или глутаминовую кислоту) и необязательно вставку отрицательно заряженной аминокислоты (например, аспарагиновой или глутаминовой кислоты) к карбоксильному концу пептида. В альтернативном варианте осуществления пептид нативного глюкагона с последовательностью SEQ ID NO: 1 модифицируют путем замены нативной аминокислоты в положении 29 на положительно заряженную аминокислоту (например, лизин, аргинин или гистидин) и необязательно путем присоединения одной или двух положительно заряженных аминокислот (например, лизина, аргинина или гистидина) к карбоксильному концу пептида. Согласно одному варианту осуществления предлагается аналог глюкагона, имеющий улучшенную растворимость и стабильность, где аналог включает аминокислотную последовательность SEQ ID NO: 34 с оговоркой, что, по меньшей мере, одну из аминокислот в положении 28 или 29 заменяют на кислую аминокислоту и/или вставляют дополнительную кислую аминокислоту к карбоксильному концу последовательности SEQ ID NO: 34. В одном варианте осуществления кислые аминокислоты независимо выбраны из группы, состоящей из Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты.
Согласно одному варианту осуществления предлагается агонист глюкагона, имеющий улучшенную растворимость и стабильность, где агонист включает аминокислотную последовательность SEQ ID NO: 33, где, по меньшей мере, одну из аминокислот в положениях 27, 28 или 29 заменяют на отличный от нативного аминокислотный остаток (т.e. по меньшей мере, один аминокислотный остаток, присутствующий в положении 27, 28 или 29 аналога, представляет собой кислую аминокислоту, отличную от аминокислоты, присутствующей в соответствующем положении в последовательности SEQ ID NO: 1). Согласно одному варианту осуществления предлагается агонист глюкагона, включающий последовательность SEQ ID NO: 33 с оговоркой, что когда аминокислота в положении 28 представляет собой аспарагин и аминокислота в положении 29 представляет собой треонин, то пептид дополнительно включает аминокислоты в количестве от одной до двух, независимо выбранные из группы, состоящей из Lys, Arg, His, Asp или Glu, вставленные к карбоксильному концу пептида глюкагона. Было опубликовано, что определенные положения пептида нативного глюкагона могут быть модифицированы при сохранении, по меньшей мере, некоторой части активности родительского пептида. Соответственно, заявители ожидают, что одна или более аминокислот, локализованных в положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27 или 29 пептида с последовательностью SEQ ID NO: 11, могут быть заменены на аминокислоту, отличную от той, что присутствует в пептиде нативного глюкагона, при сохранении повышенной эффективности, стабильности при физиологическом значении pH и биологической активности родительского пептида глюкагона. Например, согласно одному варианту осуществления остаток метионина, присутствующий в положении 27 нативного пептида, заменяют на лейцин или норлейцин для предотвращения окислительной деградации пептида.
В одном варианте осуществления предлагается аналог глюкагона с последовательностью SEQ ID NO: 33, где 1-6 аминокислот, выбранных из аминокислот с положениями 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 в аналоге, отличаются от соответствующей аминокислоты последовательности SEQ ID NO: 1. Согласно другому варианту осуществления предлагается аналог глюкагона с последовательностью SEQ ID NO: 33, где 1-3 аминокислоты, выбранные из аминокислот с положениями 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 в аналоге, отличаются от соответствующей аминокислоты последовательности SEQ ID NO: 1. В другом варианте осуществления предлагается аналог глюкагона с последовательностью SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 34, где 1-2 аминокислоты, выбранных из аминокислот с положениями 1, 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21 или 24 в аналоге, отличаются от соответствующей аминокислоты последовательности SEQ ID NO: 1, и в следующем варианте осуществления эти отличные аминокислоты в количестве от одной до двух характеризуют консервативные аминокислотные замены по отношению к аминокислоте, присутствующей в нативной последовательности (SEQ ID NO: 1). В одном варианте осуществления предлагается пептид глюкагона с последовательностью SEQ ID NO: 11 или SEQ ID NO: 13, где пептид глюкагона дополнительно включает одну, две или три аминокислотных замен в положениях, выбранных из положений 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 21, 24, 27 или 29. В одном варианте осуществления замены в положениях 2, 5, 7, 10, 11, 12, 13, 14, 16, 17, 18, 19, 20, 27 или 29 являются консервативными аминокислотными заменами.
В одном варианте осуществления предлагается агонист глюкагона, включающий пептид аналога последовательности SEQ ID NO: 1, где аналог отличается от последовательности SEQ ID NO: 1 наличием аминокислоты, отличной от серина, в положении 2 и наличием кислой аминокислоты, заменяющей нативную аминокислоту в положении 28 или 29, или наличием кислой аминокислоты, вставленной к карбоксильному концу пептида с последовательностью SEQ ID NO: 1. В одном варианте осуществления кислая аминокислота представляет собой аспарагиновую кислоту или глутаминовую кислоту. В одном варианте осуществления предлагается аналог глюкагона последовательности SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 13 или SEQ ID NO: 32, где аналог отличается от родительской молекулы заменой в положении 2. Более конкретно, аминокислоту в положении 2 заменяют на аминокислоту, выбранную из группы, состоящей из d-серина, аланина, глицина, n-метилсерина и аминоизомасляной кислоты.
В другом варианте осуществления предлагается агонист глюкагона, включающий пептид аналога последовательности SEQ ID NO: 1, где аналог отличается от последовательности SEQ ID NO: 1 наличием аминокислоты, отличной от гистидина, в положении 1 и наличием кислой аминокислоты, заменяющей нативную аминокислоту в положении 28 или 29, или наличием кислой аминокислоты, вставленной к карбоксильному концу пептида с последовательностью SEQ ID NO: 1. В одном в