Cpg-олигонуклеотидные аналоги, содержащие гидрофобные т-аналоги с усиленной иммуностимулирующей активностью
Иллюстрации
Показать всеИзобретение относится к иммуностимулирующим олигонуклеотидам. Предложен олигонуклеотид длиной 6-100 нуклеотидов, содержащий по меньшей мере одну последовательность 5'R1YZR23'. R1 и R2 выбирают из группы, состоящей из липофильного замещенного нуклеотидного аналога (L) и нуклеотида. R2 может отсутствовать, так что 5'R1YZR23' представляет собой R1YZ. По меньшей мере, один из R1 и R2 представляет собой липофильный замещенный нуклеотидный аналог (L). L выбирают из 5-хлор-урацила, 5-бром-урацила или 5-йод-урацила, 5-этил-урацила или (Е)-5-(2-бромвинил)-урацила. Y представляет собой цитозин или 5-метилцитозин. Z выбирают из группы, состоящей из гуанина, 6-тиогуанина, 2'O-метилгуанина, 7-деазагуанина и инозина. Олигонуклеотид не является 5'd[GCGAA(BrU)(BrU)CGC]3', где BrU представляет собой 5-бромурацил. Предложены варианты олигонуклеотида, а также способ индуцирования иммунного ответа на основе нуклеотидов. Описаны варианты применения олигонуклеотидов для получения лекарственного средства для лечения рака или вирусной инфекции. Олигонуклеотиды обладают высокой иммуностимулирующей активностью, что может найти применение в медицине. 8 н. и 7 з.п. ф-лы, 8 табл., 31 ил., 8 пр.
Реферат
Область изобретения
Настоящее изобретение относится в целом к области иммунологии. Более конкретно, изобретение относится к терапевтическим олигонуклеотидам с усиленной иммуностимулирующей способностью.
Предшествующий уровень техники
Бактериальная ДНК обладает иммуностимулирующими эффектами для активации В-клеток и клеток естественных киллеров в отличие от ДНК позвоночных животных (Tokunaga, Т., et al., 1988. Jpn. J. Cancer Res. 79:682-686; Tokunaga, Т., et al., 1984, JNCl 72:955-962; Messina, J.P., et al., 1991, J. Immunol. 147:1759-1764; и обзор в Krieg, 1998, В: Applied Onnronucleotide Technology, C.A. Stein and A.M. Krieg, (Eds.), John Wiley and Sons, Inc., New York, NY, pp.431-448). В настоящее время понятно, что эти иммуностимулирующие эффекты бактериальной ДНК являются результатом присутствия неметилированных CpG-динуклеотидов, в частности основных контекстов (CpG-мотивы), которые являются обычными для бактериальной ДНК, но метилированными и недостаточно представленными в ДНК позвоночных животных (Krieg et al., 1995 Nature 374:546-549; Krieg, 1999 Biochim. Biophys. Acta 93321:1-10). Иммуностимулирующие эффекты бактериальной ДНК могут быть имитированы синтетическими олигодезоксинуклеотидами (ODN), содержащими эти CpG-мотивы. Такие CpG-ODN обладают высокостимулирующими эффектами в отношении человеческих и мышиных лейкоцитов, включая пролиферацию В-клеток; секрецию цитокинов и иммуноглобулинов; литическую активность клеток естественных киллеров (NK) и секрецию IFN-γ (гамма-интерферона); и активацию дендритных клеток (DC) и других антигенпрезентирующих клеток для экспрессии костимулирующих молекул и секреции цитокинов, в особенности Th1-подобных цитокинов, которые важны для активирования развития Th1-подобных ответов Т-клеток. Эти иммуностимулирующие эффекты нативного фосфодиэфирного каркаса CpG-ODN являются в высокой степени CpG-специфическими в том, что эффекты значительно уменьшаются, если CpG-мотив метилирован, изменен на GpC или иным образом удален или изменен (Krieg et al., 1995 Nature 374:546-549; Hartmann et al., 1999 Proc. Natl. Acad. Sci USA 96:9305-10).
В ранних исследованиях полагали, что иммуностимулирующий CpG-мотив соответствует формуле пурин-пурин-СрG-пиримидин-пиримидин (Krieg et al., 1995 Nature 374:546-549; Pisetsky, 1996 J. Immunol. 156:421-423; Hacker et al., 1998 EMBO J. 17:6230-6240; Lipford et al., 1998 Trends in Microbiol. 6:496-500). Тем не менее, в настоящее время ясно, что мышиные лимфоциты достаточно хорошо реагируют на фосфодиэфирные CpG-мотивы, которые не соответствуют этой "формуле" (Yi et al., 1998 J. Immunol. 160:5898-5906), и то же самое справедливо для человеческих В-клеток и дендритных клеток (Hartmann et al., 1999 Proc. Natl. Acad. Sci USA 96:9305-10; Liang, 1996 J. Clin. Invest. 98:1119-1129).
Недавно было описано несколько различных классов CpG-нуклеиновых кислот. Один из классов обладает потенциалом в отношении активации В-клеток, но относительно малоэффективен в отношении индукции активации IFN-α и NK-клеток; этот класс назван В-классом. В-класс CpG-нуклеиновых кислот, как правило, полностью стабилизирован и включает неметилированный CpG-динуклеотид в некоторых предпочтительных основных контекстах. См., например, патенты США №№6194388; 6207646; 6214806; 6218371; 6239116 и 6339068. Другой класс CpG-нуклеиновых кислот активирует В-клетки и NK-клетки и индуцирует IFN-α; этот класс назван С-классом. С-класс CpG-нуклеиновых кислот, охарактеризованный первым, как правило, полностью стабилизированный, включает последовательность типа В-класса и GC-богатый палиндром или близкий к палиндрому. Этот класс описан в находящейся на одновременном рассмотрении предварительной заявке на патент США 60/313273, поданной 17 августа 2001 года, и 10/224523, поданной 19 августа 2002 года, и родственной РСТ-заявке PCT/US02/26468, опубликованной под номером международной публикации WO 03/015711.
Краткое изложение сущности изобретения
Изобретение относится к олигонуклеотиду, включающему одну или более чем одну модификацию, который вызывает усиленную иммуностимулирующую способность. В частности, изобретение основано на обнаружении того, что специфические подклассы олигонуклеотидов, имеющие по меньшей мере один липофильный замещенный нуклеотидный аналог, высокоэффективны в опосредовании иммунного ответа. Эти олигонуклеотиды полезны терапевтически и профилактически для индукции иммунного ответа и для лечения заболеваний и расстройств, таких как рак и вирусные инфекции.
В одном из аспектов изобретение представляет собой композицию, содержащую последовательность: R1YZR2, где R1 и R2 представляют собой липофильный замещенный нуклеотидный аналог (L), нуклеотид и связь, где по меньшей мере один из R1 и R2 представляет собой липофильный замещенный нуклеотидный аналог (L), где Y представляет собой пиримидиновый нуклеотид, и где Z представляет собой пурин, пиримидин или остаток, лишенный азотистого основания.
В некоторых воплощениях L содержит 5- или 6-членный кольцевой аналог нуклеинового основания.
В других воплощениях этого аспекта изобретения L представляет собой группу формулы I
имеющую следующие элементы: А, В, X, D, Е и F представляют собой С (углерод) или N (азот), возможно несущие водород или заместитель; n равен 0 или 1; пунктирные линии указывают на возможные двойные связи; где по меньшей мере один заместитель не выбран из группы, состоящей из оксо, тио, гидрокси, меркапто, имино, амино, метила и водорода, и где в совокупности атомы А, В, X, D, Е и F составляют не более 3 атомов азота (N). В некоторых случаях n равен 1, а в других случаях n равен 0. В некоторых воплощениях все атомы А, В, X, D, Е, F представляют собой углерод (С). В некоторых воплощениях один, два или три атома А, В, X, D, Е, F представляют собой азот (N). В соответствии с некоторыми воплощениями по меньшей мере один из атомов А, В, X, D, Е, F замещен одним из следующих: F, Cl, Br, I, алкил, алкенил, алкинил, галогенированный алкил, галогенированный алкенил, циклоалкил, O-алкил, O-алкенил, -NH-алкил, -N(алкил)2; -S-алкил, -SO-алкил, -SO2-алкил, нитро, циано, карбоксиэфир, фенил, тиофенил, бензил, оксо, тио, гидрокси, меркапто и имино, где по меньшей мере один заместитель не представляет собой оксо, тио, гидрокси, меркапто, имино, амино или метил. В соответствии с другими воплощениями один из двух атомов А или Е замещен одним из следующих: F, Cl, Br, I, С2-С6-алкил, алкенил, алкинил, галогенированный алкил, галогенированный алкенил, циклоалкил, O-алкил, O-алкенил, -NH-алкил, -N(алкил)2; -S-алкил, -SO-алкил, -SO2-алкил, нитро, циано, карбоксиэфир, фенил, тиофенил, бензил или метил, при условии, что если метил, то А, В, X, D, Е и F все представляют собой С.
В некоторых воплощениях формула 1 содержит замещенный пиримидин, урацил, толуол, имидазол или пиразол либо триазол. В соответствии с другими воплощениями формула 1 выбрана из следующих: 5-хлор-урацил, 5-бром-урацил, 5-йод-урацил, 5-этил-урацил, 5-пропил-урацил, 5-пропинил-урацил, (Е)-5-(2-бромвинил)-урацил и 2,4-дифтор-толуол. В соответствии с одним из воплощений изобретения формула 1 конденсирована с 3-6-членной ароматической или алифатической кольцевой системой. В соответствии с другими воплощениями формула 1 связана с 5-6-членной группировкой сахара, включающей пентозу или гексозу. В некоторых случаях пентоза представляет собой фуранозу, а гексоза представляет собой пиранозу, которые возможно могут быть замещены группами F, амино, алкокси, алкокси-этокси, амонипропил, алкенил, алкинил или O2,С4-алкиленовым мостиком. В других случаях фураноза представляет собой рибозу или дезоксирибозу.
В соответствии с некоторыми воплощениями изобретения оба из R1 и R2 представляют собой L. В некоторых воплощениях R1 представляет собой L, и R2 представляет собой нуклеотид. Альтернативно, в некоторых случаях R1 представляет собой L, и R2 представляет собой связь, так что олигонуклеотид содержит структуру 5'-R1CG-3'. Другие воплощения включают олигонуклеотид, где R1 представляет собой L, и R2 представляет собой связь, и где R3 расположен с 5'-конца относительно R1YZ, так что олигонуклеотид содержит структуру 5'-R3R1YZ-3'. В некоторых воплощениях R1 представляет собой L, и R2 представляет собой связь, и где второй R1 расположен с 5'-конца относительно R1YZ, разделенный одним нуклеотидом N, так что олигонуклеотид содержит структуру 5'-R1NR1YZ-3'. В некоторых случаях олигонуклеотид может включать два мотива 5'-R1NR1YZ-3'.
В соответствии с некоторыми воплощениями олигонуклеотид включает Y, представляющий собой один из следующих пиримидинов: цитозин, 5-метил-цитозин, 5-гидрокси-цитозин, 5-гидроксиметил-цитозин, 5-галогено-цитозин, 2-тио-цитозин, 4-тио-цитозин, N3-метил-цитозин, N4-алкил-цитозин или 6-замещенный цитозин.
В соответствии с некоторыми воплощениями олигонуклеотид включает Z, представляющий собой пуриновый нуклеотид, включающий: гуанин, 7-деаза-гуанин, гипоксантин, 7-деаза-гипоксантин, 2-амино-пурин, 4-тио-пурин, 2,6-диамино-пурин, 8-оксо-7,8-дигидрогуанин, 7-тиа-8-оксо-7,8-дигидрогуанин, 7-аллил-8-оксо-7,8-дигидрогуанин, 7-деаза-8-аза-гуанин, 8-аза-гуанин, N1-метил-гуанин или пурин. В других воплощениях Z представляет собой пиримидиновый нуклеотид, включающий Т.
В соответствии с некоторыми воплощениями изобретения R2 представляет собой L, и R1 представляет собой нуклеотид.
В соответствии с некоторыми воплощениями олигонуклеотид имеет длину 3-100 нуклеотидов; например, олигонуклеотид имеет длину 3-6 нуклеотидов, 3-100 нуклеотидов или 7-100 нуклеотидов. В некоторых случаях олигонуклеотид является Т-обогащенным, так что по меньшей мере 80% нуклеотидов представляют собой Т.
Изобретение включает воплощения, содержащие по меньшей мере одну палиндромную последовательность. Например, в некоторых случаях олигонуклеотид включает две палиндромные последовательности.
В соответствии с изобретением некоторые воплощения включают 1-4 неметилированных CG-динуклеотида. В некоторых воплощениях олигонуклеотид может включать по меньшей мере одну (G)m последовательность, где m равен 4-10. В некоторых случаях CG-динуклеотиды от по меньшей мере одного вплоть до всех являются неметилированными. В соответствии с некоторыми воплощениями олигонуклеотид дополнительно может содержать ненуклеотидную модификацию. Ненуклеотидные модификации включают: С6-С48-полиэтиленгликоль, С3-C20-алкан-диол, С3-C18-алкиламиновый линкер, С3-С18-алкилтиольный линкер, холестерин, желчную кислоту, насыщенную или ненасыщенную жирную кислоту, фолат, гексадецил-глицериновую или дигексадецил-глицериновую группу, октадецил-глицериновую или диоктадецил-глицериновую группу, группу витамина Е, но не ограничены ими. В других воплощениях олигонуклеотид по изобретению дополнительно содержит ненуклеотидную разветвляющую группировку или нуклеотидную разветвляющую группировку. В некоторых воплощениях олигонуклеотид включает разветвляющую группировку, где олигонуклеотиды имеют по меньшей мере два 5'-конца.
В соответствии с изобретением некоторые воплощения включают по меньшей мере два нуклеотида данного олигонуклеотида, имеющие стабилизированную связь, включающие: фосфоротиоат, фосфородитиоат, метилфосфонат, метилфосфонотиоат боранофосфонат, фосфорамидат или дефосфосвязь, либо в виде энантиомерной смеси, либо в виде энантиомерно чистой S- или R-конфигурации.
В некоторых воплощениях YZ в R1YZR2 имеет фосфодиэфирную связь или фосфоротиоатную связь. В некоторых случаях R1Y и/или ZR2 в R1YZR2 имеет фосфоротиоатную связь. В некоторых воплощениях все другие нуклеотиды имеют фосфоротиоатную связь.
В соответствии с некоторыми воплощениями изобретения олигонуклеотид не содержит микроносителя, включая липидный носитель.
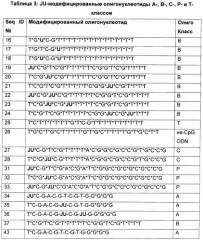
В соответствии с изобретением олигонуклеотиды могут представлять собой олигонуклеотид А-класса, олигонуклеотид В-класса, олигонуклеотид С-класса, олигонуклеотид Р-класса или олигонуклеотид Т-класса. Для олигонуклеотида В-класса по изобретению некоторые воплощения включают последовательность 5'-TCN1TX1X2CGX3X4-3', где X1 представляет собой G или А; Х2 представляет собой Т, G или А; Х3 представляет собой Т или С, и Х4 представляет собой Т или С; и N представляет собой любой нуклеотид, и N1 и N2 представляют собой последовательности нуклеиновых кислот приблизительно по 0-25 нуклеотидов каждая.
В соответствии с некоторыми воплощениями изобретения олигонуклеотид содержит по меньшей мере одну 3'-3' связь и/или по меньшей мере одну 5'-5' связь.
В еще одном аспекте изобретение представляет собой композицию олигонуклеотидов, описанных здесь в комбинации с антигеном или другим терапевтическим соединением, таким как противомикробный агент. Противомикробный агент может представлять собой, например, противовирусный агент, противопаразитарный агент, бактерицидный агент или противогрибковый агент.
В соответствии с еще одним аспектом изобретения предложена композиция в виде средства длительного высвобождения, включающая описанные здесь олигонуклеотиды.
Композиция может включать фармацевтический носитель и/или может быть приготовлена в виде средства для доставки. В некоторых воплощениях средство для доставки выбрано из группы, состоящей из катионных липидов, белков, проникающих в клетки, и средств длительного высвобождения. В одном из воплощений средство длительного высвобождения представляет собой биоразрушаемый полимер или микрочастицу.
В соответствии с еще одним аспектом изобретения предложен способ стимуляции иммунного ответа. Способ включает введение субъекту олигонуклеотида в количестве, эффективном для индукции у данного субъекта иммунного ответа. Предпочтительно, олигонуклеотид вводят перорально, местно, в виде средства длительного высвобождения, через слизистую оболочку, системно, парентерально или внутримышечно. Когда олигонуклеотид вводят через поверхность слизистых оболочек, он может быть доставлен в количестве, эффективном для индукции иммунного ответа слизистых оболочек или системного иммунного ответа. В предпочтительных воплощениях поверхность слизистых оболочек выбрана из группы, состоящей из поверхности ротовой полости, назальной, ректальной, вагинальной и глазной поверхности.
В некоторых воплощениях способ включает воздействие на субъекта антигена, где иммунный ответ представляет собой антигенспецифический иммунный ответ. В некоторых воплощениях антиген выбран из группы, состоящей из опухолевого антигена, вирусного антигена, бактериального антигена, паразитарного антигена и пептидного антигена.
Олигонуклеотиды полезны для лечения рака у субъекта, страдающего раком, или у субъекта, имеющего риск развития рака (например, снижение риска развития рака). Рак может быть выбран из группы, состоящей из рака желчных путей, рака молочной железы, рака шейки матки, хориокарциномы, рака толстой кишки, рака эндометрия, рака желудка, внутриэпителиальных новообразований, лимфом, рака печени, рака легкого (например, мелкоклеточного и немелкоклеточного), меланомы, нейробластом, рака ротовой полости, рака яичников, рака поджелудочной железы, рака предстательной железы, рака прямой кишки, сарком, рака щитовидной железы и рака почки, а также других карцином и сарком. В некоторых важных воплощениях рак выбран из группы, состоящей из рака кости, головного мозга и рака ЦНС (центральной нервной системы), рака соединительной ткани, рака пищевода, рака глаза, ходжкинской лимфомы, рака гортани, рака ротовой полости, рака кожи и рака семенников.
Олигонуклеотиды также могут быть использованы для повышения чувствительности раковой клетки к терапии рака (например, противоопухолевой терапии), возможно когда иммуностимулирующий CpG-олигонуклеотид вводят в комбинации с противоопухолевой терапией. Противоопухолевая терапия может представлять собой химиотерапию, вакцину (например, вакцину примированных in vitro дендритных клеток или вакцину на основе ракового антигена) или терапию на основе антитела. Последняя терапия также может включать введение антитела, специфичного в отношении антигена клеточной поверхности, например, раковой клетки, где иммунный ответ приводит в результате к антителозависимой клеточно-опосредованной цитотоксичности (ADCC). В одном из воплощений антитело может быть выбрано из группы, состоящей из рибутаксина, герцептина, квадрамета, панорекса, IDEC-Y2B8, ВЕС2, С225, онколима, SMART M195, ATRAGEN, оварекса, бексара, LDP-03, иора t6, MDX-210, MDX-11, MDX-22, OV103, 3622W94, антител против VEGF (фактора роста эндотелия сосудов), зенапакса, MDX-220, MDX-447, MELIMMUNE-2, MELIMMUNE-1, CEACIDE, претаргета, NovoMAb-G2, TNT, глиомаба-Н, GNI-250, EMD-72000, ЛимфоЦида, СМА 676, монофарма-С, 4 В5, иора egf.r3, иора с5, BABS, антител против FLK-2, MDX-260, ANA Ab, SMART 1D10Ab, SMART ABL 364 Ab и ImmuRAIT-CEA.
Таким образом, в соответствии с некоторыми аспектами по изобретению, субъекту, страдающему раком или имеющему риск развития рака, вводят олигонуклеотид и противоопухолевую терапию. В некоторых воплощениях противоопухолевая терапия выбрана из группы, состоящей из химиотерапевтического агента, иммунотерапевтического агента и противораковой вакцины.
Изобретение в других аспектах относится к способам предотвращения заболевания у субъекта. Способ включает введение субъекту олигонуклеотида на систематической основе, для того чтобы способствовать увеличению реактивности иммунной системы для предотвращения заболевания у субъекта. Примеры заболеваний или состояний, которые предполагается предотвращать с использованием профилактических способов по изобретению, включают микробные инфекции (например, заболевания, передаваемые половым путем) и анафилактический шок в результате пищевых аллергий.
В других аспектах изобретение представляет собой способ индукции врожденного иммунного ответа путем введения субъекту олигонуклеотида в количестве, эффективном для активации врожденного иммунного ответа.
В соответствии с еще одним аспектом изобретения предложен способ лечения вирусной или ретровирусной инфекции. Способ включает введение субъекту, страдающему вирусной или ретровирусной инфекцией или имеющему риск ее возникновения, количества любой из композиций по изобретению, эффективного для лечения вирусной или ретровирусной инфекции. В некоторых воплощениях вирусная инфекция вызвана вирусом гепатита, например гепатита В, гепатита С, вирусом иммунодефицита человека (HIV), вирусом герпеса или вирусом папилломы.
В соответствии с еще одним аспектом изобретения предложен способ лечения бактериальной инфекции. Способ включает введение субъекту, страдающему бактериальной инфекцией или имеющему риск ее возникновения, количества любой из композиций по изобретению, эффективного для лечения бактериальной инфекции. В одном из воплощений причиной бактериальной инфекции являются внутриклеточные бактерии.
В еще одном аспекте изобретение представляет собой способ лечения паразитарной инфекции путем введения субъекту, страдающему паразитарной инфекцией или имеющему риск ее возникновения, количества любой из композиций по изобретению, эффективного для лечения паразитарной инфекции. В одном из воплощений причиной паразитарной инфекции является внутриклеточный паразит. В еще одном воплощении причиной паразитарной инфекции является негельминтный паразит.
В некоторых воплощениях субъект представляет собой человека, а в других воплощениях субъект представляет собой позвоночное животное, отличное от человека, выбранное из группы, состоящей из собаки, кошки, лошади, коровы, свиньи, индейки, козы, рыбы, обезьяны, цыпленка, крысы, мыши и овцы.
В еще одном аспекте изобретение относится к способу лечения аутоиммунного заболевания путем введения субъекту, страдающему аутоиммунным заболеванием или имеющему риск его возникновения, количества любой из композиций по изобретению, эффективного для лечения или предотвращения аутоиммунного заболевания.
Изобретение в некоторых аспектах представляет собой способ лечения ремоделирования дыхательных путей, астмы или аллергии, включающий введение субъекту любой из композиций по изобретению в эффективном количестве для лечения ремоделирующей дыхательные пути астмы или аллергии у субъекта. В одном из воплощений субъект страдает астмой, хроническим обструктивным заболеванием легких, или является курильщиком. В других воплощениях субъект не страдает симптомами астмы.
Применение олигонуклеотида по изобретению для стимуляции иммунного ответа также предложено в качестве одного из аспектов изобретения.
Также предложен способ изготовления лекарственного средства на основе олигонуклеотида по изобретению для стимуляции иммунного ответа.
Каждый из признаков настоящего изобретения может охватывать различные воплощения изобретения. Таким образом, подразумевают, что каждый из признаков изобретения, в который включен любой элемент или комбинация элементов, может быть включен в каждый аспект изобретения. Изобретение не ограничивается в настоящей заявке подробным описанием создания и распределения компонентов, указанных в представленном ниже описании или проиллюстрированном в графических материалах. Изобретение допускает другие воплощения и может применяться на практике или осуществлено различными путями. Кроме того, используемая здесь фразеология и терминология предназначена только для целей описания, и ее не следует рассматривать как ограничивающую. Подразумевают, что применение терминов "включающий", "содержащий" или "имеющий", "охватывающий", "вовлекающий" и их вариантов включает элементы, перечисленные далее, и их эквиваленты, а также дополнительные элементы.
Краткое описание графических материалов
Фиг.1 представляет собой два изображения, иллюстрирующие структуру модифицированных оснований по изобретению. Фиг.1а демонстрирует участок CpG-гексамерного мотива (GTCGTT). Фиг.1b демонстрирует включенные аналоги гидрофобной формы 2'-дезокситимидина: 2,4-дифтортолуол (FF), 5-бромуридин (BU) и 5-йодуридин (JU).
Фиг.2 представляет собой график, демонстрирующий результаты люциферазного анализа с В-классом олигонуклеотидов (ODN), модифицированных аналогом тиминовой формы 2,4-дифтортолуола (FF). Активность FF-модифицированных ODN (SEQ ID NO:3-9) сравнивали с активностью немодифицированной родительской последовательности В-класса (SEQ ID NO:1), полностью PS родительской последовательности (SEQ ID NO:2) и третьего немодифицированного ODN В-класса (SEQ ID NO:37). Клетки hTLR9-LUC-293 стимулировали указанными количествами ODN и стимуляцию NF-κВ определяли путем измерения люциферазной активности через 16 ч. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.3 представляет собой график, демонстрирующий результаты люциферазного анализа с модифицированным ODN В-класса. Тимидин (Т) замещен на 5-бром-2'-дезоксиуридин (BU) (SEQ ID NO:10-12) и 5-йод-2'-дезоксиуридин (JU) (SEQ ID NO:13-15). Их активность сравнивали с активностью немодифицированной родительской последовательности В-класса (SEQ ID NO:1), полностью PS родительской последовательности (SEQ ID NO:2), и третьего немодифицированного ODN В-класса (SEQ ID NO:37). Клетки hTLR9-LUC-293 стимулировали указанными количествами ODN и стимуляцию NF-κВ определяли путем измерения люциферазной активности через 16 ч. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.4 представляет собой график, демонстрирующий результаты люциферазного анализа с модифицированным ODN В-класса. 2'-Дезокситимидин (Т) замещен 2'-дезоксиуридином (U) (SEQ ID NO:16-18). Активность U-модифицированного ODN сравнивали с активностью немодифицированной родительской последовательности В-класса (SEQ ID NO:1), полностью PS родительской последовательности (SEQ ID NO:2) и третьего немодифицированного ODN В-класса (SEQ ID NO:37). Клетки hTLR9-LUC-293 стимулировали указанными количествами ODN и стимуляция NF-κВ определяли путем измерения люциферазной активности через 16 ч. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.5 представляет собой два графика, демонстрирующие результаты люциферазного анализа и анализа РВМС (мононуклеарных клеток периферической крови) с модифицированным ODN В-класса. Относительную активность ODN с 5-этил-2'-дезоксиуридином (EU) (SEQ ID NO:42), 2'-дезоксиуридином (U) (SEQ ID NO:16), 5-йод-2'-дезоксиуридином (JU) (SEQ ID NO:13), 5-бром-2'-дезоксиуридином (BU) (SEQ ID NO:10) и 5-хлор-2'-дезоксиуридином (CU) (SEQ ID NO:41) сравнивали с активностью родительской последовательности (SEQ ID NO:1). Фиг.5а демонстрирует активность TLR9, а Фиг.5b демонстрирует продукцию IFN-альфа. Показано среднее значение +/- СО (стандартное отклонение) для трех доноров. Оси х представляют собой концентрацию ODN в мкМ, а оси у представляют собой относительный индекс стимуляции (Фиг.5а) или концентрацию IFN-альфа в пг/мл (Фиг.5b).
Фиг.6 представляет собой график, демонстрирующий результаты люциферазного анализа с EU-модифицированным ODN. Активность EU-модифицированного ODN SEQ ID NO:29, 30 и 42 сравнивали с активностью родительской последовательности (SEQ ID NO:1) и другого немодифицированного ODN В-класса (SEQ ID NO:37). Ось x представляет собой концентрацию ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.7 представляет собой график, демонстрирующий результаты люциферазного анализа модифицированным ODN В-класса. Активность JU-модифицированных SEQ ID NO:19-24 сравнивали с активностью родительской последовательности SEQ ID NO:37. Ось x представляет собой концентрацию ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.8 представляет собой два графика, демонстрирующие результаты люциферазного анализа и анализа РВМС с модифицированным ODN А-класса. Активность JU-модифицированных SEQ ID NO:35-37 сравнивали с активностью немодифицированной родительский последовательности (SEQ ID NO:43) и немодифицированного ODN SEQ ID NO:1 В-класса. Фиг.8а демонстрирует активность TLR9, а Фиг.8b демонстрирует продукцию IFN-альфа. Показано среднее значение +/- СО для трех доноров. Оси x представляют собой log концентрации ODN (Фиг.8а) или концентрацию ODN (Фиг.8b) в мкМ, а оси у представляют собой относительный индекс стимуляции (Фиг.8а) или концентрацию IFN-альфа в пг/мл (Фиг.8b).
Фиг.9 представляет собой график, демонстрирующий результаты люциферазного анализа с модифицированным ODN С-класса. Активность JU-модифицированных ODN С-класса SEQ ID NO:27-28 и 44-45 сравнивали с активностью немодифицированной родительской последовательности SEQ ID NO:45 и немодифицированного ODN В-класса (SEQ ID NO:37). Ось x представляет собой концентрацию ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.10 представляет собой график, демонстрирующий результаты люциферазного анализа с модифицированным ODN Р-класса. Активность JU-модифицированных SEQ ID NO:31-33 сравнивали с активностью немодифицированной родительской последовательности (SEQ ID NO:52). Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.11 представляет собой график, демонстрирующий результаты люциферазного анализа с модифицированным ODN Т-класса. Активность JU-модифицированных SEQ ID NO:47-50 и U-модифицированной SEQ ID NO:51 сравнивали с активностью немодифицированной родительской последовательности SEQ ID NO:25. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.12 представляет собой график, демонстрирующий результаты люциферазного анализа с коротким ODN. Активность JU-модифицированного короткого ODN SEQ ID NO:39-40 сравнивали с активностью немодифицированной родительской последовательности SEQ ID NO:38 и с ODN SEQ ID NO:37 В-класса. ODN получали с и без DOTAP (1,2-диолеоил-3-триметиламмонийпропан). Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.13 представляет собой четыре графика, демонстрирующие результаты ИФА (твердофазного иммуноферментного анализа), измеряющего концентрацию цитокина в супернатантах культуры спленоцитов, где спленоциты мышей BALB/c культивировали с различными ODN. Супернатанты культуры собирали на момент времени 6 часов (для TNF-альфа) или 24 часа (для IL-6, IL-10 и IL-12). Сравнивали активности JU-модифицированного ODN В-класса (SEQ ID NO:13), немодифицированного ODN В-класса (SEQ ID NO:37) и не-CpG ODN в качестве отрицательного контроля (SEQ ID NO:26). Фиг.13a-d демонстрируют концентрацию TNF-альфа, IL-6, IL-10 и IL-12, соответственно. Оси х представляют собой концентрацию ODN в мкг/мл, а оси у представляют собой концентрацию цитокина в пг/мл.
Фиг.14 представляет собой график, демонстрирующий результаты анализа FACS (клеточный сортер с активацией флуоресценции) пролиферации В-клеток. Окрашенные CFSE (карбоксифлуоресцеинсукцинимидильный эфир) спленоциты мыши BALB/c (4×105/лунку) инкубировали с 0,001, 0,01, 0,1, 0,3, 1, 3 или 10 мкг/мл ODN. Через 72 часа после инкубации клетки окрашивали в отношении CD19 и пролиферацию В-клеток определяли при помощи FACS с последующим анализом с использованием программного обеспечения ModFit. Сравнивали активности JU-модифицированного ODN В-класса (SEQ ID NO:13), немодифицированного ODN В-класса (SEQ ID NO:37) и не-CpG ODN в качестве отрицательного контроля (SEQ ID NO:26). Ось x представляет собой концентрацию ODN в мкг/мл, а ось у представляет собой относительную пролиферацию В-клеток.
Фиг.15 представляет собой два графика, демонстрирующие продукцию цитокина in vivo, измеренную посредством ИФА. Мышам BALB/c (5 на группу) подкожно инъецировали 10, 50 или 100 мкг ODN. Контрольная группа получала 100 мкл только PBS. У животных отбирали кровь при помощи сердечной пункции через 1 час (для TNF-альфа) или 3 часа (для IP-10) после инъекции и образцы плазмы крови анализировали в отношении TNF-альфа и IP-10 при помощи ИФА. Сравнивали активности JU-модифицированного ODN В-класса (SEQ ID NO:13) и немодифицированного ODN В-класса (SEQ ID NO:37). Фиг.15а демонстрирует концентрацию TNF-альфа, а Фиг.15b демонстрирует концентрацию IP-10. Оси х представляют собой дозу ODN в мкг, а оси у представляют собой концентрацию цитокина в пг/мл.
Фиг.16 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ ODN В-класса с универсальным основанием (6-нитробензимидазолом) (SEQ ID NO:178) вместо тимидина в родительской последовательности (SEQ ID NO:1). Клетки hTLR9-LUC-293 инкубировали указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.17 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ ODN В-класса с 5-(2-бромвинил)-уридином (SEQ ID NO:153 и 154) вместо тимина в родительской последовательности (SEQ ID NO:1). Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.18 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ ODN В-класса с модификацией сахара (2'-O-метилгуанозин) в дополнение к липофильному замещенному нуклеотидному аналогу (SEQ ID NO:111-113). Активность этих ODN сравнивали с активностью родительской последовательности (SEQ ID NO:1) и той же самой последовательности только с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:13). Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.19 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ разветвленным ODN В-класса со множественными 5' доступными концами. Активность разветвленного ODN (SEQ ID NO:96, 97, 101 и 102) сравнивали с активностью SEQ ID NO:1. Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.20 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ коротким немодифицированным ODN В-класса (SEQ ID NO:38) и ODN той же самой последовательности с липофильным замещенным нуклеотидным аналогом и липофильным 3' tag (SEQ ID NO:126). Оба получали с и без DOTAP. Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.21 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ двумя ODN В-класса с 5-проинил-dU (SEQ ID NO:116 и 117) вместо тимина родительской последовательности (SEQ ID NO:1). Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.22 представляет собой график, демонстрирующий hTLR9-опосредованную активацию NF-κВ ODN В-класса со вторым нуклеотидным аналогом в дополнение к липофильному замещенному нуклеотидному аналогу (SEQ ID NO:138, 7-деаза-dG; SEQ ID NO:139, инозин; SEQ ID NO:140, 5-метил-dC). Активность этих ODN сравнивали с активностью родительской последовательности (SEQ ID NO:1) и той же самой последовательностью только с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:13). Клетки DTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.23 представляет собой график, демонстрирующий hTLR9-опосредованную активацию NF-κВ ODN Т-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:132-134). Их активность сравнивали с активностью иммуностимулирующего ODN С-класса (SEQ ID NO:198), Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.24 представляет собой два графика, демонстрирующие DTLR9-опосредованную активацию NF-κВ ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:58-63). Фиг.24а демонстрирует активность SEQ ID NO:58-61 по сравнению с В-классом в качестве положительного контроля (SEQ ID NO:55) и немодифицированным ODN Р-класса (SEQ ID NO:56). Фиг.24b демонстрирует активность SEQ ID NO:62-63 по сравнению с активностью того же самого положительного и отрицательного контролей. Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.25 представляет собой график, демонстрирующий DTLR9-опосредованную активацию NF-κВ ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:64, 66-67). Их активность сравнивали с активностью В-класса в качестве положительного контроля (SEQ ID NO:55), ODN С-класса (SEQ ID NO:68) и немодифицированного ODN Р-класса (SEQ ID NO:57). Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.26 представляет собой два графика, демонстрирующие индукцию IFN-α ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:58-63). Фиг.26а демонстрирует активность SEQ ID NO:58-61 по сравнению с активностью В-класса в качестве положительного контроля (SEQ ID NO:55) и немодифицированного ODN Р-класса (SEQ ID NO:56). Фиг.26b демонстрирует активность SEQ ID NO:62-63 по сравнению с активностью того же самого положительного и отрицательного контролей. Человеческие РВМС инкубировали с указанными ODN в течение 48 часов. IFN-α затем определяли в супернатантах культуры клеток посредством ИФА. Оси х представляют собой концентрацию ODN в мкМ, а оси у представляют собой концентрацию IFN-α в пг/мл.
Фиг.27 представляет собой график, демонстрирующий индукцию IFN-α ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:64, 66-67). Их активность сравнивали с активностью В-класса в качестве положительного контроля (SEQ ID NO:55), ODN C-класса (SEQ ID NO:68) и немодифициров