Улучшение титра полипептида фактора viii в клеточных культурах
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к продукции терапевтически активных полипептидов с использованием клеток млекопитающих, и может быть использовано для продуцирования полипептида фактора VIII. Способ продуцирования полипептида фактора VIII предусматривает культивирование клеток млекопитающих, экспрессирующих полипептид фактор VIII, в условиях, подходящих для экспрессии указанного полипептида фактора VIII, которые включают клеточную культуральную среду с О-фосфо-L-серином (OPLS), и выделение экспрессированного полипептида фактора VIII из клеток млекопитающих с помощью подходящих средств. Изобретение позволяет получить полипептид фактор VIII с увеличенной специфической активностью. 2 н. и 9 з.п. ф-лы, 3 ил., 3 табл., 2 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к способу продуцирования полипептида фактора VIII, включающему применение лиганда С2-домена, в частности O-фосфо-L-серина (OPLS).
УРОВЕНЬ ТЕХНИКИ
Классическая гемофилия, или гемофилия А, является наследственным заболеванием крови. Оно является результатом дефицита фактора свертывания крови VIII, связанного с Х-хромосомой, и поражает почти исключительно мужчин с частотой от одного до двух случаев на 10000 человек. Дефект Х-хромосомы передается женщинами-носителями, которые сами не больны гемофилией. Клиническим проявлением гемофилии А является повышенная склонность к кровотечению. До лечения концентратами фактора VIII средняя продолжительность жизни для лиц с тяжелой формой гемофилии составляла менее 20 лет. Применение концентратов фактора VIII из плазмы значительно улучшило ситуацию для пациентов с гемофилией, экстенсивно увеличивая среднюю продолжительность их жизни, давая большинству из них возможность жить более или менее нормальной жизнью. Однако существуют некоторые проблемы, связанные с полученными из плазмы концентратами и их использованием, наиболее серьезной из которых является передача вирусов. До сих пор вирусы, вызывающие СПИД, гепатит В и гепатит ни-А, ни-В, серьезно поражают население. Поэтому в последнее время были разработаны различные способы инактивации вирусов и новые высокоочищенные концентраты фактора VIII, которые установили очень высокий стандарт безопасности и для фактора VIII, полученного из плазмы.
Известно, что фактор VIII (FVIII) экспрессируется в клетках млекопитающих на очень низком уровне. Также известно, что фактор VIII является неустойчивым белком в среде без сыворотки или без белка. Для повышения стабильности и титра фактора VIII применяли добавление различных веществ.
WO 9743436 раскрывает добавление ингибиторов металлозависимых ингибиторов и/или химотрипсинов.
WO 88/08035 и WO 87/04187 раскрывают добавление фосфолипидов к культуральной среде фактора VIII. Также описана коэкспрессия фактора Виллебранда (vWF).
US 20050227913 A1 раскрывает OPLS в качестве ингибитора агрегации фактора VIII путем связывания с С2-доменом (2303-2332). Утверждается, что менее агрегированный фактор VIII является менее иммуногенным.
K.Hansen, M.Kjalke, Р.В.Rasmussen, L.Kongerslev and M.Ezban, Cytotechnol. 24 (3), 227-234, 1997 раскрывает применение бацитрацина А и фосфатидилсерина для предотвращения деградации фактора VIII в среде.
WO 90/02175 A1 раскрывает процессы продуцирования рекомбинантного полипептида(ов) путем культивирования эукариотических клеток в присутствии ингибиторов протеазы для предотвращения деградации полипептида(ов).
ЕР 1707634 A1 раскрывает, что значительное количество фактора VIII ассоциировано с клеточной поверхностью и может быть удалено путем промывания буферами с высокой ионной силой.
В то же время по-прежнему существует необходимость совершенствования способов продуцирования для того, чтобы увеличить общий выход полипептидов фактора VIII и/или уменьшить производственные затраты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Первый аспект изобретения относится к способу продуцирования полипептида фактора VIII, включающему этапы а) культивирования клеток млекопитающих, экспрессирующих полипептид фактор VIII, в условиях, подходящих для экспрессии указанного полипептида фактора VIII, в том числе включающих клеточную культуральную среду с содержанием лиганда С2-домена, и b) выделения экспрессированного полипептида фактора VIII из клеток млекопитающих с помощью подходящих средств.
Второй аспект изобретения относится к способу продуцирования полипептида фактора VIII, включающему этапы а) культивирования клеток млекопитающих, экспрессирующих полипептид фактор VIII, в условиях, подходящих для экспрессии указанного полипептида фактора VIII, в том числе включающих клеточную культуральную среду, и b) выделения экспрессированного полипептида фактора VIII из клеток млекопитающих с помощью подходящих средств, включающих добавление к указанным клеткам лиганда С2-домена.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
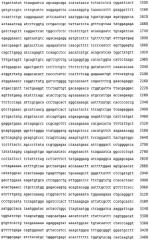
Фиг.1. Последовательность гена (кДНК) фактора VIII (SEQ ID №1).
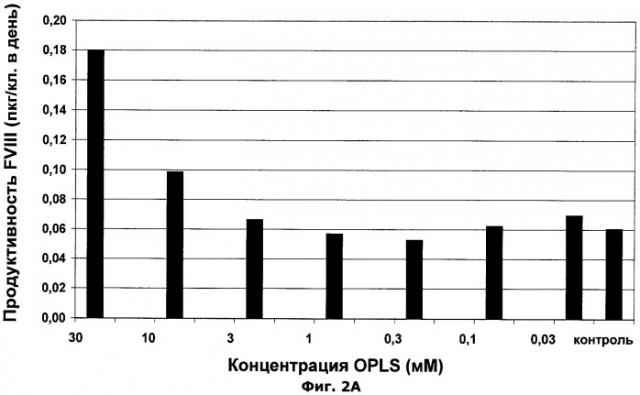
Фиг.2А-В. Влияние О-фосфо-L-серина на производительность FVIII и специфическую активность белка FVIII.
Фиг.3А-С. Влияние О-фосфо-L-серина и/или гидролизата растительного белка на фактор VIII в среде клеток, продуцирующих фактор VIII. Особенность условий A-D указана в таблице 3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как указывалось выше, первый аспект изобретения относится к способу продуцирования полипептида фактора VIII, включающему этапы а) культивирования клеток млекопитающих, экспрессирующих полипептид фактор VIII, в условиях, подходящих для экспрессии указанного полипептида фактора VIII, в том числе включающих клеточную культуральную среду с содержанием лиганда С2-домена, и b) выделения экспрессированного полипептида фактора VIII из клеток млекопитающих с помощью подходящих средств.
Второй аспект изобретения относится к способу продуцирования полипептида фактора VIII, включающему этапы а) культивирования клеток млекопитающих, экспрессирующих полипептид фактор VIII, в условиях, подходящих для экспрессии указанного полипептида фактора VIII, в том числе включающих клеточную культуральную среду, и b) выделения экспрессированного полипептида фактора VIII из клеток млекопитающих с помощью подходящих средств, включающих добавление к указанным клеткам лиганда С2-домена.
В обоих случаях лиганд С2-домена играет важную роль в способствовании повышению уровней титра полипептида фактора VIII в клеточной культуральной среде.
Без привязи к какой-либо конкретной теории считается, что увеличение уровней титра полипептида фактора VIII в клеточной культуральной среде обусловлено лигандом С2-домена (в частности О-фосфо-L-серином (OPLS)), который либо самостоятельно, либо в сочетании с соевым ингибитором трипсина (SBTI) и/или гидролизатом растительного белка или (i) увеличивает количество полипептида фактора VIII, секретируемого клетками, и/или (ii) конкурирует со связанным с клеткой полипептидом фактором VIII вне клеток, и/или (iii) уменьшает деградацию полипептида фактора VIII и тем самым увеличивает количество функционального полипептида фактора VIII, присутствующего в супернатанте.
Ниже изобретение будет рассмотрено более детально.
Лиганд С2-домена представляет собой лиганд, способный к связыванию или связанный с С2-доменом (см. ниже) полипептида фактора VIII. Предпочтительно лиганд С2-домена должен быть способен к вытеснению (конкурентному выключению) полипептида фактора VIII с клеточной мембраны.
В настоящее время в наиболее предпочтительном воплощении лиганд С2-домена представляет собой O-фосфо-L-серин (OPLS), т.е. молекулу формулы (HO)2P(O)OCH2CH(NH2)CO2H.
Подходящими альтернативными лигандами С2-домена считаются те, которые имеют формулу (XO)(HO)P(O)OCH2CH(NH2)CO2H, где Х выбирают среди возможно замещенного C1-6-алкила, возможно замещенного С2-6-алкенила, возможно замещенного фенила, возможно замещенного гетероарила, возможно замещенного гетероциклила и возможно замещенного бензила. В одном из его воплощений Х выбирают среди возможно замещенного C1-6-алкила, возможно замещенного бензила и возможно замещенного С2-6-алкенила.
В данном контексте термин "C1-6-алкил" используется для обозначения линейной, циклической и разветвленной углеводородной группы, имеющей от 1 до 6 атомов углерода, такой как метил, этил, пропил, изопропил, пентил, циклопентил, гексил, циклогексил.
Аналогичным образом термин "С2-6-алкенил" используется для обозначения линейной, циклической или разветвленной углеводородной группы, имеющей от 2 до 6 атомов углерода и содержащей по меньшей мере одну ненасыщенную связь. Примерами алкенильных групп являются винил, аллил, бутенил, пентенил и гексенил. Предпочтительными примерами алкенила являются винил, аллил, бутенил, особенно аллил.
В данном контексте, т.е. в связи с терминами "алкил" и "алкенил", термин "возможно замещенный" используется для обозначения того, что группа в данном случае может быть замещена один или несколько раз, предпочтительно 1-3 раза, группой(ами), выбранной среди гидрокси (которая при связывании с ненасыщенным атомом углерода может присутствовать в таутомерной кето-форме), C1-6-алкокси (т.е. C1-6-алкил-окси), С2-6-алкенилокси, карбокси, оксо (формирующей кетоновую или альдегидную функциональность), C1-6-алкилкарбонил, формил, арил, арилокси, ариламино, арилкарбонил, гетероарил, гетероарилокси, гетероариламино, гетероарилкарбонил, гетероциклил, гетероциклилокси, гетероциклиламино, гетероциклилкарбонил, амино, моно- и ди-(С1-6-алкил)амино; карбамоил, моно- и ди-(С1-6-алкил)аминокарбонил, амино-C1-6-алкил-аминокарбонил, моно- и ди-(С1-6-алкил)амино-С1-6-алкил-аминокарбонил, C1-6-алкилкарбониламино, гуанидино, карбамидо, C1-6-алкил-сульфонил-амино, C1-6-алкил-сульфонил, C1-6-алкил-сульфинил, С1-6-алкилтио, галоген, где любой арил, гетероарил и гетероциклил может быть замещен, как конкретно описано ниже для арила, гетероарила и гетероциклила.
Термин "галоген" включает фтор, хлор, бром и йод.
В данном контексте термин "арил" используется для обозначения полностью или частично ароматического карбоциклического кольца или кольцевой системы, такой как фенил, нафтил, 1,2,3,4-тетрагидронафтил, антрацил, фенантрацил, пиренил, бензопиренил, флуоренил и ксантенил, среди которых фенил является предпочтительным примером.
Термин "гетероарил" используется для обозначения полностью или частично карбоциклического ароматического кольца или кольцевой системы, где один или более атом углерода заменен на гетероатом, например на атом азота (=N- или -NH-), серы и/или кислорода. Примерами таких гетероарильных групп являются бензимидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пирролил, имидазолил, пиразолил, пиридинил, пиримидинил, пиразинил, пиридазинил, фурил, тиенил, хинолил, триазолил, тетразолил, изохинолил, индолил, в частности бензимидазолил, пирролил, имидазолил, пиридинил, пиримидинил, фурил, тиенил, хинолил, тетразолил и изохинолил.
Термин "гетероциклил" используется для обозначения неароматического карбоциклического кольца или кольцевой системы, где один или более атом углерода заменен на гетероатом, например на атом азота (=N- или -NH-), серы и/или кислорода. Примерами таких гетероциклических групп (названных в соответствии с кольцами) являются тетрагидрофуран, имидазолидин, пиперазин, гексагидропиридазин, гексагидропиримидин, диазепан, пирролидин, пиперидин, азепан, оксазинан (морфолин) и тиазинан.
В данном контексте, т.е. в связи с терминами "арил", "бензил", "гетероарил", "гетероциклил" и т.п. (например, "арилокси", "гетероарилкарбонил" и др.), термин "возможно замещенный" используется для обозначения того, что группа в данном случае может быть замещена один или несколько раз, предпочтительно 1-5 раз, в частности 1-3 раза, группой(ами), выбранной среди групп гидрокси, C1-6-алкил, C1-6-алкокси, оксо (который может быть представлен в таутомерной енольной форме), карбокси, C1-6-алкилкарбонил, формил, амино, моно- и ди-(С1-6-алкил)амино; карбамоил, моно- и ди-(С1-6-алкил)аминокарбонил, амино-С1-6-алкил-аминокарбонил, С1-6-алкилкарбониламино, гуанидино, карбамидо, C1-6-алкилсульфониламино, арилсульфониламино, гетероарилсульфониламино, C1-6-алкилсульфонил, C1-6-алкилсульфинил, C1-6-алкилсульфонилокси, сульфанил, амино, аминосульфонил, моно- и ди-(С1-6-алкил)аминосульфонил или галогенов, где любые алкил, алкокси и т.п. представленные заместители могут быть замещены на гидрокси, C1-6-алкокси, С2-6-алкенилокси, амино, моно- и ди-(С1-6- алкил)амино, карбокси, C1-6-алкилкарбониламино, галоген, C1-6-алкилтио, C1-6-алкилсульфониламино или гуанидино.
В наиболее интересных воплощениях (касающихся как первого, так и второго аспекта изобретения) лиганд С2-домена (например OPLS) присутствует в клеточной культуральной среде в концентрации 0,1-100 мМ, такой как 5-30 мМ, в частности 10-20 мМ.
Также интересными являются воплощения (касающиеся как первого, так и второго аспекта изобретения), в которых лиганд С2-домена добавляли к клеткам в этапе b) в концентрации 1-200 мМ, такой как 50-150 мМ, в частности 70-130 мМ.
Подробная информация об этапах продуцирования будет в деталях раскрыта ниже.
Как говорилось ранее, было установлено, что соевый ингибитор трипсина (SBTI) можно выгодно сочетать с лигандом С2-домена в клеточной культуральной среде на этапе а). Таким образом, в настоящее время в предпочтительном воплощении клеточная культуральная среда дополнительно содержит соевый ингибитор трипсина.
Соевый ингибитор трипсина выделяют из Glycine max. Соевый ингибитор трипсина из соевых бобов является мономерным белком, содержащим 181 аминокислотный остаток в одноцепочечной полипептидной цепи, связанной двумя дисульфидными мостиками. Молекулярный вес, определенный по аминокислотной последовательности, составляет 20,1 кДа. Соевый ингибитор трипсина ингибирует свою целевую протеазу путем формирования стехиометрического комплекса 1:1.
В наиболее типичных воплощениях концентрация соевого ингибитора трипсина в клеточной культуральной среде составляет 0,01-100 мг/мл, например 0,1-10 мг/мл, в частности 0,3-3 мг/мл.
Кроме того, было установлено, что гидролизат растительного белка (иногда называемый "продуктом расщепления растительного происхождения" и т.п.) можно выгодно сочетать с лигандом С2-домена (а возможно, также и с соевым ингибитором трипсина) в клеточной культуральной среде на этапе а). Таким образом, в настоящее время в одинаково предпочтительном воплощении клеточная культуральная среда дополнительно содержит гидролизат растительного белка.
Гидролизат растительного белка может быть получен от одного из различных источников, например из коммерческих источников. Типичными типами гидролизатов являются гидролизат соевого белка, гидролизаты пшеничного белка, гидролизат белка гороха, гидролизат белка риса и т.д. WO 01/23527 А1, который настоящим включен путем ссылки, раскрывает получение и общее применение гидролизата соевого белка.
В наиболее типичных воплощениях концентрация гидролизата растительного белка в клеточной культуральной среде составляет 0,1-100 мг/мл, например 1-10 мг/мл, в частности 2-7 мг/мл.
Полипептид фактор VIII
Изобретение адаптировано для продуцирования полипептида фактора VIII в клетке млекопитающих.
Зрелая молекула фактора VIII состоит из 2332 аминокислот, которые могут быть сгруппированы в три гомологичные А-домена, два гомологичные С-домена и В-домен, которые расположены в следующем порядке: А1-А2-В-А3-С1-С2. В ходе его секретирования в плазму фактор VIII превращается внутриклеточно в ряд гетеродимеров, связанных с ионами металлов, в результате чего одноцепочечный фактор VIII расщепляется на В-А3 границе и на различных участках, входящих в В-домен. В результате такого процессинга образуется тяжелая цепь, состоящая из А1, А2 и различных частей В-домена, имеющая молекулярный размер от 90 кДа до 200 кДа. Тяжелые цепи связаны через ион металла с легкой цепью, которая состоит из A3-, С1- и С2-доменов (Saenko et al., 2002). В плазме этот гетеродимерный фактор VIII связан с высокоаффинным к нему фактором Виллебранда, который защищает его от преждевременного катаболизма. Время полужизни в плазме неактивированного фактора VIII, связанного с фактором Виллебранда, составляет около 12 часов.
В процессе свертывания крови фактор VIII активируется с помощью FXa и тромбина путем протеолитического расщепления в аминокислотах Arg372 и Arg740 в тяжелой цепи и в Arg1689 в легкой цепи, в результате чего высвобождается фактор Виллебранда и образуется активированный гетеродимер фактор VIII, который будет формировать теназный комплекс с FIXa и FX на фосфолипидных поверхностях в присутствии Са2+. Гетеродимер состоит из домена А1, 50 кДа фрагмента, домена А2, 43 кДа фрагмента, и легкой цепи (А3-С1-С2), 73 кДа фрагмента. Таким образом, активная форма фактора VIII (фактор Villa) состоит из А1-субъединицы, ассоциированной через двухвалентную связь иона металла с отщепленной тромбином А3-С1-С2 легкой цепью, и свободной А2-субъединицей, относительно слабо ассоциированной с доменами А1 и A3.
Молекула фактора VIII, состоящая из тяжелой цепи (НС) и легкой цепи (LC) фактора VIII, связанная с малым линкером, полученным из В-домена (фактор VIII с удаленным В-доменом, или BDD-FVIII) сохраняет биологическую активность фактора VIII полной длины (нативного).
Практикуя способ данного изобретения, любой полипептид фактор VIII, который является терапевтически полезным, например эффективным в профилактике или лечении кровотечений, можно сделать релевантным. Он включает человеческий фактор VIII дикого типа, гибридный человеческий/свиной фактор VIII и фактор VIII с удаленным В-доменом, но не ограничивается ими.
Используемый в данном документе термин "полипептид фактор VIII" охватывает фактор VIII, а также полипептиды, связанные с фактором VIII, но не ограничивается ими.
Термин "фактор VIII" используется для обозначения полипептидов, имеющих аминокислотную последовательность, описанную в Toole et al., Nature 1984, 312: 342-347 (человеческий фактор VIII дикого типа), а также фактор VIII дикого типа, полученный от других видов, такой как, например, фактор VIII от крупного рогатого скота, свиньи, собаки, мыши и лосося, но не ограничивается этим. Он также охватывает природные аллельные вариации фактора VIII, которые могут существовать и переходить от одного индивидуума к другому. Кроме того, степень и место гликозилирования или других посттрансляционных модификаций могут варьировать в зависимости от выбранных принимающих клеток (клеток-хозяев) и характера принимающей клеточной среды. Термин "фактор VIII" также используется для обозначения полипептидов фактора VIII в их нерасщепленной (зимогенной) форме, а также тех, которые были протеолитически обработаны для получения их соответствующих биологически активных форм, которые могут быть обозначены как фактор VIIIa.
Термин "полипептиды, связанные с фактором VIII", включает полипептиды фактора VIII, которые или химически модифицированы по сравнению с человеческим фактором VIII (т.е. производные фактора VIII), и/или содержат одно или более изменение аминокислотной последовательности по сравнению с человеческим фактором VIII (т.е. варианты фактора VIII), и/или содержат усеченные аминокислотные последовательности по сравнению с человеческим фактором VIII (т.е. фрагменты фактора VIII), но не ограничивается ими. Такие полипептиды, связанные с фактором VIII, могут обладать различными свойствами по сравнению с человеческим фактором VIII, включая стабильность, связывание с фосфолипидами, измененную специфическую активность и т.п. Термин "полипептиды, связанные с фактором VIII" используется для обозначения таких полипептидов в их нерасщепленной (зимогенной) форме, а также таких, которые были протеолитически обработаны для получения их биологически активных форм, которые могут быть обозначены как "полипептиды, связанные с фактором VIII" или "активированные полипептиды, связанные с фактором VIII"
Используемый в данном документе термин "полипептиды, связанные с фактором VIII" также включает в себя, без ограничения, полипептиды, демонстрирующие большей частью такую же или повышенную биологическую активность по сравнению с человеческим фактором VIII дикого типа, а также полипептиды, в которых биологическая активность фактора VIII была большей частью изменена или уменьшена по сравнению с активностью человеческого фактора VIII дикого типа. Эти полипептиды включают фактор VIII или фактор VIIIa, который был химически модифицирован, и варианты фактора VIII, в которые были внесены специфические изменения аминокислотной последовательности, которые изменили или нарушили биологическую активность полипептида, но не ограничиваются ими.
Кроме того, он охватывает полипептиды со слегка модифицированной аминокислотной последовательностью, например полипептиды, имеющие модифицированный N-конец, включая N-концевые аминокислотные делеции или добавления, и/или полипептиды, которые были химически модифицированы по сравнению с человеческим фактором VIII.
Полипептиды, связанные с фактором VIII, в том числе варианты фактора VIII, демонстрирующие большей частью такую же или повышенную биологическую активность по сравнению с фактором VIII дикого типа, или, наоборот, демонстрирующие большей частью модифицированную или уменьшенную биологическую активность по сравнению с фактором VIII дикого типа, включают полипептиды с аминокислотной последовательностью, которая отличается от последовательности фактора VIII дикого типа вставкой, удалением или заменой одной или более аминокислот, но не ограничиваются ими.
Полипептиды, связанные с фактором VIII, включая варианты, охватывают те, которые демонстрируют специфическую активность, которая составляет по меньшей мере около 10%, по меньшей мере около 20%, по меньшей мере около 30%, по меньшей мере около 40%, по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90%, по меньшей мере около 100%, по меньшей мере около 110%, по меньшей мере около 120% и по меньшей мере около 130% от специфической активности фактора VIII дикого типа, произведенного клетками того же типа, при этом анализ активности фактора VIII проводят в соответствии с описанием в данной инструкции.
Полипептиды, связанные с фактором VIII, включая варианты, имеющие большей частью такую же или повышенную биологическую активность по сравнению с фактором VIII дикого типа, охватывают те, которые демонстрируют специфическую активность, которая составляет по меньшей мере около 25%, такую как по меньшей мере 50%, по меньшей мере 75% или по меньшей мере 90% от специфической биологической активности фактора VIII дикого типа, произведенного клетками того же типа, при этом анализ активности фактора VIII проводят в соответствии с описанием в данной инструкции ("Материалы и методы").
Полипептидами, связанными с фактором VIII, включая варианты, имеющие большей частью уменьшенную биологическую активность по сравнению с фактором VIII дикого типа, являются те, которые демонстрируют менее около 25%, например менее около 10% или менее около 5% от специфической активности фактора VIII дикого типа, произведенного клетками того же типа, при этом анализ активности фактора VIII был проведен в соответствии с описанием в данной инструкции ("Материалы и методы").
Примеры полипептидов фактора VIII включают полученный из плазмы человеческий фактор VIII, как описано например в Fulcher et al.; Proc. Acad. Nat. Sci. USA 1982; 79: 1648-1652 и Rotblat et al.; Biochemistry 1985; 24: 4294-4300, и FVIII, полученный из плазмы свиньи, как описано например в Fass et al.; Blood 1982; 59:594-600 и Knutson et al.; Blood 1982; 59: 615-624, но не ограничиваются ими. Примеры вариантов последовательностей фактора VIII описаны например в Lollar et al.; Blood 2000; 95(2): 564-568 (гибридные свиные/человеческие полипептиды FVIII) и Lollar et al.; Blood 2001; 97(1): 169-174, но не ограничиваются ими.
Клонирование кДНК фактора VIII (Wood, W.I., et al. (1984) Nature 312, 330-336; Vehar, G.A., et al. (1984) Nature 312, 337-342) сделало возможным экспрессию фактора VIII, которая позволила рекомбинантно получить несколько продуктов рекомбинантного фактора VIII, которые были одобрены регулирующими органами в период между 1992 и 2003 годами. Кодирующая последовательность фактора VIII (кДНК) показана на фиг.1. Тот факт, что центральный В-домен полипептидной цепи фактора VIII, находящийся между аминокислотами Arg-740 и Glu-1649, не представляется необходимым для полной биологической активности, привел также к разработке фактора VIII с удаленным В-доменом. См. также Kjalke M, Heding A, Talbo G, Persson E, Thomsen J and Ezban M (1995), "Amino acid residues 721-729 are required for full Factor VIII activity". Eur. J. Biochem: 234: 773-779.
Этап а) - Трансфекция и культивирование клеток
Клетки
Клетки млекопитающих, экспрессирующие полипептид фактор VIII, как правило, выбирали из группы, состоящей из клеток млекопитающих, которые эндогенно экспрессировали полипептид фактор VIII, и клеток млекопитающих, в которые был трансфицирован ген полипептида фактора VIII.
В одном интересном воплощении последнего клетки млекопитающих были трансфицированы вектором экспрессии, содержащим молекулу нуклеиновой кислоты, кодирующей полипептид фактор VIII, и области контроля экспрессии, функционально с ней связанные.
Экспрессия белка в клетках хорошо известна специалистам в области продуцирования белков. В практическом применении данного изобретения клетками являются клетки млекопитающих, более предпочтительно установленная линия клеток млекопитающих, включая клеточные линии СНО (например АТСС CCL 61), COS-1 (например АТСС CRL 1650), почек хомячков (BHK) и HEK293 (например АТСС CRL 1573; Graham et al., J. Gen. Virol. 36: 59-72, 1977), но не ограничиваясь ими. Предпочтительной клеточной линией ВНК является клеточная линия ВНК tk-ts13 (Waechter and Baserga, Proc.Natl.Acad.Sci.USA 79:1106-1110, 1982), далее именуемая клетками ВНК 570. Клеточную линию ВНК 570 можно получить из American Type Culture Collection, 12301 Parklawn Dr., Rockville, MD 20852, под регистрационным номером АТСС CRL 10314. Также клеточную линию ВНК tk-ts13 можно получить из АТСС под регистрационным номером CRL 1632. Предпочтительными клеточными линиями СНО являются клеточная линия СНО K1, доступная в АТСС под регистрационным номером СС161, а также клеточные линии CHO-DXB11 и CHO-DG44.
Другие подходящие клеточные линии включают клетки Rat Hep I (гепатомы крысы; АТСС CRL 1600), Rat Hep II (гепатомы крысы; АТСС CRL 1548), ТСМК (АТСС CCL 139), легкого человека (АТСС НВ 8065), NCTC 1469 (АТСС CCL 9.1); DUKX (клеточная линия СНО) (Urlaub and Chasin, Proc. Natl. Acad. Sci. USA 77:4216-4220, 1980) (клетки DUKX также именуются клетками DXB11) и DG44 (клеточная линия СНО) (Cell, 33:405, 1983, и Somatic Cell and Molecular Genetics 12:555, 1986), но не ограничиваются ими. Также могут использоваться клетки 3Т3, клетки Namalwa, миеломы и слияния миелом с другими клетками. В некоторых воплощениях клетки могут быть мутантными или рекомбинантными, такими как, например, клетки, которые экспрессируют спектры ферментов, катализирующих посттрансляционную модификацию белков (например ферменты гликозилирования, такие как гликозилтрансферазы и/или гликозидазы, или ферменты процессинга, такие как пропептиды), качественно или количественно отличающиеся от того типа клеток, из которых они были получены. Особенно предпочтительны клетки DUKX (клеточная линия СНО).
В настоящее время предпочтительными клетками являются клетки HEK293, COS, почек хомячков (BHK) и клетки миеломы, в частности клетки яичников китайского хомячка (СНО).
Культивирование клеток
В некоторых воплощениях клетки, используемые в практике изобретения, способны расти в суспензионных культурах. Используемыми в данном случае подходящими для суспензии клетками являются такие клетки, которые могут расти в суспензии без образования больших плотных агрегатов, т.е. клетки, которые являются монодисперсными или растут в виде неплотных агрегатов с небольшим количеством клеток в агрегате. Подходящие для суспензии клетки включают клетки, которые растут в суспензии без адаптации или манипуляций (такие как, например, гемопоэтические клетки или лимфоидные клетки), и клетки, которые стали подходящими для суспензии путем постепенной адаптации таких клеток, которым необходимо прикрепление (таких как, например, эпителиальные клетки или фибробласты) к росту в суспензии, но не ограничиваются ими.
Клетки, используемые в практике изобретения, могут быть адгезивными клетками (также известными как клетки, зависимые от адгезии или зависимые от прикрепления). Используемыми в данном случае адгезивными клетками являются такие клетки, которым для размножения и роста нужно присоединиться или заякориться на подходящей поверхности. В одном воплощении изобретения используемыми клетками являются адгезивные клетки. В этих воплощениях и фазы размножения, и фаза продуцирования включают применение микроносителей. Используемые адгезивные клетки должны быть способны к миграции на носителях (и во внутренней структуре носителей, если используется макропористый носитель) во время фаз(ы) размножения и к миграции на новые носители после их переноса в продукционный биореактор. Если адгезивные клетки не обладают достаточной способностью мигрировать на новые носители самостоятельно, их можно освободить от носителей путем связывания содержащего клетки микроносителя с протеолитическими ферментами или ЭДТА. Используемая среда (особенно без компонентов животного происхождения) должна также содержать компоненты, пригодные для поддержки адгезивных клеток; подходящую среду для культивирования адгезивных клеток можно получить от коммерческих поставщиков, таких как, например, Sigma.
Клетки также могут быть адаптированными к суспензии или подходящими для суспензии. При использовании таких клеток размножение клеток может происходить в суспензии, так что микроносители используются только в заключительной фазе размножения в культуральном сосуде для продуцирования и в стадии продуцирования. В случае адаптированных к суспензии клеток используемыми микроносителями являются, как правило, макропористые носители, в которых клетки закрепляются посредством физического захвата во внутренней структуре носителей. Однако в случае таких адаптированных к суспензии клеток и размножение клеток, и продукция могут происходить в суспензии.
В таких воплощениях клетки млекопитающих, как правило, выбирают среди СНО, BHK, HEK293, клеток миеломы и т.д.
Клеточная культуральная среда
Помимо компонентов, упомянутых выше, а именно лиганда С2-домена (необходим для изобретения, относящегося к первому аспекту изобретения), возможно соевого ингибитора трипсина, а также возможно гидролизата растительного белка, клеточная культуральная среда содержит ряд других компонентов, которые, как известно специалисту, необходимы для размножения клеток и продуцирования полипептида фактора VIII.
Термин "клеточная культуральная среда" (или просто "среда") относится к питательному раствору, используемому для выращивания клеток млекопитающих, который обычно содержит по меньшей мере один компонент из одной или более следующих категорий: (1) соли, например натрий, калий, магний и кальций, способствующие осмоляльности среды; (2) источник энергии, обычно в форме углеводов, таких как глюкоза; (3) все незаменимые аминокислоты, и обычно основной набор из двадцати аминокислот; (4) витамины и/или другие органические соединения, необходимые в низких концентрациях; и (5) микроэлементы, которые определяются как неорганические соединения, которые обычно требуются в очень низких концентрациях, обычно в микромолярных. Питательный раствор возможно может быть дополнен одним или более компонентом из любой из следующих категорий: (а) гормоны и другие факторы роста, такие как, например, инсулин, трансферрин и эпидермальный фактор роста; и (b) гидролизаты белков и тканей. Предпочтительно, чтобы клеточная культуральная среда не содержала компонентов животного происхождения.
Данное изобретение охватывает культивирование клеток млекопитающих в среде без компонентов животного происхождения. Используемый в данном случае термин "компоненты животного происхождения" подразумевает любые компоненты, которые производятся в интактных животных (такие как, например, белки, выделенные и очищенные от сыворотки), или производятся с использованием компонентов, производимых в интактных животных (такие как, например, аминокислота, сделанная с помощью фермента, выделенного и очищенного из животного для гидролиза материала растительного происхождения). Напротив, белок, который имеет последовательность животного белка (т.е. имеет геномное происхождение от животного), но который производится in vitro в культуре клеток (такой как, например, рекомбинантная дрожжевая или бактериальная клетка или установленная непрерывная линия клеток млекопитающих, рекомбинантная или нет), в средах без компонентов, производимых, а также выделенных и очищенных из интактных животных, не является компонентом "животного происхождения" (такой как, например, инсулин, производимый в дрожжевой или бактериальной клетке, или инсулин, производимый в установленной линии клеток млекопитающих, такой как, например, клетки СНО, ВНК или НЕК, или интерферон, производимый в клетках Namalwa). Например, белок, который имеет последовательность животного белка (т.е. имеет геномное происхождение от животного), но который производится в рекомбинантной клетке в средах без компонентов животного происхождения (такой как, например, инсулин, производимый в дрожжевой или бактериальной клетке) не является "компонентом животного происхождения". Соответственно, клеточной культурной средой без компонентов животного происхождения является такая среда, которая может содержать животные белки, которые получены рекомбинантно; однако такая среда не содержит, например, животную сыворотку или белки или другие продукты, очищенные от животной сыворотки. Такая среда может, например, содержать один или более компонент, полученный из растений. Может быть использована любая клеточная культуральная среда, в частности не содержащая компонентов животного происхождения, которая поддерживает рост и существование клеток в условиях изобретения. Как правило, среда содержит воду, регулятор осмоляльности, буфер, источник энергии, аминокислоты, неорганический или рекомбинантный источник железа, один или более синтетический или рекомбинантный фактор роста, витамины и кофакторы. В одном воплощении среда не содержит компонентов животного происхождения и белков ("безбелковая"). Среды без компонентов животного происхождения и/или белков доступны от коммерческих поставщиков, таких как, например, Sigma, JRH Biosciences, Gibco, Hyclone и Gemini.
В одном воплощении клеточная культуральная среда практически не содержит сыворотку. В другом воплощении среда не содержит компонентов животного происхождения. В другом воплощении среда не содержит белки ("безбелковая"), а также компоненты животного происхождения.
В одном воплощении среда является коммерчески доступной безбелковой средой СНО без компонентов животного происхождения, такой как, например, EXCELL™ (SAFC Biosciences), PF-CHO, PF-CHO-LS, SFM4CHO или CDM4CHO (все из Hyclone), а клеточной линией являются клетки СНО.
В некоторых воплощениях клетки, используемые в практике данного изобретения, адаптированы к суспензионному росту в среде без компонентов животного происхождения, такой как, например, среда без сыворотки. Такие адаптационные процедуры описаны например в Scharfenberg, et al., Animal Cell Technology Developments towards the 21st Century, E. C. Beuvery et al. (Eds.), Kluwer Academic Publishers, pp.619-623, 1995 (клетки BHK и СНО); Cruz, Biotechnol. Tech. 11: 117-120, 1997 (клетки насекомых); Keen, Cytotechnol. 17: 203-211, 1995 (клетки миеломы); Berg et al., Biotechniques 14: 972-978, 1993 (клетки человеческой почки 293). В частном предпочтительном воплощении принимающими клетками являются клетки BHK 21 или СНО, которые были разработаны для экспрессии человеческого фактора VIII и адаптированы к росту в отсутствие сыворотки или компонентов животного происхождения.
Клеточные культуральные процедуры
Способы изобретения обычно выполняли во встряхиваемом культуральном сосуде, и обычно использовали полунепрерывный тип процесса. В ходе этого процесса после инокуляции выращивали клетки, и при достижении определенной плотности собирали около 70% культуры, а к оставшейся культуре добавляли свежую клеточную культуральную среду до ее первоначального объема. Это, как правило, повторяли примерно 2-10 раз.
Кроме того, может быть использован процесс типа микроносителя. В процессе, основанном на микроносителе, клетки мигрировали во внутреннюю структуру носителей (макропористые носители), либо присоединялись к поверхности носителей (твердые носители), либо происходило и то, и другое. В процессе, основанном на микроносителе, вначале в культуральный сосуд помещали клетки млекопитающих, микроносители и клеточную культуральную среду. В последующие дни добавляли дополнительную клеточную культуральную среду, если культуральный объем не доходил до конечного рабочего объема сосуда вначале. В течение следующего периода выполняли периодический сбор культурального супернатанта, содержащего продукт, и заменяли его новой жидкой средой, до тех пор, пока культура окончательно не заканчивалась. При сборе супернатанта, содержащего продукт, перемешивание культуры, например встряхивание, останавливали и давали осесть носителям, содержащим клетк