Способ извлечения молибдена из кислых разбавленных растворов сложного состава
Иллюстрации
Показать всеИзобретение относится к области гидрометаллургии молибдена и может быть использовано для извлечения, концентрирования и очистки молибдена от элементов-спутников (Fe3+, Cu2+, Zn2+, Ni2+, Co2+, Al3+, Sn4+, Sb3+, РЗЭ3+ и др.) при переработке различных жидких и твердых молибденсодержащих отходов и промпродуктов. Способ извлечения молибдена из кислых разбавленных растворов, содержащих элементы-спутники молибдена, включает осаждение молибдена в виде его соли. При этом осаждение с очисткой молибдена осуществляют в виде его цезиевой соли 12-молибдофосфорной кислоты состава: CS3-xHxPMo12O40·nH2O (х=0-1, n=9-12). Осаждение ведут при нагревании до 40-80°С путем последовательного добавления ортофосфат-иона в виде растворимого фосфата или ортофосфорной кислоты, сильной кислоты, например, серной, или гидроксида натрия до рН 1-3 и растворимой соли цезия, включая маточные растворы, получающиеся при выщелачивании поллуцита. Техническим результатом является повышение степени извлечения молибдена из технологических и сточных растворов. 2 ил., 3 пр.
Реферат
Изобретение относится к области гидрометаллургии молибдена и может быть использовано для извлечения, концентрирования и очистки молибдена от элементов-спутников (Fe3+, Cu2+, Zn2+, Ni2+, Со2+, Al3+, Sn4+, Sb3+, РЗЭ3+ и др.) при переработке различных жидких и твердых молибденсодержащих отходов и промпродуктов.
Известен способ [Патент РФ №2181782, МПК С22В 34/34, С22В 34/36, С22В 3/40, 2002] извлечения молибдена жидкостной экстракцией с использованием триоктиламина и изооктилового спирта в керосине в черной и цветной металлургии, а также при очистке промышленных и бытовых стоков. Недостатком способа является использование пожароопасных органических растворителей, а также недостаточно низкое содержание молибдена (до 1,2 г/дм3) в перерабатываемых растворах.
Известен способ извлечения молибдена из водных многокомпонентных растворов в форме сульфидов [Патент РФ №2325327, МПК C01G 39/06, 2006], основанный на образовании растворимых тиомолибдатов и последующим их разрушением серной кислотой с образованием осадка сульфида молибдена. Недостатком способа является выделение газообразного высокотоксичного сероводорода [ПДКм.р.=0,008 мг/м3: Беспамятнов Г.П., Богушевская К.К., Беспамятнова А.В. и др. Предельно допустимые концентрации вредных веществ в воздухе и воде. Л.: Химия, 1972, 370 с.] и образование аморфных осадков сульфидов элементов-примесей.
Наиболее близким к предложенному способу по технической сущности и достигаемому результату является способ извлечения молибдена из кислых растворов [Патент РФ №2280088, МПК С22В 34/34, 2006], включающий смешение исходного раствора с реагентом (фосфорная кислота или ее соли), нейтрализацию пульпы (до рН 2,0-3,0) щелочным реагентом, выдержку пульпы при перемешивании, осаждение и удаление жидкой фазы декантацией. Оставшийся осадок растворяют раствором аммиака. Недостатками данного способа являются:
- менее широкий диапазон концентраций молибдена (до 0,1 г/л), в котором применим данный способ;
- малая степень извлечения молибдена, особенно в области низких содержаний молибдена (≈5% при 0,1 г/л).
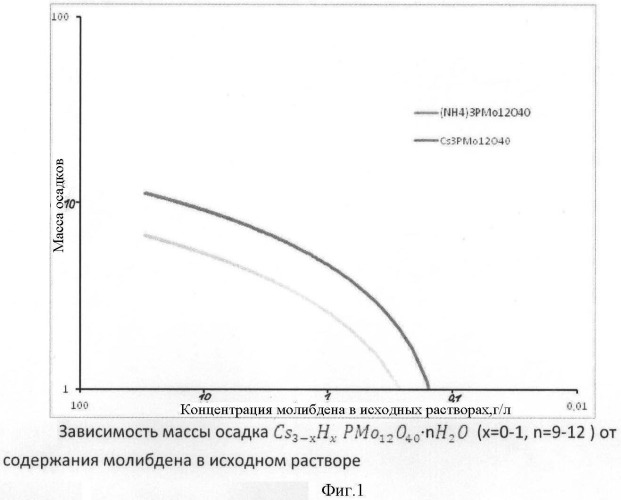
Техническим результатом настоящего изобретения является расширение диапазона содержания молибдена (до 0,05 г/л); увеличение степени его извлечения из исходных технологических водных растворов (увеличение выхода молибдена до 95-100% при СМо=10-100 г/л и 60-80% в области малых его содержаний при 1-0,05 г/л) (Фиг.1).
Указанный технический результат достигается тем, что в предлагаемом способе молибден извлекается из кислых разбавленных (0,05-10 г/л) растворов, содержащих элементы-спутники молибдена (Fe3+, Cu2+, Zn2+, Ni2+, Co2+, Al3+, Sn4+, Sb3+, РЗЭ3+ и др.). Для концентрирования, выделения и очистки молибдена от сопутствующих элементов используется извлечение молибдена в виде его цезиевой соли 12-молибдофосфорной кислоты состава: Cs3-xHxPMo12O40·nH2O (x=0-1, n=9-12), в процессе осаждения при нагревании молибденсодержащего раствора до 40-80°С, последовательно добавляют ортофосфат-ион (в виде любого растворимого фосфата или ортофосфорной кислоты), серную кислоту или гидроксид натрия до рН 1-3 и любую растворимую соль цезия, включая также маточные растворы, получающиеся после выщелачивания поллуцита.
Суть предлагаемого способа поясняется следующими примерами.
Пример 1.
Концентрирование молибдена и его отделение от большей части сопутствующих примесей происходит в результате образования в растворе 12-молибдофосфат-иона в кислой среде в присутствии любого растворимого ортофосфат-иона, включая также ортофосфорную кислоту, по реакции:
Оптимальные условия образования этого соединения: 1) рН раствора 1-3; 2) нагревание раствора до 40-80°С; 3) соотношение концентраций МоО4 2-: РО4 3- должно быть близкое к стехиометрическому, т.е. 12:1. В присутствии однозарядных ионов: М+=NH4 +, K+, Rb+ и Cs+ ион PMo12O40 3- образует малорастворимые соединения, например, при М+=Cs+ (любая растворимая в воде соль цезия), по реакции:
.
При увеличении рН раствора, начиная с рН 3-4 и выше, наблюдается ступенчатое отщепление оксометаллатных ионов молибдена с образованием ненасыщенных 11-молибдофосфатов - , которые способны не только к образованию малорастворимых цезиевых солей - Cs7PMo11O39, но и к образованию малорастворимых на холоду металлокомплексов -Cs5[PMo11O39Z(OH)] и Cs11-xHx[(PMo11O39)2Z], где Z = примесь элемента-спутника молибдена. Поэтому, учитывая возможность образования подобных соединений, при проведении осаждения Cs3PMo12O40 для предотвращения загрязнения осадка цезиевой соли необходимо создать рН<3, при этом можно использовать сильную минеральную кислоту, например, серную.
При этих условиях осаждается цезиевая соль состава Cs3-xHxPMo12O40·nH2O, где небольшая доля ионов цезия замещена на ионы водорода (х=0-1, n=9-12). Поскольку растворимость цезиевой соли 12-молибдофосфорной кислоты значительно меньше растворимости аммонийной соли (прототип), а также других, приведенных в данном примере однозарядных катионов, то полнота осаждения молибдена в виде Cs3-xHxPMo12O40·nH2O значительно выше, чем у аналогичной аммонийной соли. Она составляет 95-100% при содержании молибдена СМо=10-100 г/л и 60-80% в области малых его содержаний при 1-0,05 г/л (фиг.1), что значительно выше по сравнению с осаждением аммонийной соли: 60-80% при CMo=10-100 г/л и падает до 5-8% при СМо=0,1 г/л, а при СМо=0,05 г/л осадок аммонийной соли совсем не образуется.
Цезиевая соль в указанных условиях образуется в виде мелкокристаллического желтого осадка, характеризующегося мономодальным распределением частиц по размерам (фиг.2). Асимметрия распределения связана с характеристической формой кристаллов осадка. Средний размер его частиц составляет 0,4 мкм, что затрудняет процедуру отделения осадка от раствора методом фильтрования, но не является препятствием для отделения осадка путем отстаивания с последующей декантацией, либо с последующим центрифугированим.
Полное отстаивание цезиевых солей происходит потому, что их относительная плотность существенно выше, чем у аммонийных аналогов (ρCz=2,98>ρNH4=2,05 г/см3) при некотором уменьшении размеров осаждаемых частиц (фиг.2) [Набойченко С.С., Юнь А.А. - Расчеты гидрометаллургических процессов. М.: МИСИС, 1995, - 428 с.].
Кроме того, улучшение отстаивания солей происходит также в результате коагуляции зародышей кристаллизации вследствие сорбции высокозарядных ионов элементов-примесей на поверхности кристаллов цезиевой соли.
Пример 2.
Отличается от примера 1 тем, что для создания оптимального значения рН 1-3 используется добавление раствора NaOH для подщелачивания слишком кислого раствора молибдена по реакции:
.
Пример 3.
Отличается от примера 1 тем, что в качестве растворимой соли цезия используется маточный раствор, получаемый при кислотном выщелачивании поллуцита в процессе его гидрометаллургической переработки. Этот раствор, кроме цезия, содержит также примеси солей рубидия и калия, что не мешает осаждению 12-молибдофосфата цезия.
Таким образом, использование изобретения позволит повысить степень извлечения молибдена из технологических растворов в результате образования и осаждения 12-молибдофосфата цезия. При этом происходит очистка молибдена от большей части элементов-примесей и очистка сточных вод от молибдена [ПДКв=0,5 мг/л: Беспамятнов Г.П., Богушевская К.К., Беспамятнова А.В. и др. Предельно допустимые концентрации вредных веществ в воздухе и воде. Л.: Химия, 1972, 370 с.].
Рассмотрение полученных экспериментальных данных указывает на достоверность достижения цели изобретения и показывает, что техническим результатом данного изобретения является:
- расширение диапазона содержаний молибдена до 0,05 г/л, при котором его можно извлечь из сточных и сбросовых растворов, тем самым увеличивая сырьевую базу источников молибдена;
- увеличение степени извлечения молибдена (95-100% при СМо=10-100 г/л), особенно в области его низких содержаний (60-80% при СМо=1-0,05 г/л);
- очистка извлекаемого соединения молибдена от большей части (Fe3+, Cu2+, Zn2+, Ni2+, Со2+, Al3+, Sn4+, Sb3+, РЗЭ3+ и др.) сопутствующих примесей;
- уменьшение степени загрязнения сточных вод (до <0,05 г/л по молибдену), что значительно снижает нагрузку на окружающую среду при использовании предложенного способа в качестве средства малоотходной технологии в результате извлечения молибдена из сточных и сбросовых вод.
Способ извлечения молибдена из кислых разбавленных растворов, содержащих элементы-спутники молибдена, включающий осаждение молибдена в виде его соли, отличающийся тем, что осаждение с очисткой молибдена осуществляют в виде его цезиевой соли 12-молибдофосфорной кислоты состава Cs3-xHxPMo12O40·nH2O (х=0-1, n=9-12) при нагревании до 40-80°С путем последовательного добавления ортофосфат-иона в виде растворимого фосфата или ортофосфорной кислоты, сильной кислоты, например серной, или гидроксида натрия до рН 1-3 и растворимой соли цезия, включая маточные растворы, получающиеся при выщелачивании поллуцита.