Лечение психологических состояний с применением антагонистов m1-мускариновых рецепторов
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к психиатрии, и может быть использована для лечения депрессии. Для этого нуждающемуся в таком лечении индивидууму вводят терапевтически эффективное количество комбинации телензепина и одного или нескольких антидепрессантов, которые выбирают из группы, состоящей из флуоксетина, сертралина и венлафаксина. Также предложены фармацевтическая композиция и набор для лечения депрессии. Группа изобретений обеспечивает лечение депрессии у индивидуума, а также более сильное антидепрессантное действие, чем действие, которое достигается при введении любого из указанных лекарств по отдельности. 3 н. и 12 з.п. ф-лы, 6 ил., 1 табл., 1 пр.
Реферат
Ссылки на родственные заявки на патенты
Настоящая заявка на патент претендует на приоритет Предварительной заявки на патент США №60/805066 от 16 июня 2006 года и Предварительной заявки на патент США №60/829225 от 12 октября 2006 года, раскрытие которых во всей их полноте включается в настоящую заявку путем отсылки.
Заявление прав на изобретение, выполненное при финансировании исследований и разработок федеральным правительством, неприменимо.
Область техники, к которой относится изобретение
Настоящее изобретение касается лечения физиологических расстройств, включая депрессию, путем введения селективного антагониста M1-мускаринового рецептора (M1R) самого по себе или в комбинации с антидепрессантом.
Предшествующий уровень техники
Нейротрансмиттер ацетилхолин (Ach) взаимодействует с двумя типами рецепторов на мембранах эффекторных клеток: с никотиновыми рецепторами (nAChR), которые представляют собой лиганд-управляемые ионные каналы, и с мускариновыми рецепторами (mAChR), которые представляют собой рецепторы, сопряженные с G-белками. У млекопитающих идентифицировано пять подтипов mAChR, обозначаемых символами от M1 до М5. M1-мускариновые рецепторы (M1R) обнаружены как в центральной, так и в периферической нервной системе, в частности в коре головного мозга и в симпатических ганглиях. Мускариновые эффекты, опосредованные через M1R, исследуются, главным образом, с применением M1R-селективных антагонистов, и более недавно на модели мышей, нокаутированных по M1R (M1R-ноль мыши).
Хотя ни один из известных в настоящее время антагонистов mAChR не демонстрирует абсолютной селективности к одному из подтипов мускариновых рецепторов, такие лекарства, как пирензепин и телензепин, показывают высокое относительное сродство к M1R и поэтому часто рассматриваются как M1R-селективные антагонисты. Пирензепин применяется для лечения язвенной болезни желудка и двенадцатиперстной кишки в Европе, Японии и Канаде. Телензепин прошел клинические испытания при тех же показаниях. В терапевтических дозах оба эти агента умеренно снижают секрецию кислоты и пепсина в желудке без ингибирования активности гладких мышц, что характерно для неселективных антагонистов mAChR.
Имеется ряд доказательств того, что подтип рецепторов M1R может быть вовлечен в некоторые аспекты депрессивных расстройств и тревожности. Прямая инъекция пирензепина в прилежащее ядро (центр удовольствия, или nucleus accumbens) переднего мозга крыс приводит к увеличению времени плавания в плавательном тесте Порсолта (Porsolt swim test) (см. Chau D.T. et al., Neuroscience, 2001, vol.104, №3, p.791-8), который является стандартной мерой антидепрессантной активности. M1R-ноль мыши также демонстрируют увеличенное время плавания в плавательном тесте Порсолта, а также повышенные общественные связи (социальные контакты) в тесте на социальное взаимодействие (см. Miyakawa Т. et al., J. Neurosci., 2001, vol.21, №14, p.5239-50).
Хотя пирензепин и телензепин по своей структуре похожи на трициклические антидепрессанты, такие как имипрамин, не известно, чтобы они обладали психотропными эффектами при пероральном приеме для лечения язвенной болезни желудка и двенадцатиперстной кишки. Кроме того, в проведенных ранее исследованиях на мышах и крысах при системном введении пирензепин не проявлял никаких поведенческих эффектов (см. Rogoz Z., Skuza G., Sowinska H., Pol. J. Pharmacol. Pharm., 1981, vol.31, p.615-26). Отсутствие таких эффектов может объясняться имеющимся наблюдением, что пирензепин не может в значительной степени проникать сквозь гематоэнцефалический барьер у разных видов животных, включая грызунов и человека (см. Hammer R, Koss F.W., Scand. J. Gastroenterol, Suppl, 1979, vol.14, №57, p.1-6; Bymaster P.P. et al., J. Pharmacol. Exp. Ther., 1993, vol.267, no.1, p.16-24). Именно по этой причине в упомянутом выше исследовании влияния пирензепина в плавательном тесте Порсолта применялась прямая инъекция лекарства в мозг исследуемых животных.
В настоящее время существует потребность в новых и эффективных лекарствах для лечения психологических состояний, включая депрессию. Настоящее изобретение направлено на удовлетворение этой и других потребностей.
Раскрытие изобретения
Настоящее изобретение предоставляет способы лечения различных психологических расстройств, включая депрессию, путем системного введения терапевтически эффективного количества одного или более антагонистов мускариновых M1-рецепторов (M1R-селективных антагонистов). При применении способов настоящего изобретения на практике один или более M1R-селективный антагонист может вводиться без других фармакологических агентов или в комбинации с другими фармакологическими агентами, например с одним или более антидепрессантом, не являющимся M1R-селективным антагонистом.
В соответствии с этим в своем первом аспекте настоящее изобретение предоставляет способы лечения одного или более психологических состояний или расстройств путем системного введения индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества одного или более M1R-селективных антагонистов, в результате чего излечивается одно или более психологическое состояние.
В связанном аспекте настоящее изобретение предоставляет способы лечения одного или более психологических состояний или расстройств путем введения индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества комбинации из одного или более M1R-селективных антагонистов и одного или более антидепрессантов, не являющихся M1R-селективными антагонистами, в результате чего излечивается одно или более психологическое состояние.
В одном воплощении психологическое расстройство представляет собой эмоциональное (аффективное) расстройство. В одном воплощении психологическое расстройство представляет собой депрессию. В одном воплощении психологическое расстройство выбирается из группы, состоящей из депрессии, тревожности, социального тревожного расстройства, агорафобии (патологической боязни открытого пространства), обсессивно-компульсивного расстройства (навязчивого невроза), посттравматического стрессового расстройства («вьетнамского синдрома»), телесного дисморфического расстройства, предменструального дисфорического расстройства и злоупотребления или зависимости от психоактивных веществ.
В другом аспекте настоящее изобретение предоставляет фармацевтические композиции, включающие смесь терапевтически эффективных количеств одного или более M1R-селективных антагонистов и одного или более антидепрессантов, не являющихся M1R-селективными антагонистами.
В другом аспекте настоящее изобретение предоставляет готовые наборы, включающие смесь терапевтически эффективных количеств одного или более M1R-селективных антагонистов и одного или более антидепрессантов, не являющихся M1R-селективными антагонистами.
В отношении воплощений для осуществления способов и для фармацевтических композиций и готовых наборов в одном воплощении один или более M1R-селективный антагонист выбирается из группы, состоящей из пирензепина, телензепина и их комбинаций. В одном воплощении M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер). В одном воплощении M1R-селективный антагонист представляет собой пирензепин.
В одном воплощении один или более M1R-селективные антагонисты вводятся без второго фармакологического агента.
В одном воплощении один или более M1R-селективные антагонисты вводятся в комбинации или совместно с одним или более антидепрессантами, не являющимися M1R-селективными антагонистами. В одном воплощении антидепрессант выбирается из группы, состоящей из селективного ингибитора обратного захвата серотонина (selective serotonin reuptake inhibitor, SSRI) и селективного ингибитора обратного захвата серотонина-норадреналина (selective serotonin-norepinephrine reuptake inhibitor, SNRI).
В одном воплощении антидепрессант представляет собой SSRI. В одном воплощении SSRI выбирается из группы, состоящей из циталопрама, эсциталопрама, флуоксетина, флувоксамина, пароксетина и сертралина. В одном воплощении SSRI выбирается из группы, состоящей из циталопрама, сертралина, пароксетина и флуоксетина.
В одном воплощении антидепрессант представляет собой SNRI. В одном воплощении SNRI выбирается из группы, состоящей из милнаципрана, миртазапина, венлафаксина, дулоксетина, десвенлафаксина и сибутрамина. В одном воплощении SNRI представляет собой венлафаксин.
Эффективные результаты могут быть достигнуты без длительного введения (timed administration) одного или более M1R-селективных антагонистов. Совместное введение активных агентов, включая антидепрессанты, также обеспечивает эффективные результаты без длительного введения.
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой флуоксетин (рацемат или оптический изомер).
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой флувоксамин.
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой сертралин или его S-энантиомер, Zoloft®.
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой циталопрам (или эсциталопрам).
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой пароксетин.
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой венлафаксин (рацемат или оптический изомер).
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой десвенлафаксин.
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой дулоксетин.
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой сибутрамин.
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой милнаципран.
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой миртазапин.
В одном воплощении один или более M1R-селективный антагонист представляет собой телензепин (рацемат или оптический изомер) и один или более антидепрессант, не являющийся M1R-селективным антагонистом, представляет собой бупропион.
В связанном аспекте настоящее изобретение предоставляет способы приготовления или применения медикамента для лечения одного или более психологических состояний, медикамента, содержащего терапевтически эффективное количество одного или более M1R-селективных антагонистов. Медикамент не обязательно может также содержать один или более антидепрессант, не являющийся M1R-селективным антагонистом. Воплощения для медикамента также здесь описаны.
В некоторых воплощениях способы и композиции настоящего изобретения включают комбинации описанных здесь фармакологических агентов. В некоторых воплощениях способы и композиции настоящего изобретения состоят, главным образом, из комбинаций описанных здесь фармакологических агентов.
Определения
Термин «психологическое расстройство» или «психологическое состояние» взаимозаменяемо обозначают расстройство мышления или эмоций, или расстройство мозга, которое приводит к нарушению у субъекта мышления, ощущений (чувств), настроения и способности общаться с другими субъектами. Психологическое расстройство или состояние может проявляться как несоответствующее обстоятельствам или ничем не вызванное выражение, например, раздражения, печали, страха, тревоги или других видов социопатического поведения. Примерные категории психологических расстройств включают, но ими не ограничиваются, эмоциональные расстройства, связанные со страхом расстройства, когнитивные расстройства, расстройства контроля над побуждениями, злоупотребление или зависимость от психоактивных веществ, синдром дефицита внимания и гиперактивности, нарушения пищевого поведения, двигательные расстройства и нарушения сексуальных функций. Примеры психологических состояний, которые излечиваются способами и композициями настоящего изобретения, включают, но ими не ограничиваются, депрессию, тревожность, социальное тревожное расстройство, агорафобию (патологическую боязнь открытого пространства), обсессивно-компульсивное расстройство (навязчивый невроз), посттравматическое стрессовое расстройство («вьетнамский синдром»), телесное дисморфическое расстройство, предменструальное дисфорическое расстройство и злоупотребление или зависимость от психоактивных веществ. Психологические расстройства описаны, например, в Halgin and Whitboume, Abnormal Psychology: Clinical Perspectives On Psychological Disorders, 4th Edition, 2005, McGraw-Hill College; Barlow and Antony, Handbook of Assessment and Treatment Planning for Psychological Disorders, 2002, Guilford Press; Claridge and Davis, Personality and Psychological Disorders, 2003, Oxford Univ Pr; and Clinical Handbook of Psychological Disorders: A Step-by-Step Treatment Manual, Barlow, Ed., 2001, Guilford Press. Диагностические показатели для известных психологических расстройств могут быть разработаны со ссылкой на Diagnostic and Statistical Manual of Mental Disorders (DSM IV, 2000, American Psychiatric Association).
Термин «эмоциональное расстройство» относится к любому расстройству настроения. Эмоциональные расстройства включают депрессию, манию, биполярное расстройство (маниакально-депрессивный психоз), сезонную (зимнюю) депрессию, тревожность, панику. См., например, Paykel, Handbook of Affective Disorders, 1992, Longman Group Ltd.
Термин «депрессия» относится к клиническому синдрому в соответствии с его значением, принятым в данной области техники (см., например. Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition, Text Revision [DSM-IV-TR]; American Psychiatric Association, 2000; American Psychiatric Publishing, Inc., Arlington, VA). Симптомы депрессии включают, но ими не ограничиваются, постоянное уныние, чувство пессимизма, отчаяние, чувство беспомощности, чувство собственной бесполезности, изменения в настроении, возбуждение, раздражительность, беспокойство, потерю интереса к видам деятельности, которые раньше нравились, или получения удовольствия от них, мысли о смерти или самоубийстве, неспособность сконцентрироваться или принимать решения, замедленное мышление, утомление, сниженную энергию, бессонницу или сонливость, потерю аппетита или переедание (обжорство), потерю веса или увеличение веса, постоянные головные боли или расстройства пищеварения, хроническую боль и ненормальные гормональные циркадные ритмы.
Термин «зависимость от психоактивного вещества» применяется в соответствии с его обычно понимаемым значением, известным специалистам в данной области техники. Например, клинический диагноз «зависимость от психоактивного вещества» согласно Международной классификации болезней требует, чтобы у индивидуума соблюдалось или проявлялось три или более условий из перечисленного ниже списка в течение некоторого времени в предшествующем году: (1) трудности в контроле поведения, касающегося приема вещества в плане начала приема, окончания или уровней употребления; (2) сильное желание или непреодолимое влечение к приему вещества; (3) прогрессирующее пренебрежение к альтернативным источникам удовольствия или интереса, связанное с применением психоактивного вещества, увеличение количества времени, необходимого для получения или приема вещества или для восстановления от действия вещества; (4) упорство в отношении приема вещества, несмотря на явные признаки очевидных вредных последствий, депрессивное состояние духа после приема повышенной дозы или связанное с веществом нарушение когнитивных функций; (5) признаки устойчивости, такие как необходимость повышенных доз психоактивного вещества для достижения эффектов, ранее обеспечиваемых меньшими дозами; (6) состояние психологического синдрома отмены, когда прием вещества прекращается или снижается, о чем свидетельствуют: характерный синдром отмены для вещества; применение того же самого (или близкого) вещества для того, чтобы снять или избежать симптомов синдрома отмены. Дополнительную информацию о зависимости от психоактивного вещества можно найти, например, на сайте nida.nih.gov Национального Института Лекарственной Зависимости (National Institute on Drug Abuse (NIDA)).
В используемом здесь значении термин «введение» означает пероральное («п.о.» введение, введение в виде суппозиториев, топическое (кожное) введение, внутривенное («в.в.»), внутрибрюшинное («в.б.»), внутримышечное («в.м.»), внутриочаговое (в пораженный участок), назальное или подкожное («п.к.») введение или имплантацию субъекту приспособления для медленного высвобождения, например мини-осмотического насоса. Введение осуществляется по любому пути, включая парентеральное введение и введение через слизистые оболочки (например, пероральное, назальное, вагинальное, ректальное или трансдермальное). Парентеральное введение включает, например, внутривенное, внутримышечное, внутриартериальное, внутрикожное, подкожное, внутрибрюшинное, внутрижелудочковое и внутричерепное введение. Другие способы доставки включают, но ими не ограничиваются, применение липосомных препаратов, внутривенное вливание, трансдермальные пластыри и т.д.
Термины «системное введение» и «системно введенный» относятся к способу введения соединения или композиции млекопитающему, при котором соединение или композиция доставляются к разным частям тела, включающим участок-мишень для фармакологического действия, через кровеносную систему. Системное введение включает, но ими не ограничивается, пероральное, назальное, ректальное и парентеральное (например, введение не через пищеварительный тракт, а другим способом, таким как внутримышечное, внутривенное, внутриартериальное, трансдермальное и подкожное введение), с условием того, что в применяемом здесь значении системное введение не включает прямого введения в участок мозга не через кровеносную систему, а другим способом, таким как интратекальная (подоболочечная) инъекция и внутричерепное введение.
Термин «совместное введение» относится к одновременному присутствию двух активных агентов в крови у индивидуума. Активные агенты, которые вводятся совместно, могут доставляться одновременно или последовательно.
В используемом здесь значении термины «лечение» и «лечить» относятся к отсрочке начала, замедлению или обращению развития или облегчению или предотвращению либо болезни, либо состояния, к которому применяется данный термин, либо одного или более симптомов такой болезни или состояния.
В используемом здесь значении термины «селективный антагонист M1-мускариновых рецепторов» и «M1R-селективный антагонист» относятся к антагонисту мускаринового ацетилхолинового рецептора, который демонстрирует предпочтительное взаимодействие с мускариновым рецептором M1-подтипа по сравнению с мускариновыми рецепторами подтипов M2 и М3. Примеры M1R-селективных антагонистов включают, но ими не ограничиваются, пирензепин и телензепин. Предпочтительное связывание не должно быть полным. Например, несмотря на сравнимое сродство к M1 и М4 подтипам рецепторов, пирензепин классифицируется как M1R-селективный антагонист.
Предпочтительное связывание M1R-селективного антагониста может быть измерено с помощью метода конкурентного вытеснения. M1R-селективный антагонист будет предпочтительно вытеснять известный M1R-селективный лиганд (например, пирензепин и/или телензепин) по сравнению с известными селективными M2 (например, трипитрамин, химбацин, метоктрамин) и М3 (например, дарифенацин, гексагидросиладифенидол) лигандами. Альтернативно этому M1R-селективный антагонист будет предпочтительно вытеснять неселективный мускариновый лиганд (например, хинуклидинилбензоат (QNB), N-метилскополамин (NMS)) из M1-подтипа рецептора по сравнению с вытеснением неселективного мускаринового лиганда из связанного состояния с подтипами рецепторов M2 и М3. Сравнительная эффективность для вытеснения радиоактивно меченных конкурентов может быть выражена в виде концентрации, при которой 50% конкурента вытесняется (IC50), или с помощью равновесной константы диссоциации (Kd). Значение IC50 и/или равновесная константа диссоциации могут быть рассчитаны с помощью подходящего программного обеспечения путем введения измеренных значений меченого лиганда в присутствии разных точных количеств немеченого исследуемого соединения (например, LIGAND (Munson P.J., and Rodbard D., Anal. Biochem. (1980) 107:220-39) или DATAPLOT, National Technical Information Services). M1R-селективный антагонист будет иметь значение IC50 или значение Kd для связывания с M1-подтипом рецептора, которое, по меньшей мере, в 3 раза меньше, предпочтительно, по меньшей мере, в 10 раз меньше и, более предпочтительно, по меньшей мере, в 30 раз меньше, чем значение IC50 или значение Kd для его связывания с подтипами рецептора M2 и М3. Подходящий анализ связывания радиолигандов с использованием радиоактивно меченных NMS или QNB, раскрыт в Buckley et al., Molecular Pharmacology (1989) 35:469-76 and Bolden et al., J Pharmacol Exp Ther. (1992) 260:576-80.
В используемом здесь значении выражение «состоящий в основном из» относится к родам или видам активных фармацевтических агентов, включенных в способ или композицию, а также к любым наполнителям, не обладающим активностью, для которой предназначены способы или композиции. В некоторых воплощениях выражение «состоящий в основном из» специально исключает включение одного или более дополнительных активных агентов, не являющихся M1R-селективным антагонистом и не являющихся антидепрессантом. В некоторых воплощениях дополнительные активные агенты, которые могут исключаться, включают один или более из ингибитора пролактина, стимулятора пролактина, антагониста 5-НТ-рецепторов, агониста 5-НТ-рецепторов, антагониста рецепторов NK-1 и/или ингибитора дипептидилпептидазы IV.
Термины «контролируемое высвобождение», «длительное высвобождение», «отсроченное высвобождение» и «продолжительное высвобождение» предназначены для обозначения взаимозаменяемо любой содержащей лекарство композиции, в которой высвобождение лекарства не является немедленным, например для композиции с «контролируемым высвобождением» пероральное введение не приводит к немедленному поступлению лекарства в абсорбируемый пул. Данные термины используются взаимозаменяемо для обозначения «не-немедленного высвобождения», как это определено в Remington: The Science and Practice of Pharmacy, 21s1 Ed., Lippencott Williams & Wilkins (2006). Как здесь обсуждается, немедленное и не-немедленное высвобождение могут быть определены кинетически с помощью следующего уравнения:
«Абсорбируемый пул» представляет собой раствор введенного лекарства в определенном участке всасывания, а константы kr, ka и ke представляют собой константы скорости первого порядка для (1) высвобождения лекарства из композиции, (2) поглощения и (3) выведения соответственно. Для лекарственных форм с немедленным высвобождением константа скорости высвобождения лекарства kr значительно больше, чем константа скорости поглощения ka. Для композиций с контролируемым высвобождением справедливо обратное, т.е. kr<<ka, так что скорость высвобождения лекарства из лекарственной формы представляет собой скорость-лимитирующую стадию в доставке лекарства в участок-мишень.
Термины «длительное высвобождение» и «отсроченное высвобождение» используются в их обычном смысле для обозначения композиции лекарства, которая обеспечивает постепенное высвобождение лекарства в течение длительного периода времени, например 12 часов или более, и, что предпочтительно, но не обязательно, приводит к поддержанию определенных стационарных уровней лекарства в крови в течение длительного периода времени.
В используемом здесь значении термин «отложенное высвобождение» относится к фармацевтическим препаратам, которые проходят через желудок в интактном виде и растворяются только в тонком кишечнике.
В используемом здесь значении термины «синергизм» или «синергический» взаимозаменяемо относятся к комбинированным эффектам двух активных агентов, которые больше, чем аддитивные (суммарные) эффекты этих агентов. Синергизм также может быть достигнут путем получения действенного эффекта при комбинировании неэффективных доз двух активных агентов. Мерой синергизма является независимая статистическая достоверность.
Краткое описание фигур
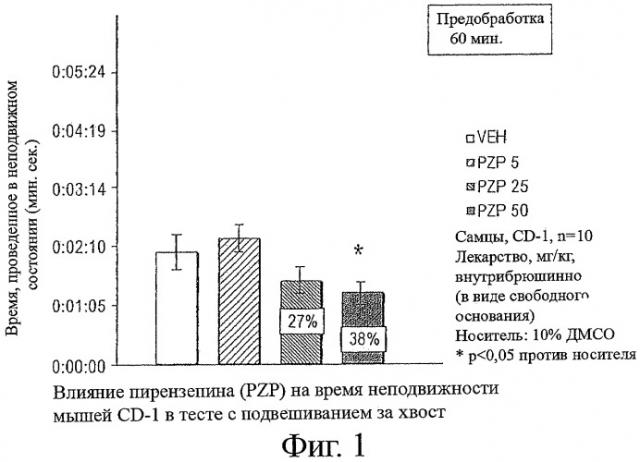
Фигура 1 показывает влияние внутрибрюшинного введения пирензепина (PZP) на время неподвижности мышей CD-I в тесте подвешивания за хвост (tail suspension test). Самцам мышей CD-I (n=10 в каждой группе) вводили пирензепин в виде свободного основания в дозах 5 мг/кг, 25 мг/кг или 50 мг/кг, как описано в приведенных ниже Примерах. Контрольным мышам (VEH) вводили 10% раствор ДМСО. * означает р<0,05 против VEH.
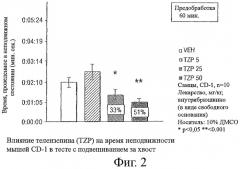
Фигура 2 показывает влияние внутрибрюшинного введения телензепина (TZP) на время неподвижности мышей CD-I в тесте подвешивания за хвост. Самцам мышей CD-I (n=10 в каждой группе) вводили телензепин в виде свободного основания в дозах 5 мг/кг, 25 мг/кг или 50 мг/кг, как описано в приведенных ниже Примерах. Контрольным мышам (VEH) вводили 10% раствор ДМСО. * означает р<0,05 против VEH. ** означает р<0,001 против VEH.
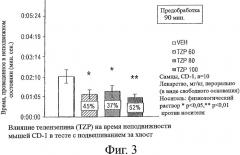
Фигура 3 показывает влияние перорального введения телензепина (TZP) на время неподвижности мышей CD-I в тесте подвешивания за хвост. Самцам мышей CD-I (n=10 в каждой группе) вводили телензепин в виде свободного основания в дозах 60 мг/кг, 80 мг/кг или 100 мг/кг, как описано в приведенных ниже Примерах. Контрольным мышам (VEH) вводили физраствор. * означает р<0,05 против VEH. ** означает р<0,01 против VEH.
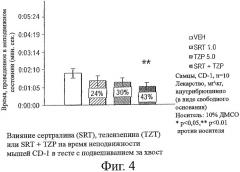
Фигура 4 показывает влияние совместного введения телензепина (TZP) и сертралина (SRT) на время неподвижности мышей CD-I в тесте подвешивания за хвост. Самцам мышей CD-I (n=10 в каждой группе) внутрибрюшинно вводили только телензепин в виде свободного основания (5,0 мг/кг), только сертралин (1,0 мг/кг) или совместно вводили телензепин (5,0 мг/кг) и сертралин (1,0 мг/кг), как описано в приведенных ниже Примерах. Контрольным мышам (VEH) вводили 10% раствор ДМСО. ** означает р<0,01 против VEH.
Фигура 5 показывает влияние совместного введения телензепина (TZP) и венлафаксина (VEN) на время неподвижности мышей CD-I в тесте подвешивания за хвост. Самцам мышей CD-I (n=10 в каждой группе) внутрибрюшинно вводили только телензепин в виде свободного основания (5,0 мг/кг), только венлафаксин (10 мг/кг) или совместно вводили телензепин (5,0 мг/кг) и венлафаксин (10 мг/кг), как описано в приведенных ниже Примерах. Контрольным мышам (VEH) вводили 10% раствор ДМСО. * означает р<0,05 против VEH. ** означает р<0,01 против VEH. «aa» означает р<0,01 против VEN. «b» означает р<0,05 против TZP.
Фигура 6 показывает влияние совместного введения телензепина (TZP) и флуоксетина (FLX) на время неподвижности мышей CD-I в тесте подвешивания за хвост. Самцам мышей CD-I (n=10 в каждой группе) внутрибрюшинно вводили только телензепин в виде свободного основания (10 мг/кг), только флуоксетин (4 мг/кг) или совместно вводили телензепин (10 мг/кг) и флуоксетин (4 мг/кг), как описано в приведенных ниже Примерах. Контрольным мышам (VEH) вводили 10% раствор ДМСО. ** означает р<0,01 против VEH.
Осуществление изобретения
1. Введение
Как обсуждалось выше, проведенные ранее исследования на крысах и мышах показали, что пирензепин при системном введении не приводит к проявлению каких-либо поведенческих эффектов (см. Rogoz Z., Skuza G., Sowinska H., Pol. J. Pharmacol. Pharm., 1981, vol.31, p.615-26) и что пирензепин не демонстрирует значительного проникновения через гематоэнцефалический барьер у разных видов, включая грызунов и человека (см. Hammer R., Koss F.W., Scand. J. Gastroenterol, Suppl., 1979, vol.14, №57, p.1-6; Bymaster F.P. et al., J. Pharmacol. Exp. Ther., 1993, vol.267, №1, p.16-24). Неожиданно, вопреки имеющимся в литературе публикациям, настоящее изобретение показало, что M1R-селективные антагонисты, включая пирензепин и телензепин, могут проходить сквозь гематоэнцефалический барьер в терапевтических количествах и вследствие этого обладают полезной антидепрессантной активностью при системном введении. Эти агенты также применимы для лечения других психологических состояний, которые часто лечатся с помощью антидепрессантов.
Настоящее изобретение также показывает, что применение M1R-селективных антагонистов в комбинации с некоторыми другими терапевтическими агентами обеспечивает неожиданные синергические эффекты, что выгодно для лечения психологических состояний, включая депрессию.
Настоящее изобретение предоставляет эффективное фармакологическое лечение депрессии, тревожности, социального тревожного расстройства, агорафобии (патологической боязни открытого пространства), обсессивно-компульсивного расстройства (навязчивого невроза), посттравматического стрессового расстройства («вьетнамского синдрома»), телесного дисморфического расстройства, предменструального дисфорического расстройства и злоупотребления или зависимости от психоактивных веществ (например, никотина, алкоголя, седативных препаратов и т.д.). Системное введение селективного антагониста M1-мускаринового рецептора (M1R-селективного антагониста) неожиданно обеспечивает антидепрессантное действие. Неожиданно оказалось, что терапевтически эффективные количества одного или более M1R-селективных антагонистов, эффективные в лечении психологических расстройств, включая депрессию, могут проходить сквозь гематоэнцефалический барьер при их системном введении субъекту. Кроме того, совместное введение одного или более M1R-селективных антагонистов и одного или более антидепрессантных агентов, не являющихся M1R-селективными антагонистами, неожиданно обеспечивает более сильное антидепрессантное действие, чем действие, которое достигается при введении любой из этих категорий лекарств по отдельности.
2. Способы лечения психологических расстройств
а. Состояния, являющиеся объектом лечения
Способы и композиции настоящего изобретения нашли применение в лечении психологических расстройств. Примеры общих категорий психологических расстройств, которые поддаются излечению с помощью способов и композиций настоящего изобретения, включают, но ими не ограничиваются: (1) эмоциональные расстройства, тревожные состояния и расстройства контроля над побуждениями (включая патологическое переедание (обжорство)), (2) расстройства, связанные со злоупотреблением/зависимостью от психоактивных веществ (например, привыкание к наркотикам), (3) когнитивные расстройства, синдром дефицита внимания и гиперактивности, (4) двигательные расстройства и нарушения сексуальных функций и (5) нарушения пищевого поведения (например, нервная анорексия и нервная булимия).
Действие ацетилхолина на мускариновые рецепторы в центральной нервной системе оказывает влияние на различные типы поведения, включая когнитивность, понимание, витальность (бессонницу), эмоции, сенсомоторные связи и как рефлекторную, так и произвольную подвижность (Bymaster et al., Curr Drug Targets CNS Neural Disord (2002) 1:163-181). Мускариновые рецепторы оказывают влияние на эти функции не только через взаимодействие с холинергическими нейронами, но также и через модуляцию активности дофаминергических, ГАМК-ергических и глутаматергических нейронов переднего/среднего мозга. Исследования нейролокализации и микродиализ подтвердили, что мускариновые рецепторы и их агонисты и антагонисты оказывают влияние на эти системы, причем направление модуляции (возбуждение/ингибирование) зависит от специфического подтипа рецепторов. В частности, локальная микроинъекция предпочтительного М1/М4-антагониста, пирензепина, приводит к пониженному выбросу дофамина в полосатом теле (Smolders et al., J Neurochem (1997) 68:1942-1948). Подобно этому, при прямой инъекции в средний мозг предпочтительного М1/М4-антагониста, телензепина, наблюдается снижение выброса ГАМК (Smolders et al., 1997, supra). Подобным же образом неселективные к подтипам рецепторов антагонисты, такие как скополамин, вызывают повышение уровней ацетилхолина в переднем мозге (Izurieta-Sanchez et al., Eur J Pharmacol (2000) 399:151-160).
В отношении злоупотреблений и зависимостей от психоактивных веществ считается, что мезолимбические дофаминовые сети играют важную роль в формировании и закреплении такой зависимости (Berridge and Robinson, Brain Res Brain Res Rev (1998) 28:309-369; Crespo et al., J Neurosci (2006) 26:6004-6010; Di Chiara and Imperato, Proc Nati AcadSci USA (1988) 85:5274-5278; Hemandez and Hoebel, Life Sci (1988) 42:1705-1712). Исследования на грызунах показали, что специфическая структура в полосатом теле, прилежащее ядро (центр удовольствия) (nucleus accumbens, NAc), вовлечена в регуляцию поощрения и отвращения (reward and aversion). NAc расположен в медиовентральном стриатуме и может далее быть подразделен на субтерритории оболочки (коры), ядра и клювовидного отростка (Zahm and Brog, Neuroscience (1992) 50:751-767).
Крысы будут сами вводить себе агонисты дофамина в область NAc (Hoebel et al., Psychopharmacology (Berl) (1983) 81:158-163), и было показано, что большое число соединений, которые, как известно, вызывают зависимость и привыкание у людей, увеличивают внеклеточные уровни дофамина в области NAc (Di Chiara and Imperato, 1988, supra; Hemandez and Hoebel, 1988, supra; Rada et al., Pharmacol Biochem Behav (1996) 53:809-816). В противоположность этому было обнаружено, что пониженный уровень внеклеточного дофамина в прилежащем ядре (центре удовольствия) сопровождает чувство отвращения во время индуцированного морфином и индуцированного никотином синдрома отмены (Acquas and Di Chiara, (1992) J Neurochem 58:1620-1625; Diana et al., J Pharmacol Exp Ther (1995) 272:781-785; Pothos et al., Brain Res (1991) 566:348-350; Rada et al., Psychopharmacology (Berl) (2001) 157:105-110). По-видимому, эффекты дофамина опосредованы через подтипы рецепторов D1 и D2. Было показано, что введение D1 или D2 агонистов дофамина в область коры, но не ядра NAc, восстанавливает поведение, направленное на поиски психоактивного вещества у крыс, которые были оперантно приучены к подавлению тяги к кокаину, но после введения они демонстрировали поведение, направленное на замену физиологического раствора кокаином (Schmidt et al., Eur J Neurosci (2006) 23:219-228).
По всей вероятности, в пределах NAc холинергические и дофаминергические сети фармакологически действуют в противоположных направлениях. Сообщалось, что локальное введение в центр удовольствия либо атропина (неспецифический мускариновый антагонист), либо мекамиламина (неспецифический никотиновый антагонист) блокирует усиление тяги к опиатам (Crespo et al., 2006, supra), тогда как морфин снижает уровни ацетилхолина в NAc (Fiserova et al., Psychopharmacology (Beri) (1999) 142:85-94; Rada et al., Neuropharmacology (1991) 30:1133-1136), а индуцированный налоксоном синдром отмены опиатов увеличивает уровни ацетилхолина (Fiserova et al., 1999, supra; Rada et al., 1991 supra; Rada et al., 1996, supra). Подобный феномен наблюдался в связи с индуцированным мекамиламином синдромом отмены у никотин-зависимых крыс (Rada et al., 2001, supra). В поддержку широкой общей связи между повышенным уровнем ACh и тревожными состояниями говорит то, что ACh высвоб