Способ лечения острого нарушения мозгового кровообращения ишемического и геморрагического характера
Иллюстрации
Показать всеИзобретение относится к медицине и касается способов лечения острых нарушений мозгового кровообращения. Способ лечения острого нарушения мозгового кровообращения ишемического и геморрагического характера заключается во введении фармкомпозиции, содержащей в качестве биологически активного вещества белково-полипептидный комплекс, полученный из быстрозамороженного эмбрионального мозга сельскохозяйственных копытных животных сроком гестации от середины первой до середины последней трети беременности, в количестве 0,05-0,8 мг/сут подкожно, внутримышечно, внутривенно, интраназально или интратекально. Указанный белково-полипептидный комплекс включает отрицательно заряженные слабокислые, нейтральные белки и полипептиды, относящиеся к факторам роста, дифференцировки, сигнальным молекулам, молекулам межклеточной адгезии, с молекулярными массами от 5 до 200 кДа, причем не менее 80% от общей массы белка имеют молекулярную массу от 10 до 120 кДа, и характеризуется наличием пика при длине волны 274-284 нм в УФ-видимой области спектра и наличием полос в интервале значений рI от 4,2 до 8,4 при изоэлектрофокусировке в 5%-ном полиакриламидном геле. Указанный белково-пептидный комплекс безопасен и хорошо переносится при его применении, эффективен в лечении больных с острым нарушением мозгового кровообращения, что обеспечивает клинически значимое влияние на показатели выживаемости, динамику и сроки восстановления утраченных функций у больных при использовании способа. 3 з.п. ф-лы, 9 табл., 23 пр.
Реферат
Изобретение относится к области медицины и касается нового способа лечения острых нарушений мозгового кровообращения при применении нейропротективных средств.
Острые нарушения мозгового кровообращения (ОНМК) являются актуальной медико-социальной проблемой современной медицины, что обусловлено их высокой долей в структуре заболеваемости и смертности населения, значительными показателями временных трудовых потерь и первичной инвалидности. Смертность от сосудистых заболеваний мозга в нашей стране, среди которых особо выделяют ишемические и геморрагические инсульты, в структуре общей смертности занимает второе место, ненамного уступая смертности от сердечных заболеваний. Летальность в острой стадии инсульта составляет 35%, увеличиваясь на 12-15% к концу первого года. Инвалидизация вследствие инсульта занимает первое место среди всех причин первичной инвалидности. Последствия инсульта выражаются в повреждении и часто гибели участка мозга, затронутого инсультом, который уже не может выполнять свои функции, что влечет за собой всевозможные нарушения речи, сознания, координации движений, зрения, чувствительности и параличи.
Известен целый ряд препаратов белково-пептидной природы из сырья животного происхождения, обладающие ноотропной и нейрометаболической активностью, которые используются для лечения заболеваний нервной системы. К этим препаратам относятся:
1. Церебролизин - средство для лечения геморрагического или ишемического инсультов фирмы «Ebewe» (Австрия) [1], - является продуктом обработки мозга интактных свиней;
2. Цереброкурин - лечебное средство при заболеваниях, сопровождающихся нарушением функций центральной нервной системы, фирмы ООО «НИР» (Украина) [2], - является продуктом обработки мозга эмбрионов животных;
3. Кортексин - препарат полипептидной природы, получаемый путем экстракции из коры головного мозга крупного рогатого скота и свиней, фирмы ООО «Герофарм» (Россия) [3], обладающий ноотропным, церебропротекторным, противосудорожным и антиоксидантным действием;
4. Церебролизат - препарат, повышающий устойчивость ткани головного мозга к интоксикации, гипоксии, гипогликемии, механической травме, фирмы «Микроген» НПО ФГУП (Иммунопрепарат) [4], обладающий ноотропным действием, представляющий собой гидролизат коры головного мозга крупного рогатого скота.
5. Семакс (Met-Glu-His-Phe-Pro-Gly-Pro) - синтетический полипептид - аналог фрагмента АКТГ/4-10/, обладающий ноотропными свойствами и лишенный гормональной активности. [5].
В состав "Церебролизина" входят аминокислоты (~85%), низкомолекулярные пептиды (-15%), микроэлементы, сырьем для получения которых служит мозг свиней. Нейропротективное и трофическое действие препарата осуществляется за счет специфических пептидов и аминокислот, молекулярной массы не выше 10000 дальтон, из которых доминирующими и определяющими свойства препарата являются аланин, лейцин и лизин. Препарат предназначен для внутримышечного, внутривенного введения и обладает невысокой концентрацией биологически активных компонентов, поэтому вводится в организм больного в значительных дозах длительное время (под ред. Ю.Ф.Крылова. Регистр лекарственных средств России. - М.: Инфармхим., 1993, с.935). Разнородность входящих в препарат пептидов (по молекулярной массе, формуле и свойствам) не позволяет с определенностью связать положительные эффекты препарата с конкретной составляющей субстанцией. Действие церебролизина проявляется, прежде всего, преимущественным его влиянием на выраженность очагового неврологического дефекта. Вместе с тем изолированное назначение церебролизина, например, при исходнотяжелых инсультах, сопровождающихся не только очаговой, но и общемозговой симптоматикой, признаками отека мозга, часто оказывается недостаточно эффективным и требует совместного его применения с другими противоишемическими препаратами. Кроме того, выявлена сильная зависимость эффективности церебролизина от адекватности выбранной дозы. Бесконтрольное избыточное повышение дозы церебролизина часто оказывает негативное влияние на темпы и выраженность восстановительных процессов. Таким образом, основными недостатками известного препарата являются значительная продолжительность курса лечения, низкая активность и специфичность препарата в связи со слабым нейропротективным действием, обладая и крайне низким регенеративным, в том числе и репаративным потенциалом для нервной ткани.
В состав «Цереброкурина» входят водорастворимые пренатальные нейропептиды и продукты расщепления неактивных высокомолекулярных предшественников из гомогенизата мозга эмбрионов животных, который после разбавления физиологическим раствором подвергают взаимодействию с иммобилизованным протеолитическим ферментом, причем режим взаимодействия устанавливают исходя из контрольной пробы получаемого средства, и полученный раствор выдерживают в течение 30 суток при температуре не выше 10°С. С помощью данной технологии достигается более высокая (по сравнению с Церебролизином) активность получаемого средства и значительно расширяется спектр его действия, за счет более высокой массы содержащихся пептидов и низкомолекулярных белков, оставшихся после протеолиза. Однако, несмотря на длительное формирование раствора до окончания процессов агрегации и протеолиза, данная технология не позволяет получить фракцию необходимой степени очистки для применения препарата внутривенно, что значительно затрудняет его биодоступность. Водная экстракция без буферизации раствора, детергентов, ингибиторов протеолиза и солюбилизаторов на этапах получения Цереброкурина, а также неопределенные сроки гестации эмбрионального мозга животных не позволяют обеспечить необходимую степень стандартизации, что допускает значительный разброс по составу полученных эволюционно закрепленных белково-пептидных концентрационных соотношений, снижая его тканеспецифическую нейрорегенеративную активность и стабильность фармакологического действия, ограничиваясь биологическим действием по типу обратной связи за счет сигнальной функции продуктов протеолиза ткани.
В состав «Кортексина» входит комплекс водорастворимых биологически активных щелочных, кислых и нейтральных полипептидов с мол. м. от 500 до 15000 Да и изоэлектрической точкой 3,5-9,5, получаемых из измельченной замороженной ткани головного мозга скота, путем экстракции раствором уксусной кислоты, содержащей хлористый цинк, отделения осадка, обработки надосадочной жидкости ацетоном, промывки образовавшегося осадка ацетоном, высушивания с последующей очисткой, стерилизации и лиофилизации целевого продукта. Препарат предназначен для внутримышечного введения и обладает невысокой концентрацией биологически активных низкомолекулярных компонентов, поэтому вводится в организм больного в значительных дозах длительное время. Несмотря на то, что препарат участвует в регуляции соотношений тормозных и возбуждающих аминокислот, концентрации серотонина и дофамина, оказывая ГАМК-позитивное влияние, снижает токсические эффекты нейротропных веществ, улучшает процессы обучения и памяти, ускоряет восстановление функций головного мозга после стрессовых воздействий. Кортексин имеет невысокую активность и специфичность в связи со слабым нейропротективным действием, обладая и низким регенеративным, в том числе незначительным репаративным потенциалом для нервной ткани, что требует значительной продолжительности курсового лечения.
В состав «Церебролизата» также входят водорастворимые полипептиды, как результат гидролиза коры головного мозга крупного рогатого скота, обладающие слабой ферментативной активностью, с молекулярной массой не более 15000 Да. Обозначенная в патенте вариация аминокислотного состава препарата допускает значительный разброс по составу полученных пептидных концентрационных соотношений, определяя низкую тканеспецифическую активность и стабильность фармакологического действия - со слабым нейрометаболическим и невыраженным ноотропным эффектом.
Семакс (Met-Glu-His-Phe-Pro-Gly-Pro) - синтетический аналог фрагмента АКТГ/4-10/, где все аминокислоты гептапептида являются L-формами. Препарат влияет на процессы, связанные с формированием памяти и обучением. Усиливает избирательное внимание при обучении и анализе информации, улучшает консолидацию памятного следа; улучшает адаптацию организма к гипоксии, церебральной ишемии, общей анестезии и др. повреждающим воздействиям. В условиях нервно-психического утомления облегчает концентрацию внимания, улучшает операторскую деятельность, способствует сохранению и ускоряет восстановление умственной работоспособности в качестве стимулятора памяти пролонгированного действия.
В настоящее время на фоне неуклонного роста заболеваний нервной системы сосудистого, токсического, инфекционного и аутоиммунного генеза не существует препаратов группы прямых репарантов, специфичных для нервной ткани.
Технической задачей заявленного изобретения является повышение эффективности способа лечения острых нарушений мозгового кровообращения с использованием подбора условий и режимов дозирования высокоэффективного лекарственного средства - белково-полипептидного комплекса при лечении острых нарушений мозгового и спинального кровообращения в зависимости от характера и тяжести состояния пациента, стадии развития заболевания для сокращения сроков курсового лечения, обеспечение положительной динамики объективных неврологических показателей больных.
Поставленная техническая задача достигается способом лечения острых нарушений мозгового кровообращения путем введения подкожно или внутримышечно, интраназально или интратекально с первых часов появления острой очаговой неврологической симптоматики фармацевтической композиции, обладающей тканеспецифическим репаративным действием на нервную ткань, содержащей белково-полипептидный комплекс и фармацевтически приемлемый разбавитель, содержащий фармокопейный буферный раствор и вспомогательные вещества, включающие высокомолекулярные вещества, стабилизаторы, консерванты и салюбилизаторы, в количестве 0,05-0,8 мг/сут в расчете на белково-полипептидный комплекс, при этом используют белково-полипептидный комплекс, полученный из эмбрионального мозга сельскохозяйственных животных сроком гестации от середины первой до середины последней трети беременности и включающий отрицательно заряженные слабокислые нейтральные белки и полипептиды, относящиеся к факторам роста, дифференцировки, сигнальным молекулам, молекулам межклеточной адгезии, определяющим его биологическую и фармакологическую активность, с молекулярной массой от 5 до 200 кДа, причем не менее 80% от общей массы белка имеют молекулярную массу в диапазоне от 10 до 120 кДа, и характеризующийся наличием пика при длине волны 274-284 нм в УФ-видимой области спектра и наличием полос в интервале значений изоэлектрической точки рI от 4,2 до 8,4 при изоэлектрофокусировке в 5%-ном полиакриламидном геле.
В зависимости от тяжести состояния пациента осуществляют подкожное, внутримышечное, внутривенное, интраназальное или интратекальное введение фармацевтической композиции с первых часов появления острой очаговой неврологической симптоматики, при этом при осуществлении заявленного способа используют следующие дозы и способы введения указанной фармацевтической композиции.
При средней степени тяжести (суммарный клинический бал по шкале комы Глазго - не ниже 12 баллов, шкале инсульта (NISS) - нe выше 7 баллов) рекомендуемая доза в расчете на количество белково-полипептидного комплекса составляет соответственно 0,1-0,2 мг по 1-2 мл 0,1% раствора путем подкожного или внутримышечного введения 1-2 раза в сутки или осуществляют интраназальное введение 0,1% раствора по 200-400 мкл в каждый носовой проход утром и днем в течение 7-10 суток с повтором курса в раннем реабилитационном периоде через 5-10 дней.
При тяжелом состоянии (на момент поступления: суммарный клинический балл по шкале Глазго - не выше 7 и не выше 12 баллов, по шкале Инсульта (NIHSS) не ниже 7 и не выше 14 баллов) рекомендуемая доза фармкомпозиции в расчете на количество белково-полипептидного комплекса в суточной дозе от 0,2 до 0,6 мг/сут по 2-3 мл 0,1%-ного раствора путем подкожного или внутримышечного введения 1-2 раза в сутки или путем внутривенной медленной инфузии 0,2-0,4 мг/сут по 2-4 мл 0,1%-ного раствора 1 раз в сутки в течение 5-10 суток с повтором курса в раннем реабилитационном периоде через 5-10 дней.
При состоянии пациента на момент поступления с крайней степенью тяжести с выраженным нарушением сознания доза препарата (фармкомпозиции, включающей указанный белково-полипептидный комплекс) составляет от 0,4 до 0,8 мг/сут в виде внутривенной медленной инфузии 0,2-0,4 мг/сут 2-4 мл 0,1% раствора 1-2 раза в сутки в течение 7-10 суток или итратекальное введение 0,2-0,4 мг/сут 2-4 мл 0,1% раствора 1 раз в 2-4 дня (при отсутствии абсолютных противопоказаний в люмбальной пункции с дальнейшим переходом на внутривенное или подкожное введение соответствующих разовых и курсовых доз согласно тяжести пациента).
Итак, при осуществлении способа лечения острых нарушений мозгового и спинального кровообращения используют новое нейропротекторное средство, стимулирующее физиологическую и репаративную регенерацию нервной ткани, которое представляет собой белково-полипептидный комплекс, полученный из эмбриональной нервной ткани копытных сельскохозяйственных животных, с молекулярной массой входящих в него нейтральных и слабокислых белков и полипептидов молекулярной массой от 5 до 200 кДа, являющихся фактором роста, дифференцировки и сигнальными молекулами в дозе 0,1-0,8 мг/сут по 1-4 мл 0,1%раствора путем подкожного, внутримышечного или внутривенного введения 1-2 раза в сутки или интраназальное введение 0,1% раствора по 0,2-0,4 мл в каждый носовой ход утром и днем в течение 7-14 суток с повтором курса через 5-14 дней. При тяжелых инсультах рекомендовано применение комплекса в суточной дозе до 0,6 мг, при состоянии пациентов крайней степени тяжести с выраженным нарушением сознания - до 0,8 мг в сутки или интратекальное введение 0,4 мг препарата 1 раз в 2-4 дня, при отсутствии абсолютных противопоказаний к люмбальной пункции. Способ оказывает благоприятное действие на выраженность и темпы восстановительных процессов, способствует ускорению регресса общемозговых и очаговых нарушений (Таблицы 3-4).
Итак, в заявленном способе используют фармкомпозицию, содержащую в качестве фармакологической субстанции (биологически-активного вещества) белково-полипептидный комплекс, полученный следующим образом:
- быстрозамороженный головной мозг эмбрионов копытных сельскохозяйственных животных сроком гестации от середины первой трети, до середины последней трети беременности размораживают и поэтапно, при режимах температур от 2° до 28°С:
- гомогенизируют в буферном растворе с одновременной экстракцией в присутствии ингибиторов протеолиза и неионных детергентов при рН не менее 5,2 и не выше 8,5, в объемных соотношениях раствора и ткани не менее 1: 0,5;
- отделяют гомогенат от нерастворившихся тканевых и клеточных компонентов центрифугированием при значении g в интервале 10000-30000 в течение 90-30 мин., соответственно;
- фильтруют супернатант поэтапно, заканчивая фильтрами с величиной пор не более 0,45 мкм;
- фильтрат подвергают анионообменной хроматографии, используя в качестве подвижной фазы солевой буферный раствор, разделяя связавшиеся с сорбентом белки и полипептиды ступенчатым градиентом с помощью элюента, имеющего ионную силу в интервале от 0,08 до 0,26 моль/л и рН от 5,2 до 8,5, повышая ионную силу подвижной фазы с шагом 0,02 моль/л, начиная сбор целевых фракций с раствором, ионная сила которого не ниже 0,1;
- собранные целевые фракции обессоливают методом диализа или гельфильтрации и после добавления консервантов с бактериостатическим и фунгицидным действием в общей концентрации не более 0,06 мг/мл и солюбилизатора в общей концентрации не более 0,01 мг/мл проводят ультрафильтрацию с величиной пор не более 0,22 мкм и стерильно упаковывают.
Полученный комплекс включает отрицательно заряженные слабокислые, нейтральные белки и полипептиды, относящиеся к факторам роста, дифференцировки, сигнальным молекулам, определяющие его биологическую и фармакологическую активность, с молекулярными массами от 5 до 200 кДа, причем не менее 80% от общей массы белка имеет молекулярную массу в диапазоне от 10 до 120 кДа, характеризующийся наличием пика при длине волны 274-284 нм в УФ-видимой области спектра и наличием полос в интервале значений рI от 4,2 до 8,4 при изоэлектрофокусировке в 5%-ном полиакриламидном геле.
Чтобы не нарушать порядок описания заявленного технического решения и излишне его не загромождать, более подробные сведения, касающиеся комплекса, приведены в конце данного описания.
На основе полученного таким образом биологически активного комплекса (белково-полипептидного комплекса) получают фармкомпозицию, содержащую белково-полипептидный комплекс в терапевтически эффективных количествах и фармацевтически приемлемые добавки, включающие фармацевтически приемлемый разбавитель в виде фармакопейного буферного раствора (например, фосфатный буфер), высокомолекулярные вещества (например, кармелоза), стабилизаторы (например, маннитол), консерванты (например, нипагин), солюбилизаторы (например, полисорб-80).
Пример получения данной фармкомпозиции
Полученный раствор биологически-активного комплекса из
эмбрионального мозга свиней разбавляют 50 мМ глициново-фосфатным буферным раствором, содержащим консерванты (нипагин или бензалкония хлорид) и солюбилизаторы (маннитол, кармелозу, полисорбат 80) в фармокопейно-приемлемых концентрациях и двузамещенного фосфорнокислого натрия до рН 8,0 с расчетом конечной концентрации общего белка в полученном растворе в пределах 0,9-1,2 мг/мл.
Полученную фармкомпозицию подвергают стерилизующей фильтрации через мембранный фильтр с диаметром пор не более 0,1 мкм, разливают в стерильные стеклянные флаконы и закупоривают.
Таким образом, входящий в используемой в заявленном способе фармкомпозиции указанный белково-полипептидный комплекс выполняет функцию эффективного лекарственного средства в остром, подостром и раннем реабилитационном периодах нарушения мозгового кровообращения, как ишемического, так и геморрагического характера, с рекомендациями адекватных режимов суточного и курсового дозирования в зависимости от характера патологического процесса и тяжести состояния пациентов. Биологическая и фармакологическая активность белково-полипептидного комплекса осуществляется за счет наличия эффективных, эволюционно закрепленных тканеспецефических концентрационных соотношений водорастворимых отрицательно заряженных слабокислых, нейтральных белков и полипептидов, относящихся к факторам роста, дифференцировки, сигнальным молекулам, обеспечивая тем самым тканеспецефическое репаративно-регенеративное действие. Однако возможность и особенности применения данного известного комплекса в качестве средства лечения острых нарушений мозгового кровообращения не описана.
Клиническая эффективность применения белково-полипептидного комплекса с обоснованием режимов дозирования в зависимости от характера, тяжести состояния пациента и стадии развития заболевания, сокращением сроков курсового лечения, положительной динамики объективных неврологических показателей больных в лечении острых нарушений мозгового кровообращения подтверждено проведенным многоцентровым рандомизированным сравнительным открытым клиническим исследованием. Наряду с безопасностью, хорошей переносимостью белково-полипептидного комплекса и отсутствием каких-либо побочных нежелательных явлений применение препарата с первых часов нарушения мозгового кровообращения вызывало снижение выраженности общемозговой и очаговой неврологической симптоматики, вплоть до полного восстановления утраченных функций. Наибольшая активность комплекса проявлялась в отношении регресса двигательных нарушений у больных в остром периоде мозгового инсульта. В этом случае к 6-10 суткам выраженность неврологического дефицита в двигательной сфере снижалась почти вдвое по сравнению с группой клинического контроля, получавшей сопоставимую комплексную дифференцированную терапию. Визуализация размеров очага с помощью инструментальных методов исследования (КТ и МРТ) показало достоверное уменьшение размеров зоны повреждения мозговой ткани и перифокального отека по сравнению с группой клинического контроля.
Всего в данное исследование было включено 120 больных с острым нарушением мозгового кровообращения, 60 из которых составили контрольную группу. Все больные с момента поступления в клинику получали комплексную дифференцированную терапию, включающую коррекцию дыхательных расстройств, нарушений центральной и церебральной гемодинамики, гемореологии, при необходимости - коррекцию нарушений гомеостаза с динамическим контролем лабораторных показателей. У всех пациентов метаболически активные препараты не применялись на протяжении всего острого периода инсульта, что позволило оценить с помощью клинических шкал (шкала Инсульта (NIHSS), Тест Информация - Память - Концентрация внимания, Опросник Речи, индекс Бартел) и динамического лабораторно-инструментального обследования (КТ и МРТ головного мозга; ультразвуковое интракраниальное дуплексное сканирование сосудов головного мозга; клинический, биохимический и реологический анализы крови) влияние исследуемого белково-полипептидного комплекса на патофизиологические и патоморфологические процессы перестройки взаимоотношений нервной и сосудистой системы на фоне комплексной дифференцированной терапии заболевания, широко применяемой в различных неврологических стационарах. В группу обследуемых больных не включались лица, страдающие заболеваниями периферической нервной системы, наследственно-дегенеративными, аутоиммунными и инфекционными заболеваниями. Из группы были исключены лица, у которых диагноз острого инсульта впоследствии не подтвердился дополнительно данными компьютерного или магнитно-резонансного томографического исследования головного мозга.
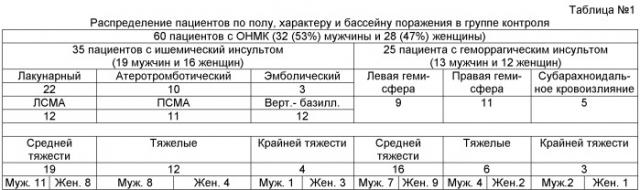
Клиническая характеристика больных с острым нарушением мозгового кровообращения, получавших базисную терапию, рандомизированных в группу сравнительного контроля: распределение пациентов по возрасту, полу, характеру и бассейну поражения при остром нарушении мозгового кровообращения в контрольной группе (см. в табл. №1).
60 Больных с острым нарушением мозгового кровообращения (50% от всех исследованных: 32 мужчин (53%) и 28 женщин (47%) в возрасте от 36 до 80 лет) были рандомизированы в группу контроля и получали комплексную дифференцированную терапию, включающую нормоволемическую управляемую гемодилюцию, восстановление водно-солевого балланса, кислотно-щелочного равновесия, направленных на поддержание внутреннего гомеостаза пациента, обеспечение клиренса продуктов метаболизма, стабилизацию работы сердечнососудистой системы с коррекцией артериального давления.
Из 60 больных, получавших базисную терапию, у 35 было верифицировано ишемическое поражение головного мозга следующих патогенетических вариантов: у 22(37%) - лакунарный инфаркт, у 10(16%) атеротромботический и у 3(5%) - эмболический.
У 25(42%>) больных (13 мужчин и 12 женщин) было верифицировано острое нарушение мозгового кровообращения по геморрагическому типу, у 20 из которых отмечалось паренхиматозное кровоизлияние в гемисфере головного мозга (у 9 - в левой гемисфере головного мозга и у 11 - в правой), а у 5 пациентов выявлено субарахноидальное кровоизлияние. При поступлении:
- у 35(58%) больных состояние оценивалось как средней тяжести (суммарный клинический балл не превышал 18 баллов по шкале Инсульта (NIHSS) и был не ниже 12 баллов по шкале комы Глазго);
- состояние 18(30%) пациентов расценивалось как тяжелое;
- 7(12%) пациентов были включены в исследование с крайней степенью тяжести 60 больных (суммарный клинический балл превышал 18 баллов по шкале Инсульта (NIHSS) и был ниже 12 баллов по шкале комы Глазго).
Клиническая характеристика больных, рандомизированных в группу, получавших белково-полипептидный комплекс: 60 больных (50% от всех исследованных: 36 мужчин (60%) и 24 женщины (40%) в возрасте от 36 до 80 лет) на фоне комплексной дифференцированной терапии в течение 10 дней и с 21-х по 28-е сутки получали белково-полипептидный комплекс (ЗАО «Фарм-Синтез», Москва) по 1-4 мл 0,1% раствора путем подкожного, внутримышечного или внутривенного введения 1-2 раза в сутки или интраназальное введение 0,1% раствора по 0,2-0,4 мл в каждый носовой ход утром и днем в течение 7-14 суток с повтором курса через 5-14 дней. При тяжелых инсультах рекомендовано применение комплекса в суточной дозе до 0,6 мг, при состоянии пациентов крайней степени тяжести с выраженным нарушением сознания - до 0,8 мг в сутки или интратекальное введение 0,4 мг препарата 1 раз в 2-4 дня при отсутствии абсолютных противопоказаний к люмбальной пункции.
Из 60 больных, получавших исследуемый препарат, у 38 было верифицировано ишемическое поражение головного мозга следующих патогенетических вариантов: у 20(33%) - лакунарный инфаркт, у 12(20%) атеротромботический, а у 6(10%) - эмболический. Распределение больных с острым нарушением мозгового кровообращения по ишемическому типу в зависимости от сосудистого бассейна и тяжести пациента (см. в табл.№2). У 22 (37%) больных (12 мужчин и 10 женщин) было верифицировано острое нарушение мозгового кровообращения по геморрагическому типу, у 18 из которых отмечалось паренхиматозное кровоизлияние в гемисфере головного мозга (у 10 - в левой гемисфере головного мозга и у 8 - в правой), а у 4 пациентов выявлено субарахноидальное кровоизлияние.
При поступлении:
- у 34 (57%) больных состояние оценивалось как средней тяжести (суммарный клинический балл не превышал 18 баллов по шкале Инсульта (NIHSS) и был не ниже 12 баллов по шкале комы Глазго);
- состояние 17 (28%) пациентов расценивалось как тяжелое;
- 9 (15%) пациентов были включены в исследование с крайней степенью тяжести, четырем из которых (1 пациенту с обширным паренхиматозным ишемическим инсультом и трем с геморрагическим препарат вводился интратекально).
У 52 больных отмечались признаки атеросклероза сосудов головного мозга и сердца, в 49 случаях сочетающегося с гипертонической болезнью. В 2 случаях у больных в возрасте до 50 лет наблюдалась артериальная гипертензия почечного генеза (нефрит и мочекаменная болезнь) и в 2 случаях высокие цифры артериального давления были обусловлены злокачественной наследственной формой гипертонической болезни. В 5 наблюдениях определялось сочетание сахарного диабета с атеросклерозом сосудов головного мозга и гипертонической болезнью. У 12 больных в анамнезе отмечались инфаркты миокарда. Сопутствующие нарушения сердечного ритма выявлялись у 11 человек в виде мерцательной аритмии постоянной формы и у 1 - в виде пароксизмов мерцания предсердий. В 47% случаев инсульт развился остро, с максимальным проявлением клинической симптоматики в течение 1 часа заболевания. В 53% случаев отмечалось подострое развитие инсульта (в течение нескольких часов). 72% больных могли связать возникновение заболевания с предшествующим действием какого-либо неблагоприятного фактора. В 7 случаях провоцирующим фактором явилось физическое перенапряжение (в 5 из них - в сочетании с отменой или нерегулярным приемом антигипертензивных препаратов), в 3 случаях - психоэмоциональное перенапряжение; 5 больных отмечали злоупотребление алкоголем накануне развития инсульта, у 2 больных провоцирующим моментом послужило посещение сауны.
У большинства больных (78%) инсульт развился на фоне повышенного артериального давления, превышающего «рабочие» значения на 20 и более мм рт.ст. В 2 случаях заболевание дебютировало в рамках кардиоцеребрального синдрома на фоне преходящей недостаточности сердечной деятельности с падением артериального давления на 40-50 мм рт.ст. В остальных наблюдениях артериальное давление сохранялось в пределах индивидуальной нормы.
Первыми симптомами заболевания в 85% случаев явились очаговые неврологические симптомы. В 21 наблюдении (у 12 больных с левополушарным инсультом и у 9 - с правополушарным) очаговая симптоматика сопровождалась общемозговой, в виде общей вялости, заторможенности, сонливости, несистемного головокружения, нелокализованной головной боли различной интенсивности. Все пациенты (60 человек, 100%) поступили в клинику в течение первых 20 часов от момента развития заболевания, из них 18 (30%) - в первые 4-6 часов, 25 (42%) - в пределах от 6 до 12 часов, остальные 17 (28%) пациентов - от 12 до 20 часов.
Среди тяжелых больных 18 человек (30%) имели суммарный клинический балл не ниже 18 по шкале Инсульта (NIHSS) и не выше 12 по шкале Глазго, что соответствовало умеренным расстройствам сознания до уровня оглушения, наличию локальных оболочечных симптомов, свидетельствующих об имеющемся перифокальном отеке; изменениям окулоцефалических рефлексов с появлением феномена «кукольных глаз», грубому очаговому дефекту. У 8 больных (13%) суммарный клинический балл был более 24 по шкале Инсульта (NIHSS) и ниже 8 по шкале Глазго, что отражало крайнюю тяжесть состояния - с глубокими нарушениями сознания (до уровня сопора или комы), с признаками отека мозга и вторичного синдрома, с центральными расстройствами дыхания по типу ритмичного тахипноэ или Чейна-Стоса (в терминальных стадиях - с появлением группового, периодического, апнейстического дыхания и, в конечном итоге, - гаспинга), с различными изменениями окулоцефалических рефлексов, с выраженными вегетативно-трофическими изменениями, грубыми очаговыми нарушениями неврологических функций. Четырем больным крайней степени тяжести исследуемый препарат вводился интратекально (эндолюмбально) на 3 и 6 сутки от начала заболевания. У 3 пациентов (1 мужчина и 2 женщины) был верифицирован полушарный инсульт (2 пациентки с паренхиматозным кровоизлиянием в правой гемисфере головного мозга и 1 пациент с обширным ишемическим инсультом в системе левой внутренней сонной артерии). У 1 пациентки было верифицировано массивное субарахноидальное кровоизлияние.
Результаты клинического изучения белково-полипептидного комплекса у пациентов с острым нарушением мозгового кровообращения на фоне комплексной дифференцированной терапии
Для оценки эффективности (по объективным клиническим показателям) и безопасности (по показателям переносимости) применения белково-полипептидного комплекса, на фоне комплексной дифференцированной терапии у больных с острым нарушением мозгового кровообращения в рамках многоцентрового рандомизированного сравнительного открытого клинического исследования, использовались клинические шкалы: комы Глазго, Прогностического Балла Алена, шкала Инсульта (NIHSS); Тест Информация - Память - Концентрация внимания и Опросник Речи. Проводилось динамическое лабораторно-инструментальное обследование пациентов, включающее компьютерное или магнитно-резонансное томографическое исследование головного мозга, транскраниальную доплерографию и дуплексное сканирование сосудов головного мозга с эмболодетекцией, ЭхоКГ для верификации тромбообразования в полостях сердца, биохимическое и клиническое мониторирование параметров крови, с основными реологическими показателями.
Анализ полученных результатов исследования доказал, что за десятидневный курс применения белково-полипептидного комплекса, как при подкожном, внутримышечном, внутривенном, так и при интратекальном введении препарата, у всех пациентов различной степени тяжести, отличающихся как характером, так и локализацией сосудистого поражения головного мозга, серьезных нежелательных явлений отмечено не было. Такие же результаты были получены при повторном назначении комплекса в раннем восстановительном периоде - с 21-х по 28-е сутки.
Динамика суммарного клинического балла всех групп больных, получавших комплекс на фоне комплексной дифференцированной терапии, в остром периоде инсульта представлена в табл. №3 и наглядно показывают динамику регресса неврологического дефицита, который более выражен в группе больных, получавших комплекс (особенно к третьим и шестым суткам от начала заболевания) по сравнению с контрольной группой. Более детальный анализ регресса общемозговой и очаговой неврологической симптоматики, а также высших корковых функций по группам сравнения представлен в табл. №4. Динамика регресса двигательных нарушений у пациентов, получавших белково-полипептидный комплекс, к 6 и 10 суткам почти вдвое опережает показатели контрольной группы, продолжая снижение выраженности пареза к концу острого периода инсульта.
Регресс речевых нарушений в группе комплекса при использовании теста Опросник речи также значительно опережает восстановление в контрольной группе, что параллельно подтверждается при использовании Теста Информация - Память - Концентрация внимания. Полученная оценка изменения данных параметра «понимание» в вышеупомянутом тесте не выявила значимых преимуществ у пациентов, получавших комплекс, по сравнению с контрольной группой.
Таким образом, данные сравнения динамики баллов, полученные при использовании международных клинических шкал для групп сравнения, позволяют сделать выводы о достаточно высокой эффективности белково-полипептидного комплекса в остром периоде ишемического инсульта. Применение комплекса позволяет значительно ускорить регресс двигательных и речевых нарушений у всех пациентов различной степени тяжести, отличающихся как характером, так и локализацией сосудистого поражения головного мозга.
Одним из важных показателей эффективности белково-полипептидного комплекса при остром нарушении мозгового кровообращения является возможность его влияния на объем и регресс очага поражения головного мозга с уменьшением выраженности перифокального отека по данным компьютерного или магнитно-резонансного томографического исследования в динамике. Несмотря на то, что на клинические проявления мозгового инсульта большое влияние оказывает не только объем поражения, но и его локализация, при подборе однородных клинических групп и достаточной выборке пациентов можно косвенно оценить влияние препарата на эти параметры. Результаты КТ и МРТ исследования головного мозга по группам сравнения представлены в табл.5. Несмотря на то, что данные уменьшения размеров очага (почти на 30%) при мозговом инсульте повторяют экспериментальные данные, полученные на лабораторных животных при влиянии белково-полипептидного комплекса на очаговое ишемическое поражение головного мозга методом фотоиндуцированного тромбоза, они требуют подтверждения более точными инструментальными методами исследования на большой выборке клинических наблюдений.
Таким образом, данные сравнения динамики баллов, полученные при использовании международных клинических шкал для групп сравнения, позволяют сделать выводы о достаточно высокой эффективности белково-полипептидного комплекса в остром периоде ишемического инсульта. Применение комплекса позволяет значительно ускорить регресс двигательных и речевых нарушений у всех пациентов различной степени тяжести, отличающихся как характером, так и локализацией сосудистого поражения головного мозга.
В группе больных (4 чел.) крайней степени тяжести, которым исследуемый препарат вводился интратекально (эндолюмбально), к 6 суткам отмечалась незначительная положительная динамика в виде изменения расстройствам сознания до уровня глубокого сопора - комы 1, однако у всех больных оставались выраженные локальные оболочечные симптомы, свидетельствующие об имеющемся выраженном перифокальном отеке, у 2 больных отмечались изменения окулоцефалических рефлексов с появлением феномена «кукольных глаз». После повторного эндолюмбального введения белково-полипептидного комплекса к 10 суткам у 3 больных, несмотря на нарушение сознания, отмечалось невыраженное двигательное возбуждение на слабую болевую стимуляцию, отмечалось более активная защитная реак