Способ получения литиевой соли коменовой кислоты и применение ее как антиоксидантного стресс- и нейропротекторного средства
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и фармакологии, а именно к способу получения литиевой соли коменовой кислоты (коменат лития) смешением раствора коменовой кислоты, подогретого до температуры не более 80±2°С, с раствором карбоната или гидроксида лития при объемах, взятых из расчета, произведенного стехиометрически, и окрашивания раствора в желтый цвет и значения рН раствора, равного 4,6 или 10,0 соответственно, и выделением литиевой соли коменовой кислоты из раствора отгонкой воды под вакуумом. Изобретение также относится к средствам для профилактики и лечения нейродегенеративных заболеваний, вызываемых оксидативным повреждением мозга. Для этого предлагается литиевую соль коменовой кислоты лития применять в количестве 2 мг на 1 кг массы тела один раз ежедневно в течение 3-х суток. 2 н.п. ф-лы, 2 ил., 5 табл.
Реферат
Изобретение относится к экспериментальной медицине и фармакологии, а именно средствам для профилактики и лечения нейродегенеративных заболеваний, вызываемых оксидативным повреждением мозга.
Негативное влияние факторов окружающей среды на человеческий организм (экзогенные, эндогенные интоксикации, влияние техногенных загрязнений и ионизирующего излучения), а также чрезмерная физическая нагрузка, стресс, переутомление сопровождается увеличением образования свободных радикалов (СР), инициирующих повреждение клеток и ведущих к развитию различных патологических состояний. Патологическое действие СР связано, прежде всего, с их влиянием на структурное состояние и функции биологических мембран. Особенно чувствителен к гиперпродукции СР и к так называемому окислительному стрессу головной мозг. Это объясняется высокой интенсивностью обменных процессов в ткани мозга, отсутствием в ней избыточных запасов энергии, высоким содержанием субстратов перекисного окисления (полиненасыщенных жирных кислот) и катализаторов реакций липидного переокисления (в основном, ионов железа и меди) в сочетании со сравнительно низкой активностью ферментов антирадикальной защиты [Попова М.С., Степаничев М.Ю. Индукция клеточного цикла, амилоид-бетта и свободные радикалы в механизме развития нейродегенеративных процессов в мозге // Нейрохимия. 2008. Т.25. №3. С.170-178; Зозуля Ю.А., Барабой В.А., Сутковой Д.А. Свободнорадикальное окисление и антиоксидантная защита при патологии головного мозга. М.: Знание. 2000. С.226-221; Halliwel В. and Chiricol S. Lipid peroxidation: its mechanism, measurement, and significance // Am. J. Clin. Nutr. 1993. V. 57. P. 715-725].
В последние годы окислительный стресс рассматривается как один из наиболее значимых факторов патогенеза нейродегенеративных заболеваний, таких как болезнь Альцгеймера и другие типы деменций, болезнь Паркинсона, боковой амиотрофический склероз, эпилепсия и рассеянный склероз. Дисбаланс анти- и прооксидантной систем в процессе старения является одним из патогенетических факторов сосудистой деменций, развитие которой обусловлено снижением мозгового кровотока и, как следствие, развитием гипоксии тканей, которые приводят к окислительному стрессу. Окислительный стресс, ведущий к гиперпродукции СР и деструкции мембран, связанной с активацией фосфолипазного гидролиза, играет главную роль в патогенетических механизмах ишемии мозга.
Активация продуктов перекисного окисления липидов (ПОЛ) наблюдается как при остром ишемическом повреждении мозга и реперфузии так и у больных с хронической недостаточностью мозгового кровообращения. [Карнеев А.Н, Соловьева Э.Ю и др. Использование препаратов альфа-липоевой кислоты в качестве нейропротективной терапии хронической ишемии мозга. Справочник поликлинического врача // http://old.consilium-medicum.com/media/refer/06_08/76.shtml]. Ишемия головного мозга инициирует каскад биохимических реакций, лежащих в основе тканевого повреждения. Основные механизмы нейронального повреждения включают истощение энергетических ресурсов в условиях ацидоза ткани мозга, нарушение ионного гомеостаза, деполяризацию клеточных мембран, накопление возбуждающих аминокислот и гиперпродукцию активных форм кислорода (АФК) (перекись водорода - H2O2, гидроксильный радикал - -ОН, синглетный кислород - 1O2) супероксидный анион-радикал - -O2). [Смирнова И.Н., Федорова Т.Н.,. Танашян М.М., Суслина З.А. Клиническая эффективность и антиоксидантная активность мексидола при хронических цереброваскулярных заболеваниях // Нервные болезни. 2006. - №1 - С.33-36; Федорова Т.Н. Окислительный стресс и защита головного мозга от ишемического повреждения // Дис. д-ра биол. наук. 03.00.04. М., 2004. 298 с. РГБ ОД, 71:05-3/67].
При нарастании ишемии нарушаются все жизненно важные функции клетки, усиливаются процессы свободнорадикального окисления, снижается активность антиоксидантной системы, развивается состояние «оксидативного» стресса. Хронический окислительный стресс приводит к повреждению всех классов биомолекул, включая липиды, белки, и нуклеиновые кислоты. Постепенное накопление окислительных повреждений в ДНК и ошибок репарации приводит к аномальной активации клеточного цикла в нейронах и к последующей гибели нейронов. [Попова М.С., Степаничев М.Ю. Индукция клеточного цикла, амилоид-бетта и свободные радикалы в механизме развития нейродегенеративных процессов в мозге // Нейрохимия. 2008. Т.25. №3. С.170-178; Calabrese V., Bates Т.Е., Stella A.M. NO synthase and NO-dependet signal pathways in brain aging and neuredegenerative disorders: the role of oxidant /antioxidant balance //Neurochem. 2000. V.25. P.1315-1341]. Антиоксидантная защита организма при оксидативном стрессе неспособна полностью нейтрализовать образующийся избыток АФК. В этих условиях очевидна целесообразность использования антиоксидантных препаратов, способных защитить мозговую ткань от повреждения [Поварова О.В. и соавт. Антиоксиданты как нейропротекторы при ишемическом инсульте // Экспериментальная и клиническая фармакология. 2003. Т.66. №3. С.69-73].
В настоящее время для профилактики и лечения дегенеративных заболеваний с ишемическим повреждением применяют антиоксиданты, которые по своему происхождению подразделяют на две основные группы: природные и синтетические.
Природные антиоксиданты: ферменты, белки, низкомолекулярные соединения (витамины Е и С, каротиноиды, убихинон и др.).
Эффективным и широко известным антиоксидантным препаратом с противоишемическим действием является витамин Е (токоферол). Однако жирорастворимые антиоксиданты, в том числе витамин Е, имеют существенный недостаток, связанный с отсроченным периодом действия. Более широкое распространение получили водорастворимые антиоксиданты, способные быстро проникать в микроциркуляторное русло. Пара "витамин Е - витамин С" служит примером согласованного взаимодействия в клетке жиро- и водорастворимых антиоксидантов.
Группу синтетических антиоксидантов представляют синтетические аналоги витамина Е, ароматические фенолы и полифенолы (ионол, пробукол), эмоксипин и мексидол, некоторые производные барбитуровой кислоты и фенотиазина, препараты железа и цинка, органические кислоты и их производные, некоторые аминокислоты и производные аминостероидов. [Карнеев А.Н., Соловьева Э.Ю. и др. Использование препаратов альфа-липоевой кислоты в качестве нейропротективной терапии хронической ишемии мозга. Справочник поликлинического врача // http://old.consilium-medicum.com/media/refer/06_08/76.shtml].
При этом интоксикация некоторыми лекарственными препаратами, в том числе барбитуратами, может вызвать обратимые когнитивные расстройства - дисметаболические деменции [Чухловина М.Л. Деменция. Диагностика и лечение. Питер.: 2010. С.60].
Известно применение антиоксидантов из группы производных 3-оксипиридина - эмоксипин и мексидол, относящихся к структурным аналогам витамина В6. Их эффективность основана на способности проникать через гематоэнцефалический барьер.
Эмоксипин стабилизирует мембранные структуры, обладает антиагрегационным и антигипоксическим действием.
Действие мексидола заключается в антиоксидантном и мембранопротекторном эффектах, которые обеспечиваются ингибированием свободнорадикального окисления липидов клеточных мембран и модулированием синтеза простагландинов, повышением активности антиоксидантных ферментов организма, повышением содержания полярных фракций липидов и снижением соотношения холестерин/фосфолипиды. [Смирнова И.Н. и соавт. Клиническая эффективность и антиоксидантная активность мексидола при хронических цереброваскулярных заболеваниях // Нервные болезни. 2006. №1. С.33-36; Катунина Е.А., Малыхина Е.А. и соавт. Антиоксиданты в комплексной терапии болезни Паркинсона // Неврология и психиатрия. 2006. №9. С.22-28].
Известно использование препаратов лития (хлористый литий, углекислый литий, литий оксибутират) в качестве лекарственного средства при различных заболеваниях центральной нервной системы (ЦНС), характеризующихся тяжелыми нейродегенеративными проявлениями, в том числе, рассеянный склероза, ишемия мозга, эпилепсия и пр. [Авруцкий Г.Я., Недува А.А. // Лечение психически больных. Руководство для врачей. М., 1988. 528 с.; Jakopec S., Karlovic D., Dubravcic K. et al. Lithium effect on glutamate induced damage in glioblastoma cells // Coll. Antropol. 2008. V.32. Suppi 1. P.87-91; Stelmashook E.V., Weih М., Zorov D. et al. Short-term block of Na+/K+-ATPase in neuro-glial cell cultures of cerebellum induces glutamate dependent damage of granule cells // FEBS Letters. 1999. V. 456. P. 41-44]. Известно применение при патологии нервной системы оксибутирата лития. Анион оксибутират (Гамма-оксимаслянная кислота (ГОМК) обладает многоплановым эффектом. ГОМК повышает фонд макроэргов в клетке, усиливает энергетический и трофический потенциал, стимулирует работу Na+/Са2+-насосов, обладает антигипоксической активностью. [Крыжановский Г.Н. Возможности применения оксибутирата лития в патологии // Новые данные по фармакологии и клиническому применению солей лития: сборник трудов НИИ фармакологии АМН ССР. Под ред. д-ра мед. наук, проф. Любимова. М., 1984. С.49-57].
Наиболее близким к заявляемому антиоксидантному нейропротекторному средству является хлорид лития. Хлористый литий проявляет антидепрессивную активность, антиагрессивное действие, усиливает активность альфа -и тета-ритмов ЭЭГ коры мозга, применяется для лечения многих нейродегенеративных заболеваний, играет важную роль в клеточной защите от оксидантного стресса, оказывает нейропротекторное действие при глутаматной токсичности нейронов мозжечка [Nonaka Sh., Hough Chr.J., Chuang D.-M. Chronic lithium treatment robustly protect neurons in the central nervous system against excitotoxicity by inhibiting N-methyl-d-aspartate receptor-mediated calcium influx // Proc. Natl. Acad. Sci. USA.1998.V. 95. P. 2642-2647; Shao L., Cui J., Young L.T. and Wang J.F. The effect of Mood stabilizer lithium on expression and activity of glutathione-S-transferase isoenzymes // Neuroscience. 2008. V. 151(2). P.518-524].
Хлорид лития проявляет антиоксидантные свойства, но не предотвращает окислительное повреждение, вызванное хроническим стрессом, не подавляет болевой синдром [Крыжановский Г.Н. Возможности применения оксибутирата лития в патологии // Новые данные по фармакологии и клиническому применению солей лития: сборник трудов НИИ фармакологии АМН ССР. Под ред. д-ра мед. наук, проф. Любимова. М., 1984. С.49-57; А.Р. de Vasconcellos, F.B. Nieto, L.M. Crema, L.A. Diehl, L.M. de Almeida, M.E. Prediger, E.R. da Rocha and C. Dalmaz Chronic lithium treatment has antioxidant properties but does not prevent oxidative damage induced by chronic variate stress // Neurochem. Res. 2006. V.31(9). P.1141-1151].
Технический результат изобретения заключается в создании нового высокоэффективного антиоксидантного стресс- и нейропротекторного средства для профилактики и лечения нейродегенеративных заболеваний, вызываемых оксидативным повреждением мозга.
Для решения технической задачи в профилактике и лечении нейродегенеративных заболеваний, вызываемых оксидативным повреждением мозга, предлагается антиоксидантное стресс- и нейропротекторное средство - литиевая соль коменовой кислоты (коменат лития), полученная смешением раствора коменовой кислоты, подогретого до температуры не более 80±2°С, с раствором карбоната или гидроксида лития при объемах, взятых из расчета, произведенного стехиометрически до значений рН раствора, равных 4,6 или 10,0 соответственно. Раствор окрашивается в желтый цвет. Литиевую соль коменовой кислоты выделяют из раствора отгонкой воды под вакуумом.
Коменат лития применяют в качестве антиоксидантного стресс- и нейропротекторного средства в количестве 2 мг на 1 кг массы тела один раз ежедневно в течение 3-х суток.
Известно, что коменовая кислота (5-гидрокси-γ-пирон-2-карбоновая)
обладает выраженным антиоксидантным свойством [Кравцов А.А., Шурыгин А.Я. Сравнительное изучение антиоксидантных свойств коменовой кислоты и ее солей // Сборник научных докладов I Международной научно-практической конференции «Научно-техническое творчество молодежи - путь к обществу, основанному на знаниях». М., 2009. С.268-269].
Установлен ее выраженный ростстимулирующий эффект на культуры нейронов коры головного мозга пренатально стрессированных животных [Шурыгин А.Я. Препарат бализ. 2002. 416 с.]. Коменовая кислота обладает мягким седативным действием, не вызывающим привыкания [патент РФ на изобретение №2209062, МПК (7) А61К 31/351, А61Р 25/20], является высокоэффективным ненаркотическим анальгетическим средством, не имеющим негативных побочных эффектов, не вызывающих зависимости и привыкания, приводящий к долговременному снятию болевого синдрома [патент РФ №2322977 A61K 31/351 (2006.01), А61Р 29/02 (2006.01)]. Обладает антиабстинентным, анксиолитическим и антидепресантными свойствами. [Панова Т.И. Механизмы влияния коменовой кислоты на интегративную деятельность мозга // Теоретическая экспериментальная медицина. Медицина сегодня и завтра. 2005. №1. С.28-33].
Известно, что литий подавляет симпатическую активность и ослабляет действие катехоламинов, активирует моноаминооксидазу и усиливает внутринейрональный метаболизм катехоламинов, уменьшает чувствительность адренергических и дофаминовых рецепторов, обладает способностью предотвращать повышенную чувствительность дофаминовых рецепторов, возникающую при лечении нейролептиками, в частности галоперидолом. [Крыжановский Г.Н. Возможности применения оксибутирата лития в патологии // Новые данные по фармакологии и клиническому применению солей лития: сборник трудов НИИ фармакологии АМН ССР. Под ред. д-ра мед. наук, проф. Любимова. М., 1984. С.49-57.].
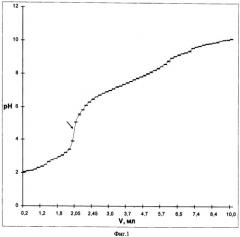
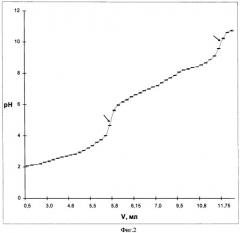
На фигуре 1 изображена кривая титрования 20 мл 0,02 н. коменовой кислоты 0,2 н. раствором карбоната лития; на фиг.2 - кривая титрования 20 мл 0,04 н. коменовой кислоты 0,1 н. раствором гидроксида лития.
Литиевую соль коменовой кислоты получали при замещении Н+ карбоксильной группы или карбоксильной и гидроксильной групп на металл при взаимодействии коменовой кислоты с карбонатом лития или с гидроксидом лития.
При замещении H+ на металл в двухосновной кислоте расчет рН первой точки эквивалентности (диссоциация по первой ступени) производили по формуле:
pH=1/2(pKa1+pKa2),
где рН - водородный показатель;
pKa1 - показатель константы кислотности коменовой кислоты по карбоксильной группе
рКа2 - показатель константы кислотности коменовой кислоты по гидроксильной группе.
[Крешков А.П. Основы аналитической химии. 1976. М.: Химия. Т. 2. С.129],
рН=1/2(1,77+7,44)=4,605≈4,6
При замещении гидроксильного Н+ расчет рН точки эквивалентности производили по формуле:
pH=7+l/2pKa2+l/2lgC,
где С - нормальная концентрация кислоты.
рН=7+1/2·7,44+1/2·lg4·10-2=10,72-1/2·1,398=10,02≈10
Получение литиевой соли коменовой кислоты при взаимодействии с карбонатом или гидроксидом лития.
Расчет объемов исходных компонентов производили по формуле
N1 xV1=N2 xV2.
Для получения комената лития готовится 0,12 М раствор коменовой кислоты (М.м.=156,09), 0,2 н. раствор карбоната лития или 0,2 н. раствор гидроксида лития. К 25 мл раствора коменовой кислоты (80°±2°С) добавляют при помешивании 15 мл раствора карбоната или гидроксида лития. Температурный режим обусловлен малой растворимостью коменовой кислоты при более низких температурах. При более высокой температуре возможно нарушение технологического процесса.
Определяют значения рН раствора, который должен соответствовать 4,60±0,05. Литиевую соль коменовой кислоты выделяют из раствора отгонкой воды под вакуумом. Выход конечного продукта - литиевой соли коменовой кислоты составляет 86±5%. Как видно на фиг.1, в интервале рН от 3,41 до 5,82 наблюдается скачок титрования, а точка эквивалентности находится при рН=4,6. При этом один скачок титрования свидетельствует о том, что замещение Н+ на Li+ происходит только по карбоксильной группе (монолитиевая соль коменовой кислоты). Кристаллы литиевой соли имеют желтый цвет и высокую растворимость.
При взаимодействии коменовой кислоты с гидроксидом лития происходит замещение водорода в карбоксильной и гидроксильной группах. Для получения дизамещенной литиевой соли коменовой кислоты берут 0,04 н. раствор коменовой кислоты в объеме 30,0 мл. Добавляют 12 мл гидроксида лития (эквивалентный объем 0,1 н. раствора гидроксида лития рассчитан по формуле: 0,04 н.×30 мл = 0,1 н.×VLiOH). Гидроксид лития добавляют порционно, по 0,05-0,1 мл, рН измеряют на рН-метре Мультитест ИПЛ-101. Реакционная масса перемешивается магнитной мешалкой. Раствор окрашивается в желтый цвет.
На основании полученных данных строят кривую титрования коменовой кислоты 0,1 н. гидроксидом лития, которая представлена на фиг.2.
Как видно на фиг.2, кривая титрования имеет два четко выраженных скачка титрования. Первый скачок отмечается в интервале рН от 3,59 до 5,63 (титрование по карбоксильной группе), а точка эквивалентности соответствует рН=4,6. Второй скачок свидетельствует о замещении гидроксильного Н+ на литий и определяется в интервале рН от 9,58 до 10,75 (титрование по гидроксильной группе), точка эквивалентности соответствует рН=10,16, что близко к расчетной величине. Из вышеприведенных данных можно заключить, что замещение Н+ на Li+ происходит как по карбоксильной, так и по гидроксильной группе, т.к. имеются два скачка титрования, т.е. две точки эквивалентности. Значения рН точек эквивалентности совпадают с расчетными значениями 4,6 и 10,0.
Антиоксидантные стресс- и нейропротекторные свойства литиевой соли коменовой кислоты изучали с использованием модельной системы, генерирующей свободные радикалы - система «цитрат-фосфат-люминол» (ЦФЛ), культуры нейронов мозга, а также различных моделей стресса на экспериментальных животных. Нами было установлено, что моно- и дизамещенная литиевые соли коменовой кислоты обладают антиоксидантными, стресс- и нейропротекторными свойствами, однако двузамещенная литиевая соль при равных антиоксидантных свойствах обладает менее выраженными нейропротекторными свойствами в сравнении с монолитиевой солью. В то же время эти свойства у обеих солей значительно выше, чем у хлорида лития.
Изучение влияния литиевой соли коменовой кислоты на свободнорадикальное окисление хемилюминесцентным методом в модельной системе ЦФЛ.
Влияние литиевой соли коменовой кислоты на генерацию АФК изучали в среде ЦФЛ следующего состава: 4 мл фосфатного буфера (105 мМ KCl, 20 мМ KH2PO4, 4 мМ цитрата натрия; рН=7,45) с добавлением люминола (10 мМ). Образование АФК инициировали введением при постоянном перемешивании 30 мкл 35 мМ раствора сернокислого железа. В данной модели окисление ионов железа в присутствии ортофосфата и цитрата сопровождается образованием АФК и при этом возникает хемилюминесценция (ХЛ), избирательно усиливающаяся люминолом, которая подавляется в присутствии антиоксидантов. Регистрацию ХЛ осуществляли прибором SmartLum 5773 в течение 5 минут. Оценивали светосумму хемилюминесценции. Результаты экспериментов определяли по интенсивности хемилюминесценции (в у.е.) и рассчитывали в процентах от контроля.
Антиокислительную активность литиевой соли коменовой кислоты оценивали по угнетению ХЛ модельной системы при добавлении водных растворов препарата в сравнении с раствором коменовой кислоты и хлористым литием. Конечная концентрация вещества в кювете составляла 0,1 мг/мл и 0,01 мг/мл. Хемилюминесценция свободных радикалов модельной системы ЦФЛ (контроль) принимается за 100%. [Фархутдинов P.P., Лиховских В.А. Хемилюминесцентные методы исследования свободнорадикального окисления в биологии и медицине. 1995. Уфа. 90 с.]. Обработку полученных данных осуществляли с помощью программного обеспечения PowerGraph версия 3.3. Достоверность отличий оценивали с помощью критерия Стьюдента. Результаты исследования представлены в таблице 1
| Таблица 1 | |||
| Уровень снижения свободных радикалов в модельной системе ЦФЛ в присутствии коменовой кислоты и ее литиевой соли (% от контроля). | |||
| № п/п | Препарат | Концентрация вещества, мг/мл | |
| 0,01 | 0,1 | ||
| 1 | Коменат лития | 36,91±1,00%* | 66,67±1,20%* ** |
| 2 | Коменовая кислота | 33,29±1,36%* | 69,39±1,16%* ** |
| 3 | Хлористый литий | 1,75±0,09% | 1,92±0,11% |
| Примечания: | |||
| 1 *р<0,001 в сравнении с контролем; | |||
| 2 **р<0,001 в сравнении с 0,01 мг/кг. |
Анализ данных, представленных в таблице 1, показывает, что литиевая соль коменовой кислоты значительно снижает содержание свободных радикалов в сравнении с контролем в модельной системе ЦФЛ. Уровень снижения свободных радикалов литиевой солью коменовой кислоты практически не отличается от уровня гашения свободных радикалов коменовой кислотой. При этом антиокислительные свойства литиевой соли коменовой кислоты, также как и коменовой кислоты, зависят от концентрации вещества. Так увеличение концентрации как коменовой кислоты, так и литиевой соли коменовой кислоты в испытуемом растворе с 0,01 мг/мл до 0,1 мг/мл способствует значительному (на 36% и 30%, соответственно) повышению уровня гашения свободных радикалов. Применение хлористого лития в этих же концентрациях влияния на уровень свободных радикалов не оказывает.
Таким образом, литиевая соль коменовой кислоты обладает выраженным антиоксидантным действием, при этом ее антиокислительные свойства практически не отличаются от таковых коменовой кислоты. В то время как хлористый литий в испытуемых нами концентрациях антиокислительных свойств в модельной системе ЦФЛ не проявил.
Для оценки состояния оксидативных механизмов наиболее часто используют определение продуктов перекисного окисления липидов (ПОЛ), промежуточным продуктом которого является малоновый диальдегид (МДА), а также исследование хемилюминесценции биологических сред, интегрально отражающей баланс про- и антиоксидантных процессов в организме [Барабой В.А., Сутковой Д.А. Окислительно-антиоксидантный гомеостаз в норме и патологии. Киев.: Наукова думка. 1977. 420 с.].
Уровень свободнорадикального окисления определяли хемилюминесцентным методом [Фархутдинов У.Р., Фархутдинов P.P. // Бюл. экспер. биол. и мед. 2000. Т.129. №3. С.260-264] на приборе SmartLum 5773. Результаты экспериментов оценивали по интенсивности хемилюминесценции (свето-сумма хемилюминесценции в у.е.). Статистический анализ результатов проводили с использованием критерия Стьюдента [Лакин Г.Ф. Биометрия. М. 1990. 352 с.]. Содержание МДА определяли по методу Гаврилова Б.В. и соавт. [Гаврилов В.Б., Гаврилова А.Р., Мажуль Л.М. Определение содержания продуктов перекисного окисления липидов в тесте с тиобарбитуровой кислотой.// Вопросы мед. химии. 1987. №1. С.19-21]. Статистический анализ результатов проводили с использованием критерия Стьюдента [Лакин Г.Ф. Биометрия. М., 1990. 352 с.] в МО Excel 2003.
Коменат лития вводили мышам per os, натощак, в течение 3-х суток, один раз в сутки, в дозе 2 мг на 1 кг массы тела до стрессирования мышей. Стресс у мышей вызывали путем подвешивания за шейную складку в течение пяти часов. Через 5 часов мышей декапитировали, головной мозг помещали в жидкий азот и затем в мозге определяли уровень свободнорадикального окисления (СРО) и МДА.
У крыс вызывали хронический стресс путем 3-дневного воздействия голода и иммобилизации в пенале при температуре +6-8°С в течение 5 часов. Стрессирование осуществляли по схеме: 1-й день - 12 часов голод, 2-й день голод-пенал (+6-8°С), кормление, голод - 12 часов, 3-й день голод-пенал (+6-8°С) в течение 5 часов, декапитация, определение СРО и МДА. Животные в течение всего периода стрессирования имели свободный доступ к воде.
Были сформированы следующие группы самцов белых беспородных мышей:
1) интактные;
2) интактные + коменат лития 1 мг/кг массы тела;
3) интактные + коменат лития 2 мг/кг массы тела;
4) интактные + коменат лития 3 мг/кг массы тела;
5) стресс;
6) стресс + коменат лития 1 мг/кг массы тела;
7) стресс + коменат лития 2 мг/кг массы тела;
8) стресс + коменат лития 3 мг/кг массы тела и группы крыс:
1) интактные;
2) стресс;
3) стресс + коменат лития 1 мг/кг массы тела;
4) стресс + коменат лития 2 мг/кг массы тела;
5) стресс + коменат лития 3 мг/кг массы тела.
Эксперимент проводился на 72 белых беспородных мышах-самцах, массой 23-25 г, по 9 мышей в каждой группе и 35 крысах-самцах линии Wistar, массой 240-250 г. Полученные результаты представлены в таблицах 2 и 3.
| Таблица 2 | |||
| Влияние комената лития на СРО и содержание МДА в мозге стрессированных мышей (М±m) | |||
| №п/п | Группы животных | СРО (светосумма у.е.) | МДА (нМ/1 г белка) |
| 1 | Интактные | 259,86±6,04 | 3,59±0,15 |
| 2 | Интактные+коменат лития 1 мг/кг | 261,56±8,54 | 3,77±0,17 |
| 3 | Интактные+коменат лития 2 мг/кг | 254,99±7,25 | 3,64±0,10 |
| 4 | Интактные+коменат лития 3 мг/кг | 275,53±9,1 | 4,3±0,17 |
| 5 | Стресс | 293,87±4,34** | 4,7±0,16*** |
| 6 | Стресс+коменат лития 1 мг/кг | 250,62±9,07▪▪ | 3,9▪±0,28 |
| 7 | Стресс+коменат лития 2 мг/кг | 237,43±16,92▪ | 3,64±0,10▪▪▪ |
| 8 | Стресс+коменат лития 3 мг/кг | 285,19±5,94 | 4,83±0,18 |
| Примечания: | |||
| 1 * - р≤0,05; ** - р≤0,01; *** - р≤0,001 - по сравнению с интактным контролем; | |||
| 2 ▪ - р5≤0,05; ▪▪ - р≤0,01; ▪▪▪ - р≤0,001 - по сравнению со стрессом |
Анализ данных, представленных в таблице 2, показывает, что при применении комената лити в дозах 1 мг/кг и 2 мг/кг массы тела у интактных животных (2 и 3 группы) уровень свободнорадикального окисления в мозге практически не отличается от интактного контроля (1 группа). Применение же комената лития в дозе 3 мг /кг массы тела (группа 4) способствует повышению, хотя и недостоверному, уровня свободных радикалов. Резкое повышение уровня свободных радикалов (р≤0,01) наблюдается после стрессового воздействия (5 группа) на организм животных. При применении комената лития в дозах 1 и 2 мг /кг массы тела у стрессированных животных наблюдается значительное снижение интенсивности свободнорадикального окисления (6, 7 группы). При этом наиболее выраженное снижение СРО отмечается в группе 7 (коменат лития 2 мг/кг массы тела). В группе 8 (3 мг/кг массы тела) интенсивность СРО в сравнении с группой 5 (стресс-контроль) снижается незначительно.
Исследование влияния комената лития на содержание МДА в мозге вышеназванных групп животных показало, что коменат лития в дозах 1 и 2 мг/кг массы тела не оказывает влияния на содержание МДА в мозге интактных животных (группы 2,3). В то время как повышение дозы комената лития до 3 мг /кг массы тела (группа 4) способствует повышению содержания МДА в мозге интактных мышей (группа 5). Значительное и достоверное, в сравнении с интактными животными, повышение уровня МДА отмечается после стрессового воздействия на организм (группа 5). В то же время у стрессированных мышей, получавших коменат лития в дозах 1 и 2 мг/кг массы тела, содержание МДА значительно ниже, чем в группе 5 (стресс-контроль). При этом наиболее выраженное снижение уровня МДА отмечается в 7 группе мышей (2 мг/кг массы тела). При применении комената лития у стрессированных мышей в дозе 3 мг/кг массы тела (группа 8) содержание МДА в мозге практически не изменилось и находилось на уровне стресс-контроля (группа 5).
Результаты исследования влияния комената лития на окислительные процессы в мозге при хроническом стрессировании экспериментальных животных представленны в таблице №3.
| Таблица 3 | |||
| Влияние комената лития на СРО и содержание МДА в мозге при хроническом стрессировании крыс (М±m) | |||
| № п/п | Группы животных | СРО (светосумма у.е.) | МДА (нМ/1 г белка) |
| 1 | Интактные | 173,16±5,19 | 3,80±0,14 |
| 2 | Стресс | 210,76±4,34* | 4,72±0,20* |
| 3 | Стресс+коменат лития 1 мг/кг | 181,62±5,07▪ | 4,05±0,18▪ |
| 4 | Стресс+коменат лития 2 мг/кг | 166,74·±4,89▪ | 3,82·±0,13▪ |
| 5 | Стресс+коменат лития 3 мг/кг | 188,19±6,94 | 4,67±0,28 |
| Примечание: | |||
| * - р≤0,05 - по сравнению с интактным контролем; | |||
| ▪ - р≤0,05 - по сравнению со стрессом |
Из таблицы №3 видно, что у стрессированных крыс (группа 2) отмечается резкое повышение, в сравнении с интактными животными (группа 1), уровня свободных радикалов (210,76±4,34) и содержания малонового диальдегида (4,72±0,20). Применение же литиевой соли коменовой кислоты в дозах 1 мг и 2 мг на 1 кг массы тела в течение 3-х дней в период стрессирования крыс способствовало достоверному снижению в мозге уровня СРО и МДА (группы 3 и 4). При этом наиболее выраженное снижение вышеназванных показателей отмечается при применении литиевой соли коменовой кислоты в дозе 2 мг на 1 кг массы тела. Не выявлено существенных изменений уровня СРО и МДА в мозге стрессированных крыс при применении комената лития в дозе 3 мг/кг массы тела.
Таким образом, установлено, что однозамещенный коменат лития в дозах 1 мг/кг и 2 мг/кг массы тела оказывает антиоксидантное стресспротекторное действие, проявляющееся в интенсивном снижении гиперпродукции свободных радикалов и содержания продуктов перекисного окисления липидов в мозге стрессированных животных. Защитное действие комената лития отмечается как при применении его до однократного стрессового воздействия на организм, т.е. в качестве профилактического средства, так лечебного при хроническом стрессировании животных. При этом наиболее выраженное антиоксидантное, стресспротекторное действие литиевая соль коменовой кислоты оказывает в дозе 2 мг/кг массы тела. Более высокая доза комената лития - 3 мг/кг массы тела существенного влияния на окислительные процессы в мозге стрессированных животных не оказывает.
Влияние литиевой соли коменовой кислоты на глутаматную цитотоксичность в культуре зернистых клеток мозжечка крысят.
Являясь возбуждающим нейромедиатором, глутамат содержится в большинстве нейронов мозга. В условиях ишемии глутамат высвобождается из окончаний ишемизированных нейронов в межклеточное пространство. Первоначально глутамат выделяется вследствие деполяризации наружных мембран. В нормальных условиях нейроны и клетки глии поглощают избыточный глутамат из межклеточного пространства. Однако ишемические клетки лишены необходимой для этого энергии. В результате накопления большого количества глутамата происходит насыщение рецепторов соседних нейронов и зона повреждения расширяется. Устойчивое связывание глутамата при ишемии мозга вызывает аномальный поток ионов кальция внутрь нейронов, повышение внутриклеточной концентрации кальция с последующим разрушением клетки [Суслина З.А., Максимова М.Ю. Концепция нейропротекции; новые возможности ургентной терапии ишемического инсульта. Симпозиум НИИ неврологии РАМН «Лечение ОНМК: состояние проблемы» // Нервные болезни. 2004. №3. С.4-7].
Разработка методов профилактики и лечения базируется на предположении о том, что значительное число клеток мозга можно спасти, блокируя инициацию или ход внутринейрональных патохимических деструктивных процессов, имеющих определенные временные и пространственные характеристики.
Влияние комената лития на глутаматную цитотоксичность в культуре нейронов мозжечка крысят изучали в сравнении с коменовой кислотой и хлоридом лития.
Исследования выполнены на крысятах линии Wistar. Культуры зернистых клеток мозжечка получали из мозга 7-9 дневных крысят методом ферментно-механической диссоциации [Викторов И.В., Хаспеков Л.Г., Шашкова Н.А. Руководство по культивированию нервной ткани: методы, техника, проблемы. М.: Наука. 1986. 266 с.]. Культуры клеток после 7 дней культивирования подвергали действию глутамата и/или литиевой соли коменовой кислоты, коменовой кислоты, хлорида лития.
Коменат лития, коменовую кислоту и хлорид лития вносили в группы культур нейронов без воздействия глутамата и после 10-минутного воздействия (100 мкМ) глутамата в сбалансированном солевом растворе (ССР), предварительно поместив их в исходную питательную среду. После чего культуры инкубировали в CO2-инкубаторе еще 4,5-5 часов. Исследовано влияние комената лития и хлорида лития в концентрациях 10-3 М, 10-4 М и 10-5 М, коменовой кислоты в концентрациях 10-3 М, 10-4 М. Контролем служили культуры, помещенные на 10 мин в ССР, а также культуры, обработанные глутаматом в ССР. После фиксации культур учитывали число живых и погибших нейронов на инвертированном микроскопе Invertoscopes ID 03. Достоверность отличий оценивали с помощью критерия Стьюдента в МО Excel 2003.
Культуры нейронов мозжечка, полученные от интактных крысят, делили на следующие группы соответственно:
1.1 контроль ССР;
1.2 ССР + коменат лития - 10-3 М;
1.3 ССР + коменат лития - 10-4 М;
1.4 ССР + коменат лития - 10-5 М;
1.5 ССР + коменовая кислота - 10-3 М;
1.6 ССР + коменовая кислота - 10-4 М;
1.7 ССР + хлорид лития - 10-3 М;
1.8 ССР + хлорид лития - 10-4 М;
1.9 ССР + хлорид лития - 10-5;
2.1 контроль- СССР с глутаматом (Glu) 100 мкМ;
2.2 ССР с глутаматом (Glu) 100мкМ + коменат лития - 10-3 М;
2.3 ССР с глутаматом (Glu) 100мкМ + коменат лития - 10-4 М;
2.4 ССР с глутаматом (Glu) 100мкМ + коменат лития - 10-5 М;
2.5 ССР с глутаматом (Glu) 100мкМ + коменовая кислота - 10-3 М;
2.6 ССР с глутаматом (Glu) 100мкМ + коменовая кислота - 10-4 М;
2.7 ССР с глутаматом (Glu) 100мкМ + хлорид лития -10-3 М;
2.8 ССР с глутаматом (Glu) 100мкМ + хлорид лития - 10-4 М;
2.9 ССР с глутаматом (Glu) 100мкМ+хлорид лития - 10-5 М.
Результаты исследования представлены в таблице 4.
| Таблица 4 | ||||||||||
| Влияние комената лития, коменовой кислоты и хлорида лития на цитотоксический эффект глутамата в культуре нейронов мозжечка | ||||||||||
| № п/п | Группы культур | Число живых нейронов (%) | ||||||||
| Контроль | Коменат лития (М) | Коменовая кислота (М) | Хлорид лития (М) | |||||||
| 10-3 | 10-4 | 10-5 | 10-3 | 10-4 | 10-3 | 10-4 | 10-5 | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||
| 1 | ССР | 84,3±0,87 | 80,69±2,60 | 84,80±1,78 | 86,36±1,04 | 85,8±3,3 | 85,2±6,0 | 83,62±4,35 | 79,97±2,06 | 82,90±2,74 |
| 2 | глутамат | 26,69±0,93# | 56,06±2,61**# | 67,50±3,92**# | 61,09±3,64**# | 46,7±3,1*# | 35,9±2,9*# | 27,12±3,21# | 28,66±2,53# | 20,61±5,26# |
| Примечания: | ||||||||||
| 1 # р<0,001 - в сравнении с контролем ССР; | ||||||||||
| 2 * р<0,05 - в сравнении с группой контроль глутамат; | ||||||||||
| 3 **р<0,001 - в сравнении с группой контроль глутамат. |
Результаты исследований показали (таблица 4), что число выживших нейронов при воздействии на интактные зернистые клетки мозжечка хлорида лития (группы 1.7, 1.8, 1.9), коменовой кислоты (группы 1.5, 1.6) и комената лития (группы 1.2, 1.3, 1.4), независимо от концентрации вещества, практически не отличается от контроля (группа 1.1). После воздействия глутамата выживаемость зернистых клеток мозжечка значительно (на 57,6%) снижается (группа 2.1), р<0,001. Практически на этом же уровне остается и выживаемость нейронов при добавлении в культуры с глутаматом хлорида лития в концентрациях - 10-3 М - 10-5 М (группы 2.7, 2,8, 2.9). При внесении в культуры, обработанные глутаматом коменовой кислоты в концентрациях - 10-3 М, 10-4 М число выживших нейронов значительно увеличилось. При этом максимальная выживаемость нейронов отмечалась в группе культур 2.5 (10-4 М) и составила 46,7±3,1%, т.е. на 20% больше, чем в группе культур контроль-глутамат. Значительное и достоверное сокращение гибели нейронов после воздействия глутамата наблюдалось при применении комената лития.
Так, если в группе культур 2.1 (контроль-глутамат) выживаемость нейронов составляла 26,69±0,93%, то в группах культур с добавлением комената лития на фоне глутаматной цитотоксичности (2.2, 2.3, 2.4) выживаемость нейронов была в 2-2,5 раза выше (р<0,001). При этом максимальная выживаемость нейронов после воздействии комената лития на культуры, обработанные глутаматом (67,50±3,92%), была в группе 2.3 (10-4 М, р<0,001).
Таким образом, применение комената лития (10-3 М - 10-5 М) в условиях глутаматной цитотоксичности способствует значительному сокращению гибели нейронов мозжечка в культуре. Менее выраженное защитное действие в условиях глутаматной цитотоксичности оказывает коменовая кислота. Не оказывает влияние на устойчивость нейронов мозжечка к глутаматной цитотоксичности хлорид лития.
В литературе имеются данные о про