Способ получения 3-алкил-2-(2-тиенил)пирролов и их n-винильных производных
Иллюстрации
Показать всеИзобретение относится к области органического синтеза, конкретно к способу получения 2-(2-тиенил)-3-алкил пирролов и их N-винильных производных общей формулы 1 и 2, где Alk - любой алкильный заместитель линейного строения. Метод представляет собой однореакторную трехкомпонентную реакцию 2-ацилтиофена, солянокислого гидроксиламина и избытка ацетилена в присутствии гидроксида щелочного металла без добавки гидрокарбоната натрия в ДМСО в автоклаве под давлением ацетилена в течение 1-3 часов при температуре 80-120°С в широком диапазоне мольных концентраций реагентов, мольное соотношение реагентов ацилтиофен: солянокислый гидроксиламин:ацетилен: МОН:ДМСО варьируется в пределах 1:1.0-1.5: 2-25:1.5-2.5:30-50. Технический результат - разработан способ получения новых соединений, которые могут использоваться в качестве мономеров для получения электропроводящих полимеров, в частности, в качестве активных компонентов электродов полимерных перезаряжаемых батарей и электрохромных устройств. 1 з.п. ф-лы, 4 пр.
Реферат
В настоящее время все большее число исследований посвящено синтезу производных 3-алкилтиофенов, полимеры которых обладают более низким окислительным потенциалом по сравнению с самим политиофеном [C.Pozo-Gonzalo, J.A.Pomposo, J.A.Alduncin, M.Salsamendi, A.I.Mikhaleva, L.B.Krivdin, B.A.Trofimov Electrochim.Acta, 2007, 52, 4784-791 (и ссылки в ней)]. Сообщалось о синтезе региорегулярного поли(3-гексилселенофена), имеющего малый HOMO-LUMO зазор [А.М.Ballantyne, L.Chen, J.Nelson, D.D.C.Bradley, Y.Astuti, A.Maurano, C.G.Shuttle, J.R.Durrant, M.Heeny, W.Duffy, I.McCulloch Adv. Mater., 2007, 19, 4544-4547]. Показано, что политиенилпиррольные нанопленки проявляют практически важные электропроводящие и электрохромные свойства [С.Pozo-Gonzalo, J.A.Pomposo, J.A.Alduncin, M.Salsamendi, A.I.Mikhaleva, L.B.Krivdin, B.A.Trofimov Electrochim. Acta, 2007, 52, 4784-4791; C.Pozo-Gonzalo, M.Salsamendi, J.A.Pomposo, H.-J.Grande, E.Yu.Schmidt, Yu.Yu.Rusakov, B.A.Trofimov Macromolecules, 2008, 41, 6886-6894]. Мономеры такого строения легко подвергаются дегидрополиконденсации как при химическом (например, FeCl3), так и при электрохимическом окислении, давая региорегулярные поли(тиенилпирролы) с алкильными заместителями в положении 3 пиррольного кольца и водородом или винильной группой в положении 1 пиррольного кольца. Полученные полимеры способны к дальнейшей сшивке по N-винильным группам с образованием проводящих сетчатых полимеров с улучшенными механическими свойствами и адгезией по отношению к субстратам. Такие мономеры можно сначала полимеризовать по винильной группе с получением винильных полимеров, которые далее могут подвергаться дополнительной сшивке за счет окислительной полимеризации, формируя проводящие полимерные пленки. Таким образом, 3-алкил-2-(2-тиенил)пирролы могут найти применение в дизайне электропроводящих полимерных слоев с контролируемыми электрофизическими свойствами, в частности как активные компоненты электродов перезаряжаемых полимерных батарей с использованием полианилина или полипиррола как основного полимерного слоя.
В литературе известно несколько методов получения 2-(2-тиенил)пирролов, которые, однако, являются многостадийными, требуют применения труднодоступных исходных соединений и не отличаются высокими выходами [N.Engel; W.Steglich Angew. Chem., 1978, 90, 719-720; J.P.Boukou-Poba, M.Farnier, R.Guilard Tetrahedron Lett., 1979, 19, 1717-1720; S.S.Ghabrial, I.Thomsen, К.B.G.Torssell Acta Chem. Scand., 1987, 41, 426-434; P.G.Aime, P.M.Antonietta, P.Giuseppe J. chem. res. synop, 1993, 6, 210-211; J.T.Reeves, J.J.Song, Z.Tan, H.Lee, N.K.Yee, С.H.Senanayake Org. Lett., 2007, 9, 1875-1878]. Как правило, эти методы заключаются во введении тиенильного заместителя в уже готовое пиррольное кольцо [D′A.Maurizio, D.L.Eliana, M.Giacomo, R.Rocco, S.Giancarlo J. Chem. Soc. Perkin Trans. 1, 1997, 16, 2369-2373].
Кроме того, в качестве исходных соединений часто используются 1,4-дикарбонильные соединения [Н.Steter, W.Haese Chem. Ber., 1984, 117, 682-693; К.A.Hansford, G.S.A.Perez, W.G.Skene, W.D.Lubell J. Org. Chem., 2005, 70, 7996-8000; M.M.M.Raposo, A.M.R.C.Sousa, A.M.C.Fonseca, G.Kirsch Tetrahedron, 2006, 62, 3493-3501].
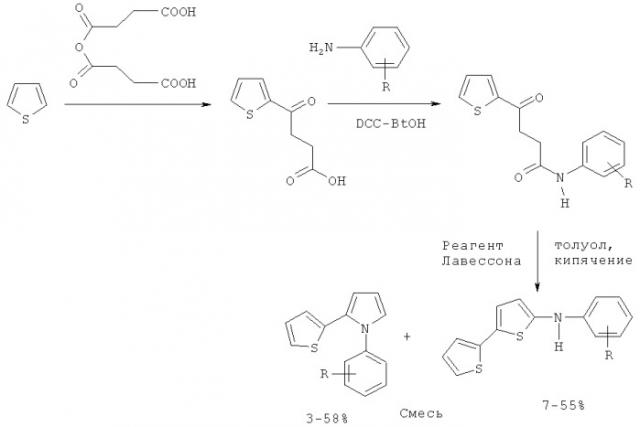
По-видимому, один из лучших (по выходу) описанных в литературе методов представляет собой многостадийный синтез 1-арил-2-(2-тиенил)пирролов на основе тиофена, который на первой стадии ацилируется сукциновым ангидридом с последующей реакцией полученного ацилтиофена с ариламинами в присутствии DCC (1,3-дициклогексилкарбодиимид), с образованием соответствующих амидов, реагирующих далее с реагентом Лавессона (2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дитион) с образованием смеси 1-арил-2-(2-тиенил)пирролов и 5-ариламино-2,2с-битиофенов, причем выход целевых пирролов на последней стадии не превышает 58% [М.М.Raposo, А.М.В.A.Sampaio, G.Kirsch Synthesis, 2005, 0199-0210]. Общий же выход с учетом всех трех стадий (исходя из взятого в реакцию тиофена) значительно ниже (около 36% при расчете с учетом двух последних стадий).
2-(2-Тиенил)-3-этилпиррол и 3-н-пропил-2-(2-тиенил)пиррол с выходами 37 и 43%, соответственно, были получены из оксимов 1-(2-тиенил)-1-бутанона и 1-(2-тиенил)-1-пентанона и ацетилена под давлением в системе КОН-ДМСО (95-100°C, начальное давление при комнатной температуре 14 атм) [С.Pozo-Gonzalo, М.Salsamendi, J.A.Pomposo, H.-J.Grande, E.Yu.Schmidt, Yu.Yu.Rusakov, B.A.Trofimov Macromolecules, 2008, 41, 6886-6894].
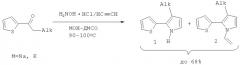
Наиболее близким по технической сущности к предлагаемому изобретению является способ (прототип), представляющий версию последней реакции. В данном прототипе исходя из соответствующих кетонов по реакции с солянокислым гидроксиламином в присутствии гидрокарбоната натрия в ДМСО сначала получают оксимы ацилтиофенов, удаляют выделяющийся углекислый газ, и полученный оксим переносят в автоклав, в котором проводится реакция полученного оксима с ацетиленом в системе КОН-ДМСО [А.И.Михалева, Е.Ю.Шмидт, А.В.Иванов, А.М.Васильцов, Е.Ю.Сенотрусова, Н.И.Процук ЖОрХ, 2007, 43, 236-238; С.Pozo-Gonzalo, М.Salsamendi, J.A.Pomposo, H.-J.Grande, E.Yu. Schmidt, Yu.Yu.Rusakov, B.A.Trofimov Macromolecules, 2008, 41, 6886-6894].
Обязательной операцией в данном случае является полное удаление углекислого газа, выделяющегося на первой стадии реакции. В противном случае остаточные количества CO2 могут понизить каталитическую активность системы КОН-ДМСО и таким образом замедлить, или даже остановить процесс формирования пиррольного цикла. Очевидным преимуществом данной версии метода является то, что устраняется необходимость выделения и очистки исходных оксимов. Вместе с тем, она требует применения дополнительного аппарата для стадии оксимирования и предварительного полного освобождения реакционной смеси от углекислого газа, что является недостатками метода-прототипа.
Выходы полученных данным способом N-винил-2-(2-тиенил)пиррола и 2-(2-тиенил)-3-этилпиррола составили 51% [А.И.Михалева, Е.Ю.Шмидт, А.В.Иванов, А.М.Васильцов, Е.Ю.Сенотрусова, Н.И.Процук ЖОрХ, 2007, 43, 236-238] и 47% [С.Pozo-Gonzalo, М.Salsamendi, J.A.Pomposo, H.-J.Grande, E.Yu.Schmidt, Yu.Yu.Rusakov, B.A.Trofimov Macromolecules, 2008, 41, 6886-6894], соответственно. Еще одним недостатком прототипа является то, что не был дан ответ на вопрос, подходит ли данный метод для ацилтиофенов с длинноцепочечными алкильными радикалами.
Предлагаемое изобретение открывает новый удобный подход к синтезу 3-алкил-2-(2-тиенил)пирролов и их N-винильных производных общей формулы:
являющихся мономерами для получения электропроводящих органических материалов, перспективных, в частности, в качестве активных компонентов электродов в полимерных перезаряжаемых источниках тока и электрохромных устройствах.
Предлагаемый нами способ основан на трехкомпонентной реакции 2-ацилтиофенов, солянокислого гидроксиламина и ацетилена в присутствии гидроксида щелочного металла в ДМСО.
Процесс реализуется однореакторно в интервале температур 80-120°C (предпочтительно 90-100°C), под давлением ацетилена (при температуре реакции давление ацетилена в автоклаве достигает 23-25 атм, а затем быстро падает) в течение 1-3 часов (предпочтительно 2 часа).
Мольное соотношение ацилтиофен:солянокислый гидроксиламин:ацетилен:МОН:ДМСО варьируется в пределах 1:1.0-1.5:2-25:1.5-2.5:30-50, M=Na, K.
Более конкретно способ реализуется следующим образом: все реагенты и растворитель (ДМСО) загружаются в стальной вращающийся автоклав и нагреваются (при вращении автоклава) при температуре реакции в течение 5-30 мин (предпочтительно 10 мин). Затем в автоклав подается ацетилен (начальное давление 10-14 атм), и реакционная смесь выдерживается во вращающемся автоклаве при температуре реакции еще 1-3 часа (предпочтительно 2 часа). После охлаждения автоклава до комнатной температуры реакционная смесь переливается в холодную воду (0-15°C, отношения объема реакционной смеси к объему воды 1:1-5). Далее продукты выделяются экстракцией подходящим экстрагентом (например, диэтиловым эфиром или дихлорметаном) и очищаются известными методами (вакуумная перегонка, перекристаллизация или хроматографически).
Целевые продукты представляют собой смесь 3-алкил-2-(2-тиенил)пирролов (1) и их N-винильных производных (2). Суммарный выход таких смесей достигает 68%, а соотношение винилированных и невинилированных пирролов зависит от условий реакции. 3-Алкил-2-(2-тиенил)пирролы и их N-винильные производные могут быть в дальнейшем разделены традиционными методами (например, колоночной хроматографией) или использованы далее в виде смеси без разделения.
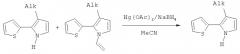
Чистые 3-алкил-2-(2-тиенил)пирролы 1 могут быть получены из смеси 3-алкил-2-(2-тиенил)пирролов и их N-винильных производных 2 удалением N-винильной группы ацетатом ртути по известной методике [Е.Yu.Schmidt, В.A.Trofimov, A.I.Mikhaleva, N.V.Zorina, N.I.Protzuk, К.В.Petrushenko, I.A.Ushakov, M.Yu.Dvorko, R.Méallet-Renault, G.Clavier, Т.T.Vu, H.Т.T.Tran, R.B.Pansu Chem. Eur. J., 2009, 15, 5823-5830].
Смеси 3-алкил-2-(2-тиенил)пирролов и их N-винильных производных могут быть также переведены в соответствующие 3-алкил-N-винил-2-(2-тиенил)пирролы 2 дополнительным винилированием ацетиленом в системе КОН-ДМСО.
Преимуществами предлагаемого способа по сравнению с ранее известными являются, во-первых, устранение стадии оксимирования ацилтиофена в отдельном аппарате и, во-вторых, что более важно, отсутствие в этом способе трудоемкого и требующего дополнительных временных затрат процесса дегазации предреакционной смеси от углекислого газа. Заявленный способ также позволяет исключить один из использовавшихся в способе-прототипе реагентов (NaHCO3) и уменьшает загрязнение окружающей среды углекислым газом, что особенно важно при реализации данного способа в промышленных масштабах. Дополнительными технологическими преимуществами заявляемого способа являются также снижение предпочтительной температуры реакции (90-100°C вместо 116-121°C [А.И.Михалева, Е.Ю.Шмидт, А.В.Иванов, А.М.Васильцов, Е.Ю.Сенотрусова, Н.И.Процук ЖОрХ, 2007, 43, 236-238]), уменьшение времени реакции (2 часа вместо 3 часов [А.И.Михалева, Е.Ю.Шмидт, А.В.Иванов, А.М.Васильцов, Е.Ю.Сенотрусова, Н.И.Процук ЖОрХ, 2007, 43, 236-238]) и облегчение экстракции целевых продуктов из водного ДМСО за счет эффекта высаливания хлоридом щелочного металла, образующимся на стадии оксимирования.
Данные преимущества являются результатом особой химической природы процесса, вытекающим из объединения в одном реакторе реакций оксимирования и пирролизации: это и модифицированная каталитическая система MCl-МОН-ДМСО вместо МОH-ДМСО, и возможность протекания наряду с обычным направлением реакции кетоксимов с ацетиленом с образованием пиррола (через винилирование оксима) двух других параллельных реакций, не свойственных синтезу через готовые кетоксимы. Первая реакция - винилирование гидроксиламина с образованием O-винилгидроксиламина, который затем оксимирует кетон, давая O-винилоксим, в дальнейшем перегруппировывающийся в целевой пиррол.
Вторая реакция - перехват ацетиленом промежуточного аддукта кетона и гидроксиламина с образованием его O-винильного производного, которое далее дегидратируется, давая O-винилоксим. Такой перехват по фундаментальным соображениям предпочтительнее винилирования соответствующего кетоксима, так как гидроксильная группа аддукта связана с менее электроотрицательным атомом азота, чем атом азота в кетоксиме.
Следующие неограничивающие примеры иллюстрируют изобретение и показывают, что процессом можно легко управлять, меняя его параметры, такие как соотношение реагентов, температуру и время.
Пример 1
1-(Тиофен-2-ил)бутан-1-он (2.00 г, 0.013 моль), солянокислый гидроксиламин (0.99 г, 0.014 моль) и КОН×0.5 H2O (1.69 г, 0.026 моль) в ДМСО (40 мл) загружают в стальной вращающийся автоклав и греют при 100°C 10 мин. Затем в автоклав подают ацетилен (начальное давление 10-14 атм) и продолжают нагрев с вращением при 100°C еще 2 часа. После охлаждения до комнатной температуры реакционную смесь переливают в ледяную воду (150 мл). Продукты экстрагируют диэтиловым эфиром (4×20 мл). Экстракт промывают холодной водой (3×30 мл) и сушат над K2CO3. После удаления растворителя получившийся сырой продукт содержит 16% 3-этил-2-(2-тиенил)пиррола и 84% N-винил-2-(2-тиенил)-3-этилпиррола (ГЖХ). Колоночной хроматографией (основная Al2O3, бензол-гексан 1:2) выделяют 1.78 г (68%) N-винил-2-(2-тиенил)-3-этилпиррола в виде красной маслянистой жидкости. Спектральные характеристики полученного соединения совпадают с литературными данными [С.Е.Коростова, А.И.Михалева, Р.Н.Нестеренко, Н.В.Мазная, В.К.Воронов, Н.М.Бородина ЖОрХ, 1985, 21, 406-411].
Пример 2
1-(Тиофен-2-ил)нонан-1-он (2.00 г, 0.009 моль), солянокислый гидроксиламин (0.69 г, 0.010 моль) и КОН×0.5 H2O (1.17 г, 0.018 моль) в ДМСО (40 мл) загружают в стальной вращающийся автоклав и греют при 100°C 15 мин. Затем в автоклав подают ацетилен (начальное давление 10-14 атм) и продолжают нагрев с вращением при 100°C еще 2 часа. После охлаждения до комнатной температуры реакционную смесь переливают в ледяную воду (160 мл). Продукты экстрагируют дихлорметаном (4×20 мл). Экстракт промывают холодной водой (3×30 мл) и сушат над K2CO3. После удаления растворителя колоночной хроматографией (основная Al2O3, бензол-гексан 1:3) выделено 0.76 г (31%) N-винил-3-гептил-2-(2-тиенил)пиррола в виде темно-красной маслянистой жидкости. ИК (KBr): ν 3387, 3103, 2955, 2926, 2856, 1688, 1578, 1524, 1510, 1466, 1416, 1378, 1233, 1106, 1081, 894, 845, 817, 721, 688, 510 см-1. 1H ЯМР (CDCl3: δ 7.43 (дд, 3J5'-4'=4.5 Гц 4J5'-3'=1.0 Гц, 1Н, Н5'), 7.14 (дд, 3J4'-3'=3.7 Гц, 3J4'-5'=4.5 Гц, 1H, Н4'), 7.11 (м, 1Н, Н5), 7.00 (дд, 3J3'-4'=3.7 Гц, 4J5'-3'=1.0 Гц, 1Н, Н3'), 6.86 (дд, 3JBX=15.8 Гц, 3JAX=9.1 Гц, 1Н, HX), 6.23 (м, 1Н, Н4), 5.10 (дд, 3JBX=15.8 Гц, 1Н, HB), 4.61 (дд, 3JAX=9.1 Гц, 1Н, НА), 2.48 (м, 2Н, CH2), 1.47-1.19 (м, 10H, СН2), 0.91 (м, 3H, Me). Рассчитано, %: C 74.67; H 8.48; N 5.12; S 11.73. C17H23NS (273.44). Найдено, %: C 74.60; H 8.51; N 5.18; S 11.72.
Пример 3
1-(Тиофен-2-ил)ундекан-1-он (2.00 г, 0.008 моль), солянокислый гидроксиламин (0.63 г, 0.009 моль) и KOH×0.5 H2O (1.04 г, 0.016 моль) в ДМСО (40 мл) загружают в стальной вращающийся автоклав и греют при 100°C 10 мин. Затем в автоклав подают ацетилен (начальное давление 10-14 атм) и продолжают нагрев с вращением при 100°C еще 2 часа. После охлаждения до комнатной температуры реакционную смесь переливают в ледяную воду (150 мл). Продукты экстрагируют диэтиловым эфиром (4×25 мл). Экстракт промывают холодной водой (3×35 мл) и сушат над K2CO3. После удаления растворителя получившийся сырой продукт содержит 49% 3-нонил-2-(2-тиенил)пиррола и 51% N-винил-3-нонил-2-(2-тиенил)пиррола (ГЖХ). Колоночной хроматографией (основная Al2O3, бензол-гексан 1:2) выделяют 1.01 г (общий выход 46%) смеси, состоящей из 3-нонил-2-(2-тиенил)пиррола (0.52 г, выход 24%) и N-винил-3-нонил-2-(2-тиенил)пиррола (0.52 г, выход 22%) в виде красной маслянистой жидкости. 3-Нонил-2-(2-тиенил)пиррол ИК (KBr): ν 3417, 3103, 2954, 2925, 1657, 1576, 1524, 1509, 1465, 1425, 1377, 1106, 1079, 893, 844, 816, 721, 688, 511 см-1. 1H ЯМР (CDCl3): δ 8.08 (с, 1Н, NH), 7.20 (дд, 3J5'-4'=4.5 Гц, 4J5'-3'=1.0 Гц, 1H, Н5'), 7.05 (дд, 3J4'-3'=3.7 Гц, 3J4'-5'=4.5 Гц, 1Н, Н4'), 6.98 (дд, 3J3'-4'=3.7 Гц, 4J5'-3'=1.0 Гц, 1Н, Н3'), 6.74 (м, 1Н, Н5), 6.16 (м, 1Н, Н4), 2.69 (м, 2Н, СН2), 1.40-1.24 (м, 14Н, СН2), 0.88 (м, 3H, Me). Рассчитано, %: C 74.13; H 9.15; N 5.08; S 11.64. C17H25NS (275.45). Найдено, %: C 74.37; H 9.00; N 4.98; S 11.80. N-Винил-3-нонил-2-(2-тиенил)пиррол 1H ЯМР (CDCl3: δ 7.45 (дд, 3J5'-4'=4.5 Гц 4J5'-3'=1.0 Гц, 1Н, Н5'), 7.17 (дд, 3J4'-3'=3.7 Гц, 3J4'-5'=4.5 Гц, 1Н, Н4'), 7.09 (м, 1Н, Н5), 7.01 (дд, 3J3'-4'=3.7 Гц, 4J5'-3'=1.0 Гц, 1Н, Н3'), 6.88 (дд, 3JBX=15.9 Гц, 3JAX=8.9 Гц, 1Н, HX), 6.29 (м, 1Н, Н4), 5.10 (дд, 3JBX=15.9 Гц, 1Н, HB), 4.67 (дд, 3JAX=8.9 Гц, 1Н, HA), 2.50 (м, 2Н, СН2), 1.51-1.15 (м, 14Н, СН2), 0.89 (м, 3H, Me). Рассчитано, %: C 75.69; H 9.03; N 4.65; S 10.64. C19H27NS (301.49). Найдено, %: C 75.57; H 9.22; N 4.68; S 10.89.
Пример 4
1-(Тиофен-2-ил)бутан-1-он (2.00 г, 0.013 моль), солянокислый гидроксиламин (1.35 г, 0.020 моль) и KOH×0.5 H2O (2.27 г, 0.035 моль) в ДМСО (50 мл) загружают в стальной вращающийся автоклав и греют при 110°C 15 мин. Затем в автоклав подают ацетилен (начальное давление 10-14 атм) и продолжают нагрев с вращением при 110°C еще 2.5 часа. После охлаждения до комнатной температуры реакционную смесь переливают в ледяную воду (150 мл). Продукты экстрагируют диэтиловым эфиром (4×20 мл). Экстракт промывают холодной водой (3×30 мл) и сушат над K2CO3. После удаления растворителя получившийся сырой продукт содержит 5% 3-этил-2-(2-тиенил)пиррола и 95% N-винил-3-этил-2-(2-тиенил)пиррола (ГЖХ). Колоночной хроматографией (основная Al2O3, бензол-гексан 1:2) выделяют 1.61 г (61%) N-винил-3-этил-2-(2-тиенил)пиррола в виде красной маслянистой жидкости. Спектральные характеристики полученного соединения совпадают с литературными данными [С.Е.Коростова, А.И.Михалева, Р.Н.Нестеренко, Н.В.Мазная, В.К.Воронов, Н.М.Бородина ЖОрХ, 1985, 21, 406-411].
1. Способ получения 3-алкил-2-(2-тиенил)пирролов и их N-винильных производных общей формулы 1 и 2 где Alk - любой алкильный заместитель линейного строения, взаимодействием оксимов 2-ацилтиофенов с ацетиленом в присутствии гидроксида щелочного металла в среде диметилсульфоксида под давлением ацетилена при нагревании, отличающийся тем, что оксимы 2-ацилтиофенов получают непосредственно в реакционной среде из ацилтиофенов и гидроксиламина солянокислого в присутствии избытка гидроксида щелочного металла без добавки гидрокарбоната натрия, а процесс проводится в одном реакторе как трехкомпонентная реакция.
2. Способ по п.1, характеризующийся тем, что процесс проводится в присутствии гидроксидов натрия или калия при температуре 80-120°С под давлением ацетилена до 25 атм. в течение 1-3-х часов и мольном соотношении реагентов ацилтиофен:солянокислый гидроксиламин:ацетилен:МОН:ДМСО, равном 1:1,0-1,5:2-25:1,5-2,5:30-50 соответственно.