Полипептид, селективный по отношению к интегрину v 3, способ его получения, кодирующий его полинуклеотид, композиция, содержащая данный полипептид, и способ лечения и профилактики
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и молекулярной генетики. Раскрываются варианты дезинтегрина и их применение в фармакологии. Вариант дезинтегрина включает выделенный полипептид, который обладает антагонистической активностью в отношении рецептора αvβ3 и значительно более низкой способностью блокировать рецептор интегрина aIIbβ3 и/или α5β1, чем дезинтегрин дикого типа. Полипептид кодируется модифицированной нуклеотидной последовательностью дезинтегрина, которая кодирует модифицированную аминокислотную последовательность, обладающую более низкой способностью связываться с интегрином αIIbβ3 и/или α5β1, чем дезинтегрин дикого типа. Изобретение можно использовать для лечения и/или профилактики интегрин αvβ3-ассоциированных заболеваний у млекопитающего, которые включают, без ограничения, остеопороз, рост опухоли или рака кости, ассоциированные с ангиогенезом рост и метастазирование опухоли, опухолевый метастаз в кости, индуцированную злокачественным заболеванием гиперкальциемию, ассоциированные с ангиогенезом заболевания глаз, болезнь Педжета, ревматоидный артрит и остеоартрит. 5 н. и 18 з.п. ф-лы, 16 ил., 10 табл., 25 пр.
Реферат
Перекрестная ссылка на родственную патентную заявку
По данной заявке испрашивается приоритет на основании 35 U.S.C. $119(e) по предварительной патентной заявке США № 60/871854, поданной 26 декабря 2006 г., которая включена в настоящее описание в качестве ссылки в полном объеме.
Описание изобретения
Область изобретения
Настоящее изобретение главным образом относится к вариантам дезинтегрина и, более конкретно, к вариантам дезинтегрина, которые являются селективными антагонистами интегрина αvβ3 и могут использоваться для лечения и профилактики интегрин αvβ3-ассоциированных заболеваний.
Уровень техники изобретения
Кость представляет собой сложную ткань, состоящую из нескольких типов клеток, которые непрерывно подвергаются процессу обновления и восстановления, называемому "ремоделирование кости". Существует два основных типа клеток, отвечающих за ремоделирование кости: остеокласты, которые осуществляют резорбцию костей, и остеобласты, обеспечивающие формирование новой кости. Известно, что ремоделирование кости регулируется некоторыми системными гормонами (например, паращитовидным гормоном, 1,25-дигидроксивитамином D3, половыми гормонами и кальцитонином) и локальными факторами (например, оксидом азота, простагландинами, факторами роста и цитокинами) [1].
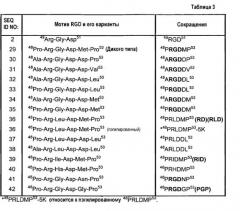
Интегрины представляют собой гетеродимерные рецепторы матрикса, которые прикрепляют клетки к субстратам и передают внешние сигналы через плазматическую мембрану [5]. Интегрин αvβ3 участвует в опосредованной остеокластами резорбции кости как in vivo [6], так и in vitro [7, 8]. Данная гетеродимерная молекула распознает аминокислотный мотив Arg-Gly-Asp (RGD, SEQ ID NO:2), содержащийся в белках костного матрикса, таких как остеопонтин и костный сиалопротеин [7, 8]. Интегрин αvβ3 экспрессируется в остеокластах [9], причем его экспрессия модулируется резорбтивными стероидами и цитокинами [10]. В экспериментах по блокированию интегрин αvβ3 индентифицирован как основной рецептор функциональной адгезии остеокластов. Ингибиторы интегрина αvβ3 снижают способность остеокластов связываться и осуществлять резорбцию кости [7, 11]. Поскольку интегрин αvβ3 играет ключевую роль в функционировании остеокластов [7, 11, 12], полагают, что ингибиторы данного интегрина могут способствовать предотвращению остеопороза [11], остеолитических метастазов [13] и гиперкальцемии, индуцированной злокачественным заболеванием.
Существует много костных заболеваний, связанных с остеолизом, опосредуемым остеокластами. Остеопороз является наиболее распространенным заболеванием, которое возникает при нарушении баланса между резорбцией и формированием кости, когда разрушение костной ткани преобладает над ее созданием. Остеопороз также вызывается другими состояниями, такими как гормональный дисбаланс, гормональные заболевания или состояние после приема гормональных лекарственных средств (таких как кортикостероиды или противоэпилептические средства) [2]. При раке молочной железы, предстательной железы, легкого и щитовидной железы человека, а также при других раковых заболеваниях кость является одним из наиболее вероятных участков метастазирования [3, 4]. Остеопороз также может возникать в результате постклимактерической недостаточности эстрогенов. Вторичный остеопороз может быть связан с ревматоидным артритом. При костном метастазе наблюдается уникальная стадия резорбции кости под действием остеокластов, которая отсутствует при метастазах в других органах. Широко известно, что связанный с раком остеолиз в большинстве случаев опосредуется остеокластами, которые по-видимому находятся в активированном состоянии и могут активироваться либо косвенно, через остеобласты, либо непосредственно, под действием опухолевых продуктов [4]. Кроме того, жизненно важным осложнением остеолитических заболеваний костей является гиперкальцемия (повышенное содержание кальция в крови). Она относительно часто встречается у пациентов с обширной деструкцией костей, чаще всего при карциномах молочной железы, легкого, почки и поджелудочной железы, а также при миеломе [4].
Дезинтегрины относятся к семейству низкомолекулярных RGD-содержащих пептидов, которые специфически связываются с интегринами αIIbβ3, α5β1 и αvβ3, которые экспрессируются на тромбоцитах и других клетках, включающих клетки эндотелия сосудов и некоторые опухолевые клетки [14, 15]. Исследования дезинтегринов, обладающих высокой антитробоцитарной активностью, показали, что их также можно использовать для диагностики сердечно-сосудистых заболеваний и конструирования терапевтических средств для лечения артериального тромбоза, остеопороза и ассоциированных с ангиогенезом роста и метастазирования опухоли [15]. Обнаружено, что родостомин (Rho), дезинтегрин, полученный из яда Colloselasma rhodostoma, ингибирует агрегацию тромбоцитов in vivo и in vitro [16, 17] посредством блокады тромбоцитарного гликопротеина αIIbβ3. Кроме того, описано, что родостомин дозозависимым образом ингибирует адгезию клеток карциномы молочной железы и предстательной железы как к неминерализованному, так и к минерализованному внеклеточному костному матриксу, не влияя на жизнеспособность опухолевых клеток. Родостомин также подавляет миграцию и инвазию клеток карциномы молочной железы и предстательной железы [18]. Показано также, что родостомин ингибирует липогенез и ожирение [19]. Однако поскольку родостомин неспецифически связывается с интегринами αIIbβ3, α5β1 и αvβ3, фармацевтическое применение родостомина вызывает серьезные побочные эффекты. Например, при применении родостомина для лечения карциномы нежелательным побочным эффектом является ингибирование агрегации тромбоцитов.
Таким образом, в данной области существует потребность в преодолении упомянутых дефектов и недостатков, в особенности, связанных с получением варианта дезинтегрина, обладающего специфической селективностью по отношению к интегрину αvβ3.
Сущность изобретения
Один аспект данного изобретения относится к полипептиду, который является селективным по отношению к интегрину αvβ3. Данный полипептид проявляет уменьшенное связывание с интегрином αIIbβ3 и/или α5β1 по сравнению с дезинтегрином дикого типа. Полипептид кодируется модифицированной нуклеотидной последовательностью дезинтегрина, которая кодирует модифицированную аминокислотную последовательность, обладающую пониженной способностью связываться с интегрином αIIbβ3 и/или α5β1. Полипептид может быть пэгилированным или конъюгированным с альбумином.
Нуклеотидную последовательность дезинтегрина можно получить из змеиного яда. Дезинтегрин может быть выбран из родостомина, альболабрина, апплагина, басилицина, батроксостатина, битистатина, цереберина, церастина, кротатроксина, дуриссина, элегантина, флаворидина, флавостатина, халисина, халистатина, ярарацина, ярастатина, кистрина, лачесина, лутосина, молоссина, салмосина, саксатилина, тергеминина, триместатина, тримукрина, тримутаса, уссуристатина и виридина.
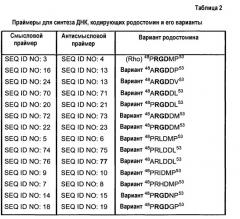
Другой аспект данного изобретения относится к полипептиду, который представляет собой вариант родостомина, где родостомин содержит аминокислотную последовательность SEQ ID NO:1.
Другой аспект данного изобретения относится к полипептиду, содержащему аминокислотную последовательность, выбранную из SEQ ID NO:30-42.
Другой аспект данного изобретения относится к полипептиду, содержащему аминокислотную последовательность SEQ ID NO:29, которая дополнительно содержит одну, две, три или четыре аминокислотные замены в положениях, соответствующих аминокислотам 48, 50, 52 или 53 SEQ ID NO:1.
Другой аспект данного изобретения относится к полипептиду, содержащему аминокислотные замены, выбранные из Ala в положении 48, Leu, Ile и His в положении 50, Asp, Met и Asn в положении 52 и Val, Leu и Met в положении 53 SEQ ID NO:1.
Другой аспект данного изобретения относится к полипептиду, который кодируется нуклеотидной последовательностью, выбранной из SEQ ID NO:43-56.
Другой аспект данного изобретения относится к полипептиду, который проявляет сродство к αIIbβ3 и/или α5β1, по меньшей мере, примерно в 5, 50 или 100 раз меньше по сравнению с родостомином. В одном варианте осуществления данного изобретения полипептид проявляет сродство к интегрину αIIbβ3 и/или α5β1, по меньшей мере, примерно в 200 раз меньше по сравнению с родостомином. В другом варианте осуществления данного изобретения полипептид проявляет сродство к интегрину αIIbβ3 и/или α5β1, по меньшей мере, примерно в 1000 или 2000 раз меньше по сравнению с родостомином. В другом варианте осуществления данного изобретения полипептид проявляет сродство к тромбоцитам, по меньшей мере, примерно в 5, 50, 100, 1000 или 2000 раз меньше по сравнению с родостомином. В следующем варианте осуществления данного изобретения полипептид обладает существенно сниженной активностью в продлении времени свертывания крови по сравнению с родостомином и/или дезинтегрином дикого типа.
Следующий аспект данного изобретения относится к физиологически приемлемой композиции, содержащей полипептид по изобретению и фармацевтически приемлемый носитель.
Другой аспект данного изобретения относится к полипептиду, содержащему аминокислотную последовательность, выбранную из SEQ ID NO:57-69.
Следующий аспект данного изобретения относится к способу применения варианта дезинтегрина для лечения и/или профилактики интегрин αvβ3-ассоциированного заболевания у млекопитающего, в том числе у человека. Данный способ включает стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества варианта дезинтегрина. Используемый в данном способе полипептид может быть пэгилированным или конъюгированным с альбумином.
В одном аспекте данного изобретения дезинтегрин может быть получен из змеиного яда и может быть выбран из родостомина, альболабрина, апплагина, басилицина, батроксостатина, битистатина, цереберина, церастина, кротатроксина, дуриссина, элегантина, флаворидина, флавостатина, халисина, халистатина, ярарацина, ярастатина, кистрина, лачесина, лутосина, молоссина, салмосина, саксатилина, тергеминина, триместатина, тримукрина, тримутаса, уссуристатина и виридина.
В одном аспекте данного изобретения дезинтегрин представляет собой родостомин.
В другом аспекте данного изобретения родостомин содержит вариант родостомина, содержащий аминокислотную последовательность SEQ ID NO:1.
В другом аспекте родостомин содержит вариант мотива RGD, содержащий аминокислотную последовательность, выбранную из SEQ ID NO:30-42.
В другом аспекте родостомин содержит аминокислотную последовательность, выбранную из SEQ ID NO:57-69.
В одном аспекте данного изобретения интегрин αvβ3-ассоциированное заболевание включает, без ограничения, остеопороз, рост опухоли или рака кости и связанные с ним симптомы, ассоциированные с ангиогенезом рост и метастазирование опухоли, опухолевый метастаз в кости, индуцированную злокачественным заболеванием гиперкальциемию, ассоциированные с ангиогенезом заболевания глаз, болезнь Педжета, ревматоидный артрит и остеоартрит.
В другом аспекте настоящего изобретения полипептид по изобретению используют для лечения и/или профилактики ассоциированного с ангиогенезом заболевания глаза, которое включает, без ограничения, возрастную дегенерацию желтого пятна, диабетическую ретинопатию, заболевания, связанные с реваскуляризацией роговицы, индуцированную ишемией реваскуляризационную ретинопатию, сильную близорукость и ретинопатию недоношенных.
В следующем аспекте полипептид по изобретению используют для лечения и/или профилактики остеопороза. Остеопороз может быть связан с патологическим состоянием, выбранным из постклимактерической недостаточности эстрогенов, вторичного остеопороза, ревматоидного артрита, овариэктомии, болезни Педжета, рака кости, опухоли кости, остеоартрита, повышенного образования остеокластов и повышенной активности остеокластов. Кроме того, остеопороз включает, без ограничения, индуцированный овариэктомией или постклимактерический остеопороз или разрежение кости.
Следующий аспект настоящего изобретения относится к способу применения полипептида по изобретению для лечения и/или профилактики индуцированного овариэктомией физиологического изменения у млекопитающего, включающего человека.
Следующий аспект настоящего изобретения относится к способу применения варианта дезинтегрина для ингибирования и/или предотвращения роста опухолевых клеток в кости, а также связанных с ним симптомов у млекопитающего, в том числе человека.
Следующий аспект настоящего изобретения относится к способу получения полипептида по изобретению, который включает следующие стадии: (a) трансфицирование клетки-хозяина полинуклеотидом, кодирующим указанный полипептид; (b) выращивание указанной клетки в культуральной среде и выделение указанного полипептида. Способ по изобретению дополнительно может включать выращивание клетки-хозяина в культуральной среде, не содержащей аминокислот; и сбор супернатанта для получения указанного полипептида. Способ также может дополнительно включать добавление метанола в культуральную среду для индукции экспрессии полипептида в клетках-хозяевах. Способ может дополнительно включать стадию проведения колоночной хроматографии для получения указанного полипептида. В одном варианте осуществления способ может дополнительно включать стадию проведения ВЭЖХ для получения выделенного полипептида.
Другой аспект настоящего изобретения относится к полинуклеотиду, кодирующему полипептид, селективный по отношению к интегрину αvβ3, где полипептид может представлять собой вариант дезинтегрина, выделенный из змеиного яда.
В другом аспекте настоящего изобретения дезинтегрин выбран из родостомина, альболабрина, апплагина, басилицина, батроксостатина, битистатина, цереберина, церастина, кротатроксина, дуриссина, элегантина, флаворидина, флавостатина, халисина, халистатина, ярарацина, ярастатина, кистрина, лачесина, лутосина, молоссина, салмосина, саксатилина, тергеминина, триместатина, тримукрина, тримутаса, уссуристатина и виридина.
В другом аспекте настоящего изобретения дезинтегрин содержит родостомин.
В другом аспекте настоящего изобретения дезинтегрин содержит вариант родостомина, содержащий аминокислотную последовательность SEQ ID NO:1.
В другом аспекте настоящего изобретения полипептид содержит вариант мотива RGD, содержащий аминокислотную последовательность, выбранную из SEQ ID NO:30-42.
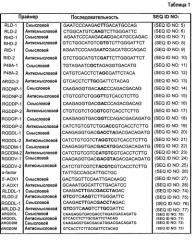
В другом аспекте настоящего изобретения полинуклеотид содержит последовательность, выбранную из SEQ ID NO:43-56 и 78-135.
В другом аспекте настоящего изобретения полинуклеотид может кодировать полипептиды, содержащие одну, две, три или четыре аминокислотные замены в положениях, соответствующих аминокислотам 48, 50, 52 или 53 SEQ ID NO:1.
Другой аспект настоящего изобретения относится к полинуклеотиду, который гибридизуется в жестких условиях с полинуклеотидом по изобретению.
Другой аспект настоящего изобретения относится к полипептиду, кодируемому полинуклеотидом, который гибридизуется с полинуклеотидной последовательностью по изобретению.
Эти и другие аспекты разъясняются в нижеследующем описании различных вариантов воплощения в сочетании с приведенными ниже фигурами, хотя возможно осуществление разных вариаций и модификаций без отступления от сущности и объема новых концепций, изложенных в настоящем описании.
Приложенные рисунки иллюстрируют один или несколько вариантов осуществления настоящего изобретения и, вместе с приведенным описанием, служат для разъяснения принципов настоящего изобретения.
Другие цели и преимущества настоящего изобретения частично приведены в нижеследующем описании и частично вытекают из данного описания, или они могут стать очевидны при осуществлении настоящего изобретения. Цели и преимущества настоящего изобретения можно достичь и реализовать с помощью конкретных элементов и их сочетаний, указанных в прилагающейся формуле изобретения.
Следует понимать, что и вышеизложенное общее описание, и нижеследующее подробное описание приведены только для иллюстрации и пояснения и не ограничивают настоящее изобретение, определенное в формуле изобретения.
Прилагающиеся фигуры, которые входят в объем настоящего описания и составляют его часть, иллюстрируют варианты осуществления настоящего изобретения и в сочетании с описанием служат для разъяснения принципов изобретения.
Краткое описание фигур
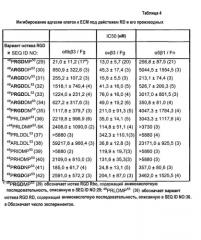
На фиг.1 приведен график, демонстрирующий, что RD, HSA-RD и ARLDDL оказывают меньше влияния на время кровотечения у мышей, чем родостомин.
На фиг.2А приведены фотографии губчатых костей, демонстрирующие ингибирование индуцированного овариэктомией разрежения кости у крыс, получающих белок PGP. Отрезок = 1 мм.
На фиг.2В приведены фотографии губчатых костей, окрашенных устойчивой к тартрату кислой фосфатазой (TRAP), демонстрирующие ингибирование индуцированного овариэктомией увеличения числа остеокластов у крыс, получающих белок PGP. Отрезок = 100 мм.
На фиг.3 приведен график, демонстрирующий ингибирование индуцированной овариэктомией активации остеокластов у крыс, получающих белок RD или алендронат (обработка лекарственным средством), возвращение концентрации маркера остеокластов к прежнему состоянию в период отмены лекарственного средства и снижение индуцированного овариэктомией увеличения активности остеокластов при повторном введении RD или алендроната.
На фиг.4A-4D приведены фотографии коленного сустава, окрашенного сафранином-O и гематоксилином, демонстрирующие подавление разрушения слоя хондроцитов у крыс с артритом, получающих белок RD. Стрелки показывают слой хондроцитов.
На фиг.5A-5C приведены графики, демонстрирующие ингибирование повышения уровня цитокинов в крови крыс с остеоартритом, получающих белок RD.
На фиг.6A-6C приведены графики, демонстрирующие ингибирование повышения уровня цитокинов в крови мышей с остеоартритом, получающих белок RD.
На фиг.7 приведен график, демонстрирующий ингибирование роста опухоли кости PC-3 у мышей SCID, получающих белок RD, а не алендронат.
На фиг.8 приведен график, демонстрирующий ингибирование индуцированного опухолью уменьшения массы тела у мышей SCID, получающих белок RD.
На фиг.9A приведены фотографии, демонстрирующие видимый рост сферической опухоли в проксимальной области большеберцовой кости каждой конечности после введения в большеберцовую кость клеток PC-3 (показано стрелками в средней панели) и ингибирование роста опухоли кости у мышей SCID, получающих белок RD.
На фиг.9B приведены рентгеновские снимки большеберцовых костей, демонстрирующие, что у мышей SCID, получающих белок RD, наблюдается подавление остеолитического повреждения костей, индуцированного опухолевыми клетками PC-3.
На фиг.9C графически изображены результаты, показанные на фиг.9B, демонстрирующие ингибирование индуцированного опухолью PC-3 остеолиза у мышей SCID, получающих белок RD.
На фиг.9D приведен график, демонстрирующий ингибирование индуцированного опухолью PC-3 увеличения уровня C-концевых телопептидов коллагена типа I у мышей SCID, получающих белок RD.
На фиг.9E приведен график, демонстрирующий ингибирование индуцированного опухолью PC-3 увеличения концентрации кальция в сыворотке мышей SCID, получающих белок RD или алендронат.
На фиг.10A приведен график, демонстрирующий ингибирование роста опухоли кости MDA-MB-231 у голых мышей, получающих белок RD.
На фиг.10B приведен график, демонстрирующий ингибирование индуцированного опухолью кости MDA-MB-231 увеличения уровня C-концевых телопептидов коллагена типа I у голых мышей, получающих белок RD.
На фиг.10C приведен график, демонстрирующий ингибирование индуцированной опухолью кости MDA-MB-231 гиперкальциемии у голых мышей, получающих белок RD.
На фиг.10D приведен график, демонстрирующий отсутствие изменений в числе белых кровяных клеток у голых мышей, обработанных клетками MDA-MB-231 и получающих белок RD.
На фиг.10E приведен график, демонстрирующий отсутствие изменений в числе красных кровяных клеток у голых мышей, обработанных клетками MDA-MB-231 и получающих белок RD.
На фиг.10F приведен график, демонстрирующий отсутствие изменений в числе тромбоцитов у голых мышей, обработанных клетками MDA-MB-231 и получающих белок RD.
На фиг.11A приведены фотографии, демонстрирующие уменьшение плотности кровеносных сосудов в слое MATRIGELTM у мышей C57BL/6, получающих белок RD или RD-альбумин (HSA-RD), по сравнению с необработанными контрольными мышами.
На фиг.11В приведен график, демонстрирующий снижение содержания гемоглобина в слое MATRIGELTM у мышей C57BL/6, получающих белок RD (ежедневно - RD/1день или через день - RD/2день) или RD-альбумин (HSA-RD через день), по сравнению с необработанными контрольными мышами.
На фиг.12A приведены фотографии, демонстрирующие ангиогенез у мышиной модели ретинопатии недоношенных (ROP) и уменьшение ангиогенеза у мыши ROP, получающей белок RD (ROP+RD). Стрелки показывают профили кровеносных сосудов (BVP).
На фиг.12B приведен график, демонстрирующий уменьшение BVP у мышиной модели ретинопатии недоношенных (ROP), получающей белок RD.
На фиг.13A приведен график, демонстрирующий ингибирование индуцированной овариэктомией активации остеокластов у мышей, получающих белок RD или RD-альбумин.
На фиг.13B приведен график, демонстрирующий ингибирование индуцированной овариэктомией инактивации щелочной фосфатазы (ALP) у мышей, получающих белок RD или RD-альбумин.
На фиг.13C приведен график, демонстрирующий ингибирование индуцированного овариэктомией уменьшения BMD.
На фиг.13D приведен график, демонстрирующий ингибирование индуцированного овариэктомией уменьшения BMC.
На фиг.14A-D показаны аминокислотные последовательности вариантов родостомина SEQ ID NO:1 и 57-69.
На фиг.15A-C показаны нуклеотидные последовательности SEQ ID NO:43-56 вариантов родостомина.
На фиг.16A-H показаны аминокислотные и нуклеотидные последовательности вариантов дезинтегрина SEQ ID NO:78-135.
Подробное описание настоящего изобретения
Настоящее изобретение более конкретно описывается в нижеследующих примерах, которые приведены только для иллюстрации, поскольку специалисты в данной области могут осуществить многочисленные модификации и вариации данных примеров. Разные варианты осуществления данного изобретения здесь описываются более подробно. В описании и нижеследующей формуле изобретения термины, используемые в единственном числе, включают множественное, если контекст не диктует иную трактовку. Кроме того, в описании и нижеследующей формуле изобретения термин "в" включает значения "в" и "на", если контекст не диктует иную трактовку. Некоторые термины, используемые в данном описании, более конкретно определены ниже. Все ссылки, цитирующиеся и упоминающиеся в настоящем описании, включены в данный документ в качестве ссылки во всей полноте в такой степени, как если бы каждая ссылка была отдельно включена в качестве ссылки.
Далее более подробно описываются варианты осуществления настоящего изобретения (иллюстративные воплощения), примеры которых отражены в прилагающихся фигурах.
Определения
В данном описании термины, используемые в контексте данного изобретения и в конкретном контексте применения каждого термина, обычно имеют общепринятое для данной области значение. Для дополнительного разъяснения описания настоящего изобретения ниже, или в любом другом месте, приводятся определения некоторых терминов, используемых для описания настоящего изобретения. Для некоторых терминов предлагаются синонимы. Употребление одного или нескольких синонимов не исключает применения других синонимов. Примеры, приводимые на протяжении данного описания, в том числе примеры любых упоминающихся здесь терминов, являются только иллюстративными и никаким образом не ограничивают объема и сущности настоящего изобретения или какого-либо конкретного термина. Данное изобретение не ограничивается разными вариантами осуществления, приведенными в данном описании.
Если не указано иначе, все технические и научные термины, используемые в данном документе, имеют традиционные значения, известные рядовым специалистам в области, к которой принадлежит настоящее изобретение. В случае конфликта данный документ, включающий определения, подлежит проверке.
Термины "около", "примерно" или "приблизительно" относятся к значению или интервалу, варьирующему в пределах 20 процентов, в пределах 10 процентов, в пределах 5, 4, 3, 2 или 1 процента от заданного значения или интервала. Численные значения являются приблизительными, то есть наличие терминов "около", "примерно" или "приблизительно" подразумевается, даже если специально не указано.
Термины "полинуклеотид", "нуклеотид", "нуклеиновая кислота", "молекула нуклеиновой кислоты", "последовательность нуклеиновой кислоты", "полинуклеотидная последовательность" и "нуклеотидная последовательность" используются как взаимозаменяемые для обозначения состоящих из нуклеотидов полимерных форм любой длины. К полинуклеотидам могут относиться дезоксирибонуклеотиды, рибонуклеотиды и/или их аналоги или производные. Данный термин включает варианты. Варианты могут содержать вставки, добавления, делеции или замены. Нуклеотидные последовательности описываются в направлении от 5'-конца к 3'-концу.
Термины "полипептид", "пептид" и "белок" используются как взаимозаменяемые для обозначения состоящих из аминокислот полимерных форм любой длины, которые могут содержать природные аминокислоты, кодируемые и некодируемые аминокислоты, химически или биохимически модифицированные, дериватизированные или сконструированные аминокислоты и аналоги аминокислот, и включают пептидомиметики и депсипептиды, а также полипептиды, имеющие модифицированные, циклические, бициклические, депсициклические или депсибициклические пептидные скелеты. Термин включает как одноцепочечные белки, так и мультимеры. Термин также охватывает белки, конъюгированные с меткой, такой как FITC, биотин и радиоизотопы, включающие, без ограничения, 64Cu, 67Cu, 90Y, 99mTc, 111In, 124I, 125I, 131I, 137Cs, 186Re, 211At, 212Bi, 213Bi, 223Ra, 241Am и 244Cm; ферменты, продукты которых можно детектировать (например, люцифераза, пероксидаза, щелочная фосфатаза, β-галактозидаза и т.п.); люминофоры и флуоресцентные метки, флюоресцирующие металлы, например, 152Eu или другие лантаниды, электрохемилюминесцентные соединения, хемилюминесцентные соединения, например, люминал, изолюминал или соли акридиния; специфические связывающие молекулы, например, магнитные частицы, микросферы, наносферы и т.п. Термин также включает пептиды, конъюгированные с терапевтическими средствами.
Термины также охватывают гибридные белки, включающие, но без ограничения, гибриды с глутатион-S-трансферазой (GST), гибриды с гетерологичной аминокислотной последовательностью, такой как биолюминесцентный белок, например, люциферин или экворин (зеленый флуоресцентный белок), содержащие гетерологичные и гомологичные лидерные последовательности, гибридные белки, содержащие или не содержащие N-концевые остатки метионина, пэгилированные белки и содержащие иммунные метки или his-меченные белки. Такие гибридные белки также включают гибриды с эпитопами. К таким гибридным белкам также относятся мультимеры пептидов данного изобретения, например, гомодимеры или гомомультимеры, а также гетеродимеры и гетеромультимеры. Термин также включает комплексы пептидов с аптамерами.
Термин "специфически гибридизуется" в контексте полинуклеотида относится к гибридизации в жестких условиях. Условия, которые повышают жесткость реакций гибридизации ДНК/ДНК и ДНК/РНК, широко известны и описаны в данной области. Примеры гибридизации в жестких условиях включают гибридизацию в 4× хлорид натрия/цитрат натрия (SSC), приблизительно при 65-70°C, или гибридизацию в 4× SSC плюс 50% формамид, приблизительно при 42-50°C, с последующим одним или несколькими промываниями в 1× SSC, приблизительно при 65-70°C.
Термин "лиганд" относится к молекуле, которая связывается с другой молекулой, такой как рецептор.
"Клетка-хозяин" представляет собой отдельную клетку или клеточную культуру, которая может быть или является реципиентом какого-либо рекомбинантного вектора (векторов) или полинуклеотида. Клетки-хозяева включают потомство одной клетки-хозяина, причем потомство не обязательно является полностью идентичным (по морфологии или полному комплекту ДНК) исходной родительской клетке вследствие природных, случайных или намеренных мутаций и/или изменений. Клетка-хозяин включает клетки, трансфицированные или инфицированные in vivo или in vitro рекомбинантным вектором или полинуклеотидом по изобретению. Клетку-хозяина, содержащую рекомбинантный вектор данного изобретения, можно называть "рекомбинантная клетка-хозяин".
Термин "лечение" охватывает любое введение или нанесение лекарственного средства против заболевания млекопитающего, в том числе человека, и включает подавление заболевания, прекращение его развития или облегчение заболевания, например, путем индуцирования регрессии, или возобновления или восстановления утраты, потери или дефекта функции; или путем стимуляции неэффективного процесса. Термин включает получение желательного фармакологического и/или физиологического эффекта и охватывает любое лечение патологического состояния или нарушения у млекопитающего, в том числе человека. Эффект может быть профилактическим, заключающимся в полном или частичном предотвращении нарушения или его симптома, и/или терапевтическим, выражающимся в частичном или полном излечении нарушения и/или неблагоприятной реакции, свойственной данному нарушению. Таким образом, настоящее изобретение предлагает способ как лечения, так и профилактики. Он включает (1) предотвращение появления или возобновления нарушения у субъекта, который может быть предрасположен к нарушению, но еще не имеет его симптомов, (2) подавление нарушения, например, прекращение его развития, (3) остановку или терминацию нарушения, или, по меньшей мере, связанных с ним симптомов, чтобы хозяин больше не страдал от нарушения или его симптомов, например, путем индукции регрессии нарушения или его симптомов, или путем возобновления или восстановления утраты, потери или дефекта функции; или путем стимуляции неэффективного процесса, или (4) облегчение, ослабление или улучшение нарушения или связанных с ним симптомов, где термин улучшение используется в широком смысле для обозначения, по меньшей мере, уменьшения значения параметра, такого как воспаление, боль и/или размер опухоли.
Термин "фармацевтически приемлемый носитель" относится к нетоксичным твердым, полутвердым или жидким наполнителям, разбавителям, капсулирующим веществам, вспомогательным средствам для композиции или средам для лекарства любых стандартных типов. Фармацевтически приемлемый носитель является нетоксичным для реципиентов в используемых дозах и концентрациях и совместимым с другими ингредиентами композиции.
Термин "композиция" относится к смеси, которая обычно содержит носитель, такой как фармацевтически приемлемый носитель, или наполнитель, традиционно используемый в данной области, который подходит для введения пациенту в терапевтических, диагностических или профилактических целях. Композиция может содержать клеточную культуру, в клетках или культуральной среде которой содержится полипептид или полинуклеотид. Например, композиции для перорального введения могут находиться в виде растворов, суспензий, таблеток, пилюль, капсул, композиций с замедленным высвобождением, полосканий для рта или порошков.
Термин "заболевание" относится к любым состояниям, инфекциям, нарушениям или синдромам, которые требуют медицинского вмешательства или при которых медицинское вмешательство желательно. Такое медицинское вмешательство может включать лечение, диагностику и/или профилактику.
Пептиды
Пептиды по изобретению можно экспрессировать с помощью известных в данной области способов. Для получения пептидов по изобретению можно использовать способы, в которых применяются клетки, или бесклеточные способы. Способы, проводимые с применением клеток, обычно включают введение конструкции нуклеиновой кислоты в клетку-хозяина in vitro и культивирование клетки-хозяина в условиях, обеспечивающих экспрессию, с последующим сбором пептида, либо из культуральной среды, либо из клетки-хозяина (например, после разрушения клетки-хозяина), либо и из того, и из другого. Настоящее изобретение также предлагает хорошо известные в данной области бесклеточные способы получения пептида, в которых транскрипцию/трансляцию проводят in vitro.
К подходящим клеткам-хозяевам относятся прокариотические или эукариотические клетки, включающие, например, бактериальные клетки, дрожжевые клетки, грибковые клетки, растительные клетки, клетки насекомых и клетки млекопитающих.
Как правило, гетерологичный пептид, как модифицированный, так и немодифицированный, можно экспрессировать сам по себе, как описано выше, или в виде гибридного белка, такой пептид может содержать не только сигналы секреции, но и секреторную лидерную последовательность. Секреторная лидерная последовательность по изобретению может направлять некоторые белки к эндоплазматическому ретикулуму (ER). ER разделяет мембрано-связанные белки от других белков. После локализации в ER белки могут далее направляться в аппарат Гольджи для распределения в везикулы, в том числе секреторные везикулы, плазматические мембраны, лизосомы и другие органеллы.
Пептиды могут содержать пептидные фрагменты и/или маркеры очистки. Такие фрагменты можно удалить перед конечной стадией получения пептида. Добавление к полипептидам пептидных фрагментов с целью обеспечения секреции или экскреции, улучшения стабильности, облегчения очистки, или с другой целью, является известной и рутинной в данной области процедурой. Подходящие маркеры очистки включают, например, V5, полигистидины, авидин и биотин. Конъюгирование пептидов с такими соединениями, как биотин, можно проводить с помощью хорошо известных в данной области способов (Hermanson ed. (1996) Bioconjugate Techniques; Academic Press). Пептиды также можно конъюгировать с радиоактивными изотопами, токсинами, ферментами, флуоресцентными метками, коллоидным золотом, нуклеиновыми кислотами, винорелбином и доксорубицином с помощью известных в данной области способов (Hermanson ed. (1996) Bioconjugate Techniques; Academic Press; Stefano et al. (2006)).
Партнеры по гибридизации, подходящие для применения в данном изобретении, включают, например, фетуин, человеческий сывороточный альбумин, Fc и/или один или несколько их фрагментов. Также предоставляются конъюгированные белки, такие как конъюгаты с полиэтиленгликолем.
Пептиды по изобретению также можно синтезировать химически с помощью известных в данной области способов (например, см. Hunkapiller et al., Nature, 310:105 111 (1984); Grant ed. (1992) Synthetic Peptides, A Users Guide, W. H. Freeman and Co.; патент США № 6974884)). Например, полипептид, соответствующий фрагменту полипептида, можно синтезировать с помощью пептидного синтезатора или с помощью известных в данной области способов твердофазного синтеза.
Кроме того, при желании можно вводить неклассические аминокислоты или химические аналоги аминокислот путем замены или добавления к полипептидной последовательности. Неклассические аминокислоты включают, без ограничения, такие соединения, как D-изомеры обычных аминокислот, 2,4-диаминомасляная кислота, a-аминоизомасляная кислота, 4-аминомасляная кислота, Abu, 2-аминомасляная кислота, g-Abu, e-Ahx, 6-аминогексановая кислота, Aib, 2-аминоизомасляная кислота, 3-аминопропионовая кислота, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, гомоцитруллин, цистеиновая кислота, т-бутилглицин, т-бутилаланин, фенилглицин, циклогексилаланин, b-аланин, фтораминокислоты, сконструированные аминокислоты, такие как b-метиламинокислоты, Ca-метиламинокислоты, Na-метиламинокислоты, а также аналоги аминокислот в общем. Аминокислота может иметь D-конфигурацию (правовращающая) или L-конфигурацию (левовращающая).
Полипептиды по изобретению можно выделит