Изолированный штамм микроорганизма lactobacillus plantarum tensia dsm 21380 как противомикробный и гипотензивный пробиотик, продукт питания и композиция, содержащая упомянутый микроорганизм, и применение упомянутого микроорганизма для получения гипотензивного лекарственного средства, способ подавления патогенов и побочных лактобактерий в продукте питания
Иллюстрации
Показать всеИзобретение относится к области микробиологии и биотехнологии и может быть использовано в пищевой промышленности и медицине. Штамм микроорганизма Lactobacillus plantarum Tensia DSM 21380 продуцирует конъюгированную линолиевую кислоту (CLA), перекись водорода (Н2O2), монооксид азота (NO), содержит гены, кодирующие плантарицин, и обладает антиоксидантной активностью. Данный штамм и его лиофилизированная форма применяются для приготовления противомикробного и гипотензивного пробиотика, молочного продукта, и лекарственного средства, понижающего кровяное давление. Также данный штамм и его лиофилизированная форма используются для увеличения оборачиваемости полиаминов в организме, для достижения доминантного положения среди кишечных лактобактерий в желудочно-кишечном тракте и для увеличения срока годности молочного продукта. Применение изобретения позволяет понизить кровяное давление, подавить нежелательную микрофлору и ингибировать окислительные процессы. 9 н. и 3 з.п. ф-лы, 7 ил., 31 табл., 7 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новому микроорганизму и его применению. Изобретение относится к области биотехнологий и используется в пищевой промышленности и медицине. Более конкретно объектом настоящего изобретения является противомикробный и гипотензивный штамм пробиотических микроорганизмов Lactobacillus. plantarum Tensia DSM 21380. Настоящее изобретение относится к применению данного штамма в составе продуктов функционального питания, например в сыре, и для получения гипотензивного препарата.
УРОВЕНЬ ТЕХНИКИ
Лактобактерии, использованные для получения ферментированных пищевых продуктов, применяются столетиями. В течение прошлых десятилетий лактобактерии широко использовались в качестве пробиотиков. Пробиотики являются живыми микроорганизмами, входящими в состав микрофлоры человеческого организма, которые, при введении в достаточном количестве, приносят пользу здоровью носителя. Обычно пробиотики используются для создания продуктов здорового питания. Продукт питания может быть отнесен к функциональным продуктам, если помимо достаточного количества питательных компонентов он содержит некоторые натуральные добавки (пре- и пробиотики), которые благотворно влияют на одну или более целевых функциональных систем организма, улучшая состояние здоровья и самочувствие, и/или понижая риск возникновения заболевания.
Пробиотическими продуктами могут быть обычные продукты (йогурт, творог, мягкие сыры) или диетические добавки (лиофилизированные микробные культуры).
В европейских странах несколько пробиотиков выведены на рынок в качестве продуктов, полезных для здоровья.
Противомикробные пробиотики
Противомикробные пробиотики, применяемые против условно-патогенных микроорганизмов и пищевых патогенов, например сальмонеллы, описаны в патентных заявках. В WO 2008/039531 (Little Columet Holdings KKC) описаны штаммы Lactobacillus acidophilus, L. bulgaricus, L. casei, L. paracasei, L. fermentum, L. plantanum, L. rhamnosus, L. salivarius, Bifidobacterium bifidum, B. infantis, B. animalis subsp. lactis, B. longum, Streptococcus thermophilus, Enterococcus faecalis и E. faecium. Пероральное применение этих штаммов способствует подавлению Campylobacter jejuni, E. coli, S. aureus, Vibrio cholera, Bacteroides sp, Clostridium sp, Klebsiella sp, Listeria sp, Proteus sp. Salmonella sp, Shigella sp и Veillonella sp в пищеварительном тракте.
В патентной заявке WO 2008/016214 (Bioneer Corporation) описывается штамм Lactobacillus gasseri BNR17, обладающий противомикробным действием против E. coli, S. aureus, S. typhimurium, В. cereus, l. monocylogenes и Р. mirabilis.
Специалисты в данной области сталкиваются с проблемой влияния побочных лактобактерий (NSLAB), появляющихся в процессе созревания сыра, на его качества. Эти микробы могут быть причиной нежелательного протеолиза, появления различных нежелательных вкусовых качеств и потери товарного качества сыра.
Попытки в процессе созревания сыра воздействовать на количество NSLAB рН-регуляторами, антиоксидантами и консервантами (NaCl) потерпели неудачу. Добавление в сыр различных противомикробных веществ (молочной или уксусной кислоты, Н2О2), приводящих к появлению микробов-антагонистов, включая пробиотические лактобактерии, также было неэффективно. Пробиотические лактобактерии, вырабатывающие H2O2, были описаны несколькими авторами (Ouwehand, AC. Westerlund, Antimicrobial components of lactic acid bacteria. In: Lactic acid bacteria: microbiological and functional aspects. Eds. Salminen, S; Wright, A, .Ouwehand, AC. 2004, pp.375-395, New York, Marcel Dekker; Hiitt, P., Shchepetova, J., Loeivukene, K., Kullisaar, Т., Mikelsaar, M. Antagonistic activity of probiotic lactobacilli and bifidobacteria against entero- and uropathogens. J. Appl. Microbiol., 2006, 100, 1324-1332).
Лактобактерии человеческого и растительного происхождения плохо адаптируются в нетипичной для них среде сыра, богатой протеином и жирами, и бедной углеводами. Вследствие этого, существует лишь небольшое количество сыров, содержащих пробиотические лактобактерии (Gardiner, G, Ross, R.P, Collins, 1.H, Fitzgerald, G, and Stanton. C. Development of a probiotic cheddar cheese containing human derived Lactobacillus paracasei strains, Appl. Environ. Microbiol., 30 1998, 64,. 6: 2192-2199; Ross, R P, Fitzgerald, G F, Collins, J K, O'sullivan, G C, Stanton, С G. Process for the manufacture of probiotic cheese, патент США 6872411, патентная заявка WO 99/62348 AI), в которых добавленные пробиотические бактерии сохраняют свою способность вызывать вегетативное брожение (WO 2002/05665, WO 2000/60948, Consejo Superior de Investigaciones Cientificas). Это же касается и сходной группы антимикробных веществ, содержащих колицины, которые в основном атакуют представителей того же рода и вида (Heinaru A, Tallmeister E. Colicin susceptibility of shigellas and coli bacteria related to episomal resistance and colicinogenicity or dissociation into S-R forms. Geneetika, 1971, 7, 5, 113-122 (на рус. яз.)). Вследствие этого, они обладают потенциалом для применения в качестве веществ, подавляющих побочные лактобактерии.
Выработка плантарицинов регулируется несколькими генами, некоторые из которых встречаются время от времени, некоторые - регулярно. Вследствие этого встречаются фенотипические различия в выработке плантарицина. Локус генома, связанный с выработкой бактериоцина, был описан в штамме 11 Lactobacillus plantarum. Два оперона этих генов, носящих названия plnEFI и plnJKLR, имеют каждый пару генов pInEF и pInJK, кодирующих два маленьких катионных бактериоциноподобных пептида глицин-сдвоенного типа лидерной последовательности (Diep, D.В., Havarstein, L.S. & Nes, 1.F. Characterization of the locus responsible for the bacteriocin production in Lactobacillus plantarum C11. J Bacterial 1996, 178, 4472-4483). Изобретений, касающихся штамма L. plantarum, который может подавлять NSLAB, и обладать полным набором офплантацирин-кодирующих генов EF и JK, не существует.
Гипотензивные пробиотики
Многие люди страдают от метаболического синдрома, симптомы которого включают избыточный вес, ожирение, рост кровяного давления, рост содержания глюкозы в крови, и некоторые другие маркеры риска развития атеросклероза. Продукты, богатые жирами (включая сыр), не являются безвредными, так как эти продукты могут увеличить риск развития атеросклероза, воспаления, диабета второго типа и/или перекисного окисления липидов (Raff M., Tholstrup Т., Basu S., Nonboe P., Sorensen MT, Straarup ЕМ. 138.509-514. A diet rich in conjugated linoleic acid and butter increases lipid peroxidation but does not affect atherosclerotic, inflammatory, or diabetic risk markers in healthy young men (American Society for Nutrition J. Nutr. 2008, 138:509-514).
Конъюгированная линолевая кислота (CLA) относится к двум естественным изомерам 18-углеводной линолевой кислоты (LA, cis-9, cis-12-18:2). CLA формируется в процессе естественной биогидронизации и окисления. Изомеры CLA формируются в процессе биогидронизации линолевой кислоты в первом отделе желудка жвачных животных и в процессе переработки вакценовой кислоты в молочной железе. В оптимальных дозах изомеры конъюгированной линолевой кислоты (CLA) имеют высокий потенциал для улучшения здоровья: они обладают противомикробным, антитуморогенным, противодиабетическим, гипоаллергенным действием и препятствуют ожирению. Гипотензивный эффект был также изучен несколькими исследовательскими группами (Inoue K., Okada F., Ito R., Kato S., Sasaki S., Nakajima S., Uno A, Saijo Y, Sata F., Yoshimura Y., Kishi R. and Nakazawa H., Perfluorooctane sulfonate (PFOS) and related perfluorinated compounds in human maternal and cord blood samples: assessment of PFOS exposure in a susceptible population during pregnancy. Environ. Health Perspect. 112 (2004), стр.1204-1207).
Однако добавление CLA в пищу в больших количествах проблематично. В ходе исследований было установлено, что потребление 5 г CLA в день ведет к росту перекисного окисления липидов (LPO), выражающегося в повышенной концентрации (83%) 8-изопростагландина F2 (Raff M., Tholstrup Т., Basu S., Nonboe P., Sorensen MT, Straarup EM. 138.509-514. A diet rich in conjugated linoleic acid and butter increases lipid peroxidation but does not affect atherosclerotic, inflammatory, or diabetic risk markers in healthy young men American Society for Nutrition 1. Nutr. 2008, 138:509-514).
Наилучшим решением является использование штамма лактобактерий, обладающего способностью ограничивать выработку CLA и физиологически выраженными антиоксидантными свойствами. Включение в пищу физиологически значимых антиоксидантных LAB позволило контролировать возрастание перекисного окисления липидов (LPO) и повышать биопригодность богатых жирами продуктов, например сыра. Lactobacillus fermentum 1VIE-3 описаны в патенте Эстонии ЕЕ04580 Университета Тарту, а в научных статьях отмечалась заметная физиологическая антиоксидантная активность (Kullisaar Т, Zilmer M, Mikelsaar M, Vihalemm Т, Annuk Н, Kairane С, Kilk A Two antioxidative lactobacilli strains as promising probiotics. Int.; J. Food Microbiol., 2002, 72, 215-224; Kullisaar, T., Songisepp, E., Mikelsaar, M., Zilmer, K., Vihalemm, Т., Zilmer, M. Antioxidative probiotic fermented goats' milk decreases oxidative stress-mediated atherogenicity in human subjects. Br. J. Nutr., 2003, 90, 449-456; Truusalu, К. Naaber, P., Kullisaar, Т., Tamm, Н., Mikelsaar, R-H., Zilmer, K., Rehema, A, Zilmer, M., Mikelsaar, M. The influence of antibacterial and antioxidative probiotic lactobacilli on gut mucosa in a mouse model of Salmonella infection. Microbial Ecology in Health and Disease 2004, 16:4, 180-187).
Концентрация полиаминов в человеческой крови и их выделение с мочой меняется в зависимости от потребления пищи с различным содержанием полиаминов, а также в зависимости от продуцентов эндогенных полиаминамов в микрофлоре кишечника человека, таких как E. coli и некоторых анаэробных бактерий (Marino M. Maifreni M, Moret S., Rondinini G. The capacity of Enterobacteriaceae sp. to produce biogenic amines in cheese. Letters of Microbiology, 2000, 31, 169-173). Некоторые пищевые продукты содержат полиамины в относительно высоких концентрациях, например апельсины содержат значительное количество путресцина 1330 мкг/100 г (Larque E." Sabater-Molina M., Zamora S. Biological significance of dietary polyamines. Nutrition, 2007, 23, 87-95.). Штаммы лактобактерий, которые способны вырабатывать умеренное количество CLA и полиаминов, и в то же время обладать физиологически значимой антиоксидантностью, еще не были описаны.
Уровень кровяного давления регулируется такими веществами, как моноксидом азота (NO), продуктами перекисного окисления липидов (LPO), окисленными липопротеинами низкой плотности и компонентами глутатион окислительно-восстановительной системы (GSSGIGSH), которая регулирует ригидность кровяных сосудов и влияет на их вазоконстрикцию.
Кроме того, рост уровней LPO, ox-LDL, GSSGIGSH является фактором риска развития атеросклероза. Метаболизм ацетилированного спермидина обеспечивает дополнительные сосудорасширяющие свойства (понижение кровяного давления) благодаря его ацетилированной форме и обычным формам полиамина (Myung CS, Blankenship JW, Meerdink DJ. A mechanism of vasodilatory action of polyamines and acetylpolyamines: possible involvement of their Ca2+ antagonistic properties, J Pharm Phannacol. 2000, 52:695-707).
Некоторые пептиды, содержащиеся в молоке, обладают свойством понижать кровяное давление посредством подавления ангиотензин-преобразующего фермента I (АСЕ) (Meisel, Н. & Bocklemann, W. Bioactive peptides encrypted m milk proteins: proteolytic activation and tropho-functional properties. In: Proceedings of the sixth symposium on lactic acid bacteria: genetics, metabolism and applications. 19-23 September. Veldhoven (W.N.Konings, O.P.Kuipers, and 1. Huis in't Veld., eds.) Kluver Academic Publishers, the Netherlands. 1999. pp.207-215 (1999)).
Монооксид азота NO принадлежит к биоактивным веществам, обладающим несколькими полезными свойствами, такими как противомикробным и противовоспалительным действием, а также способностью понижать кровяное давление (Janeway, CA, Travers, P, Walport, M, Shlomchik, M1. 2005. Immunobiology: The Immune System in Health and Disease. New York, NY: Garland Science Publishing). NO влияет на кровяное давление различным образом, например расслабляя гладкие мышцы кровяных сосудов, подавляя АСЕ или развитие эндогенных механизмов защиты (предварительной адаптации) (Jones SP, Bolli R. The ubiquitous role of nitric oxide in cardioprotection. J Mol Cell Cardio 12006; 40: 16-23).
На сегодняшний день существует лишь несколько изобретений, касающихся пробиотических микроорганизмов, которые эндогенно вырабатывают или способствуют эндогенной выработке NO. Бактерии молочной кислоты, способствующие эндогенной выработке NO, описаны в патентных заявках Эстонии ЕЕ 00200230А и ЕЕ 200200231 (Valio Ltd.). В патентной заявке ЕЕ 00200230А описан штамм Lhelveticus LBK-16H, DSM 13137, обладающий фотолитическим действием, который вырабатывает ди- и трипептиды. Эти ди- и трипептиды, полученные из казеина благодаря молочнокислому брожению, собирают посредством нанофильтраци и затем добавляют в пищевые продукты, включая продукты брожения молока, что позволяет создать продукт, содержащий противогипертонические пептиды. В патентной заявке ЕЕ20020023 описан штамм L. heiveticus LBK-15 16H, DSM 13137, который помимо способности вырабатывать ди- и трипептиды, способен также стимулировать выработку NO в двух линиях клеток (в энтероцитах мышей и человека). Данный штамм способствует понижению кровяного давления посредством выработки пептидов и NO. Авторы заявки отмечаютают, что бактериальные клетки не были единственными продуцентами NO (страница 13, строки 8-9).
В патенте США US 7183108 (Compagnie Gervais Danone, 2007) описан штамм Lactobacillus casei, обладающий противовоспалительным свойством благодаря возрастанию выработки NO (NO вырабатывается провоспалительными цитокинами и активированными энтероцитами), и vice versa - бактериальная выработка NO подавляется тогда, когда энтероциты уже активированы провоспалительными цитоксинами и бактериальными липополисахаридами.
Корхонен и др. в 2001 (Korhpnen К, Reijonen TM, Remes К, Malmstrom K, Klaukka Т, Korppi M. Reasons for and 'costs of hospitalization for paediatric asthma: A prospective I-year follow-up in a population-based setting. Pediatr Allergy Immunol 2001:12:331338) показал, что Lactobacillus rhamnosus GG могли стимулировать выработку NO клетками эпителия кишечника или посредством индукции провоспалительных цитосинов. Эти авторы указывали на возможную предпочтительную связь между выработкой LOG и выработкой NO.
В европейском патенте ЕР 0951290 (Laboratories Standa S.A., 2002) описаны вырабатывающие NO пропионибактерии, добавляемые в композицию для выработки NO в желудочно-кишечном тракте, предположительно в энтероцитах. Там же штамм Lactobacillus farciminis упоминается как негативный пример продуцента низкого количества NO. В патенте США US 7294337 (Национальный институт агрономических исследований, 2007) однако показано, что L. farciminis может вырабатывать NO в количествах, достаточных для противовоспалительного эффекта и подавления боли после растяжения в брюшной полости.
Было выявлено, что штамм L. fermentum LF1 мог вырабатывать NO аэробно в MRS бульонной питательной среде без наличия культуры клеток человека. Штамм L. plantarum DSM9843 (LP2), тестировавшийся теми же авторами, не мог действовать сходным образом в отличие от нашего штамма L.Plantarum Tensia DSM 21380 (JXu, .W.Verstraete. Evaluation of nitric oxide production by lactobacilli L Appl. Microbiol. Biotechnol., 2001, 56:504-507). Введение в человеческий организм штамма в качестве пробиотика с вышеупомянутыми свойствами позволяет контролировать кровяное давление благодаря свойству штамма вырабатывать NO и свойству NO влиять на уровень кровяного давления, как описано выше.
Кроме низкой выживаемости в пищевых продуктах, выбор пробиотических бактерий обуславливается проблемой низкой выживаемости штаммов при прохождении желудочно-кишечного тракта. Таким образом, требуются такие пробиотические бактерии, которые могут выжить и в верхней, и в нижней части желудочно-кишечного тракта. В международной патентной заявке WO 91/05850 (Университет Тарту и др., 1989) описан штамм 1. plantarum 38 как подходящий для регулирования микрофлоры толстого кишечника в случае бактериального дисбиоза. В европейском патенте ЕР 0554418 B1 (Probi АВ, 1998) описаны положительные свойства штамма L. plantarum 299 (DSM 6595) образовывать колонии в кишечнике человека, а также применение данного штамма в составе жидкого овсяного напитка, применяемого для хирургических пациентов с целью предотвращения внутренней инфекции. В международной патентной заявке WO 2007/003917 A1 (Matforsk AS et al., 2006) описаны штамм Lactobacillus plantarum DSM 16997 (DSM 17320) и штамм 1. pentosus (DSMI7321) как микробы, вызывающие брожение в мясных продуктах. Авторы данной заявки утверждают, что эти штаммы могут функционировать как пробиотики, регулирующие внутреннюю микрофлору человека посредством подавления вредоносных бактерий и также симбионтов Escherichia coli. С целью подтвердить это утверждение в заявке представлены результаты in vitro экспериментов. Однако в заявке не представлены доказательства in vivo подавления патогенов (т.е. на экспериментальной модели с животным). Кроме того, не продемонстрировано подавление побочных лактобактерий (NSLAB), несмотря на то, что в заявке описано, что NSLAB выживают в среде (колбасные изделия) при низких уровнях рН. Без предоставления доказательств в заявке утверждается, что пробиотические штаммы обладают иммуностимулирующим свойством и способны понижать риск возникновения сепсиса после хирургических вмешательств, а также улучшают самочувствие пациентов.
В патенте Эстонии ЕЕ04097 B1 (Probi АВ, 2003) описано применение Lactobacillus plantarum 299v (DSM 9843) для лечения инфекций мочеполовых путей, поскольку штамм способен прикрепляться к эпителию толстого кишечника ввиду его манноза-специфического адгезина, и конкурировать с вредоносными патогенами мочеполового тракта за место прикрепления. Согласно результатам анализа REA (эндонуклеазы рестрикции) все вышеупомянутые штаммы отличаются друг от друга и от Lactobacillus plantarum Tensia DSM, 21380 четким профилем хромосом.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому изолированному штамму микроорганизма Lactobacillus plantarum Tensia DSM 21380, используемому в качестве противомикробного и гипотензивного пробиотика, пищевым продуктам (молочным продуктам, например продуктам брожения или сыру) и композициям, содержащим упомянутые микроорганизмы, а также к использованию упомянутых микроорганизмов для производства гипотензивного лекарственного средства. Изобретение также относится к способу подавления патогенов и побочных лактробактерий в пищевых продуктах и к способу увеличения срока годности пищевых продуктов путем использовния Lactobacillus plantarum Tensia DSM 21380.
Lactobacillus plantarum Tensia DSM 21380 как противомикробный пробиотик вырабатывает противомикробные вещества - молочную кислоту, уксусную кислоту, CLA, NO, H2O2 и обладает плантарицин - II b классом парных генов EF и JK, кодирующих антимикробные структуры. При помощи своих метаболитов Lactobacillus plantarum DSM 21380 подавляет в in vitro эксперименте побочные лактобактерии и кишечные патогены. Данный штамм способен развиваться и доминировать среди лактобактерий при низких температурах и в состоянии углеводной недостаточности (например, в сыре).
В дополнение к противомикробному действию Lactobacillus plantarum Tensia DSM 21380 также является гипотензивным и антиоксидантным пробиотиком благодаря выработке NO, CLA и антиоксидантности, в in vitro эксперименте вырабатывает небольшое количество полиаминов тирамина и путресцина и превалирует в микрофлоре кишечника волонтеров после трех недель употребления сыра, содержащего Lactobacillus plantarum Tensia DSM 21380. Свойство Lactobacillus plantarum Tensia DSM 21380 организовывать колонии в человеческом кишечнике было обнаружено в пробах фекалий как на профиле электрофореза в денатурирующем градиентном геле, так и традиционными способами, принятыми в бактериологии. Lactobacillus plantarum Tensia DSM 21380 в значительной степени активизирует метаболизм путресцина и ацетилированного спермидина в человеческом теле, что сопровождается понижением систолического и диастолического кровяного давления.
ОПИСАНИЕ ШТАММА
Объект изобретения, штамм микроорганизмов Lactobacillus plantarum Tensia DSM 21380, был выделен из пробы фекалий здорового ребенка во время сравнительного изучения микрофлоры эстонских и шведских детей. Микроорганизм L. plantarum Tensia DSM 21380 выделяли путем посева раствора фекалий здорового годовалого эстонского ребенка (10-2-10-7 в фосфатном буферном растворе с 0.04% тиогликолевой кислотой; рН 7.2). Раствор сеяли в свежеподготовленную MRS агаровую среду (Oxoid) и культивировали микроаэробно при 37°С.
Штамм, который является объектом изобретения, был выделен согласно характерной морфологии колоний и подсажен к Lactobacillus sp. Предварительную и более четкую идентификацию осуществляли способами, описанными ниже.
Тот факт, что микробный штамм Lactobacillus plantarum Tensia DSM 21380 выделен из кишечного тракта здорового ребенка, подтверждает его GRAS статус (признан полностью безопасным), то есть этот штамм микроорганизмов безопасен для организма человека и подходит для перорального применения.
Микроорганизм Lactobacillus plantarum штамма Tensia был депонирован в немецкую коллекцию микроорганизмов и культур клеток 16.04.2008 под регистрационным номером DSM 21380.
Культурально-морфологические характеристики были выявлены после культивации в MRS агаре и MRS бульонной питательной среде (OXOID). Клетки Lactobacillus plantarum Tensia DSM 21380 являются грамположительными, неспороносными палочками правильной формы, встречающимися поодиночке, парно или в коротких цепочках.
Физиологические биохимические характеристики
Культивацию штамма проводили в MRS бульонной питательной среде в течение 24-48 часов в микроаэробно, после чего в бульонной питательной среде произошел гомогенный турбидный рост. Колонии на пластинах с MRS агаром после 48 часов роста при 37°С в микроаэробных условиях (атмосфера CO2/O2/N2: 10/5/85) являются круглыми, 2-2.5 мм в диаметре, цельными, выпуклыми и белыми.
Оптимальная температура роста - 37°С, штамм размножается также при температуре 15°С и 45°С. Оптимальный рН уровень среды роста - 6.5.
Штамм Lactobacillus plantarum Tensia DSM 21380 является каталазо- и оксидазонегативным, факультативно гетероферментивным, не вырабатывает газ из глюкозы и не вызывает гидролиз аргинина. Штамм Lactobacillus plantarum Tensia DSM 21380 был идентифицирован на основе биохимической активности с набором системы API 50CHL (bioMerieux, Франция) как Lactobacillus plantarum (совпадение с типом штамма: превосходное, ID % - 99.9, T index - 0.86).
Сравнение с упомянутым штаммом Lactobacillus plantarum ATCC 14917 подтвердило предварительную идентификацию по API 50CHL.
Углеводородный профиль использования Lactobacillus plantarum Tensia DSM 21380 согласно API 50 CHL следующий: положительная реакция на рибозу, L-арабинозу, галактозу, D-глюкозу, D-фруктозу, D-маннозу, маннит, метил-D-маннозид, метил-D-глюкозид, N ацетил-глюкозамин, амигдалин, арбутин, эскулин, салицин, целлобиозу, малтозу, лактозу, мелибиозу, D-арабинозу, сахарозу, трегалозу, мелицитозу, D-рафинозу, β-генциобиоза, D-туранозу, глюконат; слабая реакция на крахмал.
Согласно тест-набору API ZYM (bioMerieux, Франция), Lactobacillus plantarum Tensia DSM 21380 обладает лейцин ариламидазо-, кислотно-фосфатазной, а-глюкодазо-, β-глюкодазо- и ацетонин-активностью. Была отмечена слабая реакция на валин ариламидазу, нафтол-AS-BI-фосфогидролазу, β-галактозидазу, цистин арилиунидазу, эстеразу (С4), эстеразу (С8), N-30 ацетил-глюкозаминидазу.
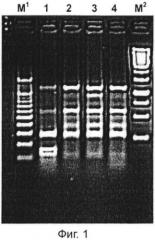
Молекулярная идентификация Lactobacillus plantarum Tensia DSM 21380 была подтверждена при помощи полимеразной цепной реакции внутреннего транскрибированного спейсера (ITS-PCR в сравнении с упомянутым штаммом Lactobacillus plantarum ATCC 14917 (Фиг.1)).
Способ. Идентификация штамма была подтверждена при помощи полимеразной цепной реакции внутреннего транскрибированного спейсера (ITS-PCR в сравнении с упомянутым штаммом Lactobacillus plantarum ATCC 14917).
Выделение ДНК из Lactobacillus было выполнено с использованием лизоцима (Serva, Швеция; 20 мг/мл), мутанолизина (Sigma; 0.5 мг/мл) и растворов K-протеиназы (Fermentas, Литва; 14.6 мг/мл).
Амплификация ДНК была выполнена в 1×Taq буферном растворе полимеразы, включавшем 1,5U Taq полимеразы (Fermentas, Литва), 0.5 мкМ каждого праймера (16S-1500F и 23S-32R; DNA Technology AS), 200 мкМ дезоксинуклеотида трифосфатов (Amersham Pharmacia Biotech, Германия), 2 мМ MgCh и 2 мкМ исследуемой ДНК.
Затем, продукт ПЦР (PCR) был ограничен с использованием Taq 1 рестриктазы (Fermentas, Литва). Продукты ПЦР были разделены 2% агарозным гелем в 1×TBE буффере; напряжение 100 В. Бендинговые паттерны визуализированы в ультрафиолетовом свете и сопоставлены с упомянутым штаммом L. plantarum ATCC 14917.
Молекулярные «отпечатки» Lactobacillus plantarum Tensia DSM 21380 были сопоставлены с упомянутым штаммом L. plantarum путем гель-электрофореза в пульсирующем поле (pFGE) (Фиг.2).
Способ. Для процедуры гель-электрофореза в пульсирующем поле (PFGE) штаммы лактобактерий выращивали в MRS бульонной питательной среде при 37°С в течение 24 часов. Клетки промывали в SE буферном растворе (75 мМ NaCl, 25 мМ EDTA, рН=7.4), плотность клеток была приведена к 1.5 (OD600). Выделение ДНК из изолированных Lactobacillus выполняли в ЕС буферном растворе (50 мМ EDTA (рН 8.5), 0.5% Na-лаурилсаркозин, 0.2%'Na-деоцитат 2 мг/мл лизозима, 10 ед. мутанолизина), а затем в буферном растворе, содержащем 1 мг/мг раствора K протеиназы (100 мМ EDTA-1% саркозил - 30 0.2% дезоксихолат, рН 8.0). Лизированные пробы промывали в ТЕ буферном растворе и делили по 2 мм, которые затем экстрагировали в течение ночи ферментами 50 ед. Not I (Bio-Rad). Электрофорез проводили в CHEF-DR II (Bio-Rad) в течение 22 часов при 14°С. Бендинговые паттерны визуализировали в ультрафиолетовом осветителе.
Устойчивость к антибиотикам
Способ. Lactobacillus plantarum Tensia DSM 21380 тестировали с использованием полосок антибиотиков Е-теста (АВ Biodisk, Solna). MIC (минимальная ингибиторная концентрация) была установлена согласно эпидемиологическим контрольным значениям, рекомендованным Европейской комиссией (EUC).
| Таблица 1 | |||
| Устойчивость Lactobacillus plantarum Tensia DSM 21380 к антибиотикам | |||
| MIC*, мкг/мл | MIC*, мкг/мл | Контрольные значения MIC* устойчивости к антибиотикам Европейской комиссии (EUC), мкг/мл | |
| Антибиотик | L. plantarum Tensia DSM 21380 | L. plantarum Tensia DSM 21379 | |
| Ампициллин | 0.25 | 0.19 | 4 |
| Гентамицин | 1.5 | 1 | 64 |
| Стрептомицин | 16 | 6 | 64 |
| Эритромицин | 0.19 | 0.25 | 4 |
| Клиндамицин | 0.032 | 0.016 | 2 |
| Тетрациклин | 8 | 6 | 32 |
| Хлоромицетин | 2 | 2 | 8 |
| Ципро/Офлоксацин | 32 | 32 | 4 |
| Квинопристин/далфопристин | 1 | 1 | 4 |
| * минимальная ингибиторная концентрация |
Штамм Lactobacillus plantarum Tensia DSM 21380 не проявлял устойчивость к антибиотикам при использовании большинства наиболее значимых противомикробных препаратов.
Несколько большая MIC для ципрофлоксацина была отмечена в нормальном состоянии для исходных штаммов, описанных ранее. Вследствие этого, вероятно, это исходный тип штамма (Vankerckhoven V, Huys G, Vancanneyt M, Yael С, KlareI, Romond M-B, Entenza J M, Moreillon P, D. Wind R, Knol J, Wiertz E, Pot В., Vaughan E.E, Kahlmeter G, Goossens H. Biosafety assessment of probiotics used for human consumption: recommendations from the EUPROSAFE project. Trends in Food Science & Technology, 2008; 19: 102e114) и горизонтальный перенос устойчивых к антибиотикам генов Lactobacillus planlarum Tensia DSM 21380 во время использования штамма в качестве пробиотика не может быть спрогнозирован.
Функциональные свойства
Профиль метаболитов
Способ. Профиль метаболитов определяли способом газовой хроматографии (Hewlett-Packard 6890) после инкубации в микроаробной среде в течение 24 и 48 часов (Таблица 2). Штамм L. plantarum выращивали микроаэробно в MRS агаре в течение 48 часов (10% CO2). Суспензию (McFarland 4.0 стандарт турбидности, 109 KOE/ml) культуры лактобактерий готовили в 0.9% растворе NaCl. 1.0 мл этой суспензии помещали в 9.0 мл MRS бульонной питательной среды. Концентрация метаболитов (ммоль) определяли с использованием капиллярной колонки HP-INNOWax (15 м × 0.25 мм; 0.15 мкм). Температурный режим колонки: 60°С 1 мин, 20°С/мин 120°С 10 мин; детектор (FID) 350°С.
Электрохимические замеры Н2О2 выполняли с интактными клетками 24-часового возраста в 500 мкл MRS бульонной питательной среды при помощи анализатора свободных радикалов Apollo 4000 (WPI, Berlin, Germany) и электродов типа ISO-HP02 и ISO-NOP.
Сигналы электродов ISO-HP02 регистрировали в течение 5-7 минут. Определяли средний уровень сигнала. Каждая экспериментальная точка была измерена в четырех независимых параллелях и каждая параллель была измерена дважды. Концентрация H2O2 была определена согласно калибровочной кривой корреляции с силой сигнала электродов.
| Таблица 2 | |||||||
| Количество уксусной кислоты, молочной кислоты и янтарной кислоты (ммоль/л), выделяемое Lactobacillus plantarum Tensia DSM 21380 в MRS бульонной питательной среде при микроаэробной культивации в течение 24 и 48 часов и концентрация H2O2 (мкг/мл) интактных клеток | |||||||
| L. plantarum | Уксусная кислота (ммоль/л) | Молочная кислота (ммоль/л) | Янтарная кислота (ммоль/л) | H2O2 (µг/мл) | |||
| 24 ч | 48 ч | 24 ч | 48 ч | 24h | 48h | 24h интактные клетки | |
| Tensia DSM 213 80 | 1,4 | 1.7 | 112,2 | 129.2 | 0.6 | 0.6 | 196.4±128.8 |
| DSM21379 | 2.1 | 2.4 | 133.3 | 186.6 | 0.6 | 0.6 | 288.9±175.8 |
Lactobacillus plantarum Tensia DSM 21380 вырабатывает значительное количество уксусной кислоты, молочной кислоты и перекиси водорода. Концентрация последнего согласно показателям анализатора Apollo, однако, немного ниже, чем у контрольного штамма.
Противомикробное действие против патогенов и побочных лактобактерий
Lactobacillusplantarum Tensia DSM 21380 проявляет в in vitro эксперименте в MRS агаровой среде антагонистическое действие в отношении побочных лактобактерий и некоторых кишечных патогенов (Таблица 3). Это свойство позволяет использовать штамм для продления срока годности пищевых продуктов.
| Таблица 3 | |
| Противомикробное действие Lactobacillus plantarum Tensia DSM 21380 проти патогенов и побочных лактобактерий в модифицированной MRS агаровой среде (зона подавления роста патогенов, мм) | |
| Патоген | Зона подавления роста, мм |
| Побочные лактобактерии (NSLAB) | 8.6±4.07 |
| Listeria monocytogenes ATCC51774 | 25.1±1.7 |
| Yersinia enterocolitica | 13.5±1.7 |
| Salmonella enteritidis | 25.2±1.5 |
| S. enterica serovar Typhimurium | 22.8±0.1 |
| Shigella sonnei | 25.1±1.6 |
| Escherichia coli | 29.8±3.7 |
| Enterobacter sakazakii | 18.5:±3.6 1 |
| Campylobacterjejuni | 12.9'±5.2 |
Противомикробное действие Lactobacillus plantarum Tensia DSM 21380 в in vitro эксперименте лабораторных условиях, определяемое при процедуре нанесения материала на питательную среду в виде полосок (определение противомикробного эффекта метаболитов) было наибольшим против Е. coli, за ним следует подавление роста Salmonella sp., Shigella sp и Listeria sp. Самое низкое противомикробное действие Lactobacillus plantarum Tensia DSM 21380 было против других лакторактерий (NSLAB).
Противомикробное действие Lactobacillus plantarum Tensia (DSM 21380) при 4°С против психрофильных патогенов
Представляется важным выявить противомикробное действие штаммов микроорганизмов, используемых как вспомогательная закваска, против психрофильных патогенов пищевого происхождения при 4°С (т.е. при температуре хранения пищи).
Способ. Процедура окраски полос использовалась для выявления противомикробных свойств Lactobacillus sp (Hutt Р, Shchepetova J, Loivukene К, Kullisaar Т, Mikelsaar M. Antagonistic activity of probiotic lactobacilli and bifidobacteria against entero- and uropathogens. J Appi Microbiol. 2006; 100 (6): 1324-32).
Зона ингибирования роста патогенов измерялась в миллиметрах. Аналогично работе Hutt et al. (2006), вычислялось арифметическое среднее и его отклонение, а также вычислялось стандартное отклонение в соответствии с результатами использованных образцов и на этой основе было выявлено антагонистическое действие штаммов (мм) в следующем виде: при 4°С - ниже <14.6; среднее 14.6-21.4; сильное >21.4. Все опыты повторялись, по меньшей мере, три раза, независимо друг от друга.
| Таблица 3А | |
| Антогоностическое действие (мм) L. plantarum Tensia (DSM 21380) по способу окрашивания полосок при 4°С инкубации в течение 3 недель | |
| Патоген | L. plantarum Tensia (DSM 21380) |
| Listeria monocytogenes ATCC 13932 | 18.8±1.0 |
| Lisleria monocytogenes ATCC 51774 | 18.5±3.0 |
| Y. enterocolitica (клинический штамм) | 19.0±2.9 |
| Зона ингибирования (мм): слабая <14.6; средняя 14.6-21.4; сильная >21,4 |
Метаболиты L. plantarum Tensia (DSM 21380) способы ингибировать жизнеспособность психрофильных L. monocytogenes и Y. enterocolitica при 4°С.
Влияние условия роста и инкубационной температуры на противомикробные свойства L. plantarum Tensia (DSM 21380)
Способ. Для оценки влияния условия роста и температуры на производство противомикробных компонентов посредством L. plantarum Tensia (DSM 21380) использовались различные инкубационные температуры (15°С; 30°C и 37°C) и различные условия роста (MRS бульон и типовое молоко для производства сыра). Лактобактерии росли при инкубационных температурах 30°С и 37°C в течение 20-22 часов и при 15°С в течение 30 дней (модель «сыра»).
Антагонистические свойства были выявлены в течение 10-дневных интервалов.
Опыты с естественным супернатантом (рН диапазон 3.65-3.85) и нейтрализованным супернатантом (рН диапазон 6.0±0.15) осуществлялись независимо друг от друга для исключения влияния органических кислот. Противомикробное действие было выявлено при проверке по методу диффузии в агар (Jimenez-Diaz R., Rios-Sanchez R.M., Desmazeaud M., Ruiz-Barba J.L. and Piard J.-C. (1993) Plantaricins S and T, Two New Bacteriocins Produced by Lactobacillus plantarum LPCO10 Isolated from a Green Olive Fermentation. Appl. Environ. Microbiol. 59, 1416-1424) штамма Listeria monocytogenes ATCC 51774 ATCC 13932.
| Таблица 3В | ||||
| Влияние различных инкубационных температур (30°С и 37°C) и рН супернатантна (естественный: 3.65…3.85 и нейтрализованный: рН 6.0±0.15) L. plantarum Tensia, выращенного в MRS на антагонистическое действие против моноцитоенов Listeria (ингибирование роста патогенов в мм) | ||||
| Штамм | 30°С | 37°С | ||
| естественный | нейтральный | естественный | нейтральный | |
| L. plantarum Tensia (DSM 21380) | 5.1±1.4# | 3.7±2.6# | 5.4±0.5§ | 4.2±2.0§ |
| L. plantarum DSM 21379 | 1.1±2.1 | 1.1±2.1 | 1.4±2.2 | 1.4±2.3 |
| #р=0.03; §p=0.04 |
Супернатант L. plantarum Tensia (DSM 21380), вырасший в молоке в течение 20-22 часов при 30°С и 37°C, не имел антагонистического воздействия на тестируемые infvvs L. monocytogenes.
Влияние бактериоцинов, произведенных лактобактериями сильнее в кислотной среде, также как и в этом случае, когда все противомикробные составляющие, произведенные бактериями, действовали синергетически. Оптимальный диапазон работы бактериоцинов рассматривается как рН 5.0…7.0 (Atrih A., Rekhif N., Moir A.J.G., Lebrihi A. and Lefebvre G. (2001) Mode of action, purification and amino acid sequnce of plantaricin С19, an anti-Listeria bacteriocin produced by Lactobacillus plantarum С19. Intern. Journal of Food Microbiol. 68, 93-104; Mezaini A., Chihib N.-E., Bouras A.D., Nedjar-Arroume, N. and Hornez, J.P. (2009) Antibacterial Activity of Some Lactic Acid Bacteria Isolated from an Algerian Dairy Product. J. of Environ. And Public Health. 1-6).
Противомикробное действие супернатанта L. plantarum Tensia (DSM 21380), вырасшего в MRS бульоне, зависит от значений рН - противомикробное действие естественного супернатанта (рН 3.65…3.85) против тестируемых штаммов Listeria sp было значительно лучше, чем таковое для нейтрализованного супернатанта (Таблица 3В).
Противомикробное действие супернатанта L. plantarum Tensia (DSM 21380), вырасшего в MRS бульоне, зависит от инкубационной температуры, и является более сильным при 37°С (Таблица 3В).
| Таблица 3С | ||||||
| Влияние низкой инкубационной температуры (15°С) и различных условий роста (MRS и молоко) на противомикробное действие против Listeria sp в течение 30 дней инкубации в MRS бульоне и молоке (ингибирование роста патогенов в мм) | ||||||
| Штамм | MRS | Молоко | ||||
| День 10 | День 20 | День 30 | День 10 | День 20 | День 30 | |
| L. plantarum Tensia | 5.6±0.8 | 5.8±1.3 | 7.1±1.4 | 0 | 3.0±2.3 | 6.0±0.7 |
| L. plantarum DSM 21379 | 0 | 0.6±1.1 | 1.9±2.6 | 0 | 2.2±2.8 | 0 |
Супернатант L. plantarum Tensia (DSM 21380), вырасший при 15°C в MRS бульоне, имел антагонистическое действие начиная с первого измерения (10-й инкубационный день). Противомикробные свойства против Listeria sp супернатанта L. plantarum Tensia (DSM 21380), отделенного от молока, наблюдались начиная с 20-го инкубационного дня, и противомикробные действия супернатанта оставались и несколько усиливались при приближении к концу инкубационного периода. Противомикробные свойства супернатанта штаммов, отделенных от молока, были значительно слабее (р<0.01) в сравнении с супернатантом лактобактерий, вырасших в MRS бульоне.
Бактериоцин-гены Lactobacillus plantarum Tensia DSM 21380
Способ. Определение в Lactobacillus plantarum Tensia DSM 21380 бактериоцин-кодирующих генов основывалось на Lactobacillus plantarum WCFS1 генах plnE, plnF plnJ и plnK. Эти гены кодируют предшествующие пептиды бактериоцина (Lactobacillus plantarum WCFS1 genome annotation - Kleerebezem et al., 2003. Complete genome sequence of Lactobacillus plantarum WCFSI. Proc Natl Acad Sci USA. 2003 Feb. 18; 100 (4): 19905). Праймеры для ПЦР были разработаны с использованием Primer Express®. Аннотированный геном Lactobacillus plantarulli WCFS1 был загружен с браузера геномов NCBI (http://vmw.ncbi.nlm.nih.gov/Genomes).
Эти праймеры были разработаны как E1F, E1R, F1F, FIR, JIF, JIR, K2F, K2R (см. перечень последовательностей) и их использование в ПЦР-реакции позволило получить положительные сигналы для всех упомянутых последовательностей. Штамм L. plantarum ВАА-793 NCIMB 8826 был использован в качестве положительного контроля, а штамм L. plantarum DSM 21379 - в качестве отрицательного контроля.
| Таблица 4 | ||||
| Наличие расширенного спектра продуктов ПЦР в геномной ДНК бактериоцин-кодирующих генов plnE, plnF, plnJ и plnK Lactobacillus plantarum DSM 21380 | ||||
| Гены | ||||
| plnE | plnF | plnJ | plnK | |
| L. plantarum BAA-793 (NCIMB 8826) | + | + | + | + |
| L. plantarum Tensia DSM 21380 | + | + | + | + |
| L. plantarum DSM 21379 | + | + | - | - |
Антагонистическое действие L. plantarum Tensia DSM 21380 по сравнению с другими противомикробными веществами также основано на вышеупомянутых генных продуктах, например противомикробных пептидах. Пептиды Е&F и J&K должны быть экспрессированы одновременно для получения максимального отклика посредством дипептидов.
Выработка микроорганизмами штамма L.plantarum Tensia DSM 21380 линолевой кислоты с сопряжёнными двойными связями (CLA)
Способ. Выработку линолевой кислоты с сопряжёнными двойными связями (CLA) определяли в MRS бульонной питательной среде (de Mann-Rogosa-Sharpe, Oxoid, UK) и в снятом молоке при помощи спектрофотометрических