Способ получения пептида
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения пептида, отличающемуся тем, что он содержит превращение группы -SH пептида, содержащего аминокислотный остаток, имеющий группу -SH, в группу -ОН, где указанный способ содержит следующие стадии от (а) до (с): (а) реакция группы -SH в пептиде с метилирующим агентом для превращения группы -SH в группу -SMe; (b) реакция группы -SMe, образованной на стадии (а), с цианирующим агентом с получением промежуточного продукта реакции в форме сложного эфира; (с) превращение промежуточного продукта реакции полученного на стадии (b) в пептид, содержащий аминокислотный остаток, имеющий группу -ОН в более основных условиях, чем условия стадии (b). 7 н. и 13 з.п. ф-лы, 7 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения пептида и гликопептида.
Уровень техники
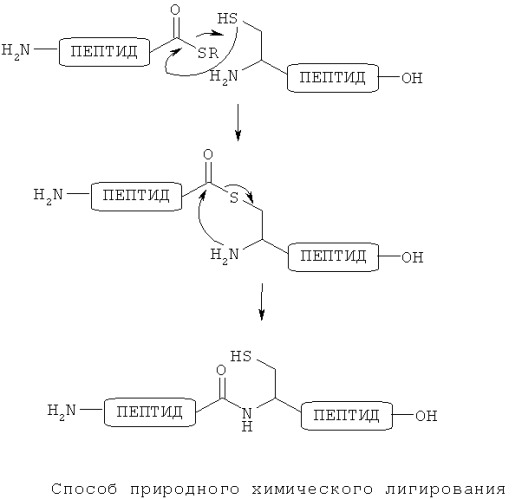
В качестве способа получения пептида полезным является способ лигирования. Среди таких способов лигирования способ природного химического лигирования (способ NCL) является способом, которым можно получать пептид, имеющий природную амидную связь (пептидную связь) в месте лигирования. Такой способ NCL можно применять для лигирования двух незащищенных пептидных цепей. Этот способ является известным в качестве способа, применимого для образования природной амидной связи в месте лигирования (см, например, патентный документ 1). Как показано на фигуре ниже, способ NCL включает в себя химическую селективную реакцию между первым пептидом, имеющим α-карбокситиоэфирную часть у его С-конца, и вторым пептидом, имеющим остаток цистеина у его N-конца. В этой реакции тиоловая группа (группа SH, которую можно также называть сульфгидрильной группой) на боковой цепи цистеина селективно реагирует с атомом углерода карбонила сложной тиоэфирной группы, и в результате реакции обмена тиола образуется связанный сложной тиоэфирной связью начальный промежуточный продукт. Этот промежуточный продукт внутримолекулярно перегруппировывается на произвольной основе с образованием природной амидной связи к месту лигирования. В то же время промежуточный продукт образует тиол на боковой цепи цистеина. С применением данной реакции становится возможным эффективный синтез различных полипептидов.
[Формула 1
Основной недостаток типичного способа NCL состоит в том, что любой из двух пептидных фрагментов, которые лигируют, должен иметь остаток цистеина у его N-конца и что пептид, полученный после лигирования, должен также иметь остаток цистеина у места лигирования по этому способу. Согласно этому этот способ нельзя применять в случае, в котором требуемый пептид, который синтезируют, не содержит остаток цистеина.
Кроме того, в типичном способе NCL два или более пептидных фрагмента, которые лигируют, получают, например, способом твердофазного синтеза. Когда пептид содержит крайне малое количество цистеина (или не содержит цистеин), подобно пептиду, существующему в живом организме, бывает необходимо получить крайне длинный пептидный фрагмент, который подвергают реакции по такому способу NCL. Таким образом, нельзя сказать, что он является эффективным способом.
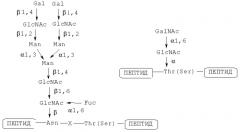
С другой стороны, известно, что в живом организме присутствуют различные гликопептиды и гликопротеины. Цепи сахаров таких гликопептидов или гликопротеинов в широком варианте классифицируют на два типа; а именно, N-связанные цепи сахаров и O-связанные цепи сахаров. N-связанной цепью сахара обычно является цепь сахара, связывающаяся с атомом азота амида на боковой цепи аспарагина посредством N-гликозидной связи. Обычно такая N-связанная цепь сахара часто связывается с Asn в согласованной последовательности -Asn-X-Ser/Thr- (где X представляет собой аминокислоту, исключая пролин) в природном состоянии. O-связанной цепью сахара является цепь сахара, связывающаяся с гидроксильной группой на боковой цепи серина или треонина посредством O-гликозидной цепи. Примеры таких N-связанных и O-связанных цепей сахаров будут представлены ниже (Gal: галактоза; GlcNAc: N-ацетилглюкозамин; Man: манноза; Fuc: фукоза; GalNAc: N-ацетилгалактозамин). Известно, что природный гликопептид, имеющий такую O-связанную цепь сахара, содержит большое количество пролина, треонина и серина (непатентные документы 1 и 2).
[Формула 2]
Примеры N-связанной цепи сахара и O-связанной цепи сахара
Патентный документ 1: международная публикация WO 96/34878.
Непатентный документ 1: TRENDS in biochemical sciences. Vol.27, No. 3, March 2002.
Непатентный документ 2: Cancer Biology & Therapy 6: 4, 481-486, April 2007.
Раскрытие изобретения
Техническая проблема
Задачей настоящего изобретения является предоставление нового способа получения пептида и гликопептида.
В частности, в общепринятом типичном способе NCL любой из двух пептидных фрагментов, которые лигируют, должен иметь остаток цистеина у его N-конца и, кроме того, пептид, полученный после лигирования, также должен иметь остаток цистеина у места лигирования. Таким образом, способ NCL должен быть предназначен и должен применяться с использованием остатка цистеина требуемого пептида (или гликопептида), чтобы в конце получить его в качестве места лигирования. Поэтому настоящее изобретение относится к новому способу получения пептида и гликопептида, который позволяет разработать способ лигирования, по которому получают требуемый пептид не только с остатком цистеина, но также с частью, соответствующей остатку серина или остатку треонина, который можно применять в качестве места лигирования.
Более определенно, в одном аспекте настоящего изобретения остаток цистеина в пептиде (или гликопептиде) можно превратить в остаток серина. Таким образом, пептид, имеющий остаток цистеина у его N-конца, лигируют с другим пептидом согласно способу NCL и после этого этот остаток цистеина можно превратить в остаток серина. Поэтому согласно настоящему изобретению, даже если остаток цистеина не присутствует в требуемой последовательности, которую получают, если в ней присутствует остаток серина, положение остатка серина может быть определено как место лигирования в способе NCL.
Кроме того, в одном аспекте настоящего изобретения пептид, имеющий у своего N-конца остаток производного треонина, имеющего группу -SH у своего N-конца (или остаток производного треонина, имеющего группу -SH, которая защищена дисульфидной связью или тому подобное), лигируют с другим пептидом согласно способу лигирования и после этого полученный остаток производного треонина можно превратить в остаток треонина. Следовательно, согласно настоящему изобретению, даже если остаток цистеина не присутствует в требуемой последовательности, которую получают, но если в ней присутствует остаток треонина, положение остатка треонина может быть определено как место лигирования в способе лигирования.
Таким образом, настоящее изобретение относится к новому способу получения пептида и гликопептида с применением способа лигирования, в котором серин или треонин, который широко распространен в гликопептидах, можно считать как место лигирования в способе лигирования.
Разрешение проблемы
Для разрешения вышеуказанных проблем настоящее изобретение может иметь следующие характеристики.
Настоящее изобретение может предложить способ получения пептида, отличающийся тем, что он содержит превращение группы -SH пептида, содержащего аминокислотный остаток, имеющий группу -SH, в группу -ОН, где указанный способ содержит следующие стадии от (а) до (с):
(a) предоставление возможности группе -SH в пептиде для реакции с метилирующим агентом;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом и
(c) модификацию условий реакции, чтобы они стали более основными, чем условия стадии (b).
Настоящее изобретение может также предложить способ получения пептида, отличающийся тем, что он содержит превращение группы -SH пептида, содержащего аминокислотный остаток, имеющий группу -SH, в группу -ОН,
где указанный способ содержит следующие стадии от (а) до (с):
(a) предоставление возможности группе -SH в пептиде для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в пептид, содержащий аминокислотный остаток, имеющий группу -ОН, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может предложить также способ получения пептида, отличающийся тем, что он содержит превращение остатка цистеина пептида, содержащего остаток цистеина, в остаток серина, где указанный способ содержит следующие стадии от (а) до (с):
(a) предоставление возможности группе -SH остатка цистеина в пептиде для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в пептид, содержащий остаток серина, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может также предложить способ получения пептида, отличающийся тем, что он содержит превращение остатка производного треонина А, представленного нижеследующей формулой (1) пептида, содержащего остаток производного треонина А в качестве аминокислотного остатка, в остаток треонина.
[Формула 3]
где указанный способ содержит следующие стадии от (а) до (с):
(a) предоставление возможности группе -SH остатка производного треонина А в пептиде для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в пептид, содержащий остаток треонина, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может предложить также способ получения пептида, отличающийся тем, что он содержит превращение группы -SMe пептида, содержащего аминокислотный остаток, имеющий группу -SMe, в группу -ОН,
где указанный способ содержит следующие стадии (b) и (с):
(b) предоставление возможности группе -SMe в пептиде для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта, полученного на стадии (b), в пептид, содержащий аминокислотный остаток, имеющий группу -ОН, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может предложить также способ получения пептида, содержащего аминокислотный остаток, имеющий группу -ОН, который содержит следующие стадии:
(о) лигирование первого пептида, содержащего у своего С-конца аминокислотный остаток, в котором карбоксильная группа замещена α-карбокситиоэфирной группой, представленной формулой -C(=O)-SR (где R выбран из бензильной группы, арильной группы и алкильной группы, которые могут быть замещены заместителями), со вторым пептидом, содержащим у своего N-конца аминокислотный остаток, имеющий группу -SH, согласно способу лигирования с получением пептида, содержащего аминокислотный остаток, имеющий группу -SH;
(а) предоставление возможности группе -SH в пептиде, полученном на стадии (о), для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в пептид, содержащий аминокислотный остаток, имеющий группу -ОН, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может предложить также способ получения пептида, содержащего остаток серина, который содержит следующие стадии:
(о) лигирование первого пептида, содержащего у своего С-конца аминокислотный остаток, в котором карбоксильная группа замещена α-карбокситиоэфирной группой, представленной формулой -C(=O)-SR (где R выбран из бензильной группы, арильной группы и алкильной группы, которые могут быть замещены заместителями), со вторым пептидом, содержащим у его N-конца остаток цистеина, согласно способу лигирования с получением пептида, содержащего остаток цистеина;
(a) предоставление возможности группе -SH остатка цистеина в пептиде, полученном на стадии (о), для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в пептид, содержащий остаток серина, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может предложить также способ получения пептида, содержащего остаток треонина, который содержит следующие стадии:
(о) лигирование первого пептида, содержащего у своего С-конца аминокислотный остаток, в котором карбоксильная группа замещена α-карбокситиоэфирной группой, представленной формулой -C(=O)-SR (где R выбран из бензильной группы, арильной группы и алкильной группы, которые могут быть замещены заместителями), со вторым пептидом, содержащим у своего N-конца остаток производного треонина, согласно способу лигирования с получением пептида, содержащего остаток производного цистеина А, представленного вышеуказанной формулой (1), в качестве аминокислотного остатка;
(a) предоставление возможности группе -SH остатка производного треонина А в пептиде, полученном на стадии (о), для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(с) превращение промежуточного продукта реакции, полученного на стадии (b), в пептид, содержащий остаток треонина, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может также предложить способ получения гликопептида, отличающийся тем, что он содержит превращение группы -SH гликопептида, содержащего аминокислотный остаток, имеющий группу -SH, в группу -ОН, где указанный способ содержит следующие стадии от (а) до (с):
(a) предоставление возможности группе -SH в гликопептиде для реакции с метилирующим агентом;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом и
(c) модификацию условий реакции, чтобы они стали более основными, чем условия стадии (b).
Настоящее изобретение может также предложить способ получения гликопептида, отличающийся тем, что он содержит превращение группы -SH гликопептида, содержащего аминокислотную последовательность, имеющую группу -SH, в группу -ОН, где указанный способ содержит следующие стадии от (а) до (с):
(a) предоставление возможности группе -SH в гликопептиде для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в гликопептид, содержащий аминокислотный остаток, имеющий группу -ОН, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может предложить также способ получения гликопептида, отличающийся тем, что он содержит превращение остатка цистеина гликопептида, содержащего остаток цистеина, в остаток серина, где указанный способ содержит следующие стадии от (а) до (с):
(a) предоставление возможности группе -SH остатка цистеина в гликопептиде для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в гликопептид, содержащий остаток серина, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может предложить также способ получения гликопептида, отличающийся тем, что он содержит превращение остатка производного треонина А, представленного вышеуказанной формулой (1) гликопептида, содержащего остаток производного треонина А в качестве аминокислотного остатка, в остаток треонина, где указанный способ содержит следующие стадии от (а) до (с):
(a) предоставление возможности группе -SH остатка производного треонина А в гликопептиде для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в гликопептид, содержащий остаток треонина, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может предложить также способ получения гликопептида, содержащего аминокислотный остаток, имеющий группу -ОН, который содержит следующие стадии:
(о) лигирование первого пептида или гликопептида, содержащего у своего С-конца аминокислотный остаток, в котором карбоксильная группа замещена а-карбокситиоэфирной группой, представленной формулой -C(=O)-SR (где R выбран из бензильной группы, арильной группы и алкильной группы, которые могут быть замещены заместителями), со вторым пептидом или гликопептидом, содержащим у его N-конца аминокислотный остаток, имеющий группу -SH, согласно способу лигирования, при условии, что по меньшей мере, один из первого пептида или гликопептида и второго пептида или гликопептида является гликопептидом, с получением гликопептида, содержащего аминокислотный остаток, имеющий группу -SH;
(a) предоставление возможности группе -SH в гликопептиде, полученном на стадии (о), для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в гликопептид, содержащий аминокислотный остаток, имеющий группу -ОН, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может предложить также способ получения гликопептида, содержащего остаток серина, который содержит следующие стадии:
(о) лигирование первого гликопептида, С-конец которого представлен следующей формулой
-caxap-Asn-X-C(=O)-SR
где caxap-Asn представляет собой аспарагин, соединенный с цепью сахара,
Х представляет собой часть, другую, чем карбоксильная группа любого данного аминокислотного остатка, другого, чем пролин, и
R выбран из бензильной группы, арильной группы и алкильной группы, которая может быть замещена заместителями, со вторым пептидом, содержащим остаток цистеина у его N-конца, согласно способу лигирования с получением гликопептида, содержащего остаток цистеина;
(a) предоставление возможности группе -SH остатка цистеина в гликопептиде, полученном на стадии (о), для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в гликопептид, содержащий остаток серина, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение может предложить также способ получения гликопептида, содержащего остаток треонина, который содержит следующие стадии:
(о) лигирование первого гликопептида, С-конец которого представлен следующей формулой
-caxap-Asn-X-C(=O)-SR
где caxap-Asn представляет собой аспарагин, соединенный с цепью сахара,
Х представляет собой часть, другую, чем карбоксильная группа любого данного аминокислотного остатка, другого, чем пролин, и
R выбран из бензильной группы, арильной группы и алкильной группы, которая может быть замещена заместителями, со вторым пептидом, содержащим остаток треонина у его N-конца, согласно способу лигирования с получением гликопептида, содержащего производное треонина А, представленного вышеуказанной формулой (1), в качестве аминокислотного остатка;
(а) предоставление возможности группе -SH остатка производного треонина А в гликопептиде, полученном на стадии (о), для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом с получением промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в гликопептид, содержащий остаток треонина, в более основных условиях, чем условия на стадии (b).
Настоящее изобретение предлагает также гликопептид, имеющий структуру, представленную следующей формулой:
-caxap-Asn-X-Y-
где caxap-Asn представляет собой аргинин, связанный с цепью сахара,
Х представляет собой любой данный аминокислотный остаток, другой, чем пролин, и
Y представляет собой остаток производного треонина А, представленный формулой (2):
[Формула 4]
В одном варианте осуществления настоящего изобретения остаток метионина в пептиде или гликопептиде на стадии (а) или стадии (с) может быть предпочтительно остатком защищенного метионина, и способ получения предпочтительно дополнительно содержит следующую стадию (d) после стадии (b) или стадии (с) и особенно после стадии (с), когда требуется:
(d) удаление защитной группы у остатка защищенного метионина.
В одном варианте осуществления настоящего изобретения промежуточный продукт реакции, полученный на стадии (b), может быть предпочтительно в форме сложного эфира.
В одном варианте осуществления настоящего изобретения стадию (b) можно предпочтительно проводить в кислотных условиях и особенно при pH 2-3.
В одном варианте осуществления настоящего изобретения цианирующим агентом, применяемым на стадии (b), предпочтительно является бромид циана.
В одном варианте осуществления настоящего изобретения стадию (с) можно предпочтительно проводить в слабоосновных условиях, например, при pH 7-9, и особенно при pH 7-8. Когда стадию (с) проводят в слабоосновных условиях, в одном варианте осуществления стадию (с) можно предпочтительно проводить в течение приблизительно 10 минут или больше и особенно в течение приблизительно 15 минут или больше (например, в течение приблизительно от 10 минут до 30 часов и особенно в течение приблизительно от 15 минут до 30 часов).
В одном варианте осуществления настоящего изобретения стадию (с) можно предпочтительно проводят в сильноосновных условиях, например, при pH 9-13 и особенно при pH 10-11. Когда стадию (с) проводят в сильноосновных условиях, в одном варианте осуществления стадию (с) можно предпочтительно проводить в течение приблизительно 1 часа или меньше, и особенно в течение приблизительно 10 минут или меньше (например, в течение приблизительно от 5 минут до 1 часа и особенно в течение приблизительно от 5 минут до 10 минут).
В одном варианте осуществления настоящего изобретения, когда остаток производного треонина содержится у N-конца второго пептида, вышеуказанный остаток производного треонина может быть N-концевым аминокислотным остатком производного треонина, представленным следующей формулой (3)
[Формула 5]
где R представляет собой Н или защитную группу для тиоловой группы, которую легко удаляют в условиях реакции лигирования, и такая группа R предпочтительно представляет собой Н или дисульфидную группу.
В одном варианте осуществления настоящего изобретения любо один, либо особенно оба из первого пептида (или гликопептида) и второго пептида (или гликопептида) предпочтительно могут не содержать цистеин или содержат защищенный цистеин.
В одном варианте осуществления настоящего изобретения либо первый пептид (или гликопептид), либо второй пептид (или гликопептид) может предпочтительно быть пептидом (или гликопептидом), имеющим 80 или меньше, предпочтительно 50 или меньше, и более предпочтительно 30 или меньше аминокислотных остатков.
В одном варианте осуществления настоящего изобретения цепь сахара в гликопептиде может предпочтительно быть N-связаной цепью сахара или O-связанной цепью сахара.
В одном варианте осуществления настоящего изобретения в качестве цепи сахара может быть предпочтительно цепь сахара, представленная следующей формулой (4).
В одном варианте осуществления настоящего изобретения способ получения может предпочтительно дополнительно содержать стадию присоединения цепи сахара после стадии (с) или стадии (d).
В одном варианте осуществления все амидные связи в пептиде или гликопептиде, полученном способом получения настоящего изобретения, могут быть предпочтительно природными амидными связями.
В одном варианте осуществления все конститутивные аминокислоты пептида или гликопептида, полученного способом получения настоящего изобретения, могут быть предпочтительно природными аминокислотами, существующими в качестве конституитивных аминокислот пептида или гликопептида в живом организме.
Благоприятные действия изобретения
Согласно способу получения пептида настоящего изобретения, группу -SH пептида, имеющего такую группу -SH, можно превратить в группу -ОН. Кроме того, группу -SH пептида, содержащего аминокислотный остаток, имеющий такую группу -SH, который получают лигированием первого пептида, имеющего α-карбокситиоэфирную часть, представленную формулой -C(=O)-SR, у его С-конца, со вторым пептидом, содержащим аминокислотный остаток, имеющий группу -SH у его N-конца, согласно способу лигирования можно превратить в группу -ОН. Эти способы можно также применять для гликопептидов.
Так, согласно способу получения пептида настоящего изобретения, остаток цистеина в пептиде можно превратить в остаток серина. В результате этого, если даже остаток цистеина не присутствует в требуемой последовательности, которую получают, но если в ней присутствует остаток серина, можно применять способ NCL.
Кроме того, настоящее изобретение предлагает также способ лигирования, в котором в качестве места лигирования применяют производное треонина, имеющее группу -SH. Поскольку остаток производного треонина, имеющего группу -SH в пептиде, полученном этим способом лигирования, можно превратить в остаток треонина, становится возможным применение способа лигирования с применением остатка треонина в качестве места лигирования для получения пептида, имеющего треонин.
Цистеин, который применяли в качестве места лигирования в обычном способе природного химического лигирования, содержится в малом количестве в пептиде, существующем в живом организме. Согласно способу настоящего изобретения, серин и треонин, которые содержатся в большом количестве в пептиде и особенно в гликопептиде, существующем в живом организме, можно рассматривать в качестве новых мест лигирования в способе лигирования.
Кроме того, вышеуказанный способ применяют для гликопептида и особенно для гликопептида, имеющего O-связанную цепь сахара и содержащего большие количества серина и треонина, или гликопептида, имеющего N-связанную цепь сахара и имеющего в качестве согласованной последовательности последовательность caxap-Asn-X-Ser- или -caxap-Asn-X-Thr (где caxap-Asn представляет собой аспарагин, связанный с цепью сахара, и X представляет собой любой данный аминокислотный остаток, другой, чем пролин), для получения с применением способа лигирования гликопептида, имеющего N-связанную цепь сахара или O-связанную цепь сахара, который имеет такую же структуру, как структура природного гликопептида.
Лучший вариант осуществления изобретения
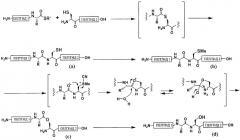
В первом аспекте настоящее изобретение относится к превращению пептида, содержащего аминокислотный остаток, имеющий группу -SH, по следующим стадиям от (а) до (с) для получения пептида, содержащего аминокислотный остаток, имеющий группу -ОН:
(a) предоставление возможности группе -SH в пептиде для реакции с метилирующим агентом;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом и
(c) модификацию условий реакции, чтобы они стали более основными, чем условия стадии (b).
Вышеописанными стадиями от (а) до (с) более конкретно являются следующие стадии:
(a) предоставление возможности группе -SH в пептиде для реакции с метилирующим агентом для превращения группы -SH в группу -SMe;
(b) предоставление возможности группе -SMe, образованной на стадии (а), для реакции с цианирующим агентом для получения промежуточного продукта реакции и
(c) превращение промежуточного продукта реакции, полученного на стадии (b), в пептид, содержащий аминокислотный остаток, имеющий группу -ОН, в условиях более основных, чем условия стадии (b).
Во втором аспекте настоящее изобретение относится к проведению следующих стадий:
лигирования первого пептида, содержащего у его С-конца аминокислотный остаток, в котором карбоксильная группа замещена α-карбокситиоэфирной группой, представленной формулой -C(=O)-SR (где R выбран из бензильной группы, арильной группы и алкильной группы, которые могут быть замещены заместителями), со вторым пептидом, содержащим у его N-конца аминокислотный остаток, имеющий группу -SH, согласно способу лигирования с получением пептида, содержащего аминокислотный остаток, имеющий группу -SH; и
стадий, включающих в себя вышеуказанные стадии от (а) до (с), с получением пептида, содержащего аминокислотный остаток, имеющий группу -ОН.
В третьем аспекте настоящее изобретение относится к превращению гликопептида, содержащего аминокислотный остаток, имеющий группу -SH, по стадиям, включающим в себя вышеуказанные стадии от (а) до (с), с получением гликопептида, содержащего аминокислотный остаток, имеющий группу -ОН.
В четвертом варианте осуществления настоящее изобретение относится к проведению следующих стадий:
лигирование первого гликопептида, С-конец которого представлен следующей формулой:
-caxap-Asn-X-C(=O)-SR
где caxap-Asn представляет собой аспарагин, присоединенный к цепи сахара,
Х представляет собой часть, другую чем карбоксильная группа любого данного аминокислотного остатка, другого, чем пролин, и R выбран из бензильной группы, арильной группы и алкильной группы, которые могут быть замещены заместителями со вторым пептидом, содержащим аминокислотный остаток, имеющий группу -SH у его N-конца, согласно способу лигирования с получением гликопептида, содержащего аминокислотный остаток, имеющий группу -SH; и
стадий, включающих в себя вышеуказанные стадии от (а) до (с), с получением гликопептида, содержащего аминокислотный остаток, имеющий группу -ОН.
В настоящем описании термин «пептид» в частности не ограничивается, пока две или более аминокислоты связываются друг с другом посредством их амидной связи. Таким образом, термин «пептид» применяют здесь для включения в него формы известного пептида, нового пептида и модифицированного пептида. В настоящем изобретении соединения, обычно называемые белками, также включены в такой термин пептид. В предпочтительном аспекте в пептиде (или гликопептиде), полученном способом получения настоящего изобретения, две аминокислоты или более аминокислот связаны друг с другом посредством такой же амидной связи (пептидной связи), как и амидная связь природного пептида или гликопептида.
В настоящем описании термин «форма модифицированного пептида» применяют для обозначения соединения, полученного природной или искусственной модификацией пептида. Примеры такой модификации включают в себя алкилирование, ацилирование (например, ацетилирование), амидирование (например, амидирование С-конца пептида), карбоксилирование, этерификацию, образование дисульфидной связи, гликозилирование, липидизацию, фосфорилирование, гидроксилирование и связывание вещества для мечения, причем все такие реакции проводят на одном или многих аминокислотных остатках пептида.
В настоящем описании термин «аминокислота» применяют в самом широком смысле. Поэтому в настоящем описании термин «аминокислота» включает в себя не только природные аминокислоты, такие как серин (Ser), аспарагин (Asn), валин (Val), лейцин (Leu), изолейцин (Ile), аланин (Ala), тирозин (Tyr), глицин (Gly), лизин (Lys), аргинин (Arg), гистидин (His), аспарагиновая кислота (Asp), глутаминовая кислота (Glu), глутамин (Gln), треонин (Thr), цистеин (Cys), метионин (Met), фенилаланин (Phe), триптофан (Thr) и пролин (Pro), но также неприродные аминокислоты, такие мутанты и производные аминокислот. Принимая во внимание такие широкие определения, специалист в данной области должен понимать, что аминокислота в настоящем описании включает в себя, например, L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, такие как мутанты и производные аминокислот; аминокислоты, которые не становятся структурными элементами для белков в живом организме, такие как норлейцин, β-аланин и орнитин; и химически синтезированные соединения, имеющие свойства аминокислот, известные специалисту в данной области. Примеры неприродных аминокислот включают в себя α-метиламинокислоты (α-метилаланин и т.д.), D-аминокислоты, подобные гистамину аминокислоты (2-аминогистидин, β-гидроксигистидин, гомогистидин, α-фторметилгистидин, α-метилгистидин и т.д.), аминокислоты, имеющие избыточный метилен на их боковой цепи ("гомо"-аминокислоты), аминокислоты, функциональная группа карбоновой кислоты которых в боковой цепи замещена группой сульфоновой кислоты (цистеиновая кислота и т.д.), а также производное треонина А, описываемое подробно ниже.
В настоящем описании термин "производное треонина" применяют для обозначения соединения, представленного следующей формулой (3):
[Формула 11]
В формуле (3) R представляет собой Н или защитную группу для тиоловой группы, которая легко удаляется в условиях реакции лигирования, и такая R предпочтительно представляет собой Н или дисульфидную группу. В частности, соединение, представленное нижеследующей формулой (1), где R представляет собой Н в указанной выше формуле (3), называют производным треонина А.
[Формула 12]
Производным треонина формулы (3) является соединение, у которого группой -ОН треонина является группа -SH. Такое производное треонина включает в себя производные, имеющие все типы конфигураций. Считается, что в способе получения настоящего изобретения пространственное обращение имеет место, когда группа -SH аминокислотного остатка в пептиде превращается в группу -ОН. Таким образом, особенно когда нужно получить треонин, существующий в природе, предпочтительно можно применять производное треонина, имеющее группу -SR, конфигурация которой является обращенной по отношению к группе -ОН треонина, существующего в природе.
Вышеуказанное производное треонина можно получить нижеследующим способом при обращении к примерам и примерам синтеза, описываемым, например, ниже.
Сначала получают треонин, содержащий аминогруппу и карбоксильную группу, которые были защищены. Типы таких защитных групп конкретно не ограничиваются, при условии, что представляющий собой интерес пептид можно получить в последующей реакции. Например, можно применять треонин с аминогруппой, защищенной Вос-группой, и карбоксильной группой, защищенной группой TMSE (триметилсилилэтил). После этого гидроксильную группу в β-положении мезилируют известным способом. Затем с применением, например, DBU и тиоуксусной кислоты эту мезильную группу заменяют на тиоацетильную группу (см. D.Crich et al., J. Am. Chem. Soc., 129, 10064 (2007)).
Согласно известному способу эту тиоацетильную группу превращают в тиоловую группу, защищенную защитной группой, известной специалистам в данной области, такой как дисульфидная группа, ацетамидметильная группа, нитробензильная группа или тритильная группа. Например, когда тиоацетильную группу превращают в тиоловую группу, защищенную дисульфидной группой, в качестве ссылки можно применять пример 1 синтеза, описываемый ниже. Дисульфидную группу легко удаляют в условиях реакции для последующего способа лигирования.
В