Лекарственная форма для доставки лекарственного средства в толстую кишку
Иллюстрации
Показать всеИзобретение относится к лекарственной форме с отсроченным высвобождением для доставки лекарственного средства в толстую кишку. Лекарственная форма включает частицу с ядром и покрытием ядра, где ядро включает лекарственное средство и покрытие. Покрытие включает смесь чувствительного к воздействию бактерий толстой кишки вещества и пленкообразующего полимерного вещества, которое нерастворимо при рН менее 5 и растворимо при рН выше 5. В качестве чувствительного к воздействию бактерий толстой кишки вещества применяется крахмал, содержащий не более 75% амилозы. Изобретение также относится к способу получения указанной лекарственной формы, который заключается в формировании ядра и покрытии ядра покрывающей композиций, включающей смесь крахмала, содержащего не более 75% амилозы, и пленкообразующего полимерного вещества. Изобретение также относится к применению заявленной лекарственной формы для производства лекарственного препарата для лечения воспалительного заболевания кишки и карциномы, а также к способам лечения указанных заболеваний путем введения терапевтически эффективного количества заявленной лекарственной формы. 10 н. и 18 з.п. ф-лы, 17 ил., 1 табл., 5 пр.
Реферат
Настоящее изобретение относится к лекарственной форме с отсроченным высвобождением с ядром, включающим лекарственное средство, и покрытие, обеспечивающим отсроченное высвобождение. В частности, изобретение относится к лекарственной форме с отсроченным высвобождением лекарственного средства для доставки в толстую кишку.
Направленная доставка лекарственных средств в толстую кишку может использоваться в качестве средства местной терапии или для системного лечения. Толстая кишка подвержена множеству заболеваний, включая воспалительное заболевание кишки, синдром раздраженной кишки, запор, диарею, инфекцию и карциному. При таких состояниях направленная доставка лекарственного средства в толстую кишку максимально увеличивает терапевтическую эффективность лечения. Толстую кишку также можно использовать как точку для введения лекарственных средств в большой круг кровообращения. Разрабатывались различные лекарственные формы для доставки лекарственного средства в толстую кишку, включая пролекарства, а также дозированные формы, при этом последние более популярны, поскольку однажды разработанная концепция может быть использована и с другими лекарственными средствами.
Бактериальную флору толстой кишки более высокого порядка также использовали для разработки дозированных форм доставки лекарственного средства в толстую кишку для применения в качестве носителей природных полисахаридных комплексов, которые являются субстратами для многочисленных ферментов бактерий, населяющих толстую кишку. Эти вещества способны неповрежденными пройти верхнюю область желудочно-кишечного тракта, но расщепляются на входе в толстую кишку. На данный момент изученные вещества включают аморфную амилозу, пектин, хитозан и галактоманнан.
Аморфная амилоза устойчива к расщеплению ферментами верхних отделов желудочно-кишечного тракта. Тем не менее она ферментируется в толстой кишке α-амилазными ферментами, продуцируемыми более чем половиной из 400 видов бактерий толстой кишки.
Основным преимуществом использования полисахаридов в этом подходе с бактериальными ферментами к доставке лекарственного средства в толстую кишку является то, что используемые вещества пригодны для употребления в пищу и, таким образом, безопасны для людей. Они обычно применяются в качестве покрытий или включаются в материал ядра в качестве матричного носителя, и их расщепление при входе в толстую кишку ферментами бактерий толстой кишки приводит к высвобождению лекарственного средства. Пример такой лекарственной формы, в которой используется амилозное покрытие, раскрыт в EP-A-0343993 (BTG International Limited).
Впрочем, основное ограничение при использовании таких природных веществ заключается в том, что они чрезмерно набухают в водных средах, что приводит к вымыванию лекарственного средства в верхних областях желудочно-кишечного тракта. Для преодоления этой проблемы их использовали в смеси с непроницаемыми веществами (например, аморфной амилозой, смешанной с нерастворимым в воде этилцеллюлозным полимером). Тем не менее, проблема таких модификаций/смесей - поиск подходящего баланса между гидрофобностью и гидрофильностью, который бы предотвратил несвоевременное высвобождение лекарственного средства в верхних областях желудочно-кишечного тракта и в то же время обеспечил доступ ферментов к полисахаридному субстрату и гарантировал адекватную скорость высвобождения лекарственного средства в толстой кишке.
Попытка решить проблему чрезмерного набухания амилозы раскрыта в EP-A-0502032 (British Technology Group Ltd). Там используют внешнее покрытие, включающее пленкообразующий целлюлозный или акрилатный полимерный материал, и аморфную амилозу для таблетки, включающей активное соединение. Один вариант выполнения изобретения представляет собой активное соединение, покрытое сначала внутренним амилозным слоем, а затем отдельным внешним слоем акрилатного или целлюлозного полимерного материала. Другим вариантом выполнения изобретения является внешнее покрытие, которое представляет собой смесь амилозы и целлюлозного или акрилатного полимера. Из этого источника ясно, что разложение целлюлозных материалов in vivo, по существу, не зависит от pH, и, предпочтительно, что это также верно для акрилатных материалов. Каждый пример, приведенный в указанном источнике, раскрывает независимый от рН целлюлозный или акрилатный полимер.
В статье в Journal of Controlled Release (Milojevic et al, 38, (1996), 75-84) сообщается о результатах исследований, касающихся включения ряда нерастворимых полимеров в амилозное покрытие для контроля набухания амилозы. Проводили оценку ряда сополимеров на основе целлюлозы и акрилата, и было установлено, что для контроля набухания наиболее эффективна коммерчески доступная этилцеллюлоза (Ethocel®). Другой исследуемый покрывающий монослой представлял собой смесь амилозы и двух pH-независимых акриловых полимеров, а именно Eudragit®RS и RL, но было установлено, что такое покрытие не дает таких эффективных результатов. Растворимое в зависимости от рН покрытие из Eudragit® L100 использовалось только в многослойной системе, включающей биологически активный компонент, с внутренним амилозным покрытием и внешним покрытием из Eudragit® L100.
Другая композиция покрытия на основе амилозы раскрыта в WO-A-99/21536 (BTG International Limited). Композиция покрытия включает смесь амилозы и водонерастворимого пленкообразующего полимера, образованного из водонерастворимого целлюлозного или акрилатного полимерного вещества. Как и в EP-A-0502032, ясно, что разложение целлюлозного материала in vivo, по существу, не зависит от pH, и, предпочтительно, что это также верно для акрилатных материалов. По-видимому, в описании PCT заявки содержится опечатка, поскольку там указывается, что предпочтительным типом акрилатного материала является “Eudragit L, разложение которого не зависит от pH”. Предполагается, что это относится к “Eudragit® RL”, разложение которого действительно не зависит от pH. Это не может относиться к Eudragit® L, поскольку разложение этого полимера зависит от pH.
В WO-A-99/25325 (BTG International Limited) также раскрывается обеспечивающее отсроченное высвобождение покрытия, включающее амилозу и (предпочтительно) этилцеллюлозу или, альтернативно, акрилатный полимер, разложение которого не зависит от pH. Композиция покрытия также включает пластификатор, а способ находит конкретное применение при приготовлении дозированных форм, включающих активные вещества, нестабильные при температурах выше 60°C, поскольку композицию получают при более низких температурах. Должно быть отмечено, что этот источник также содержит указанную выше опечатку, касающуюся Eudragit® L.
Авторы настоящего изобретения обращают внимание, что в лекарственных формах, раскрытых в источниках BTG, рассмотренных выше, используют покрытия из амилозы, а не из крахмала, и что замедленное высвобождение из лекарственных форм поддерживается в части кишечника.
В WO-A-03/068196 (Alizyme Theraputics Ltd) раскрывается покрытие, обеспечивающее конкретное отсроченное высвобождение для биологически активного компонента, преднизолона натрий метасульфобензоат, включающего стекловидную амилозу, этилцеллюлозу и дибутилсебакат.
Применение полисахаридов, отличных от аморфной амилозы, в обеспечивающем отсроченное высвобождение покрытии раскрыто в GB-A-2367002 (British Sugar PLC). Примеры включают гуаровую камедь, камедь карайи, трагантовую и ксантановую камеди. Микрочастицы таких полисахаридов распределены в водонерастворимой матрице пленкообразующего полимера, которая образована, например, из производного целлюлозы, акрилового полимера или лигнина.
В WO-A-01/76562 (Tampereen Patenttitoimisto Oy) раскрывается пероральная фармацевтическая лекарственная форма, содержащая лекарственное средство и хитозан (полисахарид, полученный из хитина) для контроля его высвобождения. Лекарственное средство и хитозан смешивают в однородную механическую сухую смесь, которую гранулируют и затем, при необходимости, таблетируют. Грануляция может быть выполнена с энтеросолюбильным полимером (таким как сополимер метакриловой кислоты), или на гранулы может быть нанесено пористое энтеросолюбильное покрытие.
В WO-A-2004/052339 (Salvona LLC) раскрывается pH-зависимая система высвобождения лекарственного средства, которая представляет собой сыпучий порошок твердых гидрофобных наносфер, включающих лекарственное средство, инкапсулированных в pH-чувствительные микросферы. Наносферы формируют из комбинации лекарственного средства с восковым материалом и образуют pH-чувствительную микросферу из pH-чувствительного полимера (такого как полимер Eudragit®) в комбинации с чувствительным к воде веществом, таким как полисахарид. Настоящая заявка, однако, предполагает, что очень малые размеры частиц, указанные в этом источнике, на практике не обеспечивают задержку высвобождения биологически активного ядра вне желудка или двенадцатиперстной кишки.
В статье в European Journal of Pharmaceutical Sciences (Akhgari et al, 28, March 2006, 307-314) сообщается о результатах исследований при использовании некоторых полиметакрилатных полимеров для контроля, inter alia, набухания инулина. Исследуемыми полиметакрилатными полимерами являлись Eudragit® RS, Eudragit® RL, 1:1 смесь Eudragit® RS и Eudragit® RL; Eudragit® FS и 1:1 смесь Eudragit® RS и Eudragit® S. В результатах было показано, что полимерные композиции, включающие полиметакрилаты, обеспечивающие замедленное высвобождение, (Eudragit® RS и Eudragit® RL, pH нечувствительные полимеры) с инулином, показали профили набухания, пригодные для использования в качестве покрытий для высвобождения в толстой кишке. Тем не менее, в других результатах было показано, что полимерные композиции, включающие инулин как с Eudragit® FS, так и с 1:1 смесью Eudragit® RS и Eudragit® S (pH зависимые полимеры), не подходили для использования в таком качестве из-за нежелательных профилей набухания.
В US-A-5422121 (Rohm GmbH) раскрывается пероральная дозированная форма, содержащая по меньшей мере один активный ингредиент, заключенный в покрывающий материал, включающий полисахарид, разлагающийся в толстой кишке. Покрывающий материал содержит пленкообразующий полимер в смеси с полисахаридом. Массовое соотношение полисахарида и пленкообразующего полимера составляло от 1:2 до 5:1, предпочтительно от 1:1 до 4:1. Примеры подходящих полисахаридов включают такие полисахариды, которые являются расщепляемыми гликозидными ферментами. Полисахариды, содержащие значительные количества предпочтительно приблизительно от 20 масс.% до 100 масс.% галактозных и маннозных остатков, являются подходящими, и наиболее предпочтительными являются камедь бобов рожкового дерева и гуаровая камедь. Предпочтительные пленкообразующие полимеры включают акрилатные pH-независимые полимеры (нерастворимые по всему ЖК тракту) и pH-зависимые (нерастворимые в желудочном соке, но растворимые в кишечном соке при pH 5,5 или выше). Указанный документ иллюстрирует применение смеси гуаровой камеди с любым из Eudragit RL 30 D (при соотношении 4:1), Eudragit® L 30 D (при соотношении 3:1) или Eudragit® S 100 (при соотношении 2,5:1) в качестве покрытий для таблеток.
Статья в European Journal of Pharmaceutical Sciences (Krogars et al, 17, (2002), 23-30) раскрывает применение Hylon™ VII (кукурузный крахмал c увеличенным содержанием амилозы (~70 масс.%), National Starch, Germany) в качестве пленочного покрытия для таблеток, содержащих лекарственное средство (теофиллин). Растворение таблеток в кислой среде было быстрым, с растворением более чем 75% лекарственного средства в течение 15 минут. Покрытие не содержало второго пленкообразующего полимера.
В соответствии с первым аспектом настоящего изобретения обеспечивается лекарственная форма с отсроченным высвобождением, включающая частицу с ядром и покрытием ядра, где ядро включает лекарственное средство, а покрытие включает смесь первого вещества, которое чувствительно к воздействию бактерий толстой кишки, и второго вещества, которое имеет порог растворимости при приблизительно pH 5 или выше, где первое вещество включает полисахарид, выбранный из группы, состоящей из крахмала, амилозы, амилопектина, хитозана, хондроитинсульфата, циклодекстрина, декстрана, пуллулана, каррагенана, склероглюкана, хитина, курдулана и левана.
Первое вещество включает полисахарид, предпочтительно содержащий множество глюкозных остатков. Предпочтительными полисахаридами являются крахмал, амилоза или амилопектин, наиболее предпочтительным - крахмал.
Неожиданно было установлено, что недостатки, заключающиеся в набухания веществ, чувствительных к воздействию бактерий толстой кишки, например амилозы, могут контролироваться pH-зависимым веществом, растворимым при pH 5 или выше. Кроме того, авторы настоящего изобретения неожиданно установили, что покрытия, содержащие большую долю амилопектина, также обеспечивают высвобождение лекарственного средства в толстой кишке из пероральной дозированной формы.
Другое техническое преимущество по настоящему изобретению (по сравнению, например, с лекарственной формой, раскрытой в WO-A-01/76562) заключается в том, что, по существу, отсутствует высвобождение лекарственного средства в течение продолжительного периода времени (то есть пока покрытие растворяется), с последующим относительно быстрым высвобождением лекарственного средства. Это является отличием по сравнению с гомогенными таблеткам, профиль высвобождения лекарственного средства из которых плавный с самого начала, а не отсроченный или пульсирующий.
Специалист в данной области способен определить, подвержен ли материал воздействию бактерий толстой кишки, с помощью методов, известных из уровня техники. Например, можно провести анализ заранее измеренного количества данного вещества, подвергнув его обработке ферментами бактерий из толстой кишки и измерив изменение массы вещества с течением времени.
Предпочтительным полисахаридом является крахмал. Крахмалы обычно получают из природных источников, таких как злаки, бобы и клубни. Подходящие крахмалы, используемые в настоящем изобретении, обычно представляют собой пищевые крахмалы и включают рисовый крахмал, пшеничный крахмал, кукурузный (или маисовый) крахмал, крахмал гороха, картофельный крахмал, крахмал батата, крахмал тапиоки, крахмал сорго, крахмал саго и крахмал из корней маранта. В примерах ниже показано применение кукурузного крахмала.
Фактически крахмал представляет собой смесь двух различных полисахаридов, а именно амилозы и амилопектина. Различные крахмалы могут иметь различные соотношения этих двух полисахаридов. Большинство природных (немодифицированных) кукурузных крахмалов содержат от приблизительно 20 масс.% до приблизительно 30 масс.% амилозы, а остальное по меньшей мере по существу составляет амилопектин. Крахмалы, пригодные для использования по настоящему изобретению, обычно содержат по меньшей мере 0,1 масс.%, например, по меньшей мере 10% или 15%, предпочтительно, по меньшей мере 35 масс.% амилозы. Крахмалы с высоким содержанием амилозы представляют собой крахмалы, содержащие по меньшей мере 50 масс.% амилозы. Особенно подходящие крахмалы содержат от приблизительно 65 масс.% до приблизительно 75 масс.%, например, приблизительно 70 масс.% амилозы.
Крахмалы, пригодные для использования в настоящем изобретении, могут содержать до 100% амилопектина, обычно от приблизительно 0,1 масс.% до приблизительно 99,9 масс.% амилопектина. Подходят также крахмалы с низким содержанием амилозы, то есть крахмалы, содержащие не более чем 50 масс.% амилозы и по меньшей мере 50 масс.% амилопектина, например до 75 масс.% амилопектина и даже до 99 масс.% амилопектина. Крахмал может быть, например, немодифицированным восковым кукурузным крахмалом. Он обычно включает приблизительно 100% амилопектина. Крахмал с низким содержанием амилозы, как ожидалось, не является подходящим, поскольку крахмал с низким содержанием амилозы обычно разрушается панкреатическими ферментами в тонкой кишке. Предпочтительные крахмалы содержат не более чем 50 масс.% амилопектина. Особенно подходящие крахмалы содержат от приблизительно 25 масс.% до приблизительно 35 масс.% амилопектина, например, приблизительно 30 масс.% амилопектина.
Специалист в данной области способен определить относительные доли амилозы и амилопектина в любом данном крахмале. Например, можно использовать спектроскопию в ближней инфракрасной области (“NIR”) для определения содержания амилозы и амилопектина в крахмале, используя калибровочные кривые, полученные посредством NIR для лабораторных смесей известных количеств этих двух компонентов. Кроме того, крахмал может быть гидролизован до глюкозы амилоглюкозидазами. Ряд реакций фосфорилирования и окисления, катализируемых ферментами, приводит к образованию восстановленного никотинамидадениндинуклеотидфосфата (“NADPH”). Количество полученного NADPH стехиометрично первоначальному содержанию глюкозы. Для этого исследования существуют тестовые наборы (например, R-Biopharm GmbH, Germany). Другой способ, который можно использовать, включает воздействие на покрытие бактериальных ферментов, например α-амилазы, для получения короткоцепочечных жирных кислот (“SCFA”), количество которых определяют газожидкостной хроматографией, используя капиллярную колонку.
Предпочтительные крахмалы содержат амилозу в стекловидной форме, хотя в соответствии с настоящим изобретением также может быть использована амилоза в аморфной форме.
Предпочтительными крахмалами являются «готовые» крахмалы, то есть такие крахмалы, которые не требуют обработки перед использованием в соответствии с настоящим изобретением. Примеры особенно подходящих крахмалов с высоким содержанием амилозы включают Hylon™ VII (National Starch, Germany) или Eurylon™ 7 (Roquette, Lestrem, France) или Amylogel 03003 (Cargill, Minneapolis, USA), каждый из перечисленных является примером кукурузного крахмала, содержащего приблизительно 70 масс.% амилозы.
Настоящее изобретение включает применение второго вещества с растворимостью, зависящей от pH. Второе вещество имеет “порог pH”, который представляет собой такое значение pH, ниже которого оно нерастворимо, а при этом значении или более оно растворимо. pH окружающей среды регулирует растворение второго вещества. Таким образом, второе вещество не растворяется (или по существу не растворяется) при рН ниже указанного порога. Как только pH окружающей среды достигнет (или превысит) порога pH, то второе вещество становится растворимым. "Нерастворимый" означает, что для 1 г второго вещества требуется более чем 10000 мл растворителя (окружающей среды) для растворения при данном pH. "Растворимый" означает, что для 1 г второго вещества требуется меньше чем 10000 мл, предпочтительно, меньше чем 5000 мл, более предпочтительно, меньше чем 1000 мл, наиболее предпочтительно, меньше чем 100 мл или 10 мл растворителя для растворения при данном pH. Предпочтительно, окружающая среда означает среду желудочно-кишечного тракта, такую как желудочный сок или кишечный сок. Альтернативно, окружающая среда может представлять собой среду, in vitro эквивалентную среде желудочно-кишечного тракта.
Нормальный pH желудочного сока обычно составляет от 1 до 3. Второе вещество нерастворимо при pH менее 5 и растворимо при pH приблизительно 5 или выше и, таким образом, обычно нерастворимо в желудочном соке. Такое вещество может быть названо "энтеросолюбильным" веществом.
Второе вещество растворимо при pH 5 или выше, например, в кишечном соке. pH кишечного сока постепенно увеличивается от приблизительно 6 в двенадцатиперстной кишке до приблизительно 7-8 в толстой кишке. Второе вещество предпочтительно нерастворимо ниже pH 6,5 (и растворимо при приблизительно pH 6,5 или выше) и, более предпочтительно, нерастворимо ниже pH 7 (и растворимо при приблизительно pH 7 или выше).
Порог pH, при котором вещество становится растворимым, может быть определен методом простого титрования, который известен специалисту в данной области из уровня техники.
Второе вещество обычно представляет собой пленкообразующее полимерное вещество, такое как акрилатный полимер, целлюлозный полимер или поливиниловый полимер. Примеры подходящих целлюлозных полимеров включают ацетатфталатцеллюлозы (“CAP”), тримеллитатацетатцеллюлозы (“CAT”) и сукцинатацетатгидроксипропилметилцеллюлозы. Примеры подходящих поливиниловых полимеров включают поливинилацетатфталат (“PVAP”).
Второе вещество предпочтительно представляет собой сополимер (мет)акриловой кислоты и C1-4-алкильного эфира (мет)акриловой кислоты, например, сополимер метакриловой кислоты и метилового эфира метакриловой кислоты. Такой полимер известен как поли(метакриловая кислота/метилметакрилат) сополимер. Подходящими примерами таких сополимеров являются обычно анионные и не обеспечивающие длительного высвобождения полиметакрилаты. Соотношение карбоксильных групп к метильным сложноэфирным группам (“соотношение кислота:эфир”) у этих сополимеров определяет pH, при котором сополимер растворим. Соотношение кислота:эфир может составлять от приблизительно 2:1 до приблизительно 1:3, например, приблизительно 1:1 или предпочтительно приблизительно 1:2. Молекулярная масса (“MW”) предпочтительных анионных сополимеров обычно составляет приблизительно от 120000 до 150000, предпочтительно приблизительно 135000.
Предпочтительные анионные поли(метакриловая кислота/метилметакрилат) сополимеры включают Eudragit® L (соотношение кислота:эфир приблизительно 1:1, молекулярная масса приблизительно 135000, порог pH приблизительно 6,0), Eudragit® S (соотношение кислота:эфир приблизительно 1:2, молекулярная масса приблизительно 135000, порог pH приблизительно 7), и Eudragit® FS (поли(метилакрилат/метилметакрилат/метакриловая кислота), соотношение кислота:эфир приблизительно 1:10, молекулярная масса приблизительно 220000, порог pH приблизительно 7).
Второе вещество может быть сополимером метакриловой кислоты и этилакрилата. Eudragit® L100-55 поли(метакриловая кислота/этилакрилат), соотношение кислота:эфир приблизительно 1:1, молекулярная масса приблизительно 250000, порог pH приблизительно 5,5 является подходящим. Сополимеры Eudragit® изготовлены и/или распространяются Degussa AG, Darmstadt, Germany.
Могут быть использованы подходящие смеси пленкообразующих полимерных веществ. Пример подходящей смеси может включать смесь, например, смесь 1:1, Eudragit® L и Eudragit® S. Однако предпочтительным является применение только конкретного пленкообразующего полимерного вещества, например, поли(метакриловая кислота/метилметакрилат).
Наиболее предпочтительным является применение только Eudragit® S в качестве второго вещества.
В предпочтительном варианте выполнения изобретения было обнаружено, что смесь двух подходящих полимеров в соответствующем отношении, применяемом в качестве пленочного покрытия на ядре, по меньшей мере минимизирует и может по существу исключить высвобождение лекарственного средства в желудке и тонкой кишке. Полагают, что последующее высвобождение лекарственного средства в толстой кишке обеспечивается совместным действием активных физиологических механизмов: то есть растворением второго вещества, в частности Eudragit® S, и ферментацией первого вещества, например, крахмала или амилозы.
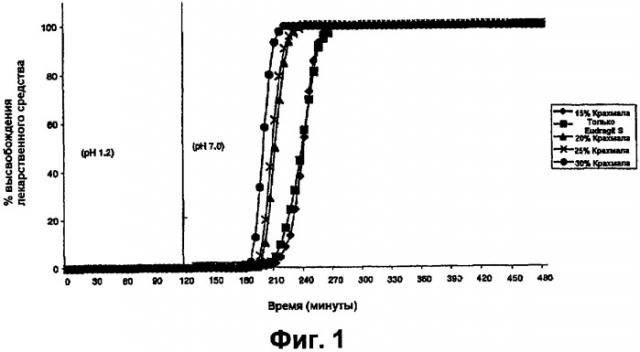
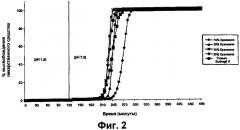
Соотношение первого вещества и второго вещества обычно составляет менее чем 99:1 и может в некоторых случаях быть до 50:50. Соотношение обычно составляет до 35:65 и предпочтительно составляет от 15:85 до 35:65, например, от 15:85 до 30:70. Авторы настоящего изобретения установили, что соотношение первого вещества и второго вещества, составляющее от приблизительно 25:75 до приблизительно 35:65, например, приблизительно 30:70, является особенно подходящим для целевого высвобождения лекарственного средства в толстой кишке, в частности, если первое вещество представляет собой крахмал, а второе вещество представляет собой Eudragit® S. Смесь первых и вторых веществ предпочтительно является по существу однородной.
В случае необходимости обычные добавки, такие как пластификаторы для пленкообразования (например, триэтилцитрат) и вещества, препятствующие прилипанию (такие как глицерилмоностеарат), могут быть добавлены в количестве до 30% от общей массы полученной композиции полимерного покрывающего препарата.
Толщина покрытия частицы обычно составляет от приблизительно 10 мкм до приблизительно 150 мкм. Однако толщина конкретного покрытия будет зависеть от композиции покрытия. Например, толщина покрытия прямо пропорциональна количеству полисахарида в покрытии. Таким образом, в вариантах выполнения изобретения, где покрытие включает крахмал с высоким содержанием амилозы и Eudragit™ S при соотношении приблизительно 30:70, толщина покрытия может составлять от приблизительно 70 мкм до приблизительно 130 мкм, и предпочтительно от приблизительно 90 мкм до приблизительно 110 мкм. Толщина (в мкм) для данной композиции покрытия не зависит от размера ядра.
Толщину покрытия также можно измерять посредством “теоретического привеса” (“TWG”) покрытой лекарственной формы. TWG для настоящей лекарственной формы зависит от ряда факторов, включая композицию покрытия и размер ядра, которое будет покрыто. Например, в вариантах выполнения изобретения, где ядро представляет собой пеллету (например, с диаметром приблизительно 8 мм), а покрытие включает крахмал с высоким содержанием амилозы и Eudragit™ S (например, при соотношении приблизительно 30:70), то TWG обычно составляет от приблизительно 4% до приблизительно 12%, например, от приблизительно 5% до приблизительно 10%, предпочтительно от приблизительно 8% до приблизительно 9%. В вариантах выполнения изобретения, где ядро представляет собой пеллету (например, с диаметром приблизительно 1 мм), и с покрытием того же состава, TWG может составлять от приблизительно 15% до приблизительно 35%, например, от приблизительно 20% до приблизительно 30%, предпочтительно приблизительно 25%.
При указании того, что покрытие включает смесь первых и вторых веществ, подразумевается, что исключаются известная многослойная дозированная форма (раскрытая, например, в упомянутом выше Milojevic et al.), в которой активное ядро покрывается сначала внутренним слоем амилозы, а затем внешним слоем Eudragit® L100. В рамках настоящего изобретения такая многослойная дозированная форма не включает смесь крахмала и Eudragit® L100. Покрытие предпочтительно представляет собой единый слой смеси первого и второго вещества, предпочтительно в однородной смеси.
Тем не менее, лекарственная форма по настоящему изобретению может иметь дополнительный слой между активным ядром и слоем, включающим композицию, обеспечивающую отсроченное высвобождение по настоящему изобретению, и/или наружный слой, покрывающий слой композиции, обеспечивающей отсроченное высвобождение по настоящему изобретению. Например, если слой композиции, обеспечивающей отсроченное высвобождение, включает смесь Eudragit®L и крахмала, то предпочтительно нанесение наружного слоя покрывающего pH зависимого вещества с порогом pH приблизительно 7, например, предпочтительным может быть Eudragit® S. В предпочтительных вариантах выполнения изобретения покрытие, обеспечивающее отсроченное высвобождение, по настоящему изобретению наносится непосредственно на активное ядро, то есть дополнительный слой между этим покрытием и активным ядром отсутствует. Обеспечивающее отсроченное высвобождение покрытие по настоящему изобретению предпочтительно представляет собой внешнее покрытие лекарственной формы. Было установлено, что композиция с отсроченным высвобождением не требует дополнительного наружного слоя.
Композиция, предпочтительно образующая покрытие вокруг биологически активного компонента, наиболее предпочтительно представляет собой смесь крахмала и Eudragit® S. Обычно "биологически активный компонент" представляет собой ядро, включающее лекарственное средство.
Лекарственная форма включает по меньшей мере одну частицу с ядром и покрытием для ядра. Лекарственная форма может включать любую подходящую покрытую пероральную дозированную форму, включая капсулы, таблетки, мини-таблетки, пеллеты, гранулы и кристаллы.
Как правило, минимальный диаметр каждой частицы составляет по меньшей мере приблизительно 10-4 м, обычно по меньшей мере приблизительно 5x10-4 м и предпочтительно по меньшей мере приблизительно 10-3 м. Максимальный диаметр обычно составляет не больше чем 30 мм, обычно не больше чем 20 мм и, предпочтительно, не больше чем 10 мм. В предпочтительном варианте выполнения изобретения диаметр частицы составляет от приблизительно 0,2 мм до приблизительно 15 мм, предпочтительно от приблизительно 1 мм до приблизительно 4 мм (например, для пеллеты или мини-таблетки) или от приблизительно 6 мм до приблизительно 12 мм (например, для некоторых таблеток или капсул). Термин "диаметр" относится к наибольшему линейному размеру частицы.
Лекарственная форма может включать множество частиц для обеспечения одной дозы лекарственного средства (средств), в частности, в вариантах выполнения изобретения, где частица представляет собой "малую" частицу, например, с диаметром менее чем 5 мм. Предпочтительны мультидозовые лекарственные формы, включающие частицы с диаметром менее 3 мм.
Настоящее изобретение применимо в лекарственной форме с многофазным высвобождением лекарственного средства, включающей по меньшей мере два типа частиц, например покрытые пеллеты в одной дозированной форме, например в капсуле, в которой частицы одного типы отличаются от частиц другого типа покрытием. Покрытия могут отличать один тип от другого толщиной покрытия или композицией, например, количественным и/или качественным составом компонентов. В частности, лекарственные формы с многофазным высвобождением лекарственного средства применимы для больных с болезнью Крона, повреждающей различные области кишечного тракта.
"Ядро" обычно представляет собой твердое тело. Ядро может состоять только из лекарственного средства (лекарственных средств) или может представлять собой гранулы годного в пищу вещества, например сахара, покрытого слоем, включающим лекарственное средство (лекарственные средства). Впрочем, чаще ядро состоит из смеси лекарственного средства (лекарственных средств) с наполнителем или разбавителем, например лактозой или целлюлозным веществом, таким как микрокристаллическая целлюлоза, связующим веществом, например поливинилпирролидоном (“PVP”), дезинтегрантом, например Ac-Di-Sol™ (то есть натрийкроскармелозой), и/или смазывающим веществом, например стеаратом магния. Ядро может представлять собой спрессованный гранулят, включающий по меньшей мере некоторые из этих веществ.
Высвобождение из лекарственных форм по настоящему изобретению отсрочено до кишечного тракта и предпочтительно толстой кишки. Высвобождение из некоторых лекарственных форм также может быть длительным. При этом в предпочтительных лекарственных формах высвобождение является пульсирующим.
Лекарственную форму обычно относят к устойчивой в желудке, если менее чем 10 масс.% лекарственного средства высвободится в течение 2 часов в кислой среде. Лекарственные формы по настоящему изобретению обычно показывают гораздо меньше, чем 10 масс.% высвобождения лекарственного средства в кислой среде, и их можно считать устойчивыми в желудке. Как правило, высвобождение из лекарственных форм составляет меньше чем 1 масс.% лекарственного средства в кислой среде, и обычно не происходит по существу какого-либо высвобождения лекарственного средства в кислых средах. При использовании комбинации крахмала с акрилатным пленкообразующим веществом для формирования покрытия для ядра обычно высвобождается менее чем 5% лекарственного средства через более чем 5 часов в условиях моделирования желудка и тонкой кишки. При использовании комбинации крахмала с целлюлозным пленкообразующим веществом для покрытия для ядра обычно высвобождается меньше чем 10% лекарственного средства через более чем 5 часов в условиях моделирования желудка и тонкой кишки.
Время от начала воздействия до условий, подходящих для высвобождения лекарственного средства и начала высвобождения лекарственного средства, обозначается как "время задержки" (лаг-период). "Время задержки" зависит от ряда факторов, включая толщину и состав покрытия. Время задержки в условиях толстой кишки лекарственных форм по настоящему изобретению обычно составляет по меньшей мере 30 минут. В большей части вариантов выполнения изобретения по настоящему изобретению время задержки составляет от приблизительно 30 минут до приблизительно 3 часов и в предпочтительных лекарственных формах время задержки составляет предпочтительно от приблизительно 45 минут до приблизительно 2 часов.
Время между началом воздействия условий, подходящих для высвобождения лекарственного средства, и полным высвобождением лекарственного средства также зависит от ряда факторов, включающих композицию покрытия и природу лекарственного средства. В большинстве вариантов выполнения настоящего изобретения это время обычно составляет не больше чем 5 часов. В предпочтительных вариантах выполнения изобретения это время обычно составляет не больше чем 4 часа.
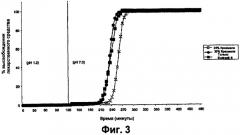
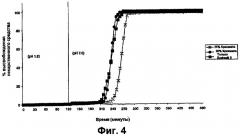
Например, в вариантах выполнения изобретения, в которых покрытие ядра таблетки толщиной от 8% до 9% TWG, где покрытие включает крахмал с высоким содержанием амилозы и Eudragit S (30:70), время между началом высвобождения и полным высвобождением может составлять меньше чем приблизительно 2 часа, предпочтительно меньше чем приблизительно 1,5 часа.
В предпочтительном варианте выполнения изобретения ядро представляет собой пеллету с диаметром приблизительно 1 мм. В другом варианте выполнения изобретения ядро представляет собой таблетку с диаметром приблизительно 8 мм. В обоих случаях покрытие предпочтительно представляет собой 30:70 смесь крахмала с высоким содержанием амилозы, например Eurylon™ 7, и акрилового полимера, например Eudragit™ S. В обоих предпочтительных вариантах выполнения изобретения толщина покрытия ядра составляет приблизительно 100 мкм, что составляет от приблизительно 8% до приблизительно 9% TWG для таблетки и от приблизительно 27% до приблизительно 32 масс.% для пеллеты.
Согласно второму аспекту настоящего изобретения обеспечивается лекарственная форма по первому аспекту для применения в способе лечения посредством терапии в теле человека или животного.
Ядро включает по меньшей мере одно лекарственное средство. В лекарственной форме обычно используют одно лекарственное средство в качестве основного терапевтически активного компонента. Тем не менее в одной лекарственной форме может быть введено более чем одно лекарственное средство.
Лекарственная форма по настоящему изобретению предназначена для применения широкого ряда лекарственных средств. Подходящие лекарственные средства включают таковые известные для кишечного введения, используемые в известных пероральных лекарственных формах с отсроченным высвобождением. В настоящем изобретении можно применять лекарственные средства с местным или системным действием.
Лекарственная форма по настоящему изобретению, в частности, применима для кишечного введения лекарственного средства, включающего по меньшей мере одну кислую группу, такую как карбоксильная группа. Такие лекарственные средства могут быть кислыми или цвиттерионными лекарственными средствами. Примером такого лекарственного средства является 5-аминосалициловая кислота (“5-ASA”).
Выбор лекарственного средства (лекарственных средств) в лекарственной форме очевидно зависит от состояния, которое лечат. В связи с этим лекарственная форма, в частности, применима при лечении IBD (включая болезнь Крона и неспецифический язвенный колит), IBS, запора, диареи, инфекции и рака, особенно рака толстой кишки или колоректального рака).
Для лечения или профилактики IBD лекарственная форма может включать по меньшей мере одно лекарственное средство, выбранное из группы, состоящей из противовоспалительных средств (например, 5-ASA), стероидов (например преднизолона, будезонида или флутиказона), иммуносупрессоров (например, азатиоприна, циклоспорина и метотрексата) и антибиотиков.
Для лечения или профилактики рака лекарственная форма может включать по меньшей мере одно противоопухолевое средство. Подходящие противоопухолевые средства включают фторурацил, метотрексат, дактиномицин, блеомицин, этопозид, таксол, винкристин, доксорубицин, цисплатин, даунорубицин, VP-16, ралтитрексед, оксалиплатин и их фармакологическ