Многокомпонентная иммуногенная композиция для предупреждения заболевания, вызванного -гемолитическими стрептококками (бгс)
Иллюстрации
Показать всеИзобретение раскрывает ряд полинуклеотидов и полипептидов β-гемолитических стрептококков, в частности полипептиды и полинуклеотиды Streptococcus pyogenes, и иммуногенные композиции на их основе, используемые для предупреждения или уменьшения симптомов колонизации или инфекции, вызванной β-гемолитическим стрептококком. Иммуногенная композиция (варианты) содержит смесь двух или более полипептидов, кодируемых последовательностью нуклеиновой кислоты (НК), имеющей по меньшей мере 90% идентичность последовательности НК, выбранной из группы, состоящей из пептидазы С5а (SCP), открытой рамки считывания (ОРС)554, ОРС 1218, ОРС 1358 и ОРС 2459. Один из вариантов иммуногенной композиции содержит полипептид SCP, полипептид пептидилпропилизоиомеразу и по меньшей мере один другой полипептид. Также раскрыты способы защиты восприимчивого млекопитающего от колонизации или инфекции, вызванной β-гемолитическим стрептококком, путем иммунизации иммуногенной композицией по изобретению. Изобретение обеспечивает иммуногенные композиции и способы для предупреждения или уменьшения симптомов инфекций, вызванных β-гемолитическими стрептококками группы А, В, С и G, а также обеспечивают иммунитет к широкому спектру бактерий БГС. 9 н. и 32 з.п. ф-лы, 16 ил., 2 табл., 3 пр.
Реферат
Область изобретения
Это изобретение в целом относится к полипептидам и полинуклеотидам β-гемолитических стрептококков (БГС), в частности полипептидам и полинукпеотидам Streptococcus pyogenes, и их применению в многокомпонентных иммуногенных композициях для предупреждения заболевания, вызванного БГС. Более конкретно, изобретение относится к полипептидам Streptococcus pyogenes, которые локализованы на поверхности. Изобретение дополнительно относится к иммуногенным композициям и способам иммунизации против инфекции, вызванной β-гемолитическими стрептококками, и ослабления такой инфекции, включающим комбинацию двух или более полипептидов.
Предшествующий уровень техники
Традиционные фенотипические критерии классификации стрептококков включают как гемолитические реакции, так и серологическое типирование по Лэнсфилд. Однако с развитием таксономии стало известно, что неродственные виды β-гемолитических (определяемых по полному лизису эритроцитов овец на чашках с агаром) стрептококков (БГС) могут продуцировать идентичные антигены по Лэнсфилд, и что штаммы, генетически родственные на уровне вида, могут иметь гетерогенные антигены по Лэнсфилд. Несмотря на эти исключения из традиционных правил таксономии стрептококков, гемолитические реакции и серологические тесты по Лэнсфилд все еще могут быть использованы для разделения стрептококков на основные группы в качестве первой стадии при идентификации клинических изолятов (Ruoff, K.L, R.A.Whiley, and D. Beighton. 1999. Streptococcus. In P.R.Murray, E.J.Baron, M.A.Pfaller, F.C.Tenover, and R.H.Yolken (eds.), Manual of Clinical Microbiology. American Society of Microbiology Press, Washington D.C.).
Изоляты β-гемолитического стрептококка с групповыми антигенами А, С или G по Лэнсфилд могут быть подразделены на две группы: микроорганизмы, образующие крупные колонии (>0,5 мм в диаметре) и мелкие колонии (<0,5 мм в диаметре). Образующие крупные колонии штаммы групп A (Streptococcus pyogenes), С и G являются "пиогенными" стрептококками с множеством эффективных механизмов вирулентности. Streptococcus agalactiae (группа В) достоверно идентифицируют еще по продуцированию им группового антигена В по Лэнсфилд или по другим фенотипическим особенностям.
Сходства между видами БГС включают не только факторы вирулентности, но также и проявления заболеваний. Последние включают пневмонию, артрит, абсцессы, ринофарингит, метрит, послеродовой сепсис, неонатальную септицемию, раневые инфекции, менингит, перитонит, целлюлит, пиодермию, некротизирующий фасцит, синдром токсического шока, септицемию, инфекционный эндокардит, перикардит, гломерулонефрит и остеомиелит.
Streptococcus pyogenes являются грамположительными диплококками, которые колонизируют глотку и кожу людей, участки, которые затем служат первичным резервуаром для этого организма. Как облигатный паразит эта бактерия переносится либо посредством прямого контакта с респираторными секретами, либо по схеме из рук в рот. Большинство инфекций, вызванных Streptococcus pyogenes, являются сравнительно легкими заболеваниями, такими как фарингит или импетиго. В настоящее время зафиксировано от двадцати до тридцати пяти миллионов случаев фарингита только в США, обходящихся примерно в 2 миллиарда долларов, затрачиваемых на визиты врачей и другие связанные с этим расходы. Кроме того, негнойные осложнения, такие как ревматическая лихорадка, скарлатина и гломерулонефрит, являются результатом инфекций, вызванных Streptococcus pyogenes. В мировом масштабе острая ревматическая лихорадка (ОРЛ) является самой распространенной причиной детской болезни сердца (1997. Case definitions for Infectious Conditions Under Public Health Surveillance. CDC.).
Из первоначальных входных ворот, глотки и кожи, Streptococcus pyogenes может диссеминировать в другие части организма, где бактерии обычно не встречаются, например, кровь, глубокая мышечная и жировая ткань или легкие, и может вызывать инвазивные инфекции. Две из наиболее тяжелых, но наименее распространенных форм инвазивного заболевания, вызванного Streptococcus pyogenes, представляют собой некротизирующий фасцит и синдром стрептококкового токсического шока (ССТШ). Некротизирующий фасцит (описанный в средствах массовой информации как вызываемый "плотоядными бактериями") представляет собой деструктивную инфекцию мышечной и жировой ткани. ССТШ представляет собой быстро прогрессирующую инфекцию, вызывающую шок и повреждение внутренних органов, таких как почки, печень и легкие. Большая часть этого повреждения происходит в результате токсемии, а не локального повреждения вследствие бактериального роста.
В 1995 инвазивные инфекции, вызванные Streptococcus pyogenes, и ССТШ стали заболеваниями, подлежащими обязательной регистрации. В отличие от миллионов индивидуумов, которые заболевают фарингитом и импетиго, отчет центров по контролю и профилактике заболеваний в США (CDC) о регистрируемых случаях показывает, что в 1997 году зарегистрировано от 15000 до 20000 случаев инвазивного заболевания, вызванного Streptococcus pyogenes, в Соединенных Штатах, приводя к более чем 2000 случаев со смертельным исходом (1997. Case definitions for Infectious Conditions Under Public Health Surveillance. CDC.). В других отчетах подсчитано, что инвазивное заболевание составляет до 10-20 случаев на 100000 индивидуумов в год (Stevens, D.L. 1995. Streptococcal toxic-shock syndrome: spectrum of disease, pathogenesis, and new concepts in treatment. Emerg Infect Dis. 1:69-78). Более конкретно, из 15000-20000 случаев инвазивного заболевания 1100-1500 являются случаями некротизирующего фасцита и 1000-1400 являются случаями ССТШ, с коэффициентом смертности 20% и 60% соответственно. Также в тяжелое инвазивное заболевание включены случаи миозита, который приводит к коэффициенту смертности от 80% до 100%. Дополнительные 10%-15% индивидуумов умирают от других форм инвазивного заболевания, вызванного стрептококками группы А. Эти числа возросли с 1995 года, когда были введены отчеты о случаях заболевания, и отражают общую тенденцию, которая имеет место на протяжении последнего десятилетия или двух. Кроме того, по общему мнению, строгость критериев при выявлении случаев заболевания приводит к заниженному и, таким образом, ошибочному числу, поскольку многие случаи успешно разрешаются благодаря ранней диагностике и лечению до того, как проведена идентификация.
Хотя Streptococcus pyogenes остается чувствительным к пенициллину и его производным, лечение не всегда уничтожает этот организм. Приблизительно от 5% до 20% населения являются носителями в зависимости от сезона (Stevens, D.L. 1995. Streptococcal toxic-shock syndrome: spectrum of disease, pathogenesis, and new concepts in treatment. Emerg Infect Dis. 1:69-78), несмотря на антибиотикотерапию. Причины этого не вполне ясны и могут включать множество механизмов. В случаях тяжелых инвазивных инфекций лечение часто требует агрессивного оперативного вмешательства. Для этих случаев, включающих ССТШ или родственное заболевание, клиндамицин (ингибитор синтеза белка) является предпочтительным антибиотиком, так как он хорошо проникает в ткани и предотвращает выработку экзотоксина. Имеются сообщения о некоторой резистентности к тетрациклину, сульфамидным препаратам и, совсем недавно, эритромицину. Очевидно, что остается потребность в композициях для предупреждения и лечения инфекции, вызванной бета-гемолитическим стрептококком.
Идентифицированы многочисленные факторы вирулентности Streptococcus pyogenes, некоторые секретируемые, а некоторые локализованы на поверхности. Хотя он инкапсулирован, капсула состоит из гиалуроновой кислоты и не подходит в качестве антигена-кандидата для включения в иммуногенные композиции, так как обычно экспрессируется клетками млекопитающих и является неиммуногенной (Dale, J.В., R.G.Washburn, M.В.Marques, and M.R.Wessels. 1996. Hyaluronate capsule and surface M protein in resistance to opsonization of group A streptococci. Infect Immun. 64:1495-501). T-антиген и групповой углевод являются другими кандидатами, но могут также вызывать образование перекрестных антител к ткани сердца. Липотейхоевая кислота присутствует на поверхности Streptococcus pyogenes, но индуцирует факторы опасности аналогичные ЛПС (липополисахариду).
Наиболее распространенные поверхностные белки принадлежат к семейству белков, называемых М или «М-подобные» белки из-за их структурного сходства. Хотя члены этого класса имеют сходные биологические роли в ингибировании фагоцитоза, каждый из них обладает уникальными свойствами субстратного связывания. Наиболее охарактеризованным белком этого семейства является спиральный М-белок. Было показано, что антитела к гомологичным М штаммам являются опсоническими и защитными (Dale, J.В., R.W.Baird, H.S.Courtney, D.L.Hasty, and М.S.Bronze. 1994. Passive protection of mice against group A streptococcal pharyngeal infection by lipoteichoic acid. J Infect Dis. 169:319-23, Dale, J.В., М.Simmons, E.C.Chiang, and E.Y.Chiang. 1996. Recombinant, Ellen, R.P., and R.J.Gibbons. 1972. M protein-associated adherence of Streptococcus pyogenes to epithelial surfaces: prerequisite for virulence. Infect Immun. 5:826-830). Сложность использования М-белка в качестве антигена-кандидата состоит в том, что существует приблизительно 100 различных идентифицированных серотипов по М-белку при еще нескольких нетипированных. Типично, М-серотипы класса I, представленные серотипами М1, М3, М6, М12 и М18, ассоциированы с фарингитом, скарлатиной и ревматической лихорадкой и не экспрессируют белки, связывающие иммуноглобулины. М-серотипы класса II, такие как М2 и М49, ассоциированы с кожными инфекциями более распространенной локализации и осложнениями гломерулонефрита и экспрессируют белки, связывающие иммуноглобулины (Podbielski, A., A.Flosdorff, and J.Weber-Heynemann. 1995. The group A streptococcal virR49 gene controls expression of four structural vir regulon genes. Infect Immun. 63:9-20). Важно отметить, что существует небольшая, если вообще существует, гетерологичная перекрестная реактивность антител к М-серотипам. Не менее важна и та роль, которую эти антитела играют при ревматической лихорадке. Специфические участки М-белка вызывают образование антител, которые перекрестно реагируют с тканью сердца хозяина, вызывая или по меньшей мере внося вклад в повреждение клеток (Cunningham, М.W., and A. Quinn. 1997. Immunological crossreactivity between the class I epitope of streptococcal M protein and myosin. Adv Exp Med Biol. 418:887-921, Quinn, A., K Ward, V.A.Fischetti, M.Hemric, and M.W.Cunningham. 1998. Immunological relationship between the class I epitope of streptococcal M protein and myosin. Infect Immun. 66:4418-24).
M и М-подобные белки принадлежат большому семейству поверхностных белков, которые характеризуются специфичным к сортазе мотивом LPXTG (Mazmanian, S.К., G.Liu, H.Ton-That, and O.Schneewind. 1999. Staphylococcus aureus sortase, an enzyme that anchors surface proteins to the cell wall. Science. 285:760-3, Ton-That, H., G.Liu, S.K.Mazmanian, K.F.Faull, and O.Schneewind. 1999. Purification and characterization of sortase, the transpeptidase that cleaves surface proteins of Staphylococcus aureus at the LPXTG motif. Proc Natl Acad Sci USA. 96:12424-12429). Этот мотив, расположенный вблизи карбокси-конца белка, сначала расщепляется сортазой между треониновым и глициновым остатками мотива LPXTG. Сразу после расщепления белок ковалентно присоединяется через карбоксильную группу треонина к свободной аминогруппе аминокислотного поперечного мостика в пептидогликане, тем самым происходит необратимое присоединение белка к поверхности бактериальной клетки. В это семейство специфичных к сортазе белков включены: пептидаза С5а (Chen, С.С., and P.P.Cleary. 1989. Cloning and expression of the streptococcal С5а peptidase gene in Escherichia соli: linkage to the type 12 M protein gene. Infect. Immun. 57:1740-1745, Chmouryguina, I., A.Suvorov, P.Ferrieri, and P.P.Cleary. 1996. Conservation of the С5а peptidase genes in group A and В streptococci. Infect. Immun. 64:2387-2390), адгезины для фибронектина (Courtney, H.S., Y.Li, J.B.Dale, and D.L.Hasty. 1994. Cloning, sequencing, and expression of a fibronectin/fibrinogen-binding protein from group A streptococci. Infect Immun. 62:3937-46, Fogg, G.C., and M.G.Caparon. 1997. Constitutive expression of fibronectin binding in Streptococcus pyogenes as a result ofanaerobic activation of rofA. J Bacteriol. 179:6172-80, Hanski, E., and M. Caparon. 1992. Protein F, a fibronectin-binding protein, is an adhesion of the group A streptococcus Streptococcus pyogenes. Proc Natl Acad Sci., USA. 89:6172-76, Hanski, E., P.A.Horwitz, and M.G.Caparon. 1992. Expression of protein F, the fibronectin-binding protein of Streptococcus pyogenes JRS4, in heterologous streptococcal and enterococcal strains promotes their adherence to respiratory epithelial cells. Infect Immun. 60:5119-5125), витронектин и коллаген IV типа, и другие М-подобные белки, которые связывают плазминоген, IgA (иммуноглобулин A), IgG (иммуноглобулин G) и альбумин (Kihiberg, В.M., M. Collin, A. Olsen, and L. Bjorck. 1999. Protein H, an antiphagocytic surface protein in Streptococcus pyogenes. Infect Immun. 67:1708-14).
Описаны многочисленные секретируемые белки, некоторые из которых, как считают, являются токсинами. Большинство изолятов Streptococcus pyogenes от больных с тяжелым инвазивным заболеванием и синдромом стрептококкового токсического шока (ССТШ) продуцируют стрептококковые пиогенные экзотоксины (SPE) А и С (Cockerill, F.R., 3rd, R.L.Thompson, J.M.Musser, Р.M.Schlievert, J.Talbot, K.E.Holley, W.S.Harmsen, D.M.llstrup, P.C.Kohner, M.H.Kirn, B.Frankfort, J.M.Manahan, J.M.Steckelberg, F.Roberson, and W.R.Wilson. 1998. Molecular, serological, and clinical features of 16 consecutive cases of invasive streptococcal disease. Southeastern Minnesota Streptococcal Working Group. Clin Infect Dis. 26:1448-58). Также были идентифицированы и охарактеризованы другие пиогенные экзотоксины в геномной последовательности Streptococcus pyogenes, расшифрованной в университете Оклахомы, переданной в банк генов GenBank и которой присвоен номер доступа АЕ004092 (Proft, Т., S. Louise Moffatt, С.J. Berkahn, and J. D. Fraser. 1999. Identification and Characterization of Novel Superantigens from Streptococcus pyogenes. J Exp Med. 189:89-102). Другие токсины, такие как токсин, вызывающий стрептококковый токсический шокоподобный синдром, стрептококковый суперантиген (Reda, K.В., V.Kapur, D.Goela, J.G.Lamphear, J.M.Musser, and R.R.Rich. 1996. Phylogenetic distribution of streptococcal superantigen SSA allelic variants provides evidence for horizontal transfer of ssa within Streptococcus pyogenes. Infect Immun. 64:1161-5) и митогенный фактор (Yutsudo, Т., K.Okumura, M.Iwasaki, А.Наrа, S.Kamitani, W.Minamide, H.Igarashi, and Y.Hinuma. 1994. The gene encoding a new mitogenic factor in a Streptococcus pyogenes strain is distributed only in group A streptococci. Infection and Immunity. 62:4000-4004), играют менее определенные роли при заболевании. Стрептолизин О также можно считать возможным антигеном-кандидатом, поскольку он вызывает высвобождение интерлейкина IL-β. Кроме того, также идентифицировано множество секретируемых ферментов, которые включают цистеиновую протеазу (Lukomski, S., С.A.Montgomery, J.Rurangirwa, R.S.Geske, J.P.Barrish, G.J.Adams, and J.M.Musser. 1999. Extracellular cysteine protease produced by Streptococcus pyogenes participates in the pathogenesis of invasive skin infection and dissemination in mice. Infect Immun. 67:1779-88, Matsuka, Y.V., S.Pillai, S.Gubba, J.M.Musser, and S.B.Olmsted. 1999. Fibrinogen cleavage by the Streptococcus pyogenes extracellular cysteine protease and generation of antibodies that inhibit enzyme proteolytic activity. Infect Immun. 67:4326-33), стрептокиназу (Huang, Т.Т., Н.Maike, and J.J.Ferretti. 1989. The streptokinase gene of group A streptococci: cloning, expression in Escherichia соli, and sequence analysis. Mol Microbiol. 3:197-205, Nordstrand, A., W.M.McShan, J.J.Ferretti, S.E.Holm, and M.Norgren. 2000. Allele substitution of the streptokinase gene reduces the nephritogenic capacity of group A streptococcal strain NZ131. Infect Immun. 68:1019-25) и гиалуронидазу (Hynes, W.L, A.R.Dixon, S.L.Walton, and L.J.Aridgides. 2000. The extracellular hyaluronidase gene (hylA) of Streptococcus pyogenes. FEMS Microbiol Lett. 184:109-12, Hynes, W.L., L.Hancock, and J.J.Ferretti. 1995. Analysis of a second bacteriophage hyaluronidase gene from Streptococcus pyogenes: evidence for a third hyaluronidase involved in extracellular enzymatic activity. Infect Immun. 63:3015-20).
Принимая во внимание количество известных факторов вирулентности, продуцируемых Streptococcus pyogenes, ясно, что важной характерной особенностью эффективной иммуногенной композиции (3-гемолитических стрептококков должна быть ее способность стимулировать ответную реакцию, которая будет предотвращать или ограничивать колонизацию на ранних стадиях инфекционного процесса. Эта защитная реакция должна или блокировать адгезию, и/или увеличивать клиренс клеток посредством опсонофагоцитоза. Показано, что антитела к М-белку являются опсоническими и обуславливают механизм преодоления антифагоцитарных свойств белка (Jones, K.F., and V.A.Fischetti. 1988. The importance of the location of antibody binding on the M6 protein for opsonization and phagocytosis of group A M6 streptococci. J Exp Med. 167:1114-23) примерно таким же способом, каким капсулярные антитела против серотипа В демонстрируют защиту от заболевания, вызванного Haemophilus influenzae В (Madore, D.V. 1998. Characterization of immune response as an indicator of Haemophilus influenzae type b vaccine efficacy. Pediatr Infect Dis J. 17:3207-10). Кроме того, показано, что антитела, специфичные к белку F, блокируют адгезию и интернализацию клетками культуры ткани (Molinari, G., S.R.Talay, P.Valentin-Weigand, M.Rohde, and G.S. Chhatwal. 1997. The fibronectin-binding protein of Streptococcus pyogenes, Sfbl, is involved in the internalization of group A streptococci by epithelial cells. Infect Immun. 65:1357-63).
Остается потребность в разработке иммуногенных композиций и способов для предупреждения или уменьшения симптомов инфекций, вызванных β-гемолитическими стрептококками, включая группы А, В, С и G. Также остается потребность в создании иммуногенных композиций, которые обеспечивают иммунитет к широкому спектру бактерий БГС.
Краткое изложение сущности изобретения
Исходя из этих и других потребностей и учитывая задачи изобретения согласно настоящему изобретению предложены иммуногенные композиции для защиты восприимчивых млекопитающих от колонизации или инфицирования β-гемолитическими стрептококками, включая стрептококки группы А, В, С и/или D, в том числе стрептококки вида Streptococcus pyogenes. Эти иммуногенные композиции содержат смесь двух или более полипептидов, которые описаны ниже более подробно. Согласно изобретению также предложены способы предупреждения или уменьшения симптомов такой колонизации у восприимчивого млекопитающего путем введения эффективного количества иммуногенной композиции для выработки антител к специфическим полипептидам, содержащимся в иммуногенной композиции. Согласно изобретению дополнительно предложены полипептиды и полинуклеотиды Streptococcus pyogenes, рекомбинантные вещества и способы их получения. Другой аспект изобретения относится к способам применения таких полипептидов и полинуклеотидов Streptococcus pyogenes. Полипептиды и полинуклеотиды могут также быть использованы в производстве лекарственного средства для предупреждения или уменьшения симптомов инфекции, вызванной β-гемолитическими стрептококками.
Полипептиды, используемые в иммуногенных композициях по изобретению, включают выделенные полипептиды, содержащие по меньшей мере одну аминокислотную последовательность согласно любой из Фиг.2, 4, 6, 8 или 10. Изобретение также включает аминокислотные последовательности, которые имеют по меньшей мере 90% идентичность любой из вышеприведенных аминокислотных последовательностей, и их зрелые полипептиды. Изобретение дополнительно включает иммуногенные фрагменты и биологические эквиваленты этих полипептидов. Также предложены антитела, которые иммуноспецифически связываются с полипептидами по изобретению.
Полинуклеотиды по изобретению включают выделенные полинуклеотиды, которые содержат нуклеотидные последовательности, которые кодируют полипептид по изобретению. Эти полинуклеотиды включают выделенные полинуклеотиды, содержащие по меньшей мере одну нуклеотидную последовательность согласно любой из Фиг.1, 3, 5, 7 или 9, и также включают другие нуклеотидные последовательности, которые в результате вырожденности генетического кода также кодируют полипептид по изобретению. Изобретение также включает выделенные полинуклеотиды, содержащие нуклеотидную последовательность, которая имеет по меньшей мере 90% идентичность нуклеотидной последовательности, которая кодирует полипептид по изобретению, и выделенные полинуклеотиды, содержащие нуклеотидную последовательность, которая имеет по меньшей мере 90% идентичность любой из вышеприведенных нуклеотидных последовательностей. Кроме того, выделенные полинуклеотиды по изобретению включают нуклеотидные последовательности, которые гибридизуются в строгих условиях гибридизации с нуклеотидной последовательностью, которая кодирует полипептид по изобретению, нуклеотидные последовательности, которые гибридизуются в строгих условиях гибридизации с нуклеотидной последовательностью любой из вышеприведенных последовательностей, и нуклеотидные последовательности, которые полностью комплементарны этим полинуклеотидам. Кроме того, изобретение включает экспрессирующие векторы и клетки-хозяева, содержащие эти полинуклеотиды.
Согласно изобретению также предложены иммуногенные композиции, которые содержат иммуногенное количество по меньшей мере двух или более компонентов (выбранных из SCP (Фиг.2 (SEQ ID NO:2)) и пептидов, кодируемых открытой рамкой считывания (ОРС) 554 (пептидилпропилизомераза (Фиг.4 (SEQ ID NO:4)), ОРС 1218 (гипотетический белок (Фиг.6 (SEQ ID NO:6)), ОРС 1358 (предполагаемый адгезивный белок (Фиг.8 (SEQ ID NO:8)) и ОРС 2459 (поверхностный липопротеин (Фиг.10 (SEQ ID NO:10)), каждый из которых содержит полипептид по изобретению в количестве, эффективном для предупреждения или уменьшения симптомов β-гемолитической стрептококковой колонизации или инфекции у восприимчивого млекопитающего. Каждый компонент может содержать сам полипептид или может содержать полипептид и любое другое вещество (например один или более чем один химический агент, белок и так далее), которое может помочь в предупреждении и/или уменьшении симптомов β-гемолитической стрептококковой колонизации или инфекции. Эти иммуногенные композиции могут дополнительно содержать по меньшей мере часть полипептида, возможно конъюгированного или связанного с пептидом, полипептидом или белком или с полисахаридом.
Изобретение также включает способы защиты восприимчивого млекопитающего от β-гемолитической стрептококковой колонизации или инфекции. В одном воплощении способ включает введение млекопитающему эффективного количества двух- или более компонентной иммуногенной композиции, содержащей иммуногенное количество полипептида по изобретению, которое эффективно для предупреждения или уменьшения симптомов β-гемолитической стрептококковой колонизации или инфекции у восприимчивого млекопитающего. Такие комбинации компонентов, как было обнаружено, эффективны для обеспечения такой защиты для широкого диапазона групп и обычно обеспечивают более сильный иммунный ответ, чем отдельные компоненты, вводимые раздельно. Иммуногенные композиции по изобретению могут быть введены любым обычным путем, например посредством подкожной или внутримышечной инъекции, перорального приема или интраназально.
Согласно изобретению дополнительно предложены иммуногенные композиции. В одном воплощении иммуногенная композиция содержит по меньшей мере один полипептид по изобретению. В другом воплощении иммуногенная композиция содержит по меньшей мере один полинуклеотид по изобретению.
Следует понимать, что вышеприведенное общее описание и последующее подробное описание являются иллюстративными, а не ограничивающими изобретение.
Краткое описание графических материалов
На Фиг.1 представлена последовательность нуклеиновых кислот, кодирующая пептидазу С5а ("SCP"; SEQ ID NO:1).
На Фиг.2 представлена аминокислотная последовательность SCP (SEQ ID NO:2).
На Фиг.3 представлена последовательность нуклеиновых кислот ОРС 554, кодирующая пептидилпропилизомеразу (SEQ ID NO:3).
На Фиг.4 представлена аминокислотная последовательность пептидилпропилизомеразы (SEQ ID NO:4),
На Фиг.5 представлена последовательность нуклеиновых кислот ОРС 1218, кодирующая гипотетический белок (SEQ ID NO:5).
На Фиг.6 представлена аминокислотная последовательность гипотетического белка (SEQ ID NO:6).
На Фиг.7 представлена последовательность нуклеиновых кислот ОРС 1358, кодирующая предполагаемый адгезивный белок (SEQ ID NO:7).
На Фиг.8 представлена аминокислотная последовательность предполагаемого адгезивного белка (SEQ ID NO:8).
На Фиг.9 представлена последовательность нуклеиновых кислот ОРС 2459, кодирующая поверхностный липопротеин (SEQ ID NO:9).
На Фиг.10 представлена аминокислотная последовательность поверхностного липопротеина (SEQ ID NO:10).
На Фиг.11 графически представлен процент киллинга при сравнении сред трехкомпонентной ("Trivax" означает SCP, пептидилпропилизомеразу (ОРС 554) и предполагаемый адгезивный белок (ОРС 1358)) и однокомпонентной ("554" означает пептидилпропилизомеразу (ОРС 554)) иммуногенных композиций, исследуемых в Примере 2.
На Фиг.12-16 графически продемонстрированы результаты переноса пассивного иммунитета согласно Примеру 3. КОЕ означает колониеобразующие единицы.
Подробное описание изобретения
Согласно настоящему изобретению предложены иммуногенные композиции для предупреждения или уменьшения симптомов инфекций, вызванных β-гемолитическими стрептококками, включая стрептококки групп А, В, С и G. Два или более полипептида, перечисленные здесь, объединены вместе для создания иммуногенной композиции.
Конкретно, в одном воплощении иммуногенная композиция по этому изобретению содержит смесь двух или более чем двух полипептидов, каждый из которых кодируется последовательностью нуклеиновых кислот, имеющей по меньшей мере 90% идентичность последовательности нуклеиновых кислот, выбранной из группы, состоящей из:
а) пептидазы С5а ("SCP") (Фиг.1 (SEQ ID NO:1));
б) открытой рамки считывания ("ОРС") 554 (Фиг.3 (SEQ ID NO:3));
в) ОРС 1218 (Фиг.5 (SEQ ID NO:5));
г) ОРС 1358 (Фиг.7 (SEQ ID NO:7));
д) ОРС 2459 (Фиг.9 (SEQ ID NO:9)).
В другом воплощении иммуногенная композиция по этому изобретению содержит смесь двух или более чем двух полипептидов, каждый из которых имеет по меньшей мере 90% идентичность аминокислотной последовательности, выбранной из группы, состоящей из:
а) SCP (Фиг.2 (SEQ ID NO: 2));
б) пептидилпропилизомеразы (Фиг.4 (SEQ ID NO:4));
в) гипотетического белка (Фиг.6 (SEQ ID NO:6));
г) предполагаемого адгезивного белка (Фиг.8 (SEQ ID NO:8)); и
д) поверхностного липопротеина (Фиг.10 (SEQ ID NO:10)). В еще одном воплощении иммуногенная композиция по этому изобретению содержит смесь:
а) полипептида SCP, кодируемого последовательностью нуклеиновых кислот, имеющей по меньшей мере 90% идентичность последовательности нуклеиновых кислот согласно Фиг.1 (SEQ ID NO:1);
б) полипептида пептидилпропилизомеразы, кодируемого последовательностью нуклеиновых кислот, имеющей по меньшей мере 90% идентичность последовательности нуклеиновых кислот согласно Фиг.3 (SEQ ID NO:3) и
в) по меньшей мере одного другого полипептида, кодируемого последовательностью нуклеиновых кислот, имеющей по меньшей мере 90% идентичность последовательности нуклеиновых кислот, выбранной из группы, состоящей из последовательности согласно (1) Фиг.5 (SEQ ID NO:5); (2) Фиг.7 (SEQ ID NO:7); и (3) Фиг.9 (SEQ ID NO:9).
В еще одном воплощении иммуногенная композиция по этому изобретению содержит смесь:
а) полипептида SCP, имеющего по меньшей мере 90% идентичность аминокислотной последовательности согласно Фиг.2 (SEQ ID NO:2);
б) полипептида пептидилпропилизомеразы, имеющего по меньшей мере 90% идентичность аминокислотной последовательности согласно Фиг.4 (SEQ ID NO:4);
в) по меньшей мере одного другого полипептида, имеющего по меньшей мере 90% идентичность аминокислотной последовательности, выбранной из группы, состоящей из последовательности согласно (1) Фиг.6 (SEQ ID NO:6);
(2) Фиг.8 (SEQ ID NO:8) и (3) Фиг.10 (SEQ ID NO:10).
Термины «полинуклеотид», «нуклеиновая кислота» и «фрагмент нуклеиновой кислоты» использованы здесь взаимозаменяемым образом. Эти термины охватывают нуклеотиды, соединенные фосфодиэфирными связями. «Полинуклеотид» может представлять собой полимер рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК), который является одно- или двухцепочечным, который возможно содержит синтетические, неприродные или измененные нуклеотидные основания. Полинуклеотид в форме полимера ДНК может содержать один или более чем один сегмент кДНК, геномной ДНК, синтетической ДНК или их смеси. Нуклеотидные основания обозначены здесь с помощью однобуквенного кода: аденин (А), гуанин (G), тимин (Т), цитозин (С), инозин (I) и урацил (U).
Полинуклеотиды стрептококков, описанные здесь, могут быть получены с использованием стандартных методик клонирования и скрининга. Эти полинуклеотиды могут быть получены, например, из геномной ДНК, из библиотеки кДНК, полученной на основе мРНК, из библиотеки геномной ДНК, или могут быть синтезированы с использованием хорошо известных и коммерчески доступных методик, таких как, например, посредством ПЦР из библиотеки кДНК или с помощью ОТ-ПЦР (полимеразная цепная реакция с обратной транскрипцией).
Существует несколько доступных и хорошо известных специалистам в данной области техники способов получения полноразмерных кДНК или удлинения короткой кДНК, таких как, например, способы, основанные на методе быстрой амплификации концов кДНК (RACE). См. Frohman et al., Proc. Natl. Acad. Sci. USA 85, 8998-9002, 1988. Недавние модификации методики, примером которых является, например, технология MARATHON™ (Clontech Laboratories Inc.) значительно упрощают поиск более длинных кДНК. В технологии MARATHON™ кДНК получают из мРНК, экстрагированной из выбранной ткани, и «адапторной» последовательности, лигированной по каждому концу. Затем проводят амплификацию нуклеиновой кислоты (ПЦР), чтобы амплифицировать «недостающий» 5'-конец кДНК, используя комбинацию генспецифических и адаптор-специфических олигонуклеотидных праймеров. Реакцию ПЦР затем повторяют с использованием «вложенных» праймеров, то есть праймеров, сконструированных для отжига в амплифицированном продукте (как правило, адаптер-специфического праймера, который отжигается далее 3'-конца в адапторной последовательности, и генспецифического праймера, который отжигается далее 5'-конца в известной последовательности генов). Продукты этой реакции можно затем проанализировать с помощью секвенирования ДНК и конструировать полноразмерную кДНК либо посредством присоединения продукта непосредственно к существующей кДНК с получением полной последовательности, либо посредством проведения отдельной полноразмерной ПЦР при использовании новой информации о нуклеотидных последовательностях для разработки 5'-праймера.
Термин «рекомбинантный» означает, например, что полинуклеотид создан посредством искусственного объединения двух или более, в иных условиях разделенных, сегментов полинуклеотидов, например посредством химического синтеза или посредством манипуляции с выделенными полинуклеотидами с использованием методик генной инженерии. «Конструкция рекомбинантной ДНК» содержит любые выделенные полинуклеотиды по настоящему изобретению, функционально связанные с по меньшей мере одним регуляторным элементом.
Ортологические или аллельные варианты полинуклеотидов стрептококков могут быть легко идентифицированы с использованием способов, хорошо известных в данной области техники. Аллельные варианты и ортологи полинуклеотидов могут содержать нуклеотидную последовательность, которая, как правило, является по меньшей мере на 90-95% или более идентичной любой одной или более чем одной нуклеотидной последовательности, показанной на нечетных Фиг.1-9 (нечетные SEQ ID NO:1-9), или ее фрагментам. Аллельные варианты и ортологи этих полинуклеотидов могут кодировать полипептид, который содержит аминокислотную последовательность, которая является по меньшей мере на 90% идентичной аминокислотной последовательности, показанной на любой одной или более чем одной четной Фиг.2-10 (четные SEQ ID NO:2-10). Такие полинуклеотиды могут быть легко идентифицированы как способные к гибридизации в строгих условиях с любым одним или более чем одним полинуклеотидом, имеющим нуклеотидную последовательность, показанную на Фиг.1-9 (нечетные SEQ ID NO:1-9), или ее фрагменты.
Специалисту в данной области техники будет совершенно ясно, что много уровней идентичности последовательностей полезно при идентификации родственных полинуклеотидных и полипептидных последовательностей. Выравнивание последовательностей и расчеты процента идентичности могут быть проведены с использованием программы MEGALIGN™ пакета компьютерных программ биоинформатики LASERGENE™ (DNASTAR Inc., Madison, Wis.). Множественное выравнивание последовательностей может быть проведено с использованием метода выравнивания Clustal (Higgins and Sharp, Gene, 73(1):237-44, 1988) со значениями параметров по умолчанию, например, GAP PENALTY (штраф за делецию) равен 10 и GAP LENGTH PENALTY (штраф за продолжение делеции) равен 10. Значения параметров по умолчанию для парных выравниваний при использовании метода Clustal могут представлять собой, например, KTUPLE (размер идентичного участка) равен 1, GAP PENALTY (штраф за делецию) равен 3, WINDOW (окно) равно 5 и DIAGONALS SAVED (баллы за сохраненные диагонали) равны 5.
Полипептидная последовательность по изобретению может быть идентична приведенной последовательности, то есть идентична на 100%, или может включать некоторое количество аминокислотных изменений по сравнению с эталонной последовательностью, так что процент идентичности составляет менее 100%. Такие изменения включают по меньшей мере одну аминокислотную делецию, замену, включая консервативную и неконсервативную замену, или вставку. Изменения могут встречаться в амино- или карбокси-концевых положениях эталонной полипептидной последовательности или где-то между этими концевыми положениями, рассеянные либо отдельно среди аминокислот в эталонной аминокислотной последовательности, либо одной или более чем одной сплошной группой в пределах эталонной аминокислотной последовательности.
Таким образом, согласно изобретению также предложены выделенные полипептиды, обладающие идентичностью последовательности аминокислотным последовательностям, содержащимся в приведенных последовательностях. В зависимости от конкретной последовательности, степень идентичности последовательности составляет предпочтительно более чем 90% (например 90%, 95%, 97%, 99% или более). Эти гомологичные белки включают мутанты и алелльные варианты.
«Идентичность», как известно в данной области техники, представляет собой родство между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, которое определяют посредством сравнения последовательностей. В данной области техники «идентичность» также означает степень сходства последовательности между полипептидными или полинуклеотидными последовательностями, в зависимости от обстоятельств, как определяют посредством сопоставления между цепочками таких последовательностей. «Идентичность» и «сходство» могут быть легко подсчитаны известным способами, включая те, которые описаны в Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994;
Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991; и Carillo, H., and Lipman, D., SIAM J. Applied Math., 48: 1073 (1988), но не ограничиваясь ими. Предпочтительные способы определения идентичности разработаны так, чтобы обеспечить наибольшее сопоставление между исследуемыми последовательностями. Способы определения идентичности и сходства систематизированы в общедоступных компьютерных программах. Предпочтительные способы определения идентичности и сходства между двумя последовательностями с помощью компьютерных программ включают пакет программ GCG (Devereux, J., et al. 1984), BLASTP, BLASTN и FASTA (Altschul, S.F., et al., 1990), но не ограничены ими. Программа BLASTX общедоступна в Национальном центре биотехнологической информации (NCBI) и других источниках (BLAST Manual, Altschul, S., et al., NCBI NLM NIH Bethesda, Md. 20894; Altschul, S., et al., 1990). Для определения идентичности можно также использовать хорошо известный алгоритм Smith Waterman.
Например, количество аминокислотных изменений для данного % идентичности может быть определено путем умножения общего количества аминокислот, представленных в одной из четных Фиг.2-10 (SEQ ID NO:2, 4, 6, 8 и 10), на число процентов соответствующей процентной идентичности (деленное на 100) и затем вычитания этого результата из указанного общего количества аминокислот, представленных в одной из четных Фиг.2-10 (SEQ ID NO:2,4,6, 8 и 10), или;
na≤xa-(xa·y),
где na равен количеству аминокислотных изменений, xa равен общему количеству аминокислот, представленных в одной из четных Фиг.2-10 (SEQ ID NO:2, 4, 6, 8 и 10), и у равен, например, 0,90 для 90%, 0,95 для 95%, 0,97 для 97% и так далее, и где любой результат умножения xa и у, не представляющий собой целое число, округляют в меньшую сторону до ближайшего целого числа перед вычитанием его из xа.
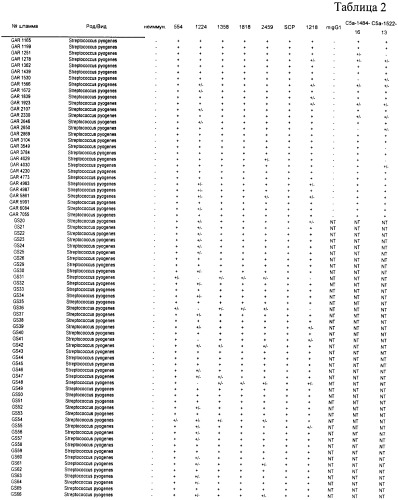
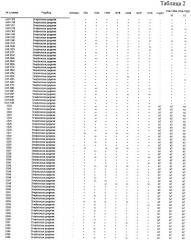
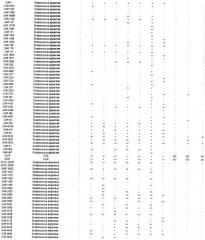
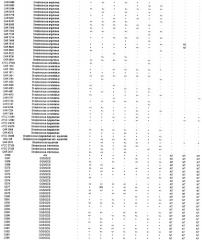
Согласно настоящему изобретению также предложены выделенные полипептиды, которые являются по существу консервативными среди штаммов β-гемолитических стрептококков. Кроме того, выделенные полипептиды, которые являются по существу консервативными среди штаммов β-гемолитических стрептококков и которые эффективны в предупреждении или уменьшении симптомов β-гемолитической стрептококковой колонизации или инфекции у восприимчивого субъекта, также предусмотрены настоящим изобретением. Использованный здесь термин «консервативный» относится, например, к количеству аминокислот, которые не подвергаются вставкам, замене и/или делециям, в процентах от общего количества аминокислот в белке. Например, если белок консервативен на 90% и имеет, например, 263 аминокислоты, тогда имеется 237 положений аминокислот в белке, в которых аминокислоты не подвергаются замене. Аналогичным образом, если белок консервативен на 95% и имеет, например, 280 аминокислот, тогда имеется 14 положений аминокислот, в которых аминокислоты могут подвергаться замене и 266 (то есть 280 минус 14) положений аминокислот, в которых аминокислоты не подвергаются замене. Согласно одному из воплощений настоящего изобретения выделенный полипептид предпочтительно по меньшей мере примерно на 90% консервативен среди штаммов β-гемолитически