Способ получения специфического иммуномодулятора
Иллюстрации
Показать всеИзобретение относится к области ветеринарной микробиологии и касается способа получения специфического иммуномодулятора. Представленный способ включает следующие стадии: культивирование вакцинного штамма БЦЖ, разрушение культуры ультразвуком, выделение антигенного комплекса, смешивание надосадочной жидкости с формалином и конъюгацию реакционной смеси на полиэлектролитах: поливинилпирролидоне (ПВП) четыре части и полиэтиленгликоле (ПЭГ) одна часть по массе, при соотношении 1 мг/мл белка - 480 мг ПВП и 120 мг ПЭГ по массе на магнитной мешалке при комнатной температуре до получения гомогенной жидкости. Представленное изобретение позволяет восстанавливать нарушенную иммунологическую реактивность, устранять вторичные иммунодефициты, получать безвредные для животных средства, обладающие выраженными протективными свойствам. 6 табл.
Реферат
Изобретение относится к ветеринарной микробиологии, а именно к технологии получения специфического иммуномодулирующего средства, иммуномодулятор может быть использован для коррекции иммунного статуса животных и повышения эффективности иммунной защиты.
В настоящее время проблема регуляции и восстановления защитных функций организма при заболеваниях и воздействии дестабилизирующих факторов окружающей среды является одной из актуальных проблем ветеринарной медицины.
Развитие средств иммунологической защиты людей и животных идет по нескольким направлениям: продолжаются поиски в области традиционного вакцинного дела; создание искусственных вакцинных макромолекул, не имеющих аналогов в природе; регуляция иммунологической реактивности с помощью неспецифической стимуляции; создание препаратов иммуностимулирующей, иммуномодулирующей активности и адъювантных свойств синтетических и естественных средств [Р.В Петров, P.M.Хаитов. Искусственные антигены и вакцины. М.: Медицина, 1988. - 188 с.].
В настоящее время для профилактики и оздоровления ферм крупного рогатого скота от туберкулеза применяют вакцину БЦЖ (BCG-Bacillus Calmette - Guerin). Вакцинация в общем комплексе противотуберкулезных мероприятий позволяет сократить сроки оздоровления ферм с меньшими материальными затратами, однако при этом создаются трудности в диагностике туберкулеза (длительные поствакцинальные реакции на взрослом скоте), отсутствие возможности сохранять у животных перманентный противотуберкулезный иммунитет.В связи с этим вакцину БЦЖ применяют только на новорожденных телятах [Наставление «По применению вакцины БЦЖ при туберкулезе крупного рогатого скота» от 26.02.1990] общий недостаток живых вакцин заключается в том, что они представляют собой мало контролируемую смесь с большим количеством балластных, в том числе токсичных, компонентов из микробных клеток с высокими аллергизирующими свойствами.
Известен способ получения вакцины против туберкулеза. Способ позволяет получить молекулярную экологически чистую вакцину, обладающую высокой иммуногенностью. Способ включает культивирование микобактерий из штамма БЦЖ, выделение двух фракций. Фракцию клеточных оболочек конъюгируют на целлюлозной матрице при соотношении 1:10 (по массе) в присутствии треххлористого хрома, затем добавляют цитоплазматическую фракцию до содержания белка 1,5-2,0 мг/мл [патент РФ RU№2217164, МПК А61К 39/04].
Однако приготовление суспензии целлюлозы из хлопковой ваты в качестве матрицы предусматривает применение сильнодействующих химических соединений (раствор аммиака, сернокислая медь, щелочной раствор, концентрированная серная кислота и другие), что является небезопасным для работающих, затратным при изготовлении. Препарат используется только для реиммунизации крупного рогатого скота, ранее привитого вакциной БЦЖ, при этом у препарата низкая способность восстанавливать у животных утраченную иммунологическую реактивность.
Наиболее близким техническим решением является способ получения специфического иммуномодулятора. Способ включает культивирование штамма БЦЖ с последующим разрушением полученной культуры ультразвуком. Из разрушенной культуры выделяют антигенный комплекс, представляющий собой цитоплазматические и клеточные оболочки, при 15000 об/мин, полученную надосадочную жидкость (антигенный комплекс) смешивают с формалином, реакционную смесь инкубируют при температуре 37°С в термостате, определяют содержание белка, конъюгируют на поливинилпирролидоне (ПВП) при соотношении 1 мг/мл белка - 600 мг ПВП (1:600) по массе на магнитной мешалке при комнатной температуре до получения гомогенной жидкости [патент РФ RU№2366455, МПК А61К 39/04; C12N 1/20; C12R 1/32].
Однако полученный комплексный иммуномодулятор микробного происхождения (КИМ-М) менее эффективно: восстанавливает утраченную иммунологическую реактивность, устраняет вторичные иммунодефициты, усиливает протективные свойства препарата. При испытании КИМ-М на телятах в возрасте до 1 месяца было установлено токсическое действие препарата на организм животного, которое проявляется клиническими признаками в течение 1,5 часа (угнетенное состояние, учащенное дыхание, мышечная дрожь), затем эти признаки исчезали и нормальное состояние телят восстанавливалось. Ранее также было установлено, что полианионы и поликатионы, в том числе ПВП, наряду с иммуностимулирующими свойствами обладают определенной токсичностью при введении in vivo и негативно влияют на отдельные этапы иммуногенеза [A.M.Наджитмитдинов, P.M.Хаитов, А.Ш.Наримов и др. Влияние сополимеров N-винилпирролидона и акриловой кислоты на отдельные этапы иммуногенеза // Журн. Микробиол. - 1979. - №9. - С.14-18].
Техническим результатом является разработка технологии изготовления специфического иммуномодулятора, способного восстанавливать утраченную иммунологическую реактивность, устранять вторичные иммунодефициты, иметь выраженные протективные свойства, при этом не оказывающего токсического действия, для применения с целью профилактики туберкулеза и микобактериозов крупного рогатого скота.
Указанный технический результат достигается путем культивирования микобактерий из штамма БЦЖ с последующим разрушением их ультразвуком, выделением антигенного комплекса (цитоплазматического и клеточных оболочек) при 15000 об/мин, надосадочную жидкость (антиген комплекс) смешивают с формалином, определяют содержание белка, реакционную смесь конъюгируют на полиэлектролитах: поливинилпирролидоне (ПВП) четыре части и полиэтиленгликоле (ПЭГ) одна часть по массе (4:1), при соотношении 1 мг/мл белка - 480 мг ПВП и 120 мг ПЭГ (1:600) по массе на магнитной мешалке при комнатной температуре до получения гомогенной жидкости.
Сущность изобретения поясняется на конкретных примерах выполнения способа.
Получение антигенного комплекса из вакцинного штамма БЦЖ
Проводят посев вакцинного штамма БЦЖ на жидкую синтетическую среду Сотона. Вакцинный штамм культивируют в конических колбах емкостью 0,5-1,0 л при температуре 37°С в течение 2-3-х недель. Выросшую бактериальную массу собирают и трижды отмывают стерильным физиологическим раствором, центрифугируют в течение 20 минут при 3 тыс.об/мин. Отмытую бактериальную массу ресуспендируют в стерильном физиологическом растворе из расчета 1:5 (1,0 г бактериальной массы и 5 мл физиологического раствора). Флаконы с суспензией бактериальных клеток помещают на 24 часа на шуттель-аппарат при комнатной температуре.
Суспензию бактериальных клеток подвергают ультразвуковой дезинтеграции на аппарате УЗДН-1 (22-35 кГц, 60-70 Вт/см2 в течение 30 мин), полученную взвесь центрифугируют 30 мин при 15000 об/мин (этот параметр является оптимальным для получения комплекса антигенов цитоплазматической фракции и клеточных оболочек БЦЖ). Надосадочную жидкость сливают.
Количество белка в надосадочной жидкости определяют на полуавтоматическом программируемом фотометре 5010 V5+ (производство «Human» Германия).
В основе определения на приборе общего белка в жидкостях используется общеизвестный биуретовый метод. Ионы меди реагируют в щелочной среде, формируя фиолетовый комплекс. Оптическая плотность образованного комплекса пропорциональна концентрации белка в пробе.
Оптическую плотность определяли в сравнении со стандартом при длине волны 546 нм, при этом оптический путь составляет 1 см при температуре 20…25°С. Измерение осуществляется против холостой пробы по реагенту (одна холостая проба на серию).
В объем антигенного комплекса (99,3 мл) добавляют 37%-ного медицинского формальдегида 0,7 мл или 40%-ного - 0,6 мл. Реакционную смесь инкубируют в термостате при 37°С в течение 5-9 дней, конъюгируют с поливинилпирролидоном (ПВП) молекулярной массой 12600±2700 (синтетический неприродный полиэлектролит, модулирующий иммуногенез, обладает митогенными свойствами, стимулирует миграцию стволовых клеток), концентрацию которого доводят на 1 мг/мл белка 480 мг ПВП и 120 мгПЭГ (синтетический неприродный полиэлектролит молекулярной массой 6000). В качестве эксперимента на 1 мг/мл белка берут разные соотношения полиэлектролитов: 600 мг ПВП; 480 мг ПВП и 120 мг ПЭГ; 420 мг ПВП и 180 мг ПЭГ; 300 мг ПВП и 300 мг ПЭГ. Установлено, что наиболее высокая способность восстанавливать утраченную иммунологическую реактивность у препарата при соотношении по массе 480 мг ПВП и 120 мг ПЭГ.
В 100 мг/мл белка после инкубирования постепенно частями добавляют ПЭГ, затем ПВП, размешивая на магнитной мешалке при комнатной температуре до получения эффекта, вновь измеряют содержание белка, доводят дозу по содержанию белка на животное. Стимулирующий эффект ПВП с молекулярной массой 12600 наиболее выражен в дозе 10-20 мг/кг массы [Р.В.Петров, P.M.Хаитов, Р.И.Атауллаханов Иммуногенетика и искусственные антигены /АМН СССР- М.: Медицина, 1983 - 256 с.]. Реакционную смесь разливают во флаконы и стерилизуют на установке АСИС при 80°С в течение 30 мин и в стерильном боксе закрывают пробками. В результате получают комплексный иммуномодулятор микробного происхождения (КИМ-М2).
Испытание препарата на лабораторных животных.
Готовят описанным способом 4 типа иммуномодулирующего средства: КИМ-М, КИМ-М2, КИМ-М3, КИМ-М4, изменив состав матрицы. К ПВП добавляют разное количество водорастворимого неионогенного полимера - полиэтиленгликоль (ПЭГ): ПВП 4 части + 1 часть ПЭГ (КИМ-М2); 3,5 части ПВП + 1,5 части ПЭГ (КИМ-МЗ); ПВП 2,5 части + 2,5 части ПЭГ (КИМ-М4). В сравнительном аспекте на 30 морских свинках изучают препараты на их способность восстанавливать иммунологическую реактивность.
Через три дня после индукции иммунологической толерантности по способу [патент РФ RU №2354401, МПК А61К 39/04, A61D 99/00] 5 морским свинкам вводят КИМ-М (1-я группа); 5 - вводят КИМ-М2 (2-я группа); 5 - вводят КИМ-М3 (3-я группа); 5 - вводят КИМ-М4 (4-я группа). Через 12 дней после толерогенной обработки морских свинок прививают вакциной БЦЖ внутрикожно в дозе 0,1 мг; других 5 морских свинок прививают БЦЖ без толерогенной обработки (5-я группа) и 4 интактные морские свинки служат в качестве контроля (6-я группа). Через 30 дней после иммунизации морских свинок заражают вирулентной культурой М.bovis штамм 14 подкожно в дозе 0,0001 мг/мл и через 30 дней убивают для проведения патологоанатомических исследований, определяют показатель интенсивности поражений и индекс защиты, используя схему С.И.Гельберга, Е.А.Финкеля [Гельберг С.И. К методике экспериментального изучения иммуногенных свойств противотуберкулезных вакцин и эффективность методов их применения / С.И.Гельберг, Е.А.Финкель // Пробл. туберкулеза. - 1959. - №2. - С.80-84].
Устанавливают, что наиболее высокая способность восстанавливать утраченную иммунологическую реактивность у препарата КИМ-М2 (соотношение по массе ПВП к ПЭГ 4:1). Степень пораженности органов 0,60±0,60 баллов; индекс защиты - 92%, тогда как у препарата КИМ-М - 80% и у морских свинок, привитых вакциной БЦЖ - 69% (табл.1). Отмечено, что четыре из пяти морских свинок, привитых КИМ-М2, противостояли экспериментальному заражению М.bovis.
Испытание протективных свойств препарата на морских свинках в зависимости от дозы.
17 морских свинок живой массой 300-350 г делят на 4 группы: 1-й группе морских свинок вводят подкожно КИМ-М2 в дозе 0,5 мл (500 мкг белка); 2-й - КИМ-М2 в дозе 1 мл (1000 мкг белка); 3-й - вводят подкожно КИМ-М2 в дозе 1,5 мл (1500 мкг белка); 4-я группа была контрольной. Через 30 суток морских свинок всех групп инфицируют вирулентной культурой М.bovis штамм 14 подкожно в дозе 0,0001 мг/мл бактериальной массы. Через 30 суток убивают для изучения туберкулезного процесса.
Интенсивность кожной туберкулиновой реакции (ГЗТ) у морских свинок опытных групп достоверно ниже по отношению к контрольной (табл.2).
Установлена наиболее эффективная доза препарата для морских свинок - 500 мкг белка, индекс защиты - 61%, увеличение белка в дозе не усиливает протективные свойства КИМ-М2.
В следующем опыте проводят сравнительное изучение протективных свойств КИМ-М2 и КИМ-М на морских свинках.
30 морских свинок делят на 3 группы: 10 - прививают КИМ-М2 подкожно в дозе 500 мкг белка (1-я группа); 10 - прививают КИМ-М подкожно в дозе 500 мкг белка (2-я группа) и 10 морских свинок служат в качестве контроля (3-я группа). Через 30 дней морских свинок всех групп инфицируют М. bovis штамм 14 подкожно в дозе 0,0001 мг/мл. Результаты исследования показаны в таблице 3.
Результаты показали высокий уровень защиты у морских свинок, привитых КИМ-М2 (1-я группа): степень пораженности составила 1,60±0,40, индекс защиты 70%. Способность формировать противотуберкулезную защиту у морских свинок на введение КИМ-М (2-я группа) ниже: степень пораженности 2,50±0,16, индекс защиты 53%, Р=0,05.
Токсическое действие препарата КИМ-М2 изучают на здоровых белых мышах и морских свинках. Одноразовое подкожное введение белым мышам доз: 50, 100, 200, 300 мкг белка не вызывало гибели ни одного животного; одноразовое подкожное введение морским свинкам доз: 125, 250, 500, 750, 1000 и 2000 мкг белка также не вызывало гибели ни одного животного. Мыши и морские свинки оставались живыми в течение всего времени наблюдения - до месяца. При испытании на лабораторных животных КИМ-М также не было установлено токсического действия.
Контроль иммуногенности препарата (КИМ-М2) на морских свинках предусматривает оценку защитных свойств по степени инфицированности органов и индекса защиты. Используют 20 морских свинок живой массой 300-350 г. Опытной группе из 10 морских свинок вводят КИМ-М2 под кожу живота в область паха в дозе 500 мкг белка. Через 30 суток этой группе и 10 интактным морским свинкам вводят вирулентный штамм М. bovis штамм 14 (ВНИИБТЖ) подкожно в дозе 0,0001 мг. Через 30 суток всех животных убивают, вскрывают в условиях бокса и проводят патологоанатомические исследования. По результатам исследования рассчитывают индекс защиты по формуле:
, где
А - показатель интенсивности поражения контрольной группы,
В - показатель интенсивности поражения опытной группы.
Рассчитывают интенсивность поражения органов и индекс защиты. Препарат считают иммуногенным, если в результате патологоанатомических и статистических исследований различия достоверны (Р<0,05) между показателями интенсивности поражения у опытной и контрольной групп, при индексе защиты не менее 60%.
Препарат расфасовывают в стерильные флаконы по ГОСТ 10782-85, которые закрывают резиновыми пробками по ТУ 38-006-108-84 и алюминиевыми колпачками по ОСТ 64-009-86.
Испытание препарата на молодняке крупного рогатого скота
Опыт 1. В опыт берут 60 телят в возрасте от 10 до 20 дней и делят их на 3 группы: 20-ти телятам вводят изучаемый препарат подкожно в дозе 20 мкг белка на кг массы животного (0,8-1,0 мг белка на животное) в 1,0 мл (1-я группа). Через 30 дней этих животных прививают вакциной БЦЖ в дозе 1 мг в 0,2 мл. Других 20 телят аналогичного возраста прививают также вакциной БЦЖ (2-я группа) и 20 телят используют в качестве контроля (3-я группа). Через 4 месяца у животных всех групп отбирают венозную кровь, в которой определяют концентрацию нейтрофилов, Т-лимфоцитов (Е-рок), Т-киллеров (ЕА), Т-лимфоцитов, распознающих антигены микобактерий туберкулеза (ЕТ), В-лимфоцитов (ЕАС), иммунологические параметры анализируют с помощью дискретно-динамического анализа составляют дифференциально-прогностические таблицы, определяют состояние иммунитета [патент РФ RU №2257913, МПК А61К 39/00, G01N 33/53].
Содержание всех иммунокомпетентных клеток у телят, привитых вакциной БЦЖ после введения препарата, достоверно выше, чем у контрольных животных, особенно выше содержание Т-лимфоцитов и Т-киллеров (Р<0,001). Повышенное количество клеток-киллеров, В-лимфоцитов, Т-лимфоцитов, распознающих антиген, установлено также у телят, привитых только вакциной БЦЖ.
Результаты оценки иммунного статуса опытных групп с использованием дискретно-динамического анализа показали, что введение препарата молодняку крупного рогатого скота перед вакцинацией БЦЖ в значительной степени усиливает сопряженность (связанность) компонентов иммунной системы. Так, у интактного молодняка определено 3 пары значимых сочетаний, у вакцинированных БЦЖ - 8 и вакцинированных БЦЖ после введения препарата - 10 пар сочетаний.
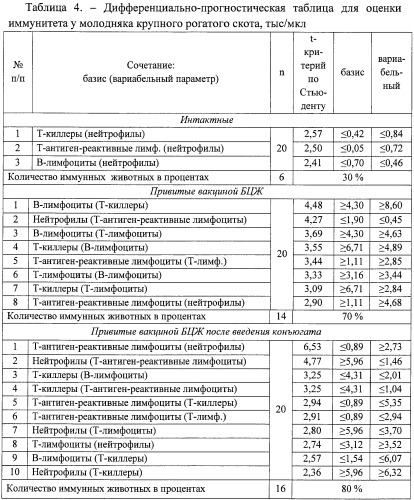
На основании выявленных достоверных сочетаний параметров составили дифференциально-прогностическую таблицу (табл.4).
В таблице 4 у интактного молодняка крупного рогатого скота представлено 3 значимых сочетания параметров. Так, нейтрофилы в качестве вариабельного параметра взаимосвязаны с Т-киллерами, Т-антиген-реактивными лимфоцитами и В-лимфоцитами.
Число значимых сочетаний у животных, привитых только вакциной БЦЖ, по сравнению со здоровыми увеличивается до 8, что свидетельствует о функциональном напряжении иммунной системы. Наибольшим числом связей определяемых показателей с другими обладают Т-лимфоциты (1 раз в качестве базисного и 3 раза в качестве вариабельного параметров) и В-лимфоциты (по 2 раза в качестве базисного и вариабельного параметров), наименьшим (2) - нейтрофилы.
У молодняка, привитого вакциной БЦЖ, после введения изучаемого препарата уровень связанности структурных компонентов иммунной системы увеличивается до 10 сочетаний. При этом наибольшим числом характеризуются нейтрофилы, Т-киллеры и Т-антиген-реактивные лимфоциты (по 5 сочетаний), наименьшим - В-лимфоциты (2).
Далее, используя дифференциально-прогностическую таблицу, оценивают каждое животное исследуемых групп по всем значимым сочетаниям параметров. Согласно результатам анализа высокой активностью иммунокомпетентных клеток характеризовались 30% интактных животных, 70% - привитых БЦЖ и 80% - привитых БЦЖ после введения конъюгата.
С увеличением числа значимых сочетаний параметров повышается степень защищенности животных против туберкулеза. У телят, привитых только БЦЖ и после введения конъюгата БЦЖ, иммунная система находится в состоянии функционального напряжения (активной работы), в то время как у интактного молодняка крупного рогатого скота количество статистически достоверных взаимосвязей между параметрами составляет только 3 сочетания (спокойное функционирование иммунной системы). Следовательно, КИМ-М2 усиливает иммуногенные свойства вакцины БЦЖ.
Опыт 2. Сравнительное испытание иммуномодуляторов КИМ-М и КИМ-М2 проводят на телятах в возрасте от 20-ти суток и до 4-х месяцев (всего 90 голов). Иммуномодуляторы вводят подкожно в дозе 2,5 мг белка на животное. Перед введением препаратов, а также на 45-е сутки после введения всех животных подвергают исследованию ППД-туберкулином для млекопитающих. Кровь для оценки иммунного статуса отбирают до введения иммуномодуляторов, на 20-е после введения КИМ-М2 и 45-е сутки после введения КИМ-М и КИМ-М2 (табл.5).
Содержание всех иммунокомпетентных клеток у телят на 20-е сутки после введения препарата выше, чем у контрольных животных, особенно выше количество Т-лимфоцитов, Т-киллеров и Т-антиген-реактивных лимфоцитов (Р<0,001). По результатам исследования в НСТ-тесте установлено снижение уровня функциональной активности нейтрофилов в спонтанном варианте и, наоборот, увеличение в стимулированном БЦЖ (Р<0,01). Отмечено также снижение числа циркулирующих иммунных комплексов. Аналогичная картина наблюдается у телят на 45-е сутки после введения КИМ-М2, однако разница в том, что концентрация циркулирующих иммунных комплексов (ЦИК) возвращается к исходному уровню.
У телят на 45-е сутки после введения КИМ-М увеличивается количество всех иммунокомпетентных клеток, усиливается функциональная активность нейтрофилов в стимулированном БЦЖ варианте при одновременном уменьшении в спонтанном варианте. Количество ЦИК существенно не изменяется.
У всех животных не установлена кожная реакция на ППД-туберкулин.
Результаты оценки иммунного статуса опытных групп с использованием дискретно-динамического анализа показывают, что введение препарата КИМ-М2 молодняку крупного рогатого скота уменьшает сопряженность (связанность) компонентов иммунной системы.
На основании выявленных достоверных взаимосвязей составляют дифференциально-прогностическую таблицу (табл.6), которая позволяет выявить животных с функциональным напряжением иммунной системы.
Иммунная система молодняка крупного рогатого скота перед введением иммуномодулирующего средства находилась в состоянии функционального напряжения, о чем свидетельствовало наличие 16 выявленных значимых сочетаний. Последующие исследования на 20-е сутки после введения КИМ-М2 и на 45-е сутки после введения КИМ-М и КИМ-М2 показали, что иммунная система перешла в режим спокойного функционирования (более высокого уровня здоровья), что подтверждало малое число взаимосвязей изученных иммунологических показателей.
Затем определяют коэффициент сопряженности (КС) по формуле:
До введения иммуномодулятора коэффициент сопряженности составил 0,38; на 20-е сутки 0,02 и на 45-е сутки 0,04 и 0,07 соответственно.
В дальнейшем, используя значения базисного и вариабельного параметров таблицы, оценивают каждое животное исследуемых групп по всем значимым сочетаниям параметров. Если показатели числа иммунокомпетентных клеток животного соответствуют интервалам хотя бы одного из сочетаний (базисного, вариабельного) таблицы, таких животных признают с функциональным напряжением иммунной системы или с наличием иммунной недостаточности.
Известно, что иммунная система является первой мишенью при воздействии на организм вредных факторов физического, химического, биологического генеза, особенно при резком ухудшении экологии окружающей среды. Указанные факторы влияют на становление иммунной системы, обуславливая у новорожденного молодняка развитие иммунодефицитных состояний. Повышенная антигенная нагрузка у животных сопровождается, как установлено, функциональным напряжением иммунной системы.
Введение молодым животным КИМ-М и КИМ-М2 снижает напряжение и переводит иммунную систему в спокойное функционирование, устраняя при этом вторичные иммунодефициты и усиливает иммуногенные свойства вакцины БЦЖ.
Проводя подобный анализ иммунологических параметров дифференциально-прогностической таблицы (табл.6) по оценке иммунного статуса, определяют 50% среди животных перед введением препарата с функциональным напряжением иммунной системы. Среди животных, которым ввели иммуномодуляторы установлено, что наиболее эффективно состояние функционального напряжения иммунной системы способен устранять КИМ-М2, о чем свидетельствует отсутствие функционального напряжения у 100% животных, тогда как среди телят, которым ввели КИМ-М, выявлено 15% с функциональным напряжением иммунной системы.
Наличие животных с функциональным напряжением иммунной системы, по нашему мнению, связано с токсическим действием препарата КИМ-М. Также необходимо отметить, что у животных в первые часы после введения КИМ-М2, отсутствовали клинические признаки токсического действия препарата (угнетенное состояние, мышечная дрожь и др.), которые были выражены у телят при введении иммуномодулятора КИМ-М.
Разработана и предлагается технология изготовления комплексного специфического иммуномодулятора микробного происхождения (КИМ-М2) из составляющих: комплекс антигенов разрушенной культуры БЦЖ, инкубированной в растворе формалина, и конъюгированный с полиэлектролитами (ПВП четыре части и ПЭГ одна часть). Полученный специфический иммуномодулятор КИМ-М2 способен более эффективно восстанавливать нарушенную иммунологическую реактивность, устранять вторичные иммунодефициты и обладает выраженными протективными свойствами, безвреден для животных.
| Таблица 1 | ||||||||
| Результаты оценки иммуномодулирующих свойств препаратов на их способность восстанавливать иммунологическую реактивность у морских свинок | ||||||||
| Группа животных | Кожная аллергическая реакция через 30 дней после вакцинации, мм | Кожная аллергическая реакция через 30 дней после заражения, мм | Степень пораженности органов, баллы М±m | Индекс защиты,% | ||||
| n | Реагировало | М±m | n | Реагировало | М±m | |||
| КИМ-М | 5 | 5 | 6,75±1,03 | 5 | 5 | 13,75±0,48 | 1,75±0,75 | 80 |
| КИМ-М2 | 5 | 3 | 4,6±2,11 | 5 | 2 | 2,2±1,35 | 0,6±0,6 | 92 |
| КИМ-М3 | 5 | 5 | 8,4±0,92 | 5 | 5 | 6,2±0,58 | 3,6±0,4 | 53 |
| КИМ-М4 | 5 | 4 | 6,8±1,93 | 4 | 4 | 7,0±1,08 | 3,5±0,5 | 55 |
| БЦЖ | 5 | 4 | 10,2±2,94 | 5 | 5 | 7,8±0,97 | 2,4±0,6 | 69 |
| Контроль | 4 | - | - | 4 | 4 | 12,75±0,94 | 7,75±0,25 | 0 |
| Таблица 2 | ||||||
| Протективные свойства КИМ-М2 в зависимости от дозы препарата | ||||||
| Группа животных, доза препарата | ГЗТ через 30 суток после заражения | Степень пораженности, баллы, М±m | Индекс защиты, % | |||
| n | реагировало | М±m | Р | |||
| КИМ-М2 - 0,5 мл | 4 | 4 | 7,66±1,66 | 0,01 | 3,33±0,33 | 61 |
| КИМ-М2 - 1,0 мл | 4 | 4 | 8,25±0,48 | 0,002 | 4,50±0,64 | 47 |
| КИМ-М2 - 1,5 мл | 5 | 3 | 6,60±2,82 | 0,02 | 3,80±0,20 | 55 |
| Контроль | 4 | 4 | 15,25±1,18 | - | 8,50±0,24 | 0 |
| Таблица 3 | |||||
| Сравнительная оценка протективных свойств КИМ-М2 и КИМ-М на морских свинках | |||||
| Группа животных | Кожная аллергическая реакция через 30 дней после заражения, мм | Степень пораженности органов, баллы, М±m | Индекс защиты, % | ||
| n | реагировало | М±m | |||
| 1-я | 10 | 10 | 13,8±0,90 | 1,60±0,40* | 70 |
| 2-я | 10 | 10 | 10,6±0,50 | 2,5±0,16 | 53 |
| 3-я | 10 | 10 | 12,2±1,00 | 5,3±0,30 | 0 |
| Примечание: * Р=0,05 по отношению к 2-й группе |
| Таблица 5 | |||||||
| Средние значения иммунологических параметров у молодняка крупного рогатого скота | |||||||
| Иммунологические параметры | Сроки исследования | ||||||
| Перед введением КИМ-М2 | на 20-е сутки после введения КИМ-М2 | на 45-е сутки после введения КИМ | на 45-е сутки после введения КИМ-М2 | ||||
| М±m | М±m | Р | М±m | Р | М±m | Р | |
| нейтрофилы, тыс./мкл | 2,18±0,19 | 2,53±0,14 | >0,05 | 2,72±0,20 | <0,05 | 2,83±0,25 | <0,05 |
| Т-лимфоциты, тыс./мкл | 0,90±0,14 | 1,68±0,15 | <0,001 | 2,53±0,20 | <0,001 | 2,20±0,10 | <0,001 |
| Т-киллеры, тыс./мкл | 1,91±0,24 | 3,20±0,21 | <0,001 | 3,67±0,25 | <0,001 | 3,78±0,27 | <0,001 |
| В-лимфоциты, тыс./мкл | 2,50±0,32 | 3,28±0,35 | >0,05 | 3,27±0,21 | <0,05 | 3,64±0,23 | <0,01 |
| Т-антиген-реактивные, тыс./мкл | 0,85±0,16 | 2,47±0,32 | <0,001 | 1,53±0,16 | <0,01 | 3,67±0,23 | <0,001 |
| НСТ, спонт., у.е. | 0,82±0,08 | 0,57±0,02 | <0,01 | 0,71±0,03 | >0,05 | 0,65±0,02 | <0,05 |
| НСТ, стимулир. БЦЖ, у.е. | 0,42±0,02 | 0,48±0,01 | <0,01 | 0,51±0,03 | <0,05 | 0,57±0,02 | <0,001 |
| ЦИК, у.е. | 65,15±3,69 | 54,20±2,39 | >0,05 | 67,84±2,40 | >0,05 | 66,30±2,35 | >0,05 |
Способ получения специфического иммуномодулятора, включающий культивирование вакцинного штамма БЦЖ с последующим разрушением культуры ультразвуком, выделением антигенного комплекса (цитоплазматического и клеточных оболочек) при 15000 об/мин, надосадочную жидкость (антиген комплекс) смешивают с формалином, определяют содержание белка, отличающийся тем, что реакционную смесь конъюгируют на полиэлектролитах: поливинилпирролидоне (ПВП) четыре части и полиэтиленгликоле (ПЭГ) одна часть по массе (4:1), при соотношении 1 мг/мл белка - 480 мг ПВП и 120 мг ПЭГ (1:600) по массе на магнитной мешалке при комнатной температуре до получения гомогенной жидкости.