Стерильный аутологичный, аллогенный или ксеногенный имплантат и способ его изготовления
Иллюстрации
Показать всеИзобретение относится к медицине. Описан стерильный дегидратированный бесклеточный имплантат, который во время его регидратации водой или жидкостями организма претерпевает анизотропное расширение и может действовать как субстрат для адгезии, миграции и роста живых клеток. Коллагеновые структуры трансплантата являются по меньшей мере частично денатурированными после воздействия тепла или органических растворителей, таких как низшие алифатические спирты и кетоны, которые одновременно действуют как консервирующие и стерилизующие агенты, особенно в отношении определенных типов вирусов. Имплантат стерилизуют излучением, предпочтительно, ускоренными электронами, в практически дегидратированном состоянии. Трансплантат можно получать из различных тканей животных, особенно из тканей млекопитающих, таких как ткани человека или свиньи. Ткани, подходящие для настоящего изобретения, могут представлять собой, например, кожу, плаценту, перикард, брюшину, стенку кишки, сухожилие, кровеносный сосуд и т.п. Дегидратированный имплантат является подходящим в качестве временного покрытия на рану или ожог, для восстановления, замещения и регенерации тканей, а также в качестве субстрата для культивирования клеток в лабораторных условиях и легче поддается сгибанию и является менее хрупким. 2 н. и 29 з.п. ф-лы, 8 ил., 6 пр.
Реферат
Область изобретения
Изобретение относится к заживлению ран и регенерации тканей. Конкретно оно относится к стерильному, дегидратированному, бесклеточному имплантату (трансплантату), который во время его регидратации водой или жидкостями организма претерпевает анизотропное расширение. Продукт указанного типа можно назвать также имплантатом или трансплантатом в зависимости от контекста и правил, принятых в различных областях экспертизы. В настоящей заявке оба термина используются в соответствии с контекстом; однако важно помнить, что они являются взаимозаменяемыми. Имплантат стерилизуют с использованием облучения, практически в дегидратированном состоянии, предпочтительно, с использованием ускоренных электронов. Имплантат можно получать из тканей различных животных, особенно из тканей млекопитающих, таких как, например, ткани человека или свиньи, таких как, например, кожа, плацента, перикард, брюшина, стенка кишки, сухожилие, кровеносный сосуд и т.д. Имплантат, согласно изобретению, является пригодным для использования в медицине и ветеринарии, например, в качестве временной повязки на раны и ожоги, для восстановления, замещения или регенерации тканей, а также в качестве субстрата для культивирования клеток в лабораторных условиях.
Уровень техники
Ткани и органы давно и широко используются для трансплантации при ряде показаний. Одна из хорошо разработанных методик представляет собой аутотрансплантацию, когда собственную ткань пациента (например, кожу, кость, вену или жировую ткань) перемещают из одного места в другое для замещения ткани. Это не всегда возможно, однако и в ряде случаев пациенту необходим трансплантат (например, сердце, почка, сетчатка и т.п.) от подходящего донора. Главными проблемами указанных так называемых аллотрансплантатов являются отторжения тканей и все чаще нехватка доноров из-за сильно возросшей в них потребности. В силу этого предпринимаются попытки различными способами заменить натуральные аллотрансплантаты. Например, возможно культивирование аутотрансплантатов из клеток пациента с использованием тканевой инженерии. Указанные аутотрансплантаты легко преодолевают иммунный барьер, однако у них есть ряд недостатков: необходимость забора ткани у пациента (биопсия), трудоемкое и дорогостоящее культивирование и большой промежуток времени от взятия биопсии до использования трансплантата. Указанную методику широко используют для замещения кожи при ожогах 3-й степени, в то время как в случае других тканей или органов указанная методика на данный момент времени является экспериментальной. Например, патенты США № 6878383, 6432710, 5858390, 5665372 и 5660850 (Boss, Jr. et al.) описывают методику и средства имплантации аутологичных фибробластов с целью вызвать гиперплазию ткани пациента.
Аутотрансплантацию с использованием искусственно созданного эпидермального слоя кожи используют для лечения пациентов с ожогами в течение ряда лет. В 1979 году Rheinwald и Green (Green H, et al., Proc. Natl. Acad. Sci. USA, 1979; 76: 5665-8) разработали способ серийного культивирования человеческих кератиноцитов для аутотрансплантации. С 1981 г. аутологичные культивированные эпидермальные трансплантаты используются в США для заживления обширных ожогов (O'Connor NE, et al., Lancet 1981; 1:75-8). Недостатком методики является длительный интервал времени, необходимый для культивирования аутологичных кератиноцитов, непрочность культивата, трудность манипуляций, высокая чувствительность к антибиотикам, инфекции и другим стрессам и трудность оценки ассимиляции трансплантата (Navsaria HA, et al., Trends in Biotechnology 1995; 15: 91-100). Описаны, таким образом, следующие различные улучшения методики.
Патент США № 4299816 (M.G. Eisinger) описывает модифицированное заживление ожогов с использованием трансплантатов из искусственно культивированных эпидермальных клеток. Патент США № 5716411 (Orgill et al.) описывает метод заживления, ведущий к регенерации кожи при ожогах и повреждениях, с использованием биосинтетического покрытия, состоящего из коллагенового матрикса и гликозаминогликанов, которое позволяет осуществлять проникновение клеток и кровеносных сосудов из заживляющейся ткани, с одной стороны, и использование пластин из аутологичных кератиноцитов, с другой стороны. WO 2006/107188 A1 (L. Lurvink et al.) описывает непористую полипептидную пленку, пригодную для культивирования клеток, и последующее ее использование для заживления ран и ожогов. Недавний обзор указанных методик можно найти в TISSUE ENGINEERING Vol. 12, № 9, 2006 Update on Tissue-Engineered Biological Dressings, M. Ehrenreich and Z. Ruszczak.
Не только аутологичные, но также и аллогенные культивированные эпидермальные трансплантаты оказывают мощное заживляющее действие на глубокие ожоги дермы, места взятия биопсий, язвы голени и другие дефекты кожи (Bolivar-Flores J. et al., Burns 1990; 16: 3-8; Matouskova E. Et al., Burns 1993; 19: 118-23.4,5).
Успех процедуры зависит также от выбора донорских клеток. P. Brychta et al. описывают в патенте Чехии № CZ 282711 культивированный эпидермальный аллотрансплантат из эмбриональных или фетальных клеток для заживления дефектов и ран кожи, главным образом, в соответствии с процедурой Rheinwald и Green, но с использованием аллогенных клеток, которые были хорошо восприняты пациентом.
Имеют место также попытки повысить механическую устойчивость и жизнеспособность кератиноцитов (например, посредством культивирования на синтетическом субстрате) и разработать методику, которая сделала бы возможной перманентную ассимиляцию культивированной ткани в ожоги 3-й степени. Одним примером субстрата, используемого для культивирования кератиноцитов, является мембрана на основе гиалуроновой кислоты (Laser skin, FIBIA, Италия), различные типы коллагеновых матриксов, комбинированных с фибробластами, или также различные субстраты, изготовленные из синтетических полимеров (например, экспериментальная pHEMA в клинике ожоговой медицины, FNKV в Праге 10). Для заполнения глубоких ожогов разработаны заместители дермы, такие как Integra (коллаген, комбинированный с гликозаминогликаном хондроитин-6-сульфатом и аллогенными фибробластами; Integra LifeSciences Corporation, Plainsboro, New Jersey, США), Dermagraft (полигалактин с засеянными дермальными аллогенными фибробластами; Adbanced Tissue Sciences, La Jolla, CA, США) или уже упоминавшийся AlloDerm - замороженный аллогенный дермис (LifeCell Corporation, The Woodlands, TX, США). Однако все указанные заместители дермы должны быть покрыты тонким аутологичным дермо-эпидермальным трансплантатом во время второго этапа (после 2-3 недель васкуляризации); покрытие ожогов 3-й степени с использованием аллогенных культиватов до настоящего времени не было успешным.
Другим решением проблем аллотрансплантации является использование ткани или органов от видов, не являющихся человеком, так называемая ксенотрансплантация. В указанном случае также необходимо преодолеть отторжение чужеродной ткани иммунной системой, и также необходимо предотвратить возможность передачи вызывающих заболевания микробов и вирусов от донора пациенту. Большое внимание уделяется предотвращению возможности передачи прионов от животных человеку (например, известного «коровьего бешенства»). С другой стороны, большое преимущество заключается в том, что ткани и органы животных являются значительно более доступными по сравнению с тканями и органами человека.
Хорошо известным примером ксенотрансплантата являются клапаны сердца свиньи, которые используются для замены клапанов сердца человека. Клапаны свиньи подвергаются поперечной сшивке с использованием глутарового альдегида (например, патент США № 4076468, Liotta et al.; патент США № 4247292, W.A. Angell), что приводит к нескольким желательным результатам: подавляется реакция отторжения в организме, повышается гидролитическая и ферментативная стабильность ксенотрансплантата, и, помимо этого, глутаровый альдегид действует как химический стерилизующий агент. Одним из недостатков указанного способа является изменение механических свойств ткани и, в некоторых случаях, даже длительное высвобождение токсичного глутарового альдегида из нерастворимых полиальдегидов, которые могут образовываться в течение процесса и не могут быть удалены простым экстрагированием.
Значительная часть трансплантатов используется в форме так называемых «биологических покрытий» для повязки на рану и получающейся основы для заживления. В зависимости от природы раны и других обстоятельств используют биологические, синтетические и полусинтетические покрытия. Биологические покрытия обычно считаются наиболее эффективными. Типичным биологическим покрытием для заживления, например, ожогов является кожа млекопитающего, но особенно человеческая кожа (аллотрансплантат) или кожа свиньи (ксенотрансплантат) различной толщины, отобранная от трупов и сохраняемая в свежем виде при низких температурах в течение короткого периода времени или даже в течение более продолжительного периода времени, будучи замороженной. Имеется большой опыт применения ксенотрансплантатов из кожи свиньи.
«Живые» повязки на рану (т.е. необработанные аллотрансплантаты или ксенотрансплантаты, содержащие все компоненты живой кожи) являются очень эффективными, однако их недостатком является ограниченный срок хранения и возможность передачи инфекции. Для ряда пациентов были предложены определенные решения, например, продукты AlloDerm и XenoDerm от LifeCell Corp., Техас, США, на основе способа криоконсервации согласно патенту США № 4865871 (S. Livesey et al.). Указанный способ делает возможным получать замороженные и, возможно, лиофилизированные ткани и клетки без повреждения их структуры или функции.
Другим способом является хранение кожи свиньи в глицерине в присутствии нитрата серебра при комнатной температуре, как описано в патентной заявке CN 19951010722 (Kai Cao).
Стерилизация кожи свиньи (после очистки и обработки с использованием углеводородов) в растворе перхлората натрия или пероксида водорода с использованием гамма-излучения из источника Со60 описана в патентной заявке TW 199001117733 (Chang Hong Chi et al.).
Другие способы стерилизации кожи свиньи для медицинского использования описаны в патентной заявке CN 19921005926 (Guohui Li et al.), которая описывает стерилизацию во влажном состоянии с использованием источника излучения кобальта, с последующим хранением при низких температурах или лиофильную сушку с последующим хранением в глицерине при комнатной температуре.
Консервация с использованием глицерина также рекомендуется для человеческой плаценты (амниона), используемой для аллотрансплантатов в Deutches Institut fur Zell- und Gewebeersatz gGmbH (Delitzcher St 141, 04128 Leipzig, SRN).
Документ UA 12391U (E.Y. Fistal et al.) описывает заживление некротических ран после глубоких ожогов с использованием лиофилизированной кожи свиньи.
Биологические повязки на раны на основе коллагена для заживления ран, включая ожоги, также описаны в документах RU 2185179 и RU 2124354.
Проблему стерильности и срока хранения можно смягчить удалением клеток из трансплантата, которые, таким образом, становятся частично или полностью бесклеточными. Одну из попыток разрешить указанную проблему можно найти в патентном документе № CN 20031124306 (Hu Jie), описывающем ксенотрансплантат как биологическую повязку для ран и ожогов. Ткань животного, такую как кожа, стенка тонкой кишки или плацента, можно частично избавить от клеток, согласно упомянутому выше изобретению, путем использования воды или раствора детергента, и это осуществляют на поверхности, которая будет в контакте с раной. Клеточная структура других частей, таких как эпидермис, будет сохранена. Затем ткань будет подвергаться поперечной сшивке с использованием подходящего агента, такого как глутаровый альдегид, промываться и храниться во влажном состоянии при температуре ниже 4°С.
Другой документ, CN 20051126108 (Dong Qun Lin), описывает способ удаления клеток из кожи млекопитающего посредством повторного воздействия раствора NaOH с концентрацией от 2 Н до 5 Н, с последующим промыванием в растворе детергента и в воде.
Другой документ, CN 20041022506 (Dai Weihua et al.), описывает способ изготовления биоразлагаемого бесклеточного дермиса с использованием комбинированного воздействия ферментов, щелочей и других химических агентов.
Опубликованная заявка US 20050186286 (Yoshihiro Takami), описывает способ удаления клеток из кожи млекопитающего (например, человека или свиньи) с использованием комбинированного воздействия протеолитических ферментов и детергентов; изготовленная таким образом кожа предназначена для использования в качестве аллотрансплантата или ксенотрансплантата для заживления ожогов. Стерилизацию осуществляют последующим погружением бесклеточного дермиса в раствор азида.
Сходным бесклеточным ксенодермическим матриксом является OASIS, изготовленный AelsLife, который обеспечивает каркас для пространственной миграции клеток. Указанное биологическое покрытие для ран, которое, согласно производителю, содержит важные неклеточные соединения и структуры, присутствующие в живой коже, изготавливают лиофилизацией дермиса свиньи после удаления клеток ферментами и детергентами.
В биосинтетической повязке E*Z DERM от Brennen Medical Inc. используется ксенотрансплантат дермиса свиньи, обработанного поперечной сшивкой коллагена с использованием альдегидов.
Патентный документ JP19900247300 (Koide Mikio) описывает биологическое покрытие, в котором используется матрикс из денатурированного коллагена, полученный из бесклеточного дермиса крупного рогатого скота посредством поперечной сшивки и термической денатурации коллагеновых структур. Указанная структура, согласно процитированному изобретению, является пригодной для засевания аутологичными кератиноцитами для более высокой заживляющей эффективности.
Другие попытки разрешения проблемы представляли собой различные полусинтетические заменители кожи, например, каркас из восстановленного коллагена крупного рогатого скота, засеянный человеческими фибробластами (т.е. упомянутая выше повязка INTEGRA).
Другим примером комбинированного трансплантата является «рекомбинированная кожа» (RK) согласно патенту CZ № 281176. RK изготавливают с использованием культивирования человеческих кератиноцитов в не содержащем клеток дермисе свиньи. (Burns 1993; 19: 118-23). Высушенный дермис используют для культивирования человеческих кератиноцитов и после культивирования дермис со слоем кератиноцитов (или RK) отделяют от чашки Петри и наносят на рану. RK наносят таким образом, чтобы кератиноциты контактировали с раной, а дермис находился снаружи («вверх дном»). По сравнению с простыми эпидермальными трансплантатами RK демонстрирует преимущества более высокой прочности, открепления от чашки Петри без ферментативного воздействия и легкого манипулирования. Преимуществом по сравнению с культурами кератиноцитов на синтетических субстратах и гелях на основе коллагена является то, что консистенция RK аналогичная коже, и это обеспечивает отличную адгезию к ране и гемостатический эффект. Возможно изготавливать RK с использованием как аутологичных, так и аллогенных кератиноцитов. Кератиноциты культивируют на эпидермальной стороне эпидермиса, т.е. там, где базальная мембрана отделяет дермис от эпидермиса. Автор процитированного выше изобретения замечает, что не содержащий клеток дермис можно стерилизовать с использованием гамма-излучения для более длительного хранения при комнатной температуре и большей безопасности. Недостатком стерилизованного с использованием гамма-излучения дермиса является, однако, его частичная деградация и утрата прочности во влажном состоянии.
Сходная комбинированная биологическая повязка на ожоги описана в патентной заявке TW 20000118374 (Yang Mei-Ru et al.), в которой живые человеческие фибробласты на бесклеточном дермисе свиньи комбинируют с человеческими кератиноцитами, культивированными на стороне базальной мембраны бесклеточного матрикса.
Главной проблемой, препятствующей широкому принятию использования указанных биологических материалов, является невозможность использования рутинного и надежного способа стерилизации. Другой специфической проблемой, препятствующей более широкому использованию упомянутых выше материалов, является ограниченный или требующий особых условий срок их хранения и, не в последнюю очередь, затраты на их производство. Сложной проблемой является также то, что дегидратированные материалы набухают изотропно во время регидратации, т.е. (относительно) одинаково увеличиваются по всем измерениям трансплантата после регидратации. Настоящее изобретение решает указанные проблемы.
Сущность изобретения
Заявители установили, что присутствие трансплантированных аллогенных или аутогенных клеток не всегда является необходимым для заживления ран и регенерации тканей, если имеется подходящий материал, который будет стимулировать, поддерживать и направлять размножение, дифференцировку и миграцию собственных клеток пациента. Согласно настоящему изобретению, указанный материал представляет собой особым образом обработанный бесклеточный коллагеновый матрикс, полученный из аутологичного, аллогенного или доже ксеногенного биологического материала. Согласно настоящему изобретению, матрикс состоит, главным образом, из коллагена и родственных белков, таких как эластин, фибрин или кератин. Указанные компоненты матрикса и их концентрации меняются в зависимости от происхождения ткани и способа ее обработки и для простоты будут называться «коллагеном», поскольку во всех случаях коллаген является главным компонентом матрикса. Помимо белков («коллагена») матрикс содержит также некоторое количество жиров и липопротеинов (до 20 мас.%), некоторое количество сахарных компонентов (полисахаридов, гликопротеинов и гликопротеогликанов) и соли. Содержание белков обычно составляет от 70% (мас.) до 95% (мас.), предпочтительно, от 80% до 90% (мас.).
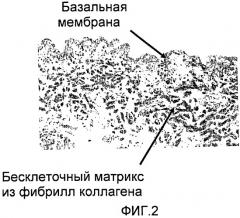
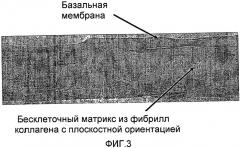
Согласно изобретению, бесклеточный матрикс конкретно характеризуется тем, что он является практически дегидратированным и состоит, главным образом, из коллагена, фибриллы которого демонстрируют структурную организацию, сходную со структурной организацией оригинальной ткани, но, кроме того, они также являются частично денатурированными и, по крайней мере, в дегидратированном состоянии являются предпочтительно ориентированными в определенном выбранном направлении или направлениях. Частичная денатурация является предпочтительной, поскольку она увеличивает устойчивость к биологической деградации, поэтому фибриллы обеспечивают больше времени для миграции и прикрепления клеток хозяина в ходе заживления. Слишком быстрая деградация имплантата может оставить за собой фокус воспаления, который будет плохо заживать и может привести к образованию рубца. Частичная денатурация фибрилл коллагена также повышает механическую прочность во влажном состоянии.
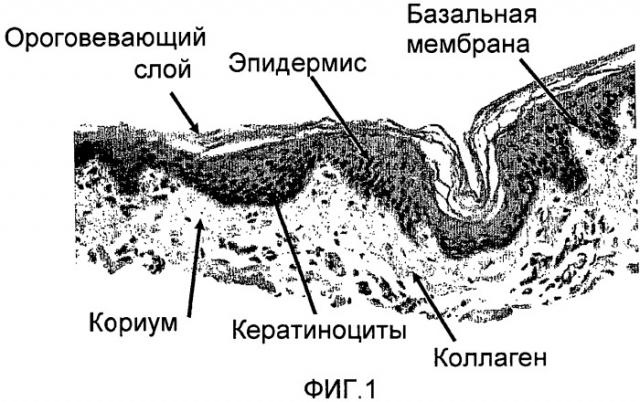
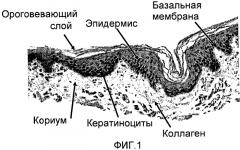
Ориентация фибрилл коллагена также сообщает имплантату более высокую прочность в выбранном направлении, и она направляет скорее миграцию и диссеминацию клеток по поверхности имплантата, чем их проникновение в имплантат. Это подтверждается также тем фактом, что бесклеточный матрикс по настоящему изобретению обладает низкой порозностью в дегидратированном состоянии по сравнению с лиофилизированными биологическими покрытиями на раны, порозность которых обычно выше 75% (по объему). Согласно изобретению порозность имплантата составляет менее 70% (по объему), предпочтительно менее 60% (по объему) и даже более предпочтительно менее 50% (по объему). Низкая порозность и благоприятная ориентация фибрилл являются важными, особенно для имплантатов, используемых в качестве биологических покрытий на раны, например, ожоги, которые, как предполагают, спонтанно отделяются по окончании заживления. Регенерация эпидермального слоя требует миграции кератиноцитов от краев раны в области заживления, которые представляют собой область контакта между раной и поверхностью имплантата. Инфильтрация клеток в структуру имплантата не будет благоприятной, поскольку она может приводить к повторному прикреплению трансплантата к ране. В случае, например, когда трансплантат является подкожным, миграция клеток вдоль его поверхности будет приводить к образованию тонкой фиброзной кисты, что во многих случаях является нежелательным.
Сохранение ориентации коллагена в дегидратированном состоянии также повышает касательную жесткость имплантата (касательную по отношению к ориентации фибрилл), следовательно, даже дегидратированный имплантат легче поддается сгибанию и является менее хрупким, чем сходный анизотропный имплантат. Это имеет значительную практическую важность, поскольку дегидратированный имплантат не нуждается в умягчителях, и в нем не образуются трещины и микроразрывы, которые могут приводить к неконтролируемой инфильтрации имплантата клетками, его разрушению и возможной кальцификации.
Другим важным результатом анизотропной организации фибрилл коллагена является анизотропное набухание имплантата во время регидратации. Согласно изобретению имплантат во время регидратации расширяется с различными скоростями в различных направлениях. Например, если коллагеновые структуры ориентированы, преимущественно, в наиболее длинном направлении (например, при использовании сухожилия), то наибольшее расширение будет наблюдаться в виде увеличения диаметра имплантата, в то время как длина будет изменяться лишь незначительно или может оставаться прежней, слегка увеличиваться или даже уменьшаться в соответствии с взаимоотношениями структурной анизотропии и набухания. В случае поверхностного имплантата, такого как покрытие на рану или ожог, ориентацию фибрилл можно выбрать преимущественно в направлении, перпендикулярной поверхности главной плоскости имплантата. В указанном случае расширение при гидратации будет проявляться в основном или только в плане увеличения толщины, в то время как опорная поверхность останется практически неизменной. Анизотропия набухания, помимо упомянутых выше преимуществ, имеет следующее практическое преимущество: хирург может лучше подобрать форму и размер имплантата для каждого отдельного пациента. Например, если необходимо нанести покрытие на рану определенной формы, имплантат соответствующего размера и формы можно просто выкроить из дегидратированного имплантата, и он останется неизменным после гидратации. В случае изотропных дегидратированных имплантатов измерения в дегидратированном виде должны быть относительно более маленькими, чтобы компенсировать эффект расширения при гидратации. Другим преимуществом также может быть то, каким образом дегидратированный имплантат, прикрепленный к ткани, сохраняет свою форму после гидратации, и, таким образом, окружающая ткань сохраняет то натяжение, которое было выбрано хирургом во время оперативного вмешательства. В случае изотропного имплантата окружающая ткань утратит свое природное натяжение в результате гидратационного расширения имплантата.
Важным является также тот факт, что анизотропия расширения предусматривает простое различение имплантата по настоящему изобретению и других имплантатов сходной природы и назначения.
Анизотропию набухания можно выразить как соотношение между коэффициентами линейного расширения в трех выбранных измерениях. Например, выбранным направлением вдоль оси «z» может быть толщина t , и его коэффициент линейного расширения Cz=(t гидрат.)/( t дегидрат.). Подобно этому можно выбрать длину l в качестве измерения в направлении оси «х» и определить коэффициент линейного расширения как Cx=(l гидрат.)/( l дегидрат.u). И наконец, в качестве измерения в направлении оси «y» можно выбрать ширину w и определить коэффициент линейного расширения как Cy=(w гидрат.)/(w дегидрат.), где подпись «гидрат.» означает размер (измерение) после гидратации, а подпись «дегидрат» означает размер (измерение) в оригинальном, дегидратированном состоянии. В случае изотропного дегидратированного материала всегда обнаруживается, что Cz/Cy=Сх/Cz=Cy/Cz=1, независимо от того, чему равны величины Cx, Cy и Cz. Анизотропное расширение во время гидратации отличается тем фактом, что, по меньшей мере,, одно из соотношений Cx, Cy и Cz имеет величину, отличающуюся от 1, и, по меньшей мере, один из коэффициентов линейного расширения Cx, Cy и Cz имеет величину менее других, и его величина может быть даже менее 1. По меньшей мере, один из коэффициентов линейного расширения Cx, Cy и Cz имеет, наоборот, величину значительно более других, обычно, по меньшей мере, на 10%, предпочтительно более чем на 30%. Например, коэффициенты линейного расширения Cx и Cy могут иметь величину менее 1, в то время как Cz имеет величину более 1,2 и предпочтительно более 1,5.
Согласно настоящему изобретению, коллагеновые фибриллы анизотропных дегидратированных имплантатов ориентированы, предпочтительно в направлении наиболее низкого коэффициента расширения или, в зависимости от обстоятельств, в плоскости, перпендикулярной направлению, в котором величина коэффициента расширения является наибольшей.
Коллагеновые фибриллы могут быть ориентированы, главным образом, в определенном направлении даже в полностью гидратированном состоянии. Указанная ориентация может достигаться частичной денатурацией коллагена в ориентированном состоянии или поперечной сшивкой коллагена (которая также является формой денатурации). Ориентация коллагеновых фибрилл затем остается практически неизменной даже после гидратации имплантата. Указанную ориентацию можно использовать во благо, для направления миграции и пролиферации клеток в определенном направлении, что является благоприятным в особенности для заживления ожогов.
Поперечную сшивку коллагена можно осуществлять с использованием хорошо известных способов, например, воздействием альдегидов, таких как, например, формальдегид или глутаровый альдегид, или поливалентных катионов, таких как, например, Ca2+, Mg2+, Al2+ или Cr3+. Поперечная сшивка также уменьшит набухание и увеличит прочность и резистентность к гидролизу коллагенового матрикса. Указанная поперечная сшивка в имплантированном состоянии часто является нестабильной, и постепенное уменьшение поперечно сшивающей плотности впоследствии приведет к постепенному увеличению набухания и к изменению факторов линейного расширения и их взаимных соотношений. Кинетика указанных процессов является контролируемой, и, следовательно, указанные процессы можно использовать, например, для создания направленного давления или натяжения на заживляемых тканях.
Согласно изобретению, бесклеточные матриксы являются в высокой степени гидрофильными, и их объем будет увеличиваться при гидратации. Гидратацию наиболее часто определяют как весовую фракцию воды в гидратированном состоянии или как содержание воды в мас.%. Согласно изобретению содержание воды в полностью гидратированном имплантате превышает 33% (мас.) и предпочтительно превышает 50% (мас.). Коэффициент объемного расширения определяется как:
Cv=Cx×Cy×Cz= (гидратированный объем)/
(дегидратированный объем)>1.
Согласно изобретению, бесклеточные матриксы имеют Cv>1,1, предпочтительно Cv>1,5. Этим они принципиально отличаются от преимущественно гидрофобных пористых структур, которые можно сформировать, например, ковалентной поперечной сшивкой тканей с использованием, например, альдегидов, или их можно сформировать из синтетических полимеров, таких как, например, полиуретаны. В данном случае во время гидратации вода заполняет поры и увеличивает массу имплантата, но его объем существенно не возрастает, а его Cv приближается или практически равняется 1.
Из приведенной выше информации можно сделать вывод о том, что предметом изобретения является, главным образом, бесклеточный, стерильный, практически дегидратированный и, по меньшей мере частично, денатурированный матрикс, полученный из ткани животного и содержащий, главным образом, коллаген, фибриллы которого демонстрируют структурную организацию, присущую оригинальной ткани, предназначенный для использования в качестве временного имплантата в медицине и ветеринарии; указанный матрикс демонстрирует анизотропные изменения своих измерений во время гидратации.
Согласно предпочтительному осуществлению настоящего изобретения во время гидратации бесклеточного матрикса, когда наблюдаются анизотропные изменения измерений матрикса, два наибольших измерения остаются практически неизменными или уменьшаются, в то время как наименьшее измерение увеличивается вместе с увеличением объема матрикса.
Согласно изобретению в другом предпочтительном варианте осуществления настоящего изобретения временный имплантат имеет практически плоскую форму, а его опорная поверхность определяется двумя наибольшими измерениями, в то время как его толщина определяется наименьшим измерением.
Согласно изобретению в еще одном предпочтительном варианте осуществления бесклеточного матрикса два из наименьших размеров будут увеличиваться, в то время как наибольшее измерение остается практически неизменным или уменьшается.
В еще одном предпочтительном варианте осуществления настоящего изобретения временный имплантат имеет, в основном, продолговатую форму, такую как призма или цилиндр, диаметр которой определяется двумя наименьшими измерениями, такими как, например, диаметр, в то время как его длина или высота определяется наибольшим измерением.
Согласно изобретению предпочтительный матрикс в дегидратированном состоянии имеет порозность менее 70% (по объему), предпочтительно менее 60% (по объему) и наиболее предпочтительно менее 50% (по объему).
Согласно изобретению в предпочтительном варианте осуществления бесклеточный матрикс состоит из фибрилл коллагена, которые, по крайней мере, в дегидратированном состоянии ориентированы преимущественно в направлениях, в которых коэффициент линейного расширения при гидратации имеет наименьшее значение, и, в основном, перпендикулярно к направлению, в котором коэффициент линейного расширения при гидратации имеет наибольшее значение.
Согласно изобретению в предпочтительном варианте осуществления бесклеточный матрикс в дегидратированном состоянии имеет содержание воды менее 20% (по массе), предпочтительно менее 10% (по массе) и наиболее предпочтительно менее 5% (по массе).
Согласно изобретению в некоторых предпочтительных вариантах осуществления матрикс может также содержать умягчающие, консервирующие или бактерицидные добавки. Предпочтительные бактерицидные добавки содержат серебро, предпочтительно в коллоидном состоянии и даже более предпочтительно в виде комплекса серебро-белок. Предпочтительные умягчающие или консервирующие добавки содержат соединения, смешивающиеся с водой, такие как DMSO или полигидроксильные соединения, выбранные из семейств гликоля или глицерина или их производных, триэтаноламина и сахаридов.
Согласно изобретению предпочтительный бесклеточный матрикс способен к объемному расширению при контакте с водными жидкостями, с коэффициентом объемного расширения более 1,1, предпочтительно более 1,5. Помимо этого, предпочтительный бесклеточный матрикс после воздействия подходящих водных растворов способен принимать форму, которая содержит более 33% воды (по массе), предпочтительно более 50% воды (по массе).
Согласно изобретению, предпочтительный бесклеточный матрикс имеет наивысший коэффициент линейного расширения на 10% выше, предпочтительно на 30% выше наименьшего коэффициента линейного расширения. Предпочтительными являются бесклеточные матриксы, у которых наивысший коэффициент линейного расширения имеет величину более 1,2, предпочтительно более 1,5, в то время как наименьший коэффициент линейного расширения имеет величину менее 1,1, предпочтительно менее 1,05.
Согласно изобретению, в еще одном предпочтительном варианте осуществления твердые вещества (сухое вещество) бесклеточного матрикса состоят преимущественно из белков, а предпочтительный белок состоит преимущественно из коллагена. Еще более предпочтительно твердые вещества (сухое вещество) бесклеточного матрикса содержат от 70% (по массе) до 95% (по массе), предпочтительно от 80% (по массе) до 90% (по массе) белков коллагенового типа. Предпочтительно, если твердые вещества (сухое вещество) матрикса содержат, помимо белков, более низкую фракцию липидных соединений, включая липопротеины и фосфолипиды.
Согласно изобретению, бесклеточный матрикс является предпочтительным, когда его белковая фракция является, по меньшей мере частично, денатурированной. Согласно изобретению, в еще одном варианте осуществления по меньшей мере белковая фракция бесклеточного матрикса является поперечно сшитой в результате взаимодействия с альдегидами или поливалентными катионами.
Согласно изобретению, предпочтительный бесклеточный матрикс получен от млекопитающего, предпочтительно от свиньи.
Согласно изобретению, предпочтительная ткань животного для бесклеточного матрикса представляет собой кожу, плаценту, перикард, твердую мозговую оболочку, кишку, сухожилие или хрящ.
Временный имплантат, образованный бесклеточным матриксом по настоящему изобретению, предпочтительно используют в качестве покрытия на рану, более предпочтительно в качестве покрытия на ожог.
Согласно изобретению, другой предпочтительный вариант осуществления бесклеточного матрикса представляет собой матрикс, который содержит также культивированные клетки млекопитающего. Предпочтительно млекопитающее представляет собой свинью, а культивированные клетки млекопитающего представляют собой человеческие аутологичные или аллогенные кератиноциты.
Согласно изобретению, другой предпочтительный вариант осуществления бесклеточного матрикса представляет собой матрикс, который будет подвергаться биологической деградации после выполнения своей функции.
Способ изготовления имплантата по настоящему изобретению, как было описано выше, включает несколько основных этапов:
1) Сбор имплантата, такого как кожа свиньи или сухожилие человека. Данный этап осуществляют, в основном, так же, как в случае других, современных способов, но с тем важным преимуществом, что, согласно настоящему изобретению, сбор имплантата не является столь же требовательным к условиям транспортировки и последующей быстрой обработки, как в случае имплантатов, содержащих клетки. Коллагеновые структуры, которые будут представлять собой конечные имплантаты, являются более стабильными, чем клеточные структуры.
2) Удаление клеток. Согласно изобретению, различные способы удаления клеток можно использовать для указанного имплантата, включая способы, описанные в настоящем уровне технологии. Последнее включает в себя удаления клеток с использованием поверхностно-активных агентов, таких как детергенты, химических соединений, таких как кислоты и щелочи, или ферментов, как описано в последующих патентных заявках и документах, которые включены в настоящую заявку: CN 200310124306 (Hu Jie); СТ20051126108 (Dong Qun Lin); CN 20041022506 20040512 (Dai Weihua et al.); US 2005 0186286 A1 (Yoshihiro Takami); JP 19900247300 (Koide Mikio) и патент CZ № 281176 (E. Matouskova).
Согласно изобретению, двухэтапный способ является предпочтительным, в котором на первом этапе собранную ткань подвергают воздействию подходящего протеолитического фермента, такого как трипсин или папаин, а на втором этапе ткань, включающую возможные оставшиеся клетки, подвергают воздействию сильного гипотонического раствора, предпочтительно избытку дистиллированной или деионизированной воды. Деионизированная вода удалит оставшиеся клетки, подвергая из осмотическому шоку, который вызывает разрыв их мембран. Указанный второй этап удаления клеток имеет место вместе с многоэтапной экстракцией оставшегося фермента (такого как трипсин) и других соединений. Вместе с удалением оставшегося фермента удаляются также растворимые пептиды, а также полисахариды, гликопротеины и другие соединения с предполагаемой биологической активностью. Удаление водорастворимых соединений является даже бол