Способ получения фотокатализатора для разложения органических загрязнителей
Иллюстрации
Показать всеИзобретение относится способу получения фотокатализатора. Описан способ получения фотокатализатора для разложения органических загрязнителей, заключающийся в приготовлении шихты из прекурсоров, взятых в стехиометрических соотношениях, которую смешивают с низкоплавким флюсом, прокаливанием смеси и последующим промыванием полученного фотокатализатора, причем в качестве прекурсоров взяты оксиды висмута, по крайней мере, один оксид металла из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å и, по крайней мере, один оксид метала из группы металлов, имеющих ионный радиус в интервале от 0,9 до 1,5 Å, смесь содержит от 1-80% флюса, в качестве флюса использована смесь NaCl и KCl, а прокаливание смеси осуществляют при температуре 700-900°С в течение 30-120 минут. Технический результат - получен эффективный фотокатализатор. 7 з.п. ф-лы, 7 ил., 1 табл., 10 пр.
Реферат
Изобретение относится способу получения материалов, обладающих каталитическими, в частности фотокаталитическими, свойствами. Каталитические свойства предлагаемых материалов могут находить применение в органическом синтезе, в частности в реакциях дегидрирования, например дегидрирования бутана до 1,3-бутадиена. Фотокаталитические материалы широко используют для очистки воздуха и воды от биологических, минеральных и органических загрязнителей путем гетерогенных фотоиндуцированных каталитических процессов, в ходе которых образуются продукты, безопасные для окружающей среды и человека.
В последние годы значительно вырос интерес к фотокатализаторам на основе фаз Ауривиллиуса. К фазам Ауривиллиуса относят соединения, обладающие общей формулой [Bi2O2][An-1BnO3n+1], где В - металл, обладающий ионным радиусом от 0,5 до 0,8Å, а А - металл, обладающий ионным радиусом от 0,9 до 1,5Å. К преимуществам таких фотокатализаторов относится в первую очередь их способность проявлять фотокаталитическую активность при облучении не только ультрафиолетовым, но и видимым светом.
В настоящее время наиболее широко используемыми способами получения фотокаталитических материалов на основе фаз Ауривиллиуса являются керамический синтез, синтез методом соосаждения и золь-гель синтез.
Известен способ получения фотокатализаторов по керамической технологии с использованием в качестве прекурсоров оксидов, гидроксидов, карбонатов или нитратов металлов [1, 2]. Известный способ требует прокаливания в течение 3 дней при 700°С [1] или 4-8 часов при 800-950°С [2]. Кроме того, получаемый таким способом материал содержит частицы больших размеров, что снижает его эффективность в качестве катализатора.
Известен способ получения фотокатализаторов соосаждением из раствора, содержащего соли металлов, с последующим прокаливанием полученного прекурсора [3]. Известный способ позволяет получать частицы размером около 100 нм. Однако он требует значительных затрат времени (получение прекурсора - до суток; прокаливание прекурсора - не менее 6 ч). Кроме того, значительные сложности вызывает его распространение на фазы Ауривиллиуса, содержащие ниобий или тантал, так как их растворимые в воде соединения значительно менее доступны.
Известен способ получения фотокатализаторов в расплаве Bi2O3 [4]. Известный способ позволяет получить частицы материала с минимальным содержанием дефектов, однако требует длительного прокаливания при 1330-1450°С.
Известен способ получения фотокатализаторов Bi4M2O11 (М=Nb, Та, V) [5] гидротермальным методом. Гидротермальная обработка проводится при 160-200°С в течение 12-24 ч и требует специализированного оборудования, устойчивого к высоким давлениям и коррозионно-активной среде.
Известен способ получения фотокатализатора на основе Bi2WO6 [6], который является наиболее близким по решаемой технической задаче, достигаемому техническому результату, использованию в качестве способа получения фотокатализатора синтеза в расплаве солей, и выбранный в качестве прототипа. Этот способ заключается в приготовлении смеси нитратов лития и натрия в весовом отношении 27:23, используемой в качестве реакционной среды; смешивании реакционной среды и используемых для реакции оксидов в весовом отношении (5-30):1, добавлении безводного спирта, перетирании и высушивании при 50-80°С; нагревании полученной смеси до 200-500°С со скоростью 2-5°С/мин и выдерживании при этой температуре в течение 2-8 часов; растворении реакционной среды, фильтровании, промывании и высушивании при 50-80°С.
Недостатком прототипа является сравнительно высокая продолжительность синтеза (4-10 часов с учетом времени нагрева), а также низкая кристалличность получаемого продукта, приводящая к сравнительно невысокой фотокаталитической активности.
Заявленное изобретение свободно от этих недостатков.
Техническим результатом заявленного изобретения является получение более эффективного фотокатализатора за более короткое время.
Указанный технический результат достигается тем, что в заявленном способе получения фотокатализатора для разложения органических загрязнителей, который заключается в приготовлении шихты из прекурсоров, взятых в стехиометрических соотношениях, которую затем смешивают с низкоплавким флюсом, проводят прокаливание смеси и последующее промывание полученного фотокатализатора, в соответствие с изобретением в качестве прекурсоров взяты оксид висмута, по крайней мере, один оксид металла из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å и, по крайней мере, один оксид метала из группы металлов, имеющих ионный радиус в интервале от 0,9 до 1,5 Å, смесь содержит от 1-80% флюса, в качестве флюса использована смесь солей NaCl и KCl, а прокаливание смеси осуществляют при температуре 700-900°С в течение 30-120 минут.
Кроме того, указанный технический результат достигается тем, что то в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å, выбран титан.
Помимо того, указанный технический результат достигается тем, что в качестве оксидов металлов из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å, выбраны титан и ниобий.
Кроме этого, указанный технический результат достигается тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å, выбран тантал.
Помимо этого, указанный технический результат достигается тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å, выбраны титан и тантал.
Кроме того, указанный технический результат достигается тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,9 до 1,5 Å, выбран висмут.
Кроме того, указанный технический результат достигается тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,9 до 1,5 Å, выбран неодим.
Кроме того, указанный технический результат достигается тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,9 до 1,5 Å, выбран неодим.
Кроме того, указанный технический результат достигается тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,9 до 1,5 Å, выбран свинец.
На базе Санкт-Петербургского государственного университета были проведены лабораторные исследования, отражающие конкретные примеры реализации указанного изобретения.
Примеры конкретной реализации составов и способов получения фотокатализатора.
Пример 1.
В качестве флюса использовали смесь солей NaCl и KCl. Указанные соли, взятые в эквимолярном соотношении, предварительно совместно перетерли с добавлением спирта и полученный флюс высушили в сушильном шкафу.
Для получения шихты взяли навески оксидов металлов, выбранных для получения фотокатализатора с общей формулой [Bi2O2][AB2O7], в стехиометрических количествах таким образом, чтобы суммарная масса шихты составила 0,5000 г. Указанные навески смешали и перетирали в агатовой ступке в течение 0,5 ч.
Затем к полученной шихте добавили такое количество флюса, чтобы получить выбранное массовое соотношение шихта-флюс. Полученную смесь дополнительно перетерли в течение 10 минут, запрессовали в таблетку и прокаливали в закрытом тигле в муфельной печи. Использовался следующий режим прокаливания: нагрев в течение 30 минут до выбранной температуры (700-900°С); выдержка при данной температуре в течение 30-120 минут, естественное охлаждение печи до комнатной температуры.
Полученную в результате прокаливания массу переносили на фильтр, представляющий собой целлюлозную мембрану типа МФАС-Б-4 (производство «Владипор»), и промывали дистиллированной водой до полного удаления флюса. Полученный твердый остаток сушили в сушильном шкафу. Чистоту полученного вещества проверяли методом рентгенофазового анализа с использованием дифрактометра Thermo ARL X'TRA. Размер и морфологию частиц изучали методом сканирующей электронной микроскопии. Выбранные для синтеза металлы, а также температурные режимы прокаливания и соотношение шихта-флюс представлены в Таблице.
| № образца | Металл А | Металл В | % флюса в реакционной смеси | Температура прокаливания | Время прокаливания, мин |
| 1 | Bi | Nb/Ti* | 80 | 800 | 60 |
| 2 | Bi | Ta/Ti* | 80 | 800 | 60 |
| 3 | Nd | Nb/Ti* | 80 | 800 | 60 |
| 4 | Pb | Nb | 80 | 800 | 60 |
| 5 | Nd | Ta/Ti* | 80 | 800 | 60 |
| 6 | Bi | Nb/Ti* | 80 | 800 | 30 |
| 7 | Bi | Nb/Ti* | 1 | 900 | 60 |
| 8 | Bi | Nb/Ti* | 1 | 800 | 120 |
| 9 | Bi | Nb/Ti* | 50 | 800 | 90 |
| 10 | Bi | Nb/Ti* | 80 | 700 | 120 |
| *) В случаях, когда в качестве металла В выбраны два металла, их брали в эквимолярных количествах. |
Пример 2.
Способ получения фотокатализатора состава Bi3NbTiO9
Для получения шихты взяли 0,3833 г Bi2O3, 0,0729 г Nb2O5, 0,0438 г TiO2. К шихте добавили 2,0000 г флюса. Прокаливание проводили при 800°С в течение 60 мин.
Пример 3.
Способ получения фотокатализатора состава Bi3NbTiO9
Для получения шихты взяли 0,3833 г Bi2O3, 0,0729 г Nb2O5, 0,0438 г TiO2. К шихте добавили 2,0000 г флюса. Прокаливание проводили при 800°С в течение 30 мин.
Пример 4.
Способ получения фотокатализатора состава Bi3NbTiO9
Для получения шихты взяли 0,3833 г Bi2O3, 0,0729 г Nb2O5, 0,0438 г TiO2. К шихте добавили 0,0050 г флюса. Прокаливание проводили при 900°С в течение 60 мин.
Пример 5.
Способ получения фотокатализатора состава Bi3NbTiO9
Для получения шихты взяли 0,3833 г Bi2O3, 0,0729 г Nb2O5, 0,0438 г TiO2. К шихте добавили 0,0050 г флюса. Прокаливание проводили при 800°С в течение 120 мин.
Пример 6.
Способ получения фотокатализатора состава Bi3NbTiO9
Для получения шихты взяли 0,3833 г Bi2O3, 0,0729 г Nb2O5, 0,0438 г TiO2. К шихте добавили 0,5000 г флюса. Прокаливание проводили при 800°С в течение 90 мин.
Пример 7.
Способ получения фотокатализатора состава Bi3NbTiO9
Для получения шихты взяли 0,3833 г Bi2O3, 0,0729 г Nb2O5, 0,0438 г TiO2. К шихте добавили 2,0000 г флюса. Прокаливание проводили при 700°С в течение 120 мин.
Пример 8.
Способ получения фотокатализатора состава Bi3TaTiO9
Для получения шихты взяли 0,3495 г Bi2O3, 0,1105 г Ta2O5, 0,0400 г TiO2. К шихте добавили 2,0000 г флюса. Прокаливание проводили при 800°С в течение 60 мин.
Пример 9.
Способ получения фотокатализатора состава Bi2NdNbTiO9
Для получения шихты взяли 0,2750 г Bi2O3, 0,0785 г Nb2O3, 0,0993 г Nd2O3, 0,0472 г TiO2. К шихте добавили 2,0000 г флюса. Прокаливание проводили при 800°С в течение 120 мин.
Пример 10.
Способ получения фотокатализатора состава Bi2PbNb2O9
Для получения шихты взяли 0,2439 г Bi2O3, 0,1392 г Nb2O5, 0,1169 г PbO2. К шихте добавили 2,0000 г флюса. Прокаливание проводили при 800°С в течение 60 мин.
Пример 11.
Способ получения фотокатализатора состава Bi2NdTaTiO9
Для получения шихты взяли 0,2491 г Bi2O3, 0,1182 г Ta2O5, 0,0900 г Nd2O3, 0,0427 г TiO2. К шихте добавили 2,0000 г флюса. Прокаливание проводили при 800°С в течение 120 мин.
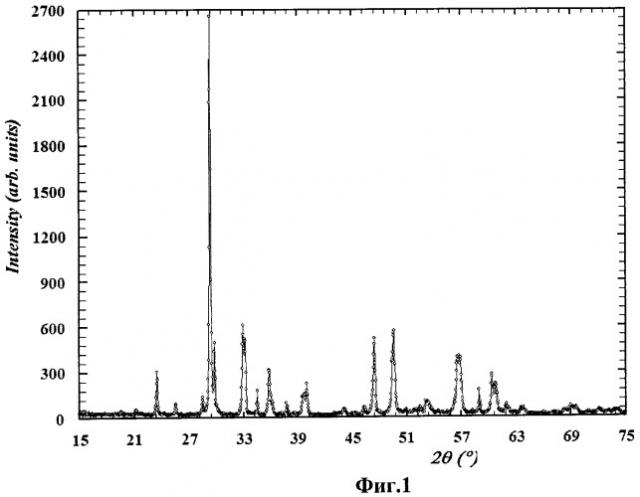
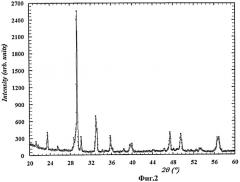
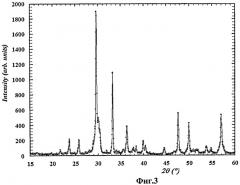
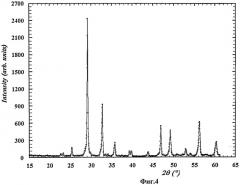
На Фиг.1-5 представлены дифрактограммы образцов фотокатализаторов, полученных способом согласно изобретению. Во всех случаях получено химически чистое вещество требуемого состава.
На Фиг.1 представлена дифрактограмма образцов фотокатализатора состава Bi3NbTiO9 (пример 3).
На Фиг.2 представлена дифрактограмма образцов фотокатализатора состава Bi3NbTiO9 (пример 4).
На Фиг.3 представлена дифрактограмма образцов фотокатализатора состава Bi2NdNbTiO9 (пример 9).
На Фиг.4 представлена дифрактограмма образцов фотокатализатора состава Bi2PbNb2O9 (пример 10).
На Фиг.5 представлена дифрактограмма образцов фотокатализатора состава Bi2NdTaTiO9 (пример 11).
На Фиг.6 представлена электронная микрофотография фотокатализатора согласно Примеру 10. Видно, что фотокатализатор образуется в виде хорошо закристаллизованных пластинок толщиной около 0,2 мкм и диаметром около 1 мкм. Низкая толщина частиц обеспечивает высокую площадь поверхности катализатора, а высокая кристалличность обеспечивает высокий квантовый выход фотокаталитического процесса.
На Фиг.7 представлены графики разложения модельного загрязнителя (краситель метиловый оранжевый) в присутствии фотокатализатора согласно примерам 2 и 10. Анализ кинетической зависимости в случае фотокатализатора согласно примеру 2 показывает, что уже через 30 мин после начала процесса степень разложения модельного загрязнителя составляет более 93%. В случае фотокатализатора, полученного согласно способу прототипа степень разложения модельного загрязнителя составляет 89,7% через 1 час после начала процесса.
Таким образом, заявленное изобретение, как показали результаты многочисленных исследований, позволяет получать более эффективный фотокатализатор за более короткий промежуток времени.
Технико-экономическая эффективность заявленного изобретения состоит в разработке быстрого и недорогого способа получения высокоэффективного фотокатализатора, пригодного для использования в системах очистки воды от органических загрязнителей.
Использованные источники информации
1. US 5935549.
2. CN 101612561.
3. US 4668500.
4. US 6143679.
5. CN 101612560.
6. CN 101264934 - прототип.
1. Способ получения фотокатализатора для разложения органических загрязнителей, заключающийся в приготовлении шихты из прекурсоров, взятых в стехиометрических соотношениях, которую смешивают с низкоплавким флюсом, прокаливанием смеси и последующим промыванием полученного фотокатализатора, отличающийся тем, что в качестве прекурсоров взяты оксиды висмута, по крайней мере, один оксид металла из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å и, по крайней мере, один оксид метала из группы металлов, имеющих ионный радиус в интервале от 0,9 до 1,5 Å, смесь содержит от 1-80% флюса, в качестве флюса использована смесь NaCl и KCl, а прокаливание смеси осуществляют при температуре 700-900°С в течение 30-120 мин.
2. Способ по п.1, отличающийся тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å, выбран титан.
3. Способ по п.1, отличающийся тем, что в качестве оксидов металлов из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å, выбраны титан и ниобий.
4. Способ по п.1, отличающийся тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å, выбран тантал.
5. Способ по п.1, отличающийся тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,5 до 0,8 Å, выбраны титан и тантал.
6. Способ по п.1, отличающийся тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,9 до 1,5 Å, выбран висмут.
7. Способ по п.1, отличающийся тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,9 до 1,5 Å, выбран неодим.
8. Способ по п.1, отличающийся тем, что в качестве оксида металла из группы металлов, имеющих ионный радиус в интервале от 0,9 до 1,5 Å, выбран свинец.