Циклические аминосоединения
Иллюстрации
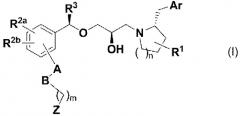
Показать всеИзобретение относится к соединениям формулы (I) или его фармацевтически приемлемым солям:
где R1 означает Н, ОН, галоген, С1-С6алкил, С1-С6алкокси, галогенС1-С6алкил, галогенС1-С6алкокси, фенил; R2a и R2b, одинаковые или отличные и означают Н, галоген, C1-С6алкил, С1-С6алкокси, галогенС1-С6алкил, галогенС1-С6алкокси; R3 означает С1-С6алкил; А означает простую связь, виниленовую группу; В означает простую связь; Аr означает фенил, который необязательно замещен группой(ами), выбранной(ыми) из группы, состоящей из галогена, CN, С1-С6алкила, С1-С6алкокси, галогенС1-С6алкила, галогенС1-С6алкокси; Z означает -СООН, тетразолил; m равно 0, 1, 2, 3, 4, 5, 6; n равно 0 или 1. Соединения проявляют антагонистическую активность в отношении кальциевых рецепторов (CaSR), что позволяет использовать их при лечении или профилактике нарушения, связанного с нарушенным костным или минеральным гомеостазом, такого, как остеопороз. 6 н. и 12 з.п. ф-лы, 151 табл., 190 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям, обладающим антагонистической активностью в отношении кальцийчувствительных рецепторов (CaSR - здесь и далее называемых просто кальциевыми рецепторами).
Предшествующий уровень техники
Известно, что кости являются динамическими органами, которые восстанавливаются за счет постоянно повторяющегося образования и резорбции для морфологических изменений самих костей или для подержания концентрации кальция в крови. В здоровых костях остеогенез за счет остеобластов и костная резорбция за счет остеокластов находятся в равновесии относительно друг друга, поддерживая костную массу в стабильном состоянии. Однако если равновесное состояние между остеогенезом и костной резорбцией нарушается, возникают метаболические костные нарушения, такие как остеопороз (непатентные документы 1 и 2).
В качестве факторов, регулирующих костный метаболизм, сообщалось о многих типах системных гормонов или локальных цитокинов, и остеогенез и стабильное состояние костной ткани поддерживаются за счет взаимодействия между указанными факторами (непатентные документы 1 и 3). Явления остеопороза широко известны как изменения костных тканей, связанные с возрастом. Однако так как в механизм возникновения остеопороза вовлечено множество аспектов, включая пониженную секрецию половых гормонов или нарушения в их рецепторах, изменения в экспрессии цитокинов в локальной кости, экспрессию стареющих генов и дифференциацию или нарушенные функции остеокластов или остеобластов и т.д., достаточно трудно представить такой механизм просто как физиологическое явление, которое связано с возрастом. Первичный остеопороз в основном подразделяют на постменопаузный остеопороз, связанный с пониженной секрецией эстрогена, и старческий остеопороз, связанный с возрастом. Для выяснения механизма возникновения остеопороза и создания терапевтического средства для борьбы с ним существенным является прогресс в фундаментальных исследованиях регуляторных механизмов костной резорбции и остеогенеза.
Остеокласты представляют собой многоядерные клетки, образующиеся из гематопоэтических стволовых клеток, и в результате выделения ионов хлора и ионов водорода на их поверхностях, прилегающих к кости, они подкисляют зазор между клеткой и адгезивной стороной кости и одновременно секретируют катепсин K, который представляет собой кислую протеазу (непатентный документ 4). В результате это вызывает разложение белка костного матрикса и кальцийфосфата, что приводит к переходу кальция в кровь.
Концентрация кальция в сыворотке здоровых млекопитающих четко поддерживается на уровне около 9-10 мг/дл (около 2,5 мМ) (т.е. гомеостаз кальция). Гормон паращитовидной железы (PTH) представляет собой гормон, который играет ключевую роль в поддержании гомеостаза кальция, и, если концентрация Ca2+ в крови понижается, немедленно стимулируется секреция PTH из паращитовидной железы. В костях секретированный PTH соответственно количественно увеличивает Ca2+ в крови за счет промотирования костной резорбции, и в почках он промотирует повторный захват Ca2+ в почечных канальцах, тем самым вызывая повышение концентрации Ca2+ в крови.
Так как известно, что PTH способен увеличивать костную массу, если его периодически вводят человеку или животному, такой способ уже применялся в клиниках в качестве терапевтического средства при лечении остеопороза. Кроме того, в соответствии с тестами, проведенными на животных, сообщалось что как остеогенез, так и костная резорбция феморальной бедренной кости промотируются за счет непрерывного введения бычьего PTH (1-84) крысам, у которых были удалены щитовидная/паращитовидная железы, что соответственно приводило к реальному снижению костной массы. Однако подкожное прерывистое введение PTH не промотирует костной резорбции, но промотирует только остеогенез, приводя к увеличению костной массы (непатентный документ 5). Более того, если человеческий PTH (1-34) периодически вводят крысам в течение 15 недель, начиная с 4 недель после овариэктомии, промотирование остеогенеза и подавление костной резорбции наблюдается в течение периода с 5 недели до 10 недели после начала введения, демонстрируя увеличение костной массы примерно вдвое по сравнению с костной массой группы, которой была проведена имитация операции (непатентный документ 6). Данное сообщение позволяет предположить, что PTH не только предотвращает уменьшение костной массы на модели остеопороза, но также оказывает эффект восстановления костной массы даже у животных, у которых уже наблюдалось заметное уменьшение костной массы.
Хотя PTH препараты являются терапевтическими средствами для лечения остеопороза, которые демонстрируют подтвержденный значимый эффект уменьшения количества переломов костей по данным клинических тестов для пациентов с постменопаузным остеопорозом, будучи биологическими препаратами, они также имеют недостатки. Более конкретно, так как в качестве способа введения используют инъекции, существует проблема, обусловленная болью, связанной с инъекциями. Таким образом, желательно создание фармацевтического препарата, который может периодически повышать концентрацию PTH в крови и который можно вводить перорально.
Кальциевый рецептор представляет собой рецептор, соединенный с G белком, который экспрессируется, главным образом, в клетках паращитовидной железы, и он регулирует секрецию PTH, воспринимая концентрацию Ca2+ в крови (непатентный документ 7). Кальциевый рецептор человека состоит из 1078 аминокислот, и имеются сообщения о том, что кальциевые рецепторы человека экспрессируются в почках, в C клетках щитовидной железы, в мозге, в клетках костного мозга и т.д., а также и в паращитовидной железе. Благодаря связыванию с Ca2+ в качестве лиганда кальциевый рецептор активирует фосфолипазу C за счет связывания с G белком, вызывает продуцирование инозитолтрифосфата и повышение внутриклеточной концентрации Ca2+ и в результате подавляет секрецию PTH (непатентный документ 8). Таким образом ожидается, что фармацевтическое средство, которое ингибирует активацию кальциевого рецептора, т.е. фармацевтический агент, который является антагонистом кальциевого рецептора, будет промотировать секрецию PTH из клеток паращитовидной железы и повышать концентрацию PTH в крови живых организмов. В этом отношении, если повышение концентрации PTH в крови является скорее кратковременным, а не постоянным, ожидается достижение такого же эффекта увеличения костной массы, который происходит в результате периодического введения PTH.
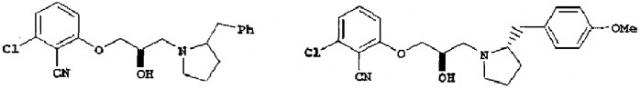
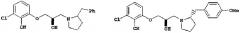
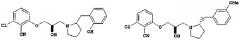
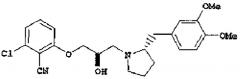
В то же самое время, хотя следующие соединения известны как соединения, имеющие структуру циклического амина (патентный документ 1), они содержат множество других частей, которые отличаются по структуре от соединений настоящего изобретения:
или
Список цитируемых документов
Патентные документы
Патентный документ 1: публикация международной заявки No. WO 2004/106295 (публикация патентной заявки США No. 2004259860).
Непатентные документы
Непатентный документ 1: Endocrinological Review, (1992) 13, p.66-80.
Непатентный документ 2: Principles of Bone Biology, Academic Press, New York, (1996) p.87-102.
Непатентный документ 3: Endocrinological Review, (1996) 17, p.308-332.
Непатентный документ 4: American Journal of Physiology, (1991) 260, C1315-C1324.
Непатентный документ 5: Endocrinology, 1982, 110, 506-512.
Непатентный документ 6: Endocrinology, 1993, 132, 823-831.
Непатентный документ 7: Brown, E.M., "Homeostatic mechanisms regulating extracellular и intracellular calcium metabolism in the parathyroids", (US), Raven press, 1994, 19.
Непатентный документ 8: Nature, 1993, 366, 575-580.
Описание настоящего изобретения
Проблемы, которые должно решить настоящее изобретение
Задачей настоящего изобретения является создание нового низкомолекулярного соединения, которое демонстрирует антагонистическую активность в отношении кальциевых рецепторов и которое в высшей степени безопасно и пригодно для перорального введения.
Средства для решения проблем
Ожидается, что фармацевтический препарат, который ингибирует активацию кальциевых рецепторов, т.е. фармацевтический препарат, который является антагонистом кальциевых рецепторов, будет промотировать секрецию PTH из клеток паращитовидной железы, тем самым вызывая повышение концентрации PTH в крови живых организмов. В этом отношении, если повышение концентрации PTH в крови является скорее кратковременным, а не постоянным, ожидается достижение такого же эффекта увеличения костной массы, который происходит в результате периодического введения PTH.
Авторы настоящего изобретения провели интенсивные исследования для создания терапевтического агента, обладающего антагонистической активностью в отношении кальциевых рецепторов, и в результате обнаружили новые аминосоединения, отличающиеся высокой безопасностью, и которые поэтому можно вводить перорально, что и привело к созданию настоящего изобретения.
Циклические аминосоединения настоящего изобретения представляют собой соединения, обладающие антагонистической активностью в отношении кальциевых рецепторов. Выражение "обладающие антагонистической активностью в отношении кальциевых рецепторов" означает, что ингибируется одна или несколько активностей кальциевых рецепторов, которые индуцируются внеклеточным Ca2+.
Более конкретно настоящее изобретение относится к следующему:
(1)
Соединению, представленному следующей формулой (I), или его фармацевтически приемлемой соли:
[в представленной формуле каждая группа заместителей определена следующим образом:
R1 представляет собой атом водорода, гидроксигруппу, атом галогена, C1-C6алкильную группу, C1-C6алкоксигруппу, галогенC1-C6алкильную группу, галогенC1-C6алкоксигруппу или арильную группу;
R2a и R2b являются одинаковыми или отличаются друг от друга и представляют собой атом водорода, атом галогена, C1-C6алкильную группу, C1-C6алкоксигруппу, галогенC1-C6алкильную группу, галогенC1-C6алкоксигруппу или цианогруппу;
R3 представляет собой C1-C6алкильную группу или галогенC1-C6алкильную группу;
A представляет собой простую связь, замещенную фениленовую группу или виниленовую группу;
B представляет собой простую связь, атом кислорода или атом серы;
Ar представляет собой арильную группу, которая необязательно замещена группой(ами), выбранной(ыми) из группы, состоящей из атома галогена, цианогруппы, C1-C6алкильной группы, C1-C6алкоксигруппы, галогенC1-C6алкильной группы и галогенC1-C6алкоксигруппы;
Z представляет собой -COOH, -SО2NHRz или тетразолильную группу;
Rz представляет собой атом водорода или C1-C6алкильную группу;
m равно 0, 1, 2, 3, 4, 5 или 6].
Предпочтительные варианты настоящего изобретения представлены ниже:
(2)
Соединению, раскрытому в пункте (1) выше, или его фармацевтически приемлемой соли, где R1 представляет собой атом водорода.
(3)
Соединению, раскрытому в пункте (1) или (2) выше, или его фармацевтически приемлемой соли, где R2a и R2b, которые являются одинаковыми или отличаются друг от друга, представляют собой атом водорода, атом фтора, атом хлора, цианогруппу, метильную группу, метоксигруппу, этоксигруппу, трифторметильную группу или трифторметоксигруппу.
(4)
Соединению, раскрытому в любом из пунктах (1)-(3) выше, или его фармацевтически приемлемой соли, где А представляет собой простую связь, и B представляет собой простую связь.
(5)
Соединению, раскрытому в любом из пунктов (1)-(3) выше, или его фармацевтически приемлемой соли, где А представляет собой виниленовую группу, и B представляет собой простую связь.
(6)
Соединению, раскрытому в любом из пунктов (1)-(5) выше, или его фармацевтически приемлемой соли, где Ar представляет собой фенильную группу, которая необязательно замещена группой(ами), выбранной(ыми) из метильной группы, этильной группы, атома фтора и атома хлора.
(7)
Соединению, раскрытому в любом из пунктов (1)-(6) выше, или его фармацевтически приемлемой соли, где n равно 0 или 1.
(8)
Соединению, раскрытому в любом из пунктов (1)-(7) выше или его фармацевтически приемлемой соли, где m равно 2, 3 или 4.
(9)
Соединению, раскрытому в любом из пунктов (1)-(8) выше, или его фармацевтически приемлемой соли, где R3 представляет собой метильную группу или этильную группу.
(10)
Соединению, раскрытому в любом из пунктов (1)-(9) выше, или его фармацевтически приемлемой соли, где Z представляет собой -COOH.
(11)
Соединению, выбранному из следующей группы соединений или их фармацевтически приемлемых солей:
(2E)-3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил]окси)этил]фенил}проп-2-еновой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]фенил]пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]-6-метилфенил}пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]-5-метилфенил]пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]-4-метилфенил}пропановой кислоты,
3-{2-фтор-6-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]фенил}пропановой кислоты,
3-{3-фтор-6-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил]окси)этил]фенил]пропановой кислоты,
3-{4-фтор-2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил]окси)этил]фенил}пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]-6-(трифторметил)фенил]пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]-5-(трифторметил)фенил}пропановой кислоты,
3-{4-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]фенил}пропановой кислоты,
4-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]фенил}бутановой кислоты,
5-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил]окси)этил]фенил}пентановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2R)-2-(3-фтор-4-метилбензил)азетидин-1-ил]-2-гидроксипропил]окси)этил]фенил}пропановой кислоты,
5-{2-[(1R)-1-({(2R)-3-[(2R)-2-(3-фтор-4-метилбензил)азетидин-1-ил]-2-гидроксипропил]окси)этил]фенил]пентановой кислоты
3-{2-хлор-6-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]фенил}пропановой кислоты,
3-{4-фтор-2-[(1R)-1-({(2R)-3-[(2S)-2-(3-фтор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)пропил]фенил}пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-хлор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]-4,5-дифторфенил]пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3,4-дихлорбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]-4,5-дифторфенил}пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(4-хлор-3-этилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]-6-метилфенил}пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(4-хлор-3-фторбензил)пирролидин-1-ил]-2-гидроксипропил}окси)этил]-4-фторфенил]пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(3-хлор-4-метилбензил)пирролидин-1-ил]-2-гидроксипропил}окси)пропил]-4,5-дифторфенил}пропановой кислоты,
3-{2-[(1R)-1-({(2R)-3-[(2S)-2-(4-хлор-3-фторбензил)пирролидин-1-ил]-2-гидроксипропил}окси)пропил]-4,5-дифторфенил}пропановой кислоты.
(12)
Соединению, раскрытому в любом из пунктов (1)-(11), или его фармацевтически приемлемой соли для применения в качестве антагониста рецепторов кальция.
(13)
Фармацевтической композиции, которая содержит соединение, раскрытое в любом из пунктов (1)-(11) выше, или его фармацевтически приемлемую соль в качестве активного компонента.
(14)
Фармацевтической композиции, раскрытой в пункте (13) выше, для применения в качестве антагониста рецепторов кальция.
(15)
Фармацевтической композиции, раскрытой в пункте (13) выше, для применения при лечении или профилактике нарушения, связанного с нарушенным костным или минеральным гомеостазом.
(16)
Фармацевтической композиции, раскрытой в пункте (15) выше, где нарушение, связанное с костным или минеральным гомеостазом, представляет собой гипопаратироидизм; остеосаркому; периодонтит; заживление костных переломов; деформирующий артрит; ревматоидный артрит; болезнь Паджета; гуморальный гиперкальцемический синдром, связанный со злокачественной опухолью и заживлением костных переломов; или остеопороз.
(17)
Фармацевтической композиции, раскрытой в пункте (15) выше, где нарушение, связанное с костным или минеральным гомеостазом, представляет собой остеопороз.
(18)
Способу улучшения костного метаболизма, который отличается тем, что млекопитающему вводят эффективное количество фармацевтической композиции, раскрытой в пункте (13) выше.
(19)
Способу профилактики или лечения остеопороза, который отличается тем, что млекопитающему вводят эффективное количество фармацевтической композиции, раскрытой в пункте (13) выше.
Эффекты настоящего изобретения
Соединение настоящего изобретения или его фармацевтически приемлемая соль функционируют как антагонисты кальциевого рецептора и поэтому эффективны при лечении или профилактике нарушений, связанных с нарушенным костным или минеральным гомеостазом, таких как гипопаратироидизм, остеосаркома, периодонтит, заживление костных переломов, деформирующий артрит, ревматоидный артрит, болезнь Паджета и гуморальный гиперкальцемический синдром, связанный со злокачественной опухолью и заживлением костных переломов, и остеопороз.
Предпочтительный вариант осуществления настоящего изобретения
Далее изобретение раскрывается более подробно.
Предпочтительные примеры соединений формулы (I) включают такие, которые включают следующие комбинации групп заместителей:
R1 представляет собой атом водорода,
R2a и R2b, одинаковые или отличаются друг от друга, и представляют собой атом водорода, атом фтора, атом хлора, цианогруппу, метильную группу, метоксигруппу, этоксигруппу, трифторметильную группу, трифторметоксигруппу,
R3 представляет собой метильную группу или этильную группу,
A представляет собой простую связь или виниленовую группу,
B представляет собой простую связь,
Ar представляет собой фенильную группу, которая необязательно замещена группой(ами), выбранной(ыми) из метильной группы, атома фтора и атома хлора,
Z представляет собой -COOH,
n равно 0 или 1, и m равно 2, 3 или 4.
Более предпочтительные примеры соединений формулы (I) включают соединения, которые раскрыты в примерах.
Термин "атом галогена" относится, например, к атому фтора, атому хлора, атому брома или атому йода, и предпочтительно он является атомом фтора или атомом хлора.
Термин "C1-C6алкильная группа" относится к неразветвленной или разветвленной алкильной группе, содержащей 1-6 атомов углерода, и предпочтительно представляет собой метильную группу, этильную группу, пропильную группу, изопропильную группу или трет-бутильную группу, более предпочтительно метильную группу.
Термин "C1-C6алкоксигруппа" относится к группе, в которой атом кислорода связан с указанной выше "C1-C6алкильной группой", и предпочтительно представляет собой метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу или трет-бутоксигруппу, более предпочтительно метоксигруппу.
Термин "галогенированная C1-C6алкильная группа" относится к группе, в которой атом галогена является заместителем указанной выше "C1-C6алкильной группы". Примеры включают фторметильную группу, дифторметильную группу, трифторметильную группу, фторэтильную группу, дифторэтильную группу и трифторэтильную группу и предпочтительно трифторметильную группу.
Термин "галогенированная C1-C6алкоксигруппа" относится к группе, в которой атом галогена является заместителем указанной выше "C1-C6алкоксигруппы". Примеры включают фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, фторэтоксигруппу, дифторэтоксигруппу и трифторэтоксигруппу и предпочтительно трифторметоксигруппу.
Термин "лечение" означает лечение или ослабление нарушения или симптома, или ингибирование симптома.
Термин "его фармацевтически приемлемая соль" относится к соли, которую можно использовать в качестве фармацевтического агента. Соединение настоящего изобретения можно преобразовать в основную соль или в кислую соль путем взаимодействия с основанием или кислотой, если у указанного соединения имеется кислотная группа или основная группа, и такие соли приведены в данном описании.
Примеры фармацевтически приемлемых "основных солей" соединений настоящего изобретения, предпочтительно, включают соли щелочных металлов, такие как натриевые соли, калиевые соли и литиевые соли; соли щелочноземельных металлов, такие как магниевые соли и кальциевые соли; соли органических оснований, такие как соли N-метилморфолина, соли триэтиламина, соли трибутиламина, соли диизопропилэтиламина, соли дициклогексиламина, соли N-метилпиперидина, соли пиридина, соли 4-пирролидинoпиридина и соли пиколина, или соли аминокислот, такие как соли глицина, соли лизина, соли аргинина, соли орнитина, соли глутамовой кислоты и соли аспарагиновой кислоты. Предпочтительными являются соли щелочных металлов.
Предпочтительные примеры фармацевтически приемлемых "кислых солей" соединений настоящего изобретения включают соли галогеноводородных кислот, такие как гидрофторидные соли, гидрохлоридные соли, гидробромидные соли и гидройодидные соли, соли неорганических кислот, такие как нитраты, перхлораты, сульфаты или фосфаты; низшие алкансульфонатные соли, такие как метансульфонат, трифторметансульфонат или этансульфонат, арилсульфонатные соли, такие как бензолсульфонат или п-толуолсульфонат; соли органических кислот, такие как ацетаты, малаты, фумараты, сукцинаты, цитраты, аскорбаты, тартраты, оксалаты или малеаты; и соли аминокислот, такие как соли глицина, соли лизина, соли аргинина, соли орнитина, соли глутамина и соли аспарагина. Наиболее предпочтительными являются соли галогеноводородных кислот.
К соединению или его фармацевтически приемлемой соли настоящего изобретения может быть добавлена адсорбционная вода, или оно становится гидратом за счет включения молекул воды, если его оставить на воздухе, или путем перекристаллизации, и такие гидраты, а также сольваты и кристаллические полиморфы также включены в объем настоящего изобретения.
Соединение, его соль или сольват соединения настоящего изобретения его соли могут иметь различные изомеры, такие как геометрические изомеры, такие как цис-форма и транс-форма, или оптические изомеры, такие как таутомеры или d-форма и l-форма, и т.д., в зависимости от типа и комбинации групп заместителей. Если нет специальных ограничений, соединения настоящего изобретения включают все изомеры, стереоизомеры и смеси изомеров и стереоизомеров в любом соотношении. Смеси изомеров могут быть разделены, используя методы разделения, хорошо известные в данной области.
Соединения настоящего изобретения включают меченные изотопами соединения, т.е. соединения, в которых один или более атомов соединения настоящего изобретения заменены изотопом (например, 2H, 3H, 13C, 14C, и 35S и т.д.).
Настоящее изобретение включает фармацевтически приемлемые пролекарства соединений настоящего изобретения. Под фармацевтически приемлемым пролекарством подразумевают соединение, содержащее группу, которую можно преобразовать в аминогруппу, гидроксигруппу или карбоксильную группу и т.д. соединения настоящего изобретения путем гидролиза или в физиологических условиях. Примеры групп, которые образуют такие пролекарства, включают группы, раскрытые в Prog. Med., Vol. 5, pages 2157-2161, 1985 или в "Development of Drugs", Molecular Design (Hirokawa Shoten, 1990), Vol. 7, pages 163-198. Конкретные примеры пролекарств включают: если в соединении настоящего изобретения присутствует аминогруппа, соединения, в которых аминогруппа ацилирована, алкилирована или фосфорилирована (т.е. соединения, в которых указанная аминогруппа эйкозаноилирована, аланилирована или пентилaминoкарбонилирована, (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонилирована, тетрагидрофуранилирована, пирролидилметилирована, пивалоилоксиметилирована или трет-бутилирована и т.д.), и т.д. Если в соединении настоящего изобретения присутствует гидроксигруппа, примеры включают соединения, в которых гидроксигруппа ацилирована, алкилирована, фосфорилирована или боратирована (т.е. соединения, в которых гидроксигруппа ацетилирована, пальмитоилирована, пропаноилирована, пивалоилирована, сукцинилирована, фумарилирована, аланилирована или диметиламинометилкарбонилирована и т.д.), и т.д. Кроме того, если в соединении настоящего изобретения присутствует карбоксигруппа, примеры включают соединения, в которых карбоксигруппа этерифицирована или амидирована (т.е. соединения, в которых карбоксигруппа этерифицирована, фенилэтерифицирована, карбоксиметилэтерифицирована, диметиламинометилэтерифицирована, пивалоилоксиметилэтерифицирована, этоксикарбонилоксиэтилэтерифицирована, амидирована или метиламидирована и т.д.) и т.д.
Кроме того, настоящее изобретение включает соединения, в которых функциональная группа соединения настоящего изобретения заменена так называемой эквивалентной группой. Примеры так называемых эквивалентных групп включают группы, раскрытые, например, в The Practice of Medicinal Chemistry (Camille Georges Wermuth, Academic Press, 1996). В частности, группы, эквивалентные карбоксигруппам, перечислены на стр. 215-217 The Practice of Medicinal Chemistry.
(Способы получения)
Соединения настоящего изобретения могут быть получены при использовании различных, хорошо известных способов синтеза в соответствии с характеристиками, которые основаны на основном скелете или на группах заместителей данного соединения. Примеры хорошо известных способов включают такие, которые описаны в "ORGANIC FUNCTIONAL GROUP PREPARATIONS", 2nd edition, ACADEMIC PRESS, INC., 1989 или в "Comprehensive Organic Transformations", VCH Publishers Inc., 1989.
В таком случае, в зависимости от типа функциональной группы может оказаться эффективным с точки зрения технологии производства защитить функциональные группы соответствующими защитными группами на время, когда исходный материал поступает на промежуточную стадию, или заменить функциональные группы группами, которые могут быть легко преобразованы.
Примеры функциональных групп включают аминогруппы, гидроксигруппы и карбоксигруппы и т.д. и поэтому защитные группы включают такие, как описано в "Protective groups in Organic Synthesis", T. W. Greene and P.G. Wuts, 3rd edition, (1999). В зависимости от условий реакции они могут быть соответствующим образом выбраны и использованы. Согласно таким способам вводят защитные группы, осуществляют реакцию и при необходимости защитные группы удаляют или превращают в группы, необходимые для получения целевого соединения.
Кроме того, пролекарство соединений настоящего изобретения можно получить введением определенных групп, пока исходный материал находится на промежуточной стадии, способом, аналогично описанному выше для защитных групп, или путем проведения взаимодействия с использованием соединения настоящего изобретения. Указанное взаимодействие можно осуществить, используя способы, хорошо известные специалистам в данной области, основанные на обычных реакциях этерификации, амидирования, дегидратации или гидрирования и т.д.
Далее будут представлены способы получения соединений настоящего изобретения. Однако способы получения не ограничиваются приведенными ниже способами.
Способ A представляет собой способ получения соединения (a-7):
Способ A
[в представленных формулах R1, Ar и n имеют указанные выше значения, и PGa представляет собой защитную группу для aминoгруппы].
Стадия A-1:
Данная стадия представляет собой реакцию конденсации карбоновой кислоты и гидроксиламина, т.е. стадию получения соединения (a-2) из соединения (a-1).
Стадия A-2:
Данная стадия представляет собой стадию получения соединения (a-3), т.е. кетона, путем взаимодействия соединения (a-2) с реактивом Гриньяра. Стадия A-3 представляет собой стадию восстановления соединения (a-3) с получением соединения (a-4).
Стадии A-1 до стадии A-3 осуществляют согласно способу, описанному Zhou et al в Heteroatom Chemistry 2003, 14, 603-606.
Стадии A-4 до стадии A-6 представляют собой стадии получения соединения (a-7) из соединения (a-4). Реакцию Barton-McCombie, включенную в стадию A-4, и стадию A-5, осуществляют согласно способу, описанному Mulzer et al в J. Org. Chem. 1986, 51, 5294-5299.
Стадию A-6 осуществляют путем удаления защитных групп согласно способу, описанному в Protective groups in Organic Synthesis (3rd edition, 1999).
Кроме того, соединение (a-7) можно синтезировать способом B.
Способ B
[в представленных формулах R1, Ar, n и PGa имеют указанные выше значения, и Ph представляет собой фенильную группу].
Стадия B-1:
Данная стадия представляет собой стадию получения соединения (b-2) путем фосфоэтерификации соединения (b-1).
Стадия B-2:
Данная стадия представляет собой стадию получения соединения (a-3) с использованием реактива Гриньяра, аналогично описанной выше стадии A-2.
Стадия B-3:
Данная стадия представляет собой стадию получения соединения (a-6) путем бензилирования кетона соединения (a-3).
Стадия B-4:
Указанную стадию осуществляют путем удаления защитных групп согласно способу, описанному в Protective groups in Organic Synthesis (3rd edition, 1999), аналогично описанной выше стадии A-6.
Стадии B-1 до стадии B-4 осуществляют согласно способам, описанным в примере реакций, показанных на стр. 16 в WO 2004/106295 и Yang et al в Bioorg. Med. Chem. Lett. 2005, 15, 1225-1228 by.
Способ C представляет собой способ получения соединения (c-10) настоящего изобретения:
Способ C
[в приведенных формулах R1, R3, Ar, m и n имеют указанные выше значения, R2 имеет такие же значения, как R2a или R2b выше, PGc представляет собой защитную группу для карбоксигруппы, и L1 и L2 представляют собой уходящую группу для реакции замещения].
Стадия C-1:
Данная стадия представляет собой стадию получения соединения (c-2) с использованием соединения (c-1), т.е. замещенной бензойной кислоты, и гидрохлоридной соли N,О-диметилгидроксиламина, и ее осуществляют согласно способу, описанному Kunishima et. al в Tetrahedron 1999, 55, 13159-13170.
Стадия C-2:
Указанную стадию можно осуществить аналогично стадии получения соединения (c-3) из соединения (c-2). Кроме того, после получения соединения (c-4) путем восстановления соединения (c-3) на стадии C-3 соединение (c-6) получают путем взаимодействия соединения (c-4) и соединения (c-5) на стадии C-4.
Стадии C-2 до стадии C-4 осуществляют согласно способу примера реакций, показанных на стр. 40 WO 02/14259. Более конкретно, стадию C-2 осуществляют согласно стадии 2 примера 23, который описан на стр. 49 WO 02/14259. Стадию C-3 осуществляют согласно стадии 1 примера 21, который описан на стр. 66 WO 02/14259. Стадию C-4 осуществляют согласно стадии 2 примера 1, который описан на стр. 50 WO 02/14259.
Стадии C-5 до стадии C-7 представляют собой стадии получения соединения (c-10) из соединения (c-6) согласно примеру реакций, описанных на стр. 61 WO 04/106280. Более конкретно, стадию C-5 осуществляют согласно стадии 2 примера 1, который описан на стр. 67 WO 04/106280. Стадию C-6 осуществляют на основании стадии 4 примера 1, который описан на стр. 68 WO 04/106280. Стадию C-7 осуществляют согласно стадии 5 примера 1, который описан на стр. 68 WO 04/106280.
Способ D представляет собой способ получения соединения (d-2) настоящего изобретения:
Способ D
[в приведенных формулах R1, R2, R3, Ar, m, n и PGc имеют указанные выше значения].
Стадия D-1:
Данная стадия представляет собой стадию получения соединения (d-1) путем восстановления соединения (c-9), и ее осуществляют согласно примеру 2, описанному на стр. 16 WO 2005/077886.
Стадия D-2:
Данная стадия представляет собой стадию получения соединения (d-2) путем гидролиза соединения (d-1) и ее осуществляют способом, аналогично описанному выше для стадии C-7.
Способ E представляет собой получения соединения (e-2):
Способ E
[в приведенных формулах Ar имеет указанные выше значения, и PGh представляет собой защитную группу для гидроксигруппы].
Стадия E-1:
Данная стадия представляет собой стадию получения соединения (e-2) путем удаления защитных групп для гидроксигрупп соединения (e-1) обычным способом.
Способ F представляет собой способ получения соединения (c-3)', которое представляет собой промежуточное соединение настоящего изобретения:
Способ F
[в приведенных формулах R3, L1 и PGh имеют указанные выше значения, и R2' представляет собой C1-C6алкильную группу или галогенC1-C6алкильную группу].
Стадия F-1:
Данная стадия представляет собой стадию получения соединения (f-2) путем удаления защитных групп для гидроксигрупп соединения (f-1).
Стадия F-2:
Данная стадия представляет собой стадию получения соединения (c-3)' путем взаимодействия гидроксигрупп соединения (f-2) с алкилирующим реагентом.
Способ G представляет собой способ получения соединения (c-1), которое является промежуточным продуктом при получении соединения настоящего изобретения:
Способ G
[в приведенных формулах R2, L1 и PGc имеют указанные выше значения].
Стадия G-1:
Данная стадия представляет собой стадию получения соединения (g-2) путем осуществления реакции внедрения CO в соединение (g-1) в присутствии палладиевого катализатора.
Стадия G-2:
Данная стадия представляет собой стадию получения соединения (g-3) путем превращения аминогруппы соединения (g-2) в уходящую группу.
Стадия G-3:
Данная стадия представляет собой стадию получения соединения (c-1) путем удаления защитных групп для карбоксигрупп соединения (g-3).
Способ H представляет собой способ получения соединения (c-3)'', которое представляет собой промежуточный продукт при получении соединения настоящего изобретения.
Способ H
[в приведенных формулах R2, L1 и PGc имеют указанные выше значения, и X представляет собой группу галогена].
Стадия H-1:
Данная стадия представляет собой стадию получения соединения (h-2) путем взаимодействия соединения (h-1) с оловоорганическим соединением в присутствии палладиевого катализатора.
Стадия H-2:
Данная стадия представляет собой стадию получения соединения (c-3)'' путем осуществления взаимодействия, аналогично описанному выше для стадии G-2.
Способ I представляет собой способ получения соединения (c-3), которое представляет собой промежуточный продукт при получении соединения настоящего изобретения:
Способ I
[в приведенных формулах R2, R3 и L1 имеют указанные выше значения].
Стадия I-1:
Данная стадия представляет собой стадию получения соединения (i-1) путем восстановления карбоксигрупп соединения (c-1).
Стадия I-2:
Данная стадия представляет собой стадию получения соединения (i-2) путем окисления гидроксигрупп соединения (i-1) до альдегида.
Стадия I-3:
Данная стадия представляет собой стадию получения соединения (i-3) путем взаимодействия соединения (i-2) с реактивом Гриньяра.
Стадия I-4:
Данная стадия представляет собой стадию