Производное циклогексана и его фармацевтическое применение
Иллюстрации
Показать всеНастоящее изобретение относится к производным циклогексана, представленным общей формулой (I), в которой заместитель А является группой общей формулы (IIa) или (IIb), где радикалы и символы определены в формуле изобретения. Соединения формулы (I) обладают сильным анальгетическим действием как на ноцицептивную боль, так и на невропатическую боль и в меньшей степени побочными действиями. Описано также их фармацевтическое применение. 5 н. и 12 з.п. ф-лы, 43 табл., 7 ил., 99 ссылочных пр., 78 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к производным циклогексана и к их медицинскому применению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ
Боль является случаем, который сопровождается неприятным ощущением или неприятными эмоциями, которые имеют место, когда ткань повреждается или может быть повреждена. Боль грубо подразделяется на ноцицептивную боль и невропатическую боль в зависимости от ее причины.
Термин “ноцицептивная боль” обозначает боль, вызываемую, когда ткани тела повреждаются или когда на ткани тела воздействует ноцицептивный стимул, который может вызвать такую боль, и ноцицептивная боль вызывается через воздействие ноцицептора. Примеры ноцицептивной боли включают в себя физиологические боли и воспалительные боли.
Термин “невропатическая боль” обозначает патологическую боль вследствие функциональной аномалии периферических нервов или самой центральной нервной системы, и невропатическая боль вызывается непосредственно повреждением нервов или давлением на них без воздействия ноцицептивного стимула на ноцицептор.
Примеры терапевтических лекарственных средств от ноцицептивной боли включают в себя нестероидные противовоспалительные лекарственные средства (NSAID) и наркотические анальгетические средства (например, опиоид), и примеры терапевтических средств от невропатической боли включают антиконвульсивные агенты, антидепрессанты, противотревожные агенты и антиэпилептики, такие как габапентин и прегабалин.
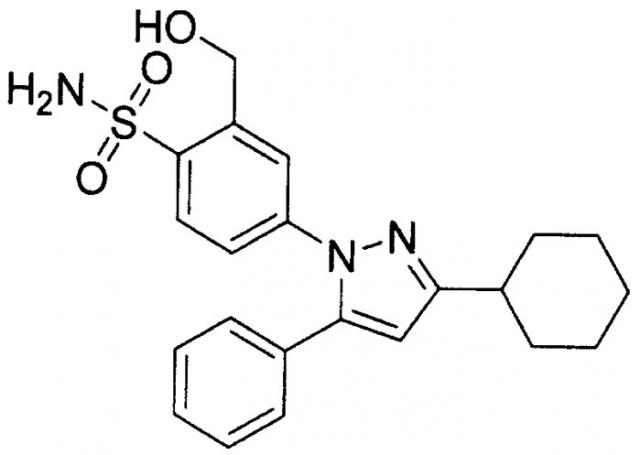
Далее, в последние годы сообщается, что производные пиразола являются эффективными в качестве анальгетического или терапевтического лекарственного средства от невропатической боли (Патентный документ 1) и что производное циклогексана следующей ниже формулы, имеющее сульфонил в ароматическом кольце, связанном с пиразольным кольцом, оказывает анальгетическое действие на невропатическую боль (Патентный документ 2).
ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Патентные документы
[Патентный документ 1] WO 08/105383
[Патентный документ 2] WO 00/066562
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
Однако, что касается производных циклогексана, не было обнаружено соединений, имеющих или не имеющих серных функциональных групп в ароматическом кольце, связанном с пиразольным кольцом, которые оказывают анальгетическое действие, и пока не предполагалась возможность того, что такие соединения оказывают анальгетическое действие.
Далее, известно, что введение нестероидного противовоспалительного лекарственного средства сопровождается побочными эффектами, такими как желудочно-кишечная дисфункция и ренальные расстройства, а введение наркотического анальгетика сопровождается такими побочными эффектами, как констипация (замедленное, затрудненное или систематически недостаточное опорожнение кишечника), сонливость, тошнота и рвота. Далее, указывалось, что введение описанных выше терапевтических лекарственных средств от невропатической боли часто сопровождается побочными эффектами центральной нервной системы, такими как вертиго (головокружение), тошнота и рвота, и поэтому их длительное введение затруднено.
Далее, поскольку механизм, по которому вызывается боль, в огромной степени различен между ноцицептивной болью и невропатической болью, пока еще не разработаны соединения, обладающие сильным анальгетическим действием на обе боли.
Таким образом, настоящее изобретение направлено на создание соединения, оказывающего сильное анальгетическое действие как на ноцицептивную боль, так и на невропатическую боль и проявляющего меньше побочных эффектов, и на его медицинское применение.
СРЕДСТВА РЕШЕНИЯ ПРОБЛЕМ
Настоящие изобретатели провели интенсивные исследования по решению указанных выше проблем и нашли циклогексановые производные, оказывающие сильное анальгетическое действие как на ноцицептивную, так и на невропатическую боль, и указанные циклогексановые производные обладают отличной метаболической стабильностью и безопасностью.
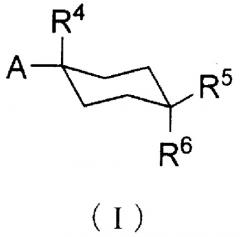
А именно, настоящее изобретение предоставляет производное циклогексана, представленное общей формулой (I):
[в которой
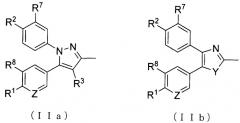
А представляет собой заместитель, представленный общей формулой (IIa) или (IIb):
R1 и R2, каждый независимо, представляет атом водорода, атом хлора, С1-С3 галогеналкил, С1-С4 алкил, С1-С4 алкокси или циано;
R3 представляет атом водорода или атом хлора;
R4 представляет атом фтора, гидроксиметил или гидроксил;
R5 и R6, каждый независимо, представляет атом водорода, атом фтора, С1-С3 галогеналкил, карбоксил, метоксикарбонил, этоксикарбонил, С1-С4 алкокси, гидроксил или С2-С5 алкилкарбонилокси, или R5 и R6 могут вместе образовывать оксо группу;
R7 и R8, каждый независимо, представляет атом водорода или атом фтора;
Y представляет атом кислорода или серы; и
Z представляет атом азота или метин]
или его фармацевтически приемлемую соль или пролекарство.
Предпочтительно, в указанном выше производном циклогексана R1 и R2, каждый независимо, представляет собой атом водорода, атом хлора, С1-С3 галогеналкил, С1-С4 алкил или С1-С4 алкокси; R5 и R6, каждый независимо, представляет атом водорода, атом фтора, С1-С3 галогеналкил, карбоксил, С1-С4 алкокси, гидроксил или С2-С5 алкилкарбонилокси, или R5 и R6 могут вместе образовывать оксо группу; и R7 и R8 представляют атомы водорода.
Более предпочтительно, в указанном выше производном циклогексана R1 и R2, каждый независимо, представляет трифторметил, метил или метокси; R3 представляет атом водорода; R4 представляет гидроксиметил или гидроксил; R5 и R6, каждый независимо, представляет атом водорода, атом фтора, трифторметил, карбоксил, метокси, гидроксил или ацетилокси (или R5 и R6 вместе могут образовывать оксо группу).
Настоящее изобретение предоставляет также фармацевтическую композицию или средство, включающую эффективное количество указанного выше производного циклогексана или его фармацевтически приемлемой соли или пролекарства.
Фармацевтическое средство является предпочтительно анальгетическим, более предпочтительно, терапевтическим лекарственным средством от невропатической и/или ноцицептивной боли. Более предпочтительно, указанное выше фармацевтическое средство оказывает сильное анальгетическое действие также на диабетическую невропатическую боль и может подходящим образом применяться в качестве терапевтического средства от диабетической невропатической боли.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Поскольку производное циклогексана настоящего изобретения, или его фармацевтически приемлемая соль, или пролекарство оказывает анальгетическое действие на ноцицептивную и невропатическую боль, также как и на диабетическую невропатическую боль, терапевтическое действие в отношении боли может быть оказано пациентам, страдающим от боли, этиология которой не известна. Далее, производное циклогексана настоящего изобретения, или его фармацевтически приемлемая соль, или пролекарство оказывает сильное анальгетическое действие и имеет меньше побочных эффектов, оно может вводиться в качестве фармацевтического средства от широкого ряда болевых симптомов, включая диабетическую невропатическую боль.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг. 1 представляет собой диаграмму, показывающую действие соединения Примера 2-А на модели мышей с частичным перевязыванием седалищного или ишиалгического нерва (оральное введение).
Фиг. 2 представляет диаграмму, показывающую действие соединения Примера 2-В на модели мышей с частичным перевязыванием седалищного нерва (оральное введение).
Фиг. 3 представляет диаграмму, показывающую действие соединения Примера 62 настоящего изобретения на модели мышей с частичным перевязыванием седалищного нерва (оральное введение).
Фиг. 4 представляет диаграмму, показывающую действие соединения Сравнительного Примера 29 на модели мышей с частичным перевязыванием седалищного нерва (оральное введение).
Фиг. 5 представляет диаграмму, показывающую действие соединения Примера 2-В настоящего изобретения на мышах с болью вследствие диабетической невралгии, вызванной стрептозотоцином (STZ) (оральное введение).
Фиг. 6 представляет диаграмму, показывающую изменение в плазме уровня соединения Примера 2-В настоящего изобретения на мышах, которым вводили соединение Примера 2-В.
Фиг. 7 представляет диаграмму, показывающую изменение в плазме уровня соединения сравнительного Примера 29 на мышах, которым вводили соединение сравнительного Примера 29.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Следующие термины, используемые в настоящем описании, определяются, как описано ниже, если не указано иное.
Производное циклогексана настоящего изобретения представлено общей формулой (I):
[в которой
А представляет собой заместитель, представленный ниже общей формулой (IIa) или (IIb):
R1 и R2, каждый независимо, представляет атом водорода, атом хлора, С1-С3 галогеналкил, С1-С4 алкил, С1-С4 алкокси или циано;
R3 представляет собой атом водорода или хлора;
R4 представляет атом фтора, гидроксиметил или гидроксил;
R5 и R6, каждый независимо, представляет атом водорода, атом фтора, С1-С3 галогеналкил, карбоксил, метоксикарбонил, этоксикарбонил, С1-С4 алкокси, гидроксил или С2-С5 алкилкарбонилокси, или R5 и R6 могут вместе образовывать оксо группу;
R7 и R8, каждый независимо, представляет атом водорода или атом фтора;
Y представляет атом кислорода или серы; и
Z представляет атом азота или метин].
“С1-С4 алкил” обозначает линейную, разветвленную или циклическую алкильную группу, имеющую 1-4 атома углерода, и примеры ее включают в себя метил, этил, н-пропил, изопропил, циклопропил, циклопропилметил, н-бутил, втор-бутил и трет-бутил.
“С1-С4 алкокси” обозначает линейную, разветвленную или циклическую алкил-окси группу, имеющую 1-4 атома углерода, и примеры ее включают в себя метокси, этокси, н-пропилокси, изопропилокси, циклопропилокси, н-бутокси, втор-бутокси и трет-бутокси.
“С1-С3 галогеналкил” обозначает линейную алкильную группу, имеющую 1-3 атома углерода, в которой атомы водорода в группе частично или полностью замещены атомом (атомами) галогена (атом галогена обозначает атом фтора, хлора, брома или йода), и примеры ее включают монохлорметил, монофторметил, дифторметил, трифторметил, трихлорметил и пентафторэтил.
Примеры “С2-С5 алкилкарбонилокси” включают ацетилокси, этаноилокси, пропаноилокси, изопропаноилокси, бутаноилокси, изобутаноилокси и пивалоилокси.
В общей формуле (I) А предпочтительно представляет собой (IIc).
Y предпочтительно представляет атом серы.
R1 и R2, каждый независимо, представляют собой предпочтительно атом водорода, атом хлора, трифторметил, метил, этил, н-пропил, изопропил, метокси, этокси, н-пропилокси, изопропилокси или циано и, более предпочтительно, трифторметил, метил или метокси.
R3 предпочтительно представляет атом водорода.
R4 представляет предпочтительно гидроксил.
Предпочтительно, R5 и R6, каждый независимо, представляет собой атом водорода, атом фтора, трифторметил, карбоксил, метоксикарбонил, этоксикарбонил, метокси, этокси, н-пропилокси, изопропилокси, гидроксил, ацетилокси, пропаноилокси, бутаноилокси, изобутаноилокси или пивалоилокси, или R5 и R6 вместе образуют оксо группу. Более предпочтительно, R5 и R6, представляют собой атом водорода, атом фтора, трифторметил, карбоксил, метокси, гидроксил или ацетилокси, или R5 и R6 вместе образуют оксо группу.
R7 и R8, каждый независимо, представляет предпочтительно атом водорода или атом фтора и, более предпочтительно, атом водорода.
Конкретные предпочтительные примеры соединений, представленных общей формулой (I), и их фармацевтически приемлемых солей (называемых в описании ниже Соединения (I)) показаны в Таблице 1, но они не ограничивают настоящее изобретение.
В случаях, когда в Соединении (I) существуют асимметрические атомы углерода, в объем настоящего изобретения включены все энантиомеры и их смеси.
Далее, в случаях, когда в Соединении (I) существуют стереоизомеры, в объем настоящего изобретения включены все стереоизомеры и их смеси.
Примеры “фармацевтически приемлемой соли” включают соли неорганических кислот, такие как гидрохлорид, сульфат, фосфат и гидробромид; соли органических кислот, такие как оксалат, малонат, цитрат, фумарат, лактат, малат, сукцинат, тартрат, ацетат, трифторацетат, малеат, глюконат, бензоат, аскорбат, метансульфонат, п-толуолсульфонат и циннамат; соли неорганических оснований, такие как натриевая, калиевая, кальциевая, магниевая и аммониевая соль; соли органических оснований, такие как метиламиновая, диэтиламиновая, триметиламиновая, триэтиламиновая, пиридиниевая, триэтаноламиновая, этилендиаминовая и гуанидиевая соли. Далее, Соединение (I) может образовывать гидрат, сольват или кристаллический полиморф.
Соединение (I) можно синтезировать, например, в соответствии с способом получения, описанным ниже. Символы в каждой реакционной формуле имеют значения, определенные выше, если не указано иное.
В случаях, когда сырьевой материал соединения имеет карбоксильную группу или гидроксильную группу, может быть введена обычно используемая защитная группа, и после реакции, если требуется, защитная группа может быть удалена. Примеры защитной группы для гидроксильной группы включают С1-С4 алкил, фенил, тритил, С1-С4 аралкил (например, бензил), ацил (например, формил, ацетил и бензоил), С7-С10 аралкил-карбонил (например, бензилкарбонил) и замещенный силил (например, триметилсилил, триэтилсилил и трет-бутилдиметилсилил). Примеры защитной группы карбоксильной группы включают С1-С4 алкил.
Способ удаления защитной группы варьирует в зависимости от типа защитной группы, и удаление может осуществляться в соответствии с способом, описанным в документе предшествующего уровня техники (PROTECTIVE GROUPS IN ORGANIC SYNTHESIS (WILEY-INTERSCIENCE)), или соответствующим ему способом.
В способе получения, описываемом ниже, может использоваться в качестве сырьевого соединения соль. Примеры солей включают соли, описанные выше как фармацевтически приемлемые соли.
Соединение (I), получаемое по способу получения, описываемому ниже, может выделяться и очищаться согласно общепринятым способам, и примеры данных способов включают экстракцию растворителем, перекристаллизацию и хроматографию.
В случаях, когда Соединение (I) имеет оптические изомеры, стереоизомеры, региоизомеры и/или ротамеры, каждый из них может быть получен в виде единственных отдельных соединений с помощью общепринятого способа синтеза и способа отделения.
(Способ получения 1: Способ получения Соединения (Ic), Соединения (Id), Соединения (Ie) и Соединения (If))
[где R5a и R6a, каждый независимо, представляет атом водорода, С1-С3 галогеналкил, карбоксил или аналогичные; R7 и R8, каждый независимо, представляет С1-С4 алкил или аналогичные; а другие символы имеют те же значения, что определены выше].
Соединение (Ic) может быть получено алкилированием Соединения (Ia), а Соединение (Id) может быть получено алкилированием Соединения (Ib). Соединение (Ie) может быть получено ацилированием Соединения (Ia), а Соединение (If) может быть получено ацилированием Соединения (Ib).
(Стадия 1 и Стадия 2)
Реакция алкилирования Соединения (Ia) или Соединения (Ib) обычно осуществляется с помощью реакции Соединения (Ia) или Соединения (Ib) с галогенированным алкилом в растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и простой диметиловый эфир этиленгликоля; ацетон; ацетонитрил; и N,N-диметилформамид; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают кислые карбонаты щелочных металлов, такие как кислый карбонат натрия и кислый карбонат калия; карбонаты щелочных металлов, такие как карбонат калия и карбонат цезия; амины, такие как триэтиламин, диизопропилэтиламин и пиридин; трет-бутоксид калия; и гидрид натрия.
Количество используемого основания составляет предпочтительно 0,5-6 молей, более предпочтительно, 0,8-3 моля по отношению к 1 молю Соединения (Ia) или Соединения (Ib).
Количество используемого галогенированного алкила составляет предпочтительно 0,5-5 молей, более предпочтительно, 0,8-2 моля по отношению к 1 молю Соединения (Ia) или Соединения (Ib).
Температура реакции алкилирования составляет предпочтительно -78-200°С, более предпочтительно, -20-100°С.
Время реакции алкилирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 78 часов, более предпочтительно, от 30 минут до 48 часов.
(Стадия 3 и Стадия 4)
Реакция ацилирования Соединения (Ia) или Соединения (Ib) обычно осуществляется с помощью реакции Соединения (Ia) или Соединения (Ib) с ацилирующим агентом, таким как галогенангидрид кислоты или ангидрид кислоты в растворителе в присутствии основания, и растворитель выбирается соответственно так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; и простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают пиридин, триэтиламин, диизопропилэтиламин и N,N-диметиламинопиридин.
Количество используемого галогенангидрида кислоты или ангидрида кислоты составляет предпочтительно 0,5-3 моля, более предпочтительно, 0,8-1,5 моля по отношению к 1 молю Соединения (Ia) или Соединения (Ib).
Количество используемого основания составляет предпочтительно 0,1-6 молей, более предпочтительно, 0,8-3 моля по отношению к 1 молю Соединения (Ia) или Соединения (Ib).
Температура реакции ацилирования составляет предпочтительно -20-150°С, более предпочтительно, 0-100°С.
Время реакции ацилирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 2: Способ получения Соединения (Ih))
[где R5b и R6b, каждый независимо, представляют атом водорода, атом фтора, С1-С3 галогеналкил, С1-С4 алкокси, С2-С5 алкилкарбонилокси или аналогичные; а другие символы имеют те же значения, что определены выше].
Соединение (Ih) может быть получено фторированием Соединения (Ig).
(Стадия 5)
Фторирование Соединения (Ig) обычно осуществляется с помощью реакции Соединения (Ig) с фторирующим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил; и в качестве растворителя могут также использоваться их смеси.
Примеры фторирующего агента включают трифториды алкиламиносеры, такие как трифторид (диметиламино)серы (DAST) и трифторид бис(2-метоксиэтил)аминосеры со свойствами кислоты.
Количество используемого фторирующего агента составляет предпочтительно от 0,25 до 20 молей, более предпочтительно, от 0,5 до 4 молей по отношению к 1 молю Соединения (Ig).
Температура реакции фторирования составляет предпочтительно -20-150°С, более предпочтительно, 0-100°С.
Время реакции фторирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 3: Способ получения Соединения (Ij))
[где символы имеют те же значения, что определены выше].
Соединение (Ij) может быть получено фторированием Соединения (Ii).
(Стадия 6)
Реакция фторирования Соединения (Ii) обычно осуществляется с помощью реакции Соединения (Ii) с фторирующим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; и алкилнитрилы, такие как ацетонитрил; и в качестве растворителя могут также использоваться их смеси.
Примеры фторирующего агента включают трифториды алкиламиносеры, такие как трифторид (диметиламино)серы (DAST) и трифторид бис(2-метоксиэтил)аминосеры со свойствами кислоты.
Количество используемого фторирующего агента составляет предпочтительно от 0,25 до 20 молей, более предпочтительно, от 0,5 до 4 молей по отношению к 1 молю Соединения (Ii).
Температура реакции фторирования составляет предпочтительно -20-150°С, более предпочтительно, 0-100°С.
Время реакции фторирования варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 4: Способ получения Соединения (Ik) и Соединения (Il))
[где символы имеют те же значения, что определены выше].
Соединение (Ik) и Соединение (Il) могут быть получены восстановлением Соединения (Ii).
(Стадия 7)
Реакция восстановления Соединения (Ii) обычно осуществляется с помощью реакции Соединения (Ii) с восстанавливающим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и спирты, такие как метанол, этанол и изопропиловый спирт; и в качестве растворителя могут также использоваться их смеси.
Примеры восстанавливающего агента включают боргидрид натрия, боргидрид лития, диизобутилалюминийгидрид, литийалюминийгидрид, литийтриэтилгидрид, натрий-бис(2-метоксиэтокси)алюминийгидрид и борановые комплексы.
Количество используемого восстанавливающего агента составляет предпочтительно от 0,25 до 100 молей, более предпочтительно, от 0,5 до 20 молей по отношению к 1 молю Соединения (Ii).
Температура реакции восстановления составляет предпочтительно -78-150°С, более предпочтительно, -78-100°С.
Время реакции восстановления варьирует в зависимости от условий реакции, таких как температура реакции и количество восстанавливающего агента, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 24 часов.
(Способ получения 5: Способ получения Соединения (Im) и Соединения (In))
[где символы имеют те же значения, что определены выше].
Соединение (Im) и Соединение (In) могут быть получены трифторметилированием Соединения (Ii).
(Стадия 8)
Примеры трифторметилирующего реагента включают органосиликоновые соединения, такие как (трифторметил)триметилсилан. Реакция трифторметилирования с использованием органосиликонового соединения может осуществляться по способу, описанному в документе предшествующего уровня техники (Journal of the American Chemical Society, 1989, Vol. 39, стр. 393-395), или по соответствующему ему способу.
(Способ получения 6: Способ получения Соединения (Io))
[где символы имеют те же значения, что определены выше].
Соединение (SI) получают с помощью воздействия реагента Виттига (LI) на Соединение (Ii), с последующим гидролизом получающегося в результате соединения. Применяемый реагент Виттига (LI) может быть промышленно доступным, но реагент можно также синтезировать в соответствии с способом, очевидным специалистам в данной области. Соединение (Io) получают окислением Соединения (SI).
(Стадия 9)
Реакция Виттига Соединения (Ii) обычно осуществляется с помощью реакции Соединения (Ii) с реагентом Виттига в растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают диизопропиламид лития, трет-бутоксид калия, гидрид натрия, фениллитий и трет-бутиллитий.
Количество используемого основания составляет предпочтительно 0,5-3 моля, более предпочтительно, 0,8-2 моля по отношению к 1 молю Соединения (Ii).
Количество используемого Соединения (LI) составляет предпочтительно 0,5-3 моля, более предпочтительно, 0,8-2 моля по отношению к 1 молю Соединения (Ii).
Температура реакции Виттига составляет предпочтительно -78 - 100°С, более предпочтительно, -78-50°С.
Время реакции Виттига варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 48 часов, более предпочтительно, от 30 минут до 24 часов.
Реакция гидролиза для получения Соединения (SI) осуществляется в выбираемом соответствующим образом растворителе, который не ингибирует реакцию. Примеры растворителя, который не ингибирует реакцию, включают в себя простые эфиры, такие как тетрагидрофуран, 1,4-диоксан и простой диметиловый эфир этиленгликоля; спирты, такие как метанол, этанол и трет-бутанол; ацетонитрил; и воду; и в качестве растворителя могут также использоваться их смеси.
Концентрация кислоты, используемой в реакции гидролиза, составляет предпочтительно 0,1-12 М, а количество используемой кислоты составляет предпочтительно 1 моль - избыточное количество по отношению к 1 молю Соединения (Ii).
Примеры используемой в реакции гидролиза кислоты включают неорганические кислоты, такие как соляная кислота и серная кислота; и органические кислоты, такие как уксусная кислота.
Температура реакции гидролиза составляет предпочтительно -20-200°С, более предпочтительно, 0-100°С.
Время реакции гидролиза варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 48 часов, более предпочтительно, от 30 минут до 24 часов.
(Стадия 10)
Примеры окисляющего агента, используемого в реакции окисления соединения (SI), включают оксид хрома (VI)-уксусную кислоту, реагент Джонса и хлорид натрия. Реакция окисления осуществляется в соответствии со способом, очевидным специалистам в данной области.
(Способ получения 7: Способ получения Соединения (Ii))
[где R9 и R10, каждый независимо, представляют метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил или аналогичные, или R9 и R10 вместе образуют этиленовую группу (-СН2-СН2-) или пропиленовую группу (-СН2СН2СН2-); и другие символы имеют значения, определенные выше.]
Соединение (Ii) получают посредством удаления защитной группы Соединения (Ip).
(Стадия 11)
Реакция удаления защитной группы Соединения (Ip) может осуществляться в соответствии со способом, описанным в документе предшествующего уровня техники (PROTECTIVE GROUPS IN ORGANIC SYNTHESIS (WILEY-INTERSCIENCE)), или соответствующим ему способом.
(Способ получения 8: Способ получения соединения (IIIb))
[где символы имеют те же значения, что определены выше].
Соединение (IIIb) может быть получено хлорированием Соединения (IIIa).
(Стадия 12)
Реакция хлорирования Соединения (IIIa) обычно осуществляется с помощью реакции Соединения (IIIa) с хлорирующим агентом в растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; ацетонитрил; и этилацетат; и в качестве растворителя могут также использоваться их смеси.
Примеры хлорирующего агента включают N-хлорсукцинимид (NCS).
Количество используемого хлорирующего агента составляет предпочтительно 0,5-2 моля, более предпочтительно, 0,8-1,2 моля по отношению к 1 молю Соединения (IIIa).
Температура реакции хлорирования составляет предпочтительно 0-200°С, более предпочтительно, 0-120°С.
Время реакции хлорирования варьирует в зависимости от условий реакции, таких как температура реакции, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 9: Способ получения Соединения (IIIa))
[где символы имеют те же значения, что определены выше].
Соединение (IIIa) может быть получено циклизацией Соединения (LII) и Соединения (SII). Соединение (LII) может быть промышленно доступным, но его можно также синтезировать в соответствии со способом, очевидным специалистам в данной области.
(Стадия 13)
Реакция циклизации Соединения (LII) и Соединения (SII) обычно осуществляется в растворителе, выбираемом соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают спирты, такие как метанол, этанол и изопропиловый спирт; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; бензол; толуол; уксусную кислоту; и воду; и в качестве растворителя могут также использоваться их смеси.
Количество используемого Соединения (LII) составляет предпочтительно 0,5-1,5 моля, более предпочтительно, 0,8-1,2 моля по отношению к 1 молю Соединения (SII).
В реакции циклизации может использоваться катализатор, и примеры катализатора включают органические основания, такие как триэтиламин и пиридин; неорганические кислоты, такие как соляная кислота и серная кислота; и органические кислоты, такие как уксусная кислота.
Количество используемого катализатора составляет предпочтительно 0,1-3 моля по отношению к 1 молю Соединения (SII).
Температура реакции циклизации составляет предпочтительно 0-200°С, более предпочтительно, 0-120°С.
Время реакции циклизации варьирует в зависимости от условий реакции, таких как температура реакции, и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 10: Способ получения Соединения (IV))
[где символы имеют те же значения, что определены выше].
Соединение (IV) может быть получено с помощью депротонирования и окисления Соединения (SIII). Реакция окисления может осуществляться в соответствии со способом, описанным в документе известного уровня техники (Tetrahedron, 1989, vol. 45, стр. 5703-5742), или соответствующим ему способом.
(Стадия 14)
Реакция депротонирования и реакция окисления обычно осуществляются с помощью реакции Соединения (SIII) с основанием и окисляющим агентом в безводном растворителе, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, и гептан; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают бутиллитий, такой как н-бутиллитий, втор-бутиллитий и трет-бутиллитий.
Количество используемого основания составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (SIII).
Количество используемого Соединения (LIII) составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (SIII).
Примеры окисляющего агента, используемого в реакции гидролиза, включают 3-фенил-2-(фенилсульфонил)-1,2-оксазиридин.
Температура реакции депротонирования и реакции окисления составляет предпочтительно -78-150°С, более предпочтительно, 0-50°С.
Время реакции депротонирования и реакции окисления варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Способ получения 11: Способ получения Соединения (VI))
[где символы имеют те же значения, что определены выше].
Соединение (VI) может быть получено с помощью реакции Соединения (LIV) с Соединением (LV) с последующим сольволизом получающегося в результате Соединения (V). Соединение (LIV) и Соединение (LV) могут быть промышленно доступными, но их можно также синтезировать в соответствии с способом, очевидным специалистам в данной области.
(Стадия 15)
Реакция Соединения (LIV) с Соединением (LV) обычно осуществляется в безводном растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают углеводороды, такие как октан, гексан, бензол и толуол; и простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, простой диметиловый эфир этиленгликоля и диэтиловый эфир; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают алкиллитиевые соединения, такие как метиллитий и н-бутиллитий; и соли диалкиламинов, такие как диизопропиламид лития, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия.
Количество используемого основания составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (LIV).
Количество используемого соединения (LV) составляет предпочтительно 0,8-5 молей, более предпочтительно, 0,9-3 моля по отношению к 1 молю Соединения (LIV).
Температура реакции между Соединением (LIV) и Соединением (LV) составляет предпочтительно -78-150°С, более предпочтительно, -78-100°С.
Время реакции между Соединением (LIV) и Соединением (LV) варьирует в зависимости от условий реакции и предпочтительно составляет от 5 минут до 72 часов, более предпочтительно, от 30 минут до 48 часов.
(Стадия 16)
Реакция сольволиза обычно осуществляется в растворителе в присутствии основания, и растворитель выбирается соответствующим образом так, чтобы он не ингибировал реакцию. Примеры растворителя, который не ингибирует реакцию, включают спирты, такие как метанол и этанол; и воду; и в качестве растворителя могут также использоваться их смеси.
Примеры основания включают карбонат калия, карбонат натрия, гидроксид калия и гидроксид натрия.
Количество используемого основания составляе