Соединения ((фенил)имидазолил)метилгетероарила, их применение, фармацевтическая композиция, содержащая указанные соединения, и набор, включающий такую композицию
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным ((фенил)имидазолил)метилгетероарила формулы , где A представляет собой пиридил или тиенил, имеющий 0 или 1 заместитель; В представляет собой фенил, имеющий 0, 1 или 2 заместителя; где каждый заместитель независимо представляет собой алкил, имеющий от 1 до 8 атомов углерода, -F, -Сl, -Вr или -CF3. Также изобретение относится к применению заявленных соединения для изготовления лекарственного средства, фармацевтической композиции на основе заявленных соединений, и к набору, содержащему указанную выше фармацевтическую композицию. Технический результат: получены новые производные ((фенил)имидазолил)метилгетероарила, полезные при лечении боли. 4 н. и 6 з.п. ф-лы, 1 табл., 2 пр.
Реферат
Перекрестная ссылка
Настоящая заявка испрашивает приоритет заявки США 60/917833, поданной 14 мая 2007, которая включена здесь путем ссылки в полном объеме.
[1] Предшествующий уровень техники
[2] Человеческие адренергические рецепторы представляют собой интегральные мембранные белки, которые разделяются на два широких класса: альфа- и бета-адренергические рецепторы. Оба типа опосредуют действие периферической симпатической нервной системы при связывании катехоламинов, норэпинефрина и эпинефрина.
[3] Норэпинефрин продуцируется адренергическими нервными окончаниями, тогда как эпинефрин продуцируется мозговым веществом надпочечника. Связывающее сродство адренергических рецепторов к этим соединениям составляет одну основу классификации: альфа-рецепторы имеют тенденцию к связыванию с норэпинефрином более сильную, чем с эпинефрином, и намного более сильную, чем с синтетическим соединением изопротеренолом. Предпочтительное сродство связывания с этими гормонами является обратным для бета-рецепторов. Во многих тканях функциональные ответы, такие как сокращение гладких мышц, которые индуцирует активация альфа-рецепторов, противоположны ответам, индуцированным связыванием бета-рецепторов.
[4] В дальнейшем функциональное различие между альфа- и бета-рецепторами было дополнительно освещено и уточнено путем фармакологической характеристики этих рецепторов из различных животных и тканевых источников. В результате альфа- и бета-адренергические рецепторы были дополнительно подразделены на подтипы α1, α2, β1 и β2. Функциональные различия между α1 и α2 рецепторами известны, и разработаны соединения, которые проявляют селективность связывания в отношении этих двух подтипов. Так, в опубликованной Международной заявке WO 92/0073 сообщали об избирательной способности R(+) энантиомера теразозина к селективному связыванию с адренергическими рецепторами α1 подтипа. Селективность α1/α2 этого соединения была раскрыта как значимая, поскольку сообщалось, что агонистическая стимуляция α2 рецепторов ингибирует секрецию эпинефрина и норэпинефрина, тогда как антагонизм α2 рецептора повышает секрецию этих гормонов. Таким образом, утверждалось, что применение неселективных альфа-адренергических блокаторов, таких как феноксибензамин и фентоламин, ограничено опосредованной α2 адренергическим рецептором индукцией повышенной концентрации катехоламина в плазме и сопровождающими ее физиологическими осложнениями (повышенной частотой сердечных сокращений и сокращений гладких мышц). В качестве дополнительного источника общих сведений об α-адренергических рецепторах внимание читателя следует направить на Robert R. Ruffolo, Jr., a-Adrenoreceptors: Molecular Biology, Biochemistry and Pharmacology (Progress in Basic and Clinical Pharmacology series, Karger, 1991), где исследутся основа подклассификации α1/α2, молекулярная биология, преобразование сигнала, взаимоотношения структуры и активности агонистов, рецепторные функции и терапевтические применения для соединений, проявляющих сродство к α-адренергическим рецепторам.
[5] Клонирование, секвенирование и экспрессия подтипов альфа-рецепторов из тканей животных привели к субклассификации α1 адренорецепторов на α1А, α1B и α1D. Подобным образом, α2 адренорецепторы также классифицированы на α1A, α1B и α1C рецепторы. Каждый подтип α2 рецепторов, как оказалось, проявляет свою собственную фармакологическую и тканевую специфичность. Соединения, обладающие определенной степенью специфичности к одному или более чем одному из этих подтипов, могут быть более специфичными терапевтическими агентами для данного показания, чем пан-агонист (такой, как лекарственное средство клонидин) или пан-антагонист α2 рецептора.
[6] Помимо других показаний, таких как лечение глаукомы, гипертензии, половой дисфункции и депрессии, некоторые соединения, обладающие агонистической активностью в отношении альфа2 адренергических рецепторов, являются известными анальгетиками. Однако многие соединения, обладающие такой активностью, не обеспечивают активность и специфичность, которые желательны при лечении расстройств, модулируемых альфа2 адренорецепторами. Например, у многих соединений, открытых как эффективные агенты при лечении боли, часто обнаруживают обладание нежелательными побочными эффектами, как, например, они вызывают гипертензию и седацию при системно эффективных дозах. Существует необходимость в новых лекарственных средствах, которые обеспечивают облегчение боли, не вызывая этих нежелательных побочных эффектов. Кроме того, существует необходимость в агентах, которые проявляют активность против боли, в частности хронической боли, такой как хроническая невропатическая и висцеральная боль.
[7] Описание изобретения
[8] Здесь описано соединение формулы
где А представляет собой моноциклический гетероарил, имеющий 0, 1, 2 или 3 заместителя; и
В представляет собой фенил, имеющий 0, 1, 2 или 3 заместителя;
где каждый заместитель независимо состоит из атомов углерода в количестве от 0 до 8, из атомов кислорода в количестве от 0 до 3, атомов галогена в количестве от 0 до 3, атомов азота в количестве от 0 до 2, атомов серы в количестве от 0 до 2 и из атомов водорода в количестве от 0 до 24.
[9] Если не указано иное, указание на соединение следует рассматривать в широком смысле как включающее фармацевтически приемлемые соли, пролекарства, таутомеры, варианты твердых форм и нековалентные комплексы химической группировки, обладающей обозначенными структурой или химическим названием.
[10] Фармацевтически приемлемая соль представляет собой любую соль, которая сохраняет активность исходного соединения и не обладает дополнительными неприемлемыми вредными или ненаправленными эффектами в отношении субъекта, которому ее вводят, и окружения, в котором ее вводят, по сравнению с исходным соединением. Фармацевтически приемлемая соль обозначает любую соль, которая может образоваться in vivo в результате введения кислоты, другой соли или пролекарства, которое преобразуется в кислоту или соль.
[11] Фармацевтически приемлемые соли кислых функциональных групп могут иметь происхождение от органических или неорганических оснований. Соль может включать одно- или многовалентный ион. Особый интерес представляют неорганические ионы, литий, натрий, калий, кальций и магний. Органические соли могут быть получены с аминами, в частности аммонийные соли, такие как моно-, ди- и триалкиламины или этаноламины. Такие соли могут быть также образованы с кофеином, трометамином и подобными молекулами. Соляная кислота или другая фармацевтически приемлемая кислота может образовать соль с соединением, которое включает основную группу, такую как амин или пиридиновое кольцо.
[12] Пролекарство представляет собой соединение, которое преобразуется в терапевтически активное соединение после введения. Хотя объем изобретения не ограничивается указанным, преобразование может происходить посредством гидролиза сложноэфирной группы или какой-либо другой биологически лабильной группы. Как правило, но не обязательно, пролекарство является неактивным или менее активным, чем терапевтически активное соединение, в которое оно преобразуется. Конкретно предусматриваются сложноэфирные пролекарства соединений, раскрытых здесь. Сложный эфир может быть образован из карбоновой кислоты C1 (то есть концевой карбоновой кислоты природного простагландина), либо сложный эфир может быть образован из функциональной группы карбоновой кислоты на другой части молекулы, как, например, на фенильном кольце. Хотя объем настоящего изобретения не ограничивается указанным, сложный эфир может представлять собой алкиловый эфир, ариловый эфир или гетероариловый эфир. Термин “алкил” имеет значение, обычно понимаемое специалистами в данной области техники, и относится к прямым, разветвленным или циклическим алкильным группам. Особенно пригодны C1-6 алкиловые эфиры, где алкильная часть эфира имеет от 1 до 6 атомов углерода и включает, но не ограничиваясь указанным, метил, этил, пропил, изопропил, н-бутил, втор-бутил, изобутил, терт-бутил, изомеры пентила, изомеры гексила, циклопропил, циклобутил, циклопентил, циклогексил и их комбинации, содержащие от 1-6 атомов углерода, и т.д.
[13] Таутомеры представляют собой изомеры, которые находятся в быстром равновесии друг с другом. Они часто, но не обязательно, включают передатчик протона, атом водорода или гидридный ион. Например, указанные структуры включают, не ограничиваясь указанным, таутомерные формы, показанные ниже.
[14]
[15] Если стереохимия не обозначена конкретно, структура включает каждый возможный стереоизомер, как чистый, так и в любой возможной смеси.
[16] Варианты твердых форм представляют собой иные твердые формы, чем те, которые могут быть результатом применения описанных здесь способов. Например, варианты твердых форм могут представлять собой полиморфы, различные виды аморфных твердых форм, стекла и тому подобное.
[17] Нековалентные комплексы представляют собой комплексы, которые могут образоваться между соединением и одним или более чем одним дополнительным видом химических соединений без участия ковалентных связей между соединением и дополнительным видом химических соединений. В этих комплексах может иметь место или отсутствовать конкретное соотношение между соединением и дополнительным видом химического соединения. Примеры могут включать сольваты, гидраты, комплексы с переносом заряда и тому подобное.
[18] А представляет собой моноциклический гетероарил, означающий ароматическое кольцо с одним или более чем одним атомом азота, серы или кислорода в кольце. Типичные примеры гетероарила включают пиридил, тиенил, фурил, пирролил, пирролидинил, имидазолил, оксазолил, тиазолил, пиразолил, пиримидинил и пиразинил. А может быть незамещенным или замещенным заместителями в количестве вплоть до 3.
[19] B представляет собой фенил, который является незамещенным или имеет вплоть до 3 заместителей.
[20] Заместители A и B являются предметом некоторых ограничений. Однако заместители являются независимыми, что означает, что A и B могут иметь одинаковые или разные заместители; заместители на A могут быть одинаковыми или отличными друг от друга; и заместители на В могут быть одинаковыми или отличными друг от друга.
[21] В зависимости от ограничений, описанных здесь (например, ограничений на число атомов для заместителя), примеры заместителей включают, но не ограничены ими:
[22] Углеводородный остаток, означающий группировку, состоящую только из атомов углерода и водорода, включает, но не ограничен ими:
а. алкил, означающий углеводородный остаток, не имеющий двойных или тройных связей, включающий, но не ограниченный ими:
- нормальный алкил, например метил, этил, н-пропил, н-бутил, н-пентил, н-гексил и т.д.,
- разветвленный алкил, например изопропил, трет-бутил и другие разветвленные изомеры бутила, разветвленные изомеры пентила и т.д.,
- циклоалкил, например циклопропил, циклобутил, циклопентил, циклогексил и т.д.,
- комбинации прямого, разветвленного и/или циклоалкила;
б. алкенил, например углеводородный остаток, имеющий одну или более чем одну двойную связь, включая прямой, разветвленный или циклоалкенил,
в. алкинил, например углеводородный остаток, имеющий одну или более чем одну тройную связь, включая прямой, разветвленный или циклоалкинил;
г. комбинации алкила, алкенила и/или алкинила.
[23] Алкил-CN, такой как -CH2-CN, -(CH2)2-CN; -(CH2)3-CN и тому подобное;
[24] Гидроксиалкил, то есть алкил-OH, такой как гидроксиметил, гидроксиэтил и тому подобное;
[25] Эфирные заместители, включая -O-алкил, алкил-O-алкил и тому подобное;
[26] Тиоэфирные заместители, включая -S-алкил, алкил-S-алкил и тому подобное;
[27] Аминные заместители, включая -NH2, -NH-алкил, -N-алкил1алкил2 (то есть алкил1 и алкил2 являются одинаковыми или разными, и оба присоединены к N), алкил-NH2, алкил-NH-алкил, алкил-N-алкил'алкил2 и тому подобное;
[28] Аминоалкил, означающий алкил-амин, такой как аминометил (-CH2-амин), аминоэтил и тому подобное;
[29] Сложноэфирные заместители, включая -CO2-алкил, -CO2-фенил и т.д.;
[30] Другие карбонильные заместители, включая альдегиды, кетоны, такие как ацил (то есть углеводородный остаток), и тому подобное; в частности, рассматривают ацетильные, пропионильные и бензоильные заместители;
[31] Фенил или замещенный фенил;
[32] Фторуглероды или гидрофторуглероды, такие как -CF3CH2CF3 и т.д.; и
[33] -CN;
[34] возможны также комбинации вышеописанного в зависимости от вышеописанных ограничений.
[35] Альтернативно заместитель может представлять собой -F, -Cl, -Br или -I.
[36] В частности, в качестве заместителя рассматривается алкил, содержащий от 1 до 8 атомов углерода.
[37] Альтернативно рассматривается алкил, содержащий от 1 до 4 атомов углерода.
[38] Заместители должны быть достаточно стабильными, чтобы их можно было хранить в бутылке при комнатной температуре в нормальной атмосфере в течение по меньшей мере 12 часов, либо быть достаточно стабильными, чтобы быть пригодными для любой раскрытой здесь цели.
[39] Если заместитель представляет собой соль, например, карбоновой кислоты или амина, противоион указанной соли, то есть ион, который ковалентно не связан с остальной частью молекулы, не учитывают при подсчете количества тяжелых атомов в заместителе. Так, например, соль -CO2Na+ является стабильным заместителем, состоящим из 3 тяжелых атомов, то есть натрий не учитывают. В другом примере соль -NH(Me)2 +Cr является стабильным заместителем, состоящим из 3 тяжелых атомов, то есть хлор не учитывают.
[40] В одном воплощении A представляет собой пиридинил, что означает, что рассматриваются соединения структур таких, как показано ниже.
[41] В этих структурах R1, R2 и R3 представляют собой заместители, как определено здесь.
[42] В другом воплощении A представляет собой тиенил, что означает, что рассматривают соединения структур, показанных ниже.
[43] В этих структурах R1, R2 и R3 представляют собой заместители, как определено здесь.
[44] В другом воплощении A представляет собой фурил, что означает, что рассматриваются соединения структур, показанных ниже.
[45] В этих структурах R1, R2 и R3 представляют собой атом водорода или заместители, как определено здесь.
[46] В одном воплощении каждый заместитель независимо представляет собой алкил, содержащий от 1 до 8 атомов углерода, -F, -Cl, -Br, -CH2OH, аминометил, содержащий от 1 до 8 атомов углерода, -CH2CN, -CF3 или ацил, содержащий от 1 до 8 атомов углерода.
[47] В другом воплощении A является незамещенным или имеет изопропильный заместитель.
[48] В другом воплощении каждый заместитель B представляет собой -F, -Cl,-CH3 или -CF3.
[49] В другом воплощении A представляет собой пиридил, тиенил, фурил, пирролил, пирролидинил, имидазолил, оксазолил, тиазолил, пиразолил, пиримидинил или пиразинил, имеющий 0, 1, 2 или 3 заместителя.
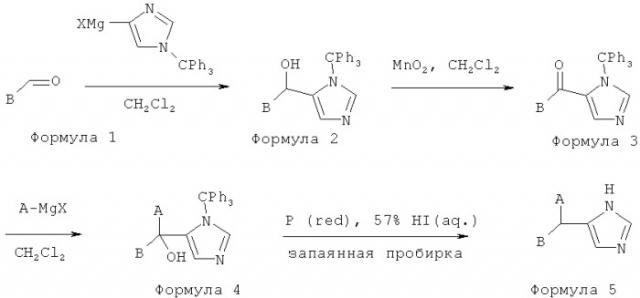
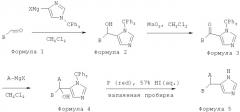
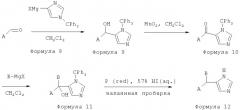
[50] В другом воплощении A представляет собой пиридил.
[51] В другом воплощении A представляет собой тиенил.
[52] Другое воплощение относится к способу лечения боли, при котором вводят соединение, раскрытое здесь, млекопитающему, нуждающемуся в этом.
[53] Другое воплощение относится к применению соединения, раскрытого здесь, при изготовлении лекарственного средства для лечения боли.
[54] Другое воплощение относится к фармацевтически приемлемой композиции, содержащей соединение, раскрытое здесь.
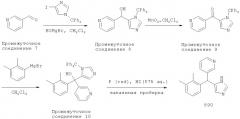
[55] Другое воплощение относится к набору, включающему упаковку, содержащую композицию, раскрытую здесь, и этикетку, на которой указано применение композиции для лечения боли.
[56] Некоторые гипотетические примеры полезных соединений изображены ниже.
[57]
[58] Соединения, раскрытые здесь, полезны для лечения неврологических состояний и заболеваний, которые отвечают на лечение альфа2 адренергическими агонистами. Такие состояния и заболевания включают, но не ограничены ими, боль, включая хроническую боль (которая может представлять собой без ограничения висцеральную, воспалительную, реперкуссионную или невропатическую по происхождению), невропатическую боль, роговичную боль, глаукому, пониженное и повышенное внутриглазное давление, ишемические невропатии и другие нейродегенеративные заболевания, диарею и заложенность носа. Хроническая боль может возникать в результате состояний или сопутствовать состояниям, включающим без ограничения: артрит (включая ревматоидный артрит), спондилоартрит, подагрический артрит, остеоартрит, ювенильный артрит, и аутоиммунные заболевания, включающие без ограничения системную красную волчанку. Висцеральная боль может включать без ограничения боль, вызванную раком или сопутствующую лечению рака, как, например, химиотерапии или лучевой терапии. Кроме того, соединения, раскрытые здесь, полезны для лечения мышечной спастичности, включая болезненный позыв на мочеиспускание, диурез, синдромы отмены, нейродегенеративных заболеваний, включающих глазную невропатию, ишемию спинного мозга и удар, нарушений памяти и познавательной способности, синдрома дефицита внимания, психозов, включая маниакальные расстройства, тревоги, депрессии, гипертензии, застойной сердечной недостаточности, ишемической болезни сердца и заложенности носа, хронических желудочно-кишечных воспалений, болезни Крона, гастрита, синдрома раздраженной кишки (СРК), функциональной диспепсии и неспецифического язвенного колита. Активность альфа2В/2C специфичных или селективных соединений, раскрытых здесь, обладает большим преимуществом, поскольку введение этих соединений млекопитающим не приводит в результате к седации или к значительным сердечно-сосудистым эффектам (таким, как изменение кровяного давления или частоты сердечных сокращений).
[59] Известно, что хроническая боль (такая, как боль вследствие рака, артрита и многих невропатических повреждений) и острая боль (такая, как боль, производимая внезапным механическим стимулом, таким как порез, стягивание, укол или сдавливание ткани) представляют собой различные неврологические явления, опосредованные в высокой степени либо различными нервными волокнами и нейрорецепторами, либо перегруппировкой или изменением функции этих нервов при хронической стимуляции. Ощущение острой боли передается очень быстро, прежде всего, афферентными нервными волокнами, называемыми C волокнами, которые в норме имеют высокий порог для механической, термической и химической стимуляции. Хотя механизмы хронической боли не полностью понятны, острое повреждение ткани может вызвать в пределах нескольких минут или часов после первоначальной стимуляции вторичные симптомы, включая региональное снижение величины стимула, необходимой, чтобы вызвать болевой ответ. Это явление, которое, как правило, имеет место в области, происходящей из места исходного стимула, но превосходящей его по размерам, называют гипералгезией. Вторичный ответ может вызвать значительно усиленную чувствительность к механическому или термическому стимулу.
[60] Афферентные волокна A (волокна Aβ и А) можно стимулировать при более низком пороге, чем волокна C, и оказывается, что они вовлечены в ощущение хронической боли. Например, в нормальных условиях стимуляция этих волокон с низким порогом (такая, как легкое поглаживание щеткой или щекотание) не является болезненной. Однако при определенных состояниях, таких как следствие повреждения нерва или при состоянии, опосредованном вирусом герпеса, известном как опоясывающий лишай, применение даже такого легкого прикосновения или щекотание одеждой могут быть очень болезненными. Это состояние называют аллодинией, и оказывается, что оно опосредовано, по меньшей мере частично, афферентными нервами Aβ. Волокна C могут быть также вовлечены в ощущение хронической боли, но если так, то оказывается понятным, что устойчивое возбуждение нейронов с течением времени вызывает некоторый вид изменения, которые теперь приводят в результате к ощущению хронической боли.
[61] Под “острой болью” понимают внезапную, обычно с высоким порогом, боль, вызванную повреждением, таким как порез, сдавливание, ожог, или химической стимуляцией, такой как испытывают при воздействии капсаицина, активного ингредиента в перцах Чили.
[62] Под “хронической болью” понимают боль, иную, чем острая боль, такую как, без ограничения, невропатическая боль, висцеральная боль (включая боль, вызванную болезнью Крона и синдромом раздраженной кишки (СРК)) и реперкуссионная боль.
[63] Для целей данного описания “лечить”, “лечение” или “терапия” относятся к применению соединений, композиции, терапевтически активного агента или лекарственного средства при диагностике, лечении, облегчении, терапии, предупреждении заболевания или другого нежелательного состояния.
[64] Препараты этих соединений можно готовить в твердой, жидкой или других типах лекарственных форм, используя способы, известные в данной области техники. Как изготовление препаратов лекарственных форм, так и определение терапевтически эффективной дозы может легко осуществить обычный специалист в данной области техники, используя рутинные способы.
[65] ОБЩИЕ СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ
[66] Реакционные схемы А и Б иллюстрируют общие способы получения биарилимидазола.
[67] Реакционная схема А
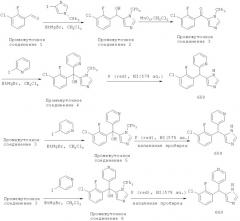
Реакционная схема Б
[69] КОНКРЕТНЫЕ ВОПЛОЩЕНИЯ, ЭКСПЕРИМЕНТЫ
[70] Пример А
[71] Способ А: Методика получения 2-((3-хлор-2-фторфенил)(1H-имидазол-5-ил)метил)пиридина (658)
[72] Раствор 4-йод-1-тритилимидазола (имеющегося в продаже, 5,1 г, 11,8 ммоль) в дихлорметане (40 мл) при -10°C обрабатывали этилмагния бромидом (3,9 мл, 11,8 ммоль, 3 М в эфире) и давали возможность взаимодействовать в течение 45 мин. Раствор 3-хлор-2-фтор-бензальдегида (Промежуточное соединение 1) (1,5 г, 9,4 ммоль) в дихлорметане добавляли через шприц при -10°C и перемешивали в течение 16 часов при комнатной температуре. Смесь гасили водой (50 мл) и насыщенным раствором хлорида аммония (50 мл). Остаток выделяли при типичной водной обработке и очищали с помощью ЖХСД (жидкостной хроматографии среднего давления) 3-5% MeOH:CH2Cl2 с получением (3-хлор-2-фторфенил)(1-тритил-1H-имидазол-4-ил)метанола (Промежуточное соединение 2) в виде твердого вещества (3,5 г, 78,7%).
[73] Смесь (3-хлор-2-фторфенил)(1-тритил-1H-имидазол-4-ил)метанола (Промежуточное соединение 2) (3,5 г, 7,4 ммоль) в CH2Cl2 (60 мл) обрабатывали оксидом марганца (IV), активированным (имеющимся в продаже от Aldrich): MnO2 (3,9 г, 44,8 ммоль) при комнатной температуре. Смесь нагревали до 60°C в течение 2 часов. Затем смесь охлаждали до комнатной температуры и фильтровали через целлит и растворитель удаляли в вакууме. Остаток очищали ЖХСД 3-5% MeOH:CH2Cl2 с получением (3-хлор-2-фторфенил)(1-тритил-1H-имидазол-5-ил)метанона (Промежуточное соединение 3) (3,3 г, 97%).
[74] Раствор 2-йодпиридина (имеющегося в продаже) (415 мг, 2,02 ммоль) в дихлорметане (25 мл) при комнатной температуре обрабатывали этилмагния бромидом (0,67 мл, 2,02 ммоль, 3 М в эфире) и давали им возможность взаимодействовать в течение 45 минут. При комнатной температуре добавляли через шприц раствор (3-хлор-2-фторфенил)(1-тритил-1H-имидазол-5-ил)метанона (Промежуточное соединение 3) (630 мг, 1,35 ммоль) в дихлорметане, а затем реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Смесь гасили водой (50 мл) и насыщенным раствором хлорида аммония (20 мл). Остаток выделяли при типичной водной обработке с получением (3-хлор-2-фторфенил)(пиридин-2-ил)(1-тритил-1H-имидазол-5-ил)метанола (Промежуточное соединение 4) (726 мг, сырой).
[75] К смеси (3-хлор-2-фторфенил)(пиридин-2-ил)(1-тритил-1H-имидазол-5-ил)метанола (Промежуточное соединение 4) (726 г, 1,33 ммоль) в 57% водной HI (10 мл) и iPrOH (2 мл) добавляли красный фосфор (412 мг, 13,3 ммоль) в перепломбируемой пробирке и нагревали при 160°C в течение 16 ч. Затем смесь охлаждали до комнатной температуры и наливали на лед-воду, которую затем подщелачивали NaOH и разбавляли CHCl3. Остаток выделяли при типичной водной обработке, используя СНСl3, и очищали ЖХСД 5-15% MeOH:CH2Cl2 с получением (3-хлор-2-фторфенил)(пиридин-2-ил)(1-тритил-1H-имидазол-5-ил)метанола (658) в виде твердого вещества, 236 мг (61% в две стадии). 1H ЯМР (CD3OD, 300 МГц) δ 8.47 (d, J=4.4 Гц, 1H), 7.80 (dt, J=2.1, 7.8 Гц,=1H), 7.76 (s, 1H), 7.39-7.23 (m, 3H), 7.12-7.00 (m, 2H), 6.60 (s, 1H), 5.86 (s, 1H).
[76] Следуя методике, подобной таковой для 658, получили 659, 3-((3-хлор-2-фторфенил)(1H-имидазол-5-ил)метил)пиридин (162 мг, 44% выход в две стадии) из (Промежуточного соединения 3) в виде белого твердого вещества. 1H ЯМР (CD3OD, 300 МГц) δ 8.42 (d, J=5.1 Гц, 1H), 8.38 (d, J=2.1 Гц, 1H), 7.70 (s, 1H), 7.67-7.64 (m, 1H), 7.41-7.37 (m, 2H), 7.15-7.05 (m, 2H), 6.66 (s, 1H), 5.80 (s, 1H).
[77] Следуя методике, подобной таковой для 658, получили 660, 4-((3-хлор-2-фторфенил)(1H-имидазол-5-ил)метил)пиридин (208 мг, 57,5% выход в две стадии) из (Промежуточного соединения 3) в виде белого твердого вещества. 1H ЯМР (CD3OD, 300 МГц) δ 8.47-8.45 (m, 2H), 7.70 (s, 1H), 7.42 (td, J=1.8 Гц, 7.5 Гц, 1H), 7.37-7.24 (m, 2H), 7.15-7.03 (m, 2H), 6.69 (s, 1H), 5.78 (s, 1H).
[78] Пример Б
[79] Способ Б: Методика получения 3-((2,3-диметилфенил)(1H-имидазол-5-ил)метил)пиридина (AGN213890)
[80] Смесь 4-йод-1-тритилимидазола (имеющегося в продаже) (10,1 г, 23,3 ммоль) в дихлорметане (100 мл) при -10°C обрабатывали этилмагния бромидом (7,76 мл, 23,3 ммоль, 3 М в эфире) и давали им возможность взаимодействовать в течение 45 минут. Раствор 3-пиколинальдегида (Промежуточное соединение 7) (2 г, 18,69 ммоль) в дихлорметане добавляли через шприц при -10°C и перемешивали в течение 16 часов при комнатной температуре. Смесь гасили водой (50 мл) и насыщенным раствором хлорида аммония (50 мл). Остаток выделяли при типичной водной обработке с получением пиридин-3-ил(1-тритил-1H-имидазол-5-ил)метанола (Промежуточное соединение 8) в виде твердого вещества, 6,48 г (82%).
[81] Раствор пиридин-3-ил(1-тритил-1H-имидазол-5-ил)метанола (Промежуточное соединение 8) (6,48 г, 15,56 ммоль) в CH2Cl2 (100 мл) обрабатывали оксидом марганца (IV), активированным (имеющимся в продаже от Aldrich) MnO2 (8,1 г, 93,36 ммоль) при комнатной температуре. Смесь нагревали до 60°C в течение 2 часов. Смесь охлаждали до комнатной температуры и фильтровали через целлит и растворитель удаляли в вакууме. Остаток очищали хроматографией на силикагеле с 5% MeOH:CH2Cl2 с получением пиридин-3-ил(1-тритил-1H-имидазол-5-ил)метанона (Промежуточное соединение 9) (6,1 г, 94,4%).
[82] Раствор пиридин-3-ил(1-тритил-1H-имидазол-5-ил)метанона (Промежуточное соединение 9) (500 мг, 1,20 ммоль) в дихлорметане (20 мл) при комнатной температуре обрабатывали 2,3-диметилфенилмагния бромидом (имеющимся в продаже) (3,6 мл, 1,8 ммоль, 0,5 М в ТГФ) и перемешивали при комнатной температуре в течение 16 часов. Смесь гасили водой (50 мл) и насыщенным раствором хлорида аммония (50 мл). Остаток выделяли при типичной водной обработке с получением (2,3-диметилфенил)(пиридин-3-ил)(1-тритил-1H-имидазол-5-ил)метанола (Промежуточное соединение 10) в виде твердого вещества, 535 мг (сырой).
[83] К смеси (3-хлор-2-фторфенил)(пиридин-3-ил)(1-тритил-1H-имидазол-5-ил)метанола (Промежуточное соединение 10) (535 мг, 1,02 ммоль) в 57% водной HI (10 мл) добавляли красный фосфор (318 мг, 10,2 ммоль) в перепломбируемой пробирке и нагревали при 160°C в течение 16 часов. Затем смесь охлаждали до комнатной температуры и наливали на лед-воду, которую затем подщелачивали NaOH и разбавляли CHCl3. Остаток выделяли при типичной водной обработке и очищали хроматографией на силикагеле с 3-5% NH3-MeOH:CH2Cl2 с получением (3-хлор-2-фторфенил)(пиридин-3-ил)(1-тритил-1H-имидазол-5-ил)метанола (890) в виде твердого вещества (51 мг). 1H ЯМР (CD3OD, 300 МГц): δ 8.39-8.37 (m, 1H), 8.29 (d, J=2.4 Гц, 1H), 7.67 (s, 1H), 7.56-7.52 (m, 1H), 7.37-7.33 (m, 1H), 7.07-6.97 (m, 2H), 6.68 (d, 7=7.5 Гц, 1H), 6.40 (s, 1H), 5.76 (s, 1H), 2.27 (s, 3H), 2.16 (s, 3H).
[84] Приведенные ниже соединения синтезировали одним из способов, описанных выше:
[85] 2-((2,3-диметилфенил)(1H-имидазол-4-ил)метил)пиридин, 301:
[86] (Способ: В)
[87] 1H ЯМР (300 МГц, CD3OD): δ 8.47 (d, J=4.2 Гц, 1H), 7.89 (s, 1H), 7.83-7.72 (m, 1H), 7.31-7.27 (m, 1H), 7.11-6.96 (m, 3H), 6.66 (d, J=7.5 Гц, 1H), 6.45 (s, 1H), 5.85 (s, 1H), 2.28 (s, 3H), 2.16 (s, 3H).
[88] 4-((2,3-диметилфенил)(1H-имидазол-5-ил)метил)пиридин, 300:
[89] (Способ: В)
[90] 1H ЯМР (300 МГц, CD3OD): δ 8.42-8.40 (m, 2H), 7.67 (s, 1H), 7.17-7.15 (m, 2H), 7.07-6.96 (m, 2H), 6.70 (d, J=7.5 Гц, 1H), 6.44 (s, 1H), 5.74 (s, 1H), 2.27 (s, 3H), 2.15 (s, 3H).
[91] 2-((2-фтор-3-(трифторметил)фенил)(1H-имидазол-5-ил)метил)пиридин, 393:
[92] (Способ: А)
[93] 1H ЯМР (300 МГц, CD3OD): δ 8.48 (d, J=4.8 Гц, 1H), 7.79 (t, 7=7.8, Гц, 1H), 7.69 (s, 1H), 7.58 (t, J=6.3 Гц, 1H), 7.42 (t, J=6.3 Гц, 1H), 7.38-7.24 (m, 3H), 6.66 (s, 1H), 5.92 (s, 1H).
[94] 3-((2-фтор-3-(трифторметил)фенил)(1H-имидазол-5-ил)метил)пиридин, 394:
[95] (Способ: А)
[96] 1H ЯМР (300 МГц, CD3OD): δ 8.43 (dd, J=1.5, 5.1 Гц, 1H), 8.40 (d, J=2.4 Гц, 1H), 7.71 (s, 1H), 7.69-7.65 (m, 1H), 7.62 (t, J=7.8 Гц, 1H), 7.44-7.38 (m, 2H), 7.31 (t, J=7.8 Гц, 1H), 6.68 (s, 1H), 5.87 (s, 1H).
[97] 4-((2-фтор-3-(трифторметил)фенил)(1H-имидазол-5-ил)метил)пиридин, 395:
[98] (Способ: А)
[99] 1H ЯМР (300 МГц, CD3OD): δ 8.48-8.46 (m, 2H), 7.71 (s, 1H), 7.63 (t, J=6.6 Гц, 1H), 7.42 (t, 7=6.9 Гц, 1H), 7.34 (d, 7=7.8 Гц, 1H), 7.29-7.25 (m, 2H), 6.72 (s, 1H), 5.85 (s, 1H).
[100] 2-((2,3-дихлорфенил)(1H-имидазол-5-ил)метил)пиридин, 049:
[101] (Способ: А)
[102] 1H ЯМР (300 МГц, CD3OD): δ 8.48-8.45 (m, 1H), 7.76 (td, 7=7.8, 9.6 Гц, 1H), 7.68 (s, 1H), 7.44 (dd, J=1.8, 8.4 Гц, 1H), 7.31-7.26 (m, 1H), 7.23 (t, 7=8.1 Гц, 1H), 7.16 (d, 7=7.8 Гц, 1H), 6.99 (dd, 7=6.3, 7.5 Гц, 1H), 6.53 (s, 1H), 6.04 (s, 1H).
[103] 3-((2,3-дихлорфенил)(1H-имидазол-5-ил)метил)пиридин, 050:
[104] (Способ: А)
[105] 1H ЯМР (300 МГц, CD3OD): δ 8.43 (dd, J=1.8, 5.1 Гц, 1H), 8.35 (d, J=7 Гц, 1H), 7.70 (s, 1H), 7.62-7.58 (m, 1H), 7.47 (dd, J=1.5, 7.8 Гц, 1H), 7.39 (dd, J=5.1, 8.1 Гц, 1H), 7.25 (t, J=8.1 Гц, 1H), 7.05 (dd, J=1.5, 7.8 Гц, 1H), 6.56 (s, 1H), 5.96 (s, 1H).
[106] 4-((2,3-дихлорфенил)(1H-имидазол-5-ил)метил)пиридин, 051:
[107] (Способ: А)
[108] 1H ЯМР (300 МГц, CD3OD): δ 8.46-8.44 (m, 2H), 7.70 (s, 1H), 7.48 (dd, J=1.8, 8.1 Гц, 1H), 7.24 (t, J=8.1 Гц, 1H), 7.21-7.19 (m, 2H), 7.05 (dd, J=1.5, 7.5 Гц, 1H), 6.60 (s, 1H), 5.95 (s, 1H).
[109] 2-((3-хлор-2-метилфенил)(1H-имидазол-5-ил)метил)пиридин, 984:
[110] (Способ: А)
[111] 1H ЯМР (300 МГц, CD3OD): δ 8.49-8.47 (m, 1H), 7.8 (s, 1H), 7.81-7.75 (m, 1H), 7.33-7.28 (m, 2H), 7.14-7.06 (m, 2H), 6.80 (d, J=9 Гц, 1H), 6.51 (s, 1H), 5.85 (s, 1H), 2.31 (s, 3H).
[112] 4-((3-хлор-2-метилфенил)(1H-имидазол-5-ил)метил)пиридин, 983:
[113] (Способ: А)
[114] 1H ЯМР (300 МГц, CD3OD): δ 8.46-8.44 (m, 2H), 7.70 (s, 1H), 7.30 (d, J=9 Гц, 1H), 7.19-7.17 (m, 2H), 7.10 (t, J=6 Гц, 1H), 6.82 (d, J=9 Гц, 1H), 6.51 (s, 1H), 5.75 (s, 1H), 2.31 (s, 3H).
[115] 2-((3-фтор-2-метилфенил)(1H-имидазол-5-ил)метил)пиридин, 119:
[116] (Способ: В)
[117] 1H ЯМР (300 МГц, CD3OD): δ 8.49-8.47 (m, 1H), 7.80-7.74 (m, 2H), 7.32-7.28 (m, 1H), 7.14-7.07 (m, 2H), 6.95 (t, J=8.7 Гц, 1H), 6.67 (d, J=7.5 Гц, 1H), 6.49 (s, 1H), 5.80 (s, 1H), 2.16 (s, 3H).
[118] 4-((3-фтор-2-метилфенил)(1H-имидазол-5-ил)метил)пиридин, 330:
[119] (Способ: Б)
[120] 1H ЯМР (300 МГц, CD3OD): δ 8.45-8.43 (m, 2H), 7.69 (s, 1H), 7.20-7.09 (m, 3H), 6.97 (t, J=8.4 Гц, 1H), 6.71 (d, J=8.1 Гц, 1H), 6.51 (s, 1H), 5.70 (s, 1H), 2.15 (s, 3H).
[121] 2-((2,3-дифторфенил)(1H-имидазол-5-ил)метил)пиридин, 419: [122] (Способ: А)
[123] 1H ЯМР (300 МГц, CD3OD): δ 8.47 (d, J=4.2 Гц, 1H), 7.78 (td, J=7.8 Гц, 9.3 Гц, 1H), 7.68 (s, 1H), 7.32-7.23 (m, 2Н), 7.19-7.06 (m, 2Н), 6.91-6.86 (m, 1H), 6.63 (s, 1H), 5.88 (s, 1H).
[124] 3-((2,3-дифторфенил)(1H-имидазол-5-ил)метил)пиридин, 519:
[125] (Способ: А)
[126] 1H ЯМР (300 МГц, CD3OD): δ 8.43 (d, J=6 Гц, 1H), 8.39 (d, J=3 Гц, 1H), 7.70 (s, 1H), 7.68 (d, J=9 Гц, 1H), 7.40 (dd, J=6 Гц, 9 Гц, 2Н), 7.20-7.11 (m, 2Н), 6.94 (t, J=9 Гц, 1H), 6.66 (s, 1H), 5.82 (s, 1H).
[127] 4-((2,3-дифторфенил)(1H-имидазол-5-ил)метил)пиридин, 665:
[128] (Способ: А)
[129] 1H ЯМР (300 МГц, CD3OD): δ 8.47-8.45 (m, 2Н), 7.70 (s, 1H), 7.27-7.25 (m, 2Н), 7.21-7.11 (m, 2Н), 6.92 (t, J=6 Гц, 1H), 6.70 (s, 1H), 5.80 (s, 1H).
[130] 2-((2-метилфенил)(1H-имидазол-5-ил)метил)пиридин, 668:
[131] (Способ: Б)
[132] 1H ЯМР (300 МГц, CD3OD): δ 8.46 (d, J=4.8 Гц, 1H), 7.76 (td, J=9 Гц, 14.4 Гц, 1H), 7.66 (s, 1H), 7.31-7.27 (m, 1H), 7.19-7.09 (m, 3H), 6.84 (d, 6.6 Гц, 1H), 6.40 (s, 1H), 5.77 (s, 1H), 2.25 (s, 1H).
[133] 3-((2-метилфенил)(1H-имидазол-5-ил)метил)пиридин, 669:
[134] (Способ: Б)
[135] 1H ЯМР (300 МГц, CD3OD): δ 8.41-8.39 (m, 1H), 8.31 (s, 1H), 7.68 (s, 1H), 7.57 (d, J=9 Гц, 1H), 7.38 (dd, J=3, 6 Гц, 1H), 7.18-7.12 (m, 3H), 6.87 (d, J=6 Гц, 1H), 6.43 (s, 1H), 5.71 (s, 1H), 2.26 (s, 3H).
[136] 4-((2-метилфенил)(1H-имидазол-5-ил)метил)пиридин, 742:
[137] (Способ: Б)
[138] 1H ЯМР (300 МГц, CD3OD): δ 8.44-8.42 (m, 2Н), 7.68 (s, 1H), 7.19-7.17 (m, 2Н), 7.16-7.11 (m, 2Н), 7.19 (d, J=9 Гц, 1H),6.47 (s, 1H), 5.68 (s, 1H), 2.25 (s, 3H).
[139] 2-((2-фторфенил)(1H-имидазол-5-ил)метил)пиридин, 667:
[140] (Способ: А)
[141] 1H ЯМР (300 МГц, CD3OD): δ 8.47-8.45 (d, J=9 Гц, 1H), 7.76 (td, J=8.1 Гц, 9.9 Гц, 1H), 7.66 (s, 1H), 7.31-7.20 (m, 3H), 7.10-7.07 (m, 3H), 6.58 (s, 1H), 6.86 (s, 1H).
[142] 3-((2-фторфенил)(1H-имидазол-5-ил)метил)пиридин, 982:
[143] (Способ: А)
[144] 1H ЯМР (300 МГц, CD3OD): δ 8.41-8.39 (m, 1H), 8.67 (d, J=2.1 Гц, 1H), 7.69 (s, 1H), 7.67 (d, J=6 Гц, 1H), 7.35 (dd, J=12.6 Гц, 12.9 Гц, 2Н), 7.30-7.26 (m, 2Н), 7.10-7.16 (m, 3H), 6.61 (s, 1H), 5.79 (s, 1H).
[145] 4-((2-фторфенил)(1H-имидазол-5-ил)метил)пиридин, 666:
[146] (Способ: А)
[147] 1H ЯМР (300 МГц, CD3OD): δ 8.45-8.43 (m, 2Н), 7.69 (s, 1H), 7.33-7.28 (m, 2Н), 7.24-7.22 (m, 2Н), 7.14-7.06 (m, 2Н), 7.04 (s, 1H), 6.65 (s, 1H), 5.78 (s, 1H).
[148] 2-((3-фторфенил)(1H-имидазол-5-ил)метил)пиридин, 118:
[149] (Способ: Б)
[150] 1H ЯМР (300 МГц, CD3OD): δ 8.48-8.46 (m, 1H), 7.77 (ddd, J=1.8, 7.8, 13.5 Гц, 1H), 7.66 (s, 1H), 7.33-7.26 (m, 3H), 7.05 (d, J=7.5 Гц, 1H), 6.98-6.90 (m, 2Н), 6.64 (s, 1H), 5.59 (s, 1H).
[151] 3-((3-фторфенил)(1H-имидазол-5-ил)метил)пиридин, 447:
[152] (Способ: Б)
[153] 1H ЯМР (300 МГц, CD3OD): δ 8.41-8.39 (m, 2Н), 7.68 (s, 1H), 7.67-7.63 (m, 1H), 7.39-7.28 (m, 2Н), 7.04-6.91 (m, 3H), 6.64 (s, 1H), 5.56 (s, 1H).
[154] 4-((3-фторфенил)(1H-имидазол-5-ил)метил)пиридин, 298:
[155] (Способ: Б)
[156] 1H ЯМР (300 МГц, CD3OD): δ 8.446-8-44 (m, 2Н), 7.69 (s, 1H), 7.35-7.31 (m, 1H), 7.27-7.25 (m, 2Н), 7.03-6.90 (m, 3H), 6.68 (s, 1H), 5.53 (s, 1H).
[157] 2-((фенил)(1H-имидазол-5-ил)метил)пиридин, 302:
[158] (Способ: Б)
[159] 1H ЯМР (300 МГц, CD3OD): δ 8.47 (d, J=4.8 Гц, 1H), 7.79-7.73 (m, 2Н), 7.32-7.19 (m, 7Н), 6.62 (s, 1H), 5.59 (s, 1H).
[160] 3-((фенил)(1H-имидазол-5-ил)метил)пиридин, 891:
[161] (Способ: Б)
[162] 1H ЯМР (300 МГц, CD3OD): δ 8.39-8.36 (m, 2Н), 7.67 (s, 1H), 7.66-7.62 (m, 1H), 7.39-7.18 (m, 6Н), 6.57 (s, 1H), 5.52 (s, 1H).
[163] 4-((фенил)(1H-имидазол-5-ил)метил)пиридин, 892:
[164] (Способ: Б)
[165] 1H ЯМР (300 МГц, CD3OD): δ 8.42-8.40 (m, 2Н), 7.66 (s, 1H), 7.33-7.18 (m, 7Н), 6.60 (s, 1H), 5.48 (s, 1H).
[166] 4-((3-хлор-2-фторфенил)(тиофен-2-ил)метил)-1Н-имидазол, 056:
[167] (Способ: А)
[168] 1H ЯМР (300 МГц, CDCl3): δ 7.63 (s, 1H), 7.35 (dd, J=2.1 Гц, 7.5 Гц, 9.9 Гц, 1H), 7.28-7.26 (m, 1H), 7.14-7.04 (m, 2Н), 6.94 (dd, J=3.3 Гц, 5.1 Гц, 1H), 6.78 (d, J=3.6 Гц, 1H), 6.71 (s, 1H), 5.96 (s, 1H).
[169] 3-((2-хлор-3-фторфенил)(1H-имидазол-4-ил)метил)пиридин, 322:
[170] (Способ: А)
[171] 1H ЯМР (300 МГц, CDCl3): δ 8.47-8.45 (m, 2Н), 7.56 (s, 1H), 7.50 (dt, J=7.8, 2.1 Гц, 1H), 7.25-7.13 (m, 2Н), 7.04 (td, J=1.8 Гц, 8.7 Гц, 1H), 6.94 (d, J=7.8 Гц, 1H), 6.48 (s, 1H), 5.88 (s, 1H).
[172] 4-((2-хлор-3-фторфенил)(4,5-диизопропилтиофен-2-ил)метил)-1Н-имидазол, 332:
[173] (Способ: А)
[174] 1H ЯМР (300 МГц, CDCl3): δ 7.44 (s, 1H), 7.19-7.09 (m, 2Н), 7.03-6.97 (m, 1H), 6.66 (s, 1H), 6.57 (s, 1H), 6.02 (s, 1H), 3.22 (гептет, J=6.9 Гц, 1H), 2.94 (гептет, J=6.9 Гц, 1H), 1.22 (d, J=6.9 Гц, 6Н), 1.13-1.10 (m, 6Н).
[175] 4-((2-хлор-3-фторфенил)(4-изопропилтиофен-2-ил)метил)-1H-имидазол, 335:
[176] (Способ: А)
[177] 1H ЯМР (300 МГц, CDCl3): δ 7.55 (s, 1H), 7.21-7.00 (m, 3H), 6.79-6.78 (m, 1H), 6.71-6.70 (m, 2Н), 6.08 (s, 1H), 2.85 (гептет, J=6.6 Гц, 1H), 1.19 (d, J=6.6 Гц, 6Н).
[178] 4-((2-хлор-3-фторфенил)(5-изопропилтиофен-2-ил)метил)-1H-имидазол, 337:
[179] (Способ: А)
[180] 1H ЯМР (300 МГц, CDCl3): δ 7.52 (s, 1H), 7.2-6.99 (m, 3H), 6.69 (s, 1H), 6.6-6.57 (m, 2Н), 6.04 (s, 1H), 3.07 (гептет, J=6.6 Гц