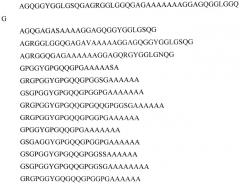Способ получения суспензий гидрогелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины и их применение
Иллюстрации
Показать всеИзобретение представляет собой способ получения суспензии гидрогелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины. Способ включает получение раствора белка, который освобождают от растворителя, получение гидрогеля и получение микрогелевой суспензии, определение размера гелевых микрочастиц, получение гелевых микрочастиц с заданными размерами. При этом используют рекомбинантный белок паутины паука-кругопряда, который растворяют в растворе лития хлористого в муравьиной кислоте. Диализ раствора проводят против калий-фосфатного буфера, центрифугируют. Раствор белка подвергают воздействию ультразвука. Раствор оставляют при комнатной температуре до образования геля. Гель протирают через сито, помещают в 96% этиловый спирт, встряхивают, выдерживают. Микрочастицы разделяют дифференциальным центрифугированием. Изобретение относится также к применению суспензии гидрогелевых микрочастиц, полученных описанным способом, для адгезии и пролиферации клеток человека или животных на поверхности гидрогелевых микрочастиц или имплантации гидрогелевых микрочастиц в организм человека или животных. Изобретение позволяет эффективно получать суспензии гидрогелевых микрочастиц с заданными размерами. 2 н. и 3 з.п. ф-лы, 6 ил., 14 пр.
Реферат
Область техники, к которой относится изобретение.
Изобретение относится к области биотехнологии и направлено на способ получения суспензий гелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины и их применению.
Уровень техники
Паутина является уникальным биоматериалом, сочетающим в себе удивительную прочность и эластичность. По этим показателям она не имеет аналогов как в природе, так и среди материалов, созданных человеком. Так, например, каркасная нить паутины паука-кругопряда Nephila clavipes no значениям прочности на разрыв превосходит сталь и сопоставима с кевларом, а по величине энергии разрыва превосходит и кевлар; в то же время она может растягиваться до 35% своей длины [Gosline J.M. et al. Endeavor, 1986, v.10, 37-43].
Получение промышленных количеств таких материалов возможно лишь с помощью генно-инженерных и биотехнологических методов. К настоящему времени выделены и достаточно полно охарактеризованы несколько генов, кодирующих белки паутины [Xu M. & Lewis R. Proc. Natl.Acad.Sci, USA, 1990, v.87, 7120-7124; HinnmanM. & Lewis R.J.Biol. Chem, 1992, v.267, 19320-19324; Guerette P. et al. J.Science, 1996, v.272, 112-115; Hayashi C.Y.& Lewis R.V.J.Mol. Biol.,1998, v.275, 773-784]. Эти гены относятся к наиболее протяженным из известных цистронов (размеры мРНК лежат в диапазоне от 7,5 до 15,5 т.н.) и состоят из большого числа тандемно повторяющихся протяженных последовательностей, которые заметно различаются у разных генов. Наиболее изученная каркасная нить паука-кругопряда Nephila clavipes состоит из двух белков - спидроина 1 и спидроина 2 (MaSp1 и MaSp2 соответственно) синтезируемых большой ампуловидной железой [Hinnman M. & Lewis R.J.Biol. Chem., 1992, v.267, 19320-19324; Guerette P. et al. Science, 1996, v.272, 112-115]. Повторяющийся элемент спидроина 1 можно представить в виде следующей консенсусной последовательности:
[GGAGQGGYGGLGSQGAGRGGLGGQGAG(A)4-7],
а повторяющуюся последовательность спидроина 2 - в виде
[GPGGYGPGQQGPGGYAPGQQPSGPGS(A)6-10].
Принципиальным различием между этими белками является то, что в случае спидроина 1 элементарным повтором является трипептид GGX (Х=А, S или Y), а в случае спидроина 2 - пентапептиды GPGGY и GPGQQ. При этом для спидроина 1 характерна повышенная прочность, а для спидроина 2, способного образовывать (β-спирали [Hayashi et al., 1999, Int. J.Biol. Macromol., v.24, 271-275], - большая эластичность. Взаимодействие этих белков в составе каркасной нити паутины и обеспечивает уникальное сочетание ее свойств.
Белки MiSp1 и MiSp2, синтезируемые малой ампуловидной железой, и белок Flag ловчей нити паука-кругопряда также имеют повторяющуюся структуру. Повторяющиеся области обогащены аланином и глицином. Мотивы GGX и GA представлены по всей длине аминокислотной последовательности как белка MiSpl, так и белка MiSp2 [К. Vasanthavada et al. Cell. Mol. Life Sci, 2006, v.63, 1986-1999]. В последовательности белка Flag ловчей нити доминантные повторяющияся мотивы представлены пентапептидом GPGG1X и трипептидом GGX.
Результаты исследования белков каркасной нити паука-кругопряда Nephila clavipes, а также белка ловчей нити и белков, синтезируемых малой ампуловидной железой [KohlerT. & VollrathF. J. Exp.ZooL, 1995, v.271, 1-17; Colgin M.A. & Lewis R., Protein Sci., 1998, v.7, 667-672], позволили выдвинуть модульную гипотезу строения белков паутины [Hinman at al., 2000, TIBTECH, V.1, 374-379]. Структурный анализ белков паутины свидетельствует о наличии в них кристаллических областей, образованных β-складчатыми структурами (считается, что они формируются блоками (А)n и (GA)n), которые обеспечивают прочность нитей паутины и которые погружены в менее структурированный Gly-обогащенный матрикс, ответственный за эластичность. На концах молекул содержатся неповторяющиеся (NR) уникальные консервативные последовательности, которые необходимы, как полагают, для повышения растворимости белков в концентрированном растворе внутри железы, а также для правильной подгонки молекул при формировании нити при прядении.
В первом случае более 80% целевого белка обнаруживалось в водонерастворимой фракции, и средний выход составлял 6-8 мг белка на 1 литр ферментационной культуры дрожжей. В дрожжах Pichia pastoris средний выход чистого белка 1F9 составил приблизительно 70 мг на 1 кг влажной клеточной массы (приблизительно 23 мг/л ферментационной культуры). Последовательности рекомбинантных белков были максимально приближены к последовательностям природных белков, в частности, повторяющаяся область белка 1F9 содержала 9 повторов «мономера», состоящего из пяти вариантов первичных повторов, обнаруженных в природном спидроине 1. С целью увеличения уровня синтеза рекомбинантного белка в клетках дрожжей структура генов 1F9 и 2Е12 была модифицирована путем замены "редких" триплетов на кодоны, характерные для эффективно экспрессирующихся генов дрожжей, а количество внутренних повторов нуклеотидных последовательностей сведено к минимуму. Фрагменты ДНК, кодирующие соответствующие мономеры обоих белков, были получены в результате химико-ферментативного синтеза и затем амплифицированы. Конечный ген белка 1F9 кодировал девять повторов соответствующего «мономера», составляющих белок с молекулярной массой 94 кДа; белок 2Е12 (молекулярная масса 113 кДа), содержал 12 «мономерных» повторов.
В растворах белков 1F9 и 2Е12, очищенных с использованием катионообменной хроматографии, были исследованы структурные переходы, возникающие при определенных воздействиях [Bogush V.G. & Debabov V.G., 2009, J.Neuroimmune PharmacoL, v.4, 17-27]. Несмотря на отсутствие гидрофильных N- и С-концевых уникальных последовательностей (NR), которые, как предполагалось ранее, необходимы для формирования нанофибрилл и мицелл, оба белка в водном растворе спонтанно формировали нанофибриллы длиной 100 нм - 1 мкм и мицеллы диаметром около 1 мкм. Причем нанофибриллы имели спиралевидную структуру с периодом в 40 нм.
Из уровня техники известен способ получения гидрогеля из аналога паучьего спидроина 1, который был взят в качестве ближайшего аналога [Rammensee S, Huemmerich D, Hermanson KD, Scheibel T, Bausch AR (2006) Rheological characterization of hydrogels formed by recombinantly produced spider silk. Appl Phys A Mater Sci Process 82:261-264].
Для получения гидрогеля в статье использован аналог паучьего спидроина 1-ADF-4 с 16 повторами консенсусной последовательности (С16):
(GSSAAAAAAAASGPGGYGPENQGPSGPGGYGPGGP), с молекулярной массой 48 кДа.
Белок был экспрессирован в E.coli BLR (DE3). Очищенный белок промывали в 8 М мочевине, растворяли в 6М GdmSCN и диализовали против 10 мМ NH4HCO3. Нерастворившиеся фрагменты удаляли ЦФ при 50000 g, 30 мин. Оставшийся раствор белка лиофилизировали.
Лиофилизированный белок растворяли в 6М GdmSCN и диализовали против 5 мМ фосфата калия рН 8,0. Нерастворившиеся фрагменты удаляли ЦФ при 125000 g, 30 мин. Осадок отбрасывали.
Добавляли метанол до концентрации 10%. При этом белок собирался в нанофибриллы при концентрации от 5 до 30 мг/мл.
В зависимости от концентрации нанофибриллы образовывали гидрогель за период от нескольких дней до 1 недели.
Этот гидрогель легко разрушался при встряхивании и струении.
Для упрочнения гидрогель сшивали аммоний пероксодисульфатом (APS) и Tris(2,2'-bipiridyl)dichlororuthenium(II)(Rubpy). Количество реагентов рассчитывали так, чтобы финальная концентрация составляла 10 мМ APS и 100 мкм Rubpy. Реагенты добавляли к гидрогелю и давали впитаться в течение ночи. Затем гидрогель экспонировали на видимом свету под вольфрамовой лампой в течение 1 мин и остатки жидкости удаляли с поверхности гидрогеля.
Отличие предложенной методики от известной:
- использовали другие последовательности белков;
- два белка - аналога спидроинов 1 и 2, а не один;
- более разнообразные последовательности (более приближенные к природным);
- белки имеют высокие молекулярные массы - 94 и 113 кД, что должно давать более плотные гидрогели;
- экспрессия генов - в клетках дрожжей, а не в E.coli.
- гели получали в течение ночи, а не нескольких дней;
- получены суспензии гидрогелевых микрочастиц с заданными диапазонами размеров и различной плотностью.
Возможность получать гидрогели в виде суспензии гидрогелевых микрочастиц имеет большое преимущество по сравнению с неизмельченными гидрогелями: частицы могут быть покрыты монослоем клеток (это уже показано авторами) и вводиться с помощью шприца в организм. Заявленный метод позволяет использовать значительно большее количество клеток на единицу объема материала и способствует лучшей выживаемости клеток благодаря более эффективной доставке питательных веществ. Суспензия микрогелей может использоваться для нанесения на поверхность ран, что имеет определенные преимущества по сравнению с пленками (не надо подбирать размер, лучший газообмен и доступ лекарственных веществ). Кроме того, суспензии гидрогелевых микрочастиц с заданными размерами позволяют использовать их в медицине в случаях, когда необходимо достичь равномерной и программируемой скорости биодеградации микрочастиц.
Раскрытие изобретения
Авторами настоящего изобретения впервые предложен способ получения рекомбинантных белков паутины пауков-кругопрядов (Araneidae) в клетках дрожжей, обеспечивающий продукцию рекомбинантных белков в количествах, в десятки раз превышающих количества рекомбинантных белков паутины, продуцируемых в соответствии со способами, известными из предшествующего уровня техники, и способ получения суспензий гидрогелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины и их медицинское применение.
Согласно предложенному способу рекомбинантные белки паутины пауков-кругопрядов экспрессируют в клетках дрожжей в виде гибрида с убиквитин-подобным белком, занимающим в составе гибрида N-концевое положение и содержащим сайт процесинга, распознаваемый природными дрожжевыми протеиназами, предпочтительно убиквитин-специфичными протеиназами DUB или SUMO-специфичными протеиназами дрожжей, в результате чего в ходе экспрессии гибридные белки подвергаются процессингу под действием протеиназ, что обеспечивает накопление в клетках дрожжей зрелого белка паутины, не содержащего гибридный компонент, причем белок накапливается в водонерастворимой фракции дрожжевых клеток.
Предпочтительно способ согласно изобретению предусматривает получение рекомбинантного белка паутины, консенсусные последовательности которого происходят из каркасных белков большой ампуловидной железы и/или белков малой ампуловидной железы или белка ловчей нити паука-кругопряда.
В одном из предпочтительных воплощений способ, согласно изобретению, предусматривает получение рекомбинантных белков паутины, консенсусные последовательности которых происходят из каркасных белков большой ампуловидной железы Nephila clavipes и/или Nephila madagascariensis, и убиквитин-подобный белок выбирают из группы, включающей убиквитин и белок SUMO дрожжей Saccharomyces cerevisiae.
В одном из наиболее предпочтительных воплощений способ согласно изобретению, направлен на получение рекомбинантного белка 2Е12 каркасной нити паука-кругопряда Nephila madagascariensis в клетках Saccharomyces cerevisiae под контролем промотора гена GAL1 дрожжей, причем ген рекомбинантного белка слит с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
Еще в одном наиболее предпочтительном воплощении способ согласно изобретению направлен на экспрессию гена рекомбинантного белка 1F9 каркасной нити паука-кругопряда Nephila clavipes в клетках Saccharomyces cerevisiae под контролем промотора гена GAL1 дрожжей, причем ген рекомбинантного белка слит с последовательностью, кодирующей убиквитин или белок SUMO Saccharomyces cerevisiae.
В соответствии с еще одним аспектом изобретение обеспечивает хозяйские клетки дрожжей, продуцирующие рекомбинантные белки паутины паука-кругопряда. Наиболее предпочтительными хозяйскими клетками, согласно изобретению, являются клетки дрожжей Saccharomyces cerevisisae. В еще одном аспекте изобретение обеспечивает штаммы-продуценты рекомбинантых белков 1F9 и 2Е12 каркасной нити паука-кругопряда.
Краткое описание чертежей
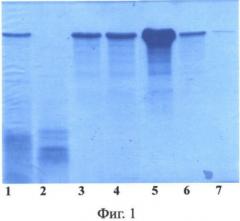
Фиг.1. Электрофорез в 12% ПААГ с ДДС-Na фракций 1F9 после хроматографии на катионообменной колонке HiPrep 16/10 SP FF. Дорожки: 1 - исходный раствор перед нанесением на колонку; 2 - проскок; 3-6 - фракции, содержащие белок 1F9, 7 - образец стандартного 1F9.
Фиг.2. Электрофорез в 12% ПААГ с ДДС-Na фракций 2Е12 после хроматографии на катионообменной колонке HiPrep 16/10 SP FF. Дорожки: 1 - исходный раствор перед нанесением на колонку; 2 - проскок; 3 - стандарты молекулярных масс (сверху вниз, в кДа): 170, 130, 95, 72, 55, 43, 34, 26, 17; 4 - фракция, содержащая 2Е12, 5 - образец стандартного 2Е12.
Фиг.3. Карта вектора pPDX3-HUB-1F9.
Обозначения: SPIDROIN - синтетический ген рекомбинантного белка 1F9 (спидроин-1 паука N.clavipes); HUB - ген убиквитина дрожжей S.cerevisiae; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae соответственно; сус1Т - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2-микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации, обеспечивающий селективную амплификацию вектора в клетках E.coli.
Фиг.4. Карта вектора pPDX3-SUMO-1F9.
Обозначения: SPIDROIN - синтетический ген рекомбинантного белка 1F9 (рекомбинантный спидроин-1 паука N.clavipes); SUMO - ген SMT3 дрожжей S.cerevisiae, кодирующий белок SUMO; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae соответственно; сус1Т - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2-микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации дрожжей; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации для обеспечения селективной амплификации вектора в клетках Е.coli.
Фиг.5. Схема вектора pPDX3-HUB-2E12.
Условные обозначения: SPIDROIN - последовательность ДНК, кодирующая рекомбинантный белок 2Е12; HUB - последовательность ДНК, кодирующая убиквитин дрожжей S.cerevisiae; GAL1 - промоторная область гена GAL1 дрожжей S.cerevisiae; URA3 и PGK1 - структурные гены URA3 и PGK1 дрожжей S.cerevisiae соответственно; cyc1T - последовательность терминатора транскрипции гена CYC1 дрожжей S.cerevisiae; 2 mkm - фрагмент эндогенной 2-микронной плазмиды дрожжей S.cerevisiae, содержащий область начала репликации; pUC18 - фрагмент плазмиды pUC18, содержащий ген бета-лактамазы (ApR) и область начала репликации, обеспечивающий селективную амплификацию вектора в клетках E.coli.
Фиг.6. Фотография искусственной нити из белка 1F9 в сосуде с этанолом.
Осуществление изобретения
Настоящее изобретение основано на неожиданном открытии, что экспрессия рекомбинантного белка паутины паука-кругопряда в клетках дрожжей в виде слитого белка с убиквитин-подобным белком, занимающим в составе гибрида N-концевое положение, позволяет в десятки раз увеличить продукцию рекомбинантного белка паутины, причем рекомбинантный белок, экспрессируемый в виде гибридного белка, накапливается в клетках дрожжей в водонерастворимой фракции в виде процессированного белка, не содержащего гибридный компонент.
Следовательно, в одном из аспектов настоящее изобретение обеспечивает способ получения рекомбинантного белка паутины паука-кругопряда в клетках дрожжей, предусматривающий конструирование вектора экспрессии, трансформацию клеток дрожжей полученным вектором экспрессии и экспрессию в трансформированных клетках гена рекомбинантного белка паутины паука-кругопряда, отличающийся тем, что используют вектор экспрессии, который включает последовательность ДНК, кодирующую рекомбинантный белок паутины паука-кругопряда, слитую с последовательностью, кодирующей убиквитин-подобный белок, занимающий в составе слитого белка N-концевое положение по отношению к рекомбинантному белку паутины, и содержащий сайт процессинга, распознаваемый природными дрожжевыми протеиназами, предпочтительно убиквитин-специфичными протеиназами DUB или SUMO-специфичными протеиназами дрожжей, в результате чего в ходе экспрессии гибридные белки подвергаются процессингу под действием протеиназ, что обеспечивает накопление в клетках дрожжей в водонерастворимой фракции рекомбинантного белка паутины в виде процессированного белка, не содержащего гибридный компонент.
Рекомбинантные белки, получаемые способом согласно изобретению, имеют явно выраженную периодическую структуру, которая может быть представлена в виде ряда консенсусных последовательностей, выведенных путем выравнивания повторяющихся единиц природных белков паутины пауков-кругопрядов. Рекомбинантные белки согласно изобретению представляют собой белки, последовательности которых содержат как повторы одной консенсусной последовательности, так и комбинации повторов консенсусных последовательностей различного типа, происходящих из каркасных белков большой ампуловидной железы, и/или белков малой ампуловидной железы, и/или белков Flag ловчей нити паука-кругопряда, в частности, выбираемых из группы, включающей консенсусные последовательности:
где MaSpl и MaSpl - белки каркасной нити большой ампуловидной железы Latrodectus hesperus [Lawrence B.A. et al., 2004, Biomacromolecules, v.5, 689-695];
MiSp1 и MiSp1 - белки малой ампуловидной железы Nephila clavipes [Colgin M.A. & Lewis R.V., 1998, Protein ScL, v.7, 667-672];
Flag - белок ловчей нити Nephila madagascariensis [Hayashi С.& Lewis R.V., 1998, J.Mol.Biol, v.275, 773-784].
Предпочтительно, согласно предложенному способу, используют консенсусные последовательности, происходящие из повторяющихся последовательностей белков большой ампуловидной железы Nephila clavipes и Nephila madagascariensis и выбираемые из группы:
Конструирование искусственных генов, кодирующих рекомбинантные белки большой и/или малой ампуловидных желез, или белки Flag ловчей нити паука-кругопряда включает реконструкцию последовательности ДНК, кодирующей консенсусную последовательность или комбинации повторов консенсусных последовательностей различного типа, происходящие из повторяющихся последовательностей указанных выше белков; конструирование и химический синтез серии праймеров к консенсусной последовательности/последовательностям; единовременный отжиг смеси всех синтезированных праймеров, необходимых для образования двухцепочечной молекулы ДНК, и последующую обработку их лигазой для удаления однонитевых разрывов ДНК или реакцию ПЦР с последовательным использованием необходимых праймеров и поэтапным достраиванием растущего фрагмента ДНК, причем образуемый фрагмент («мономер») затем подвергается поэтапному удвоению в составе плазмиды до получения гена необходимой длины [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22; Богуш В.Г. с соавт., 2006, Биотехнология, т.4, 3-12; Bogush V.G. & Debabov V.G., 2009, J. Neuroimmune PharmacoL, v.4, 17-27].
Последовательности соответствующих кДНК могут быть выведены на основе последовательности природного белка с учетом вырожденности кода и частоты встречаемости кодонов у дрожжей. В частности, при конструировании гена, кодирующего белок 1F9 и содержащего 9 копий "мономера", фрагменты, кодирующие наиболее типичные первичные повторы, были выбраны из последовательности природного белка и отличались друг от друга набором делеций. Реконструированная последовательность ДНК включала приблизительно 400 п.н. и кодировала полипептид, соответствующий 134 аминокислотным остаткам. «Редкие» кодоны в последовательности искусственного гена были заменены на наиболее часто используемые у дрожжей. «Мономер» был получен с помощью химико-ферментативного синтеза, и мультимерная форма получена путем пошаговой мультипликации мономера в составе рекомбинантной плазмиды [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22].
При конструировании гена 2Е12 были использованы последовательности спидроинов типа 2 большой ампуловидной железы, содержащиеся в базе данных белковых последовательностей NCBI и включающие более 200 аминокислотных остатков. На основании математического анализа всех последовательностей были разработаны последовательности блоков (каждый состоял из 3-5 первичных повторов) и составлена формула полного искусственного гена [Bogush V.G. et al., 2009, J. Neuroimmune PharmacoL, v.4, 17-27].
В одном из предпочтительных воплощений предложенный способ получения рекомбинантного белка паутины паука-кругопряда в клетках дрожжей предусматривает слияние гена рекомбинантного белка паутины с последовательностью ДНК, кодирующей убиквитин или белок SUMO дрожжей Saccharomyces cerevisiae.
В одном из наиболее предпочтительных воплощений изобретения в клетках Saccharomyces cerevisiae получают рекомбинантный белок 1F9 каркасной нити паутины паука-кругопряда Nephila clavipes, причем структурный ген белка 1F9 слит с последовательностью ДНК, кодирующей убиквитин Saccharomyces cerevisiae. Еще в одном наиболее предпочтительном воплощении изобретения в клетках Saccharomyces cerevisiae получают рекомбинантный белок 2Е12 каркасной нити паутины паука-кругопряда Nephila madagascariensis, причем ген белка 2Е12 слит с последовательностью ДНК, кодирующей убиквитин Saccharomyces cerevisiae.
В еще одном наиболее предпочтительном воплощении изобретения в клетках дрожжей Saccharomyces cerevisiae экспрессируют слитый белок, содержащий последовательность рекомбинантного белка 1F9, причем последовательность белка 1F9 слита с последовательностью белка SUMO дрожжей Saccharomyces cerevisiae. Рекомбинантные белки, получаемые согласно предложенному способу, были выделены из водонерастворимой фракции хозяйских клеток Saccharomyces cerevisiae с помощью хроматографии на катионообменной колонке (примеры 9 и 11). Электрофоретический анализ фракций (Фиг.1 и 2) показал, что рекомбинантные белки 1F9 и 2Е12 накапливаются во фракции водонерастворимых белков клеток дрожжей (в водорастворимой фракции рекомбинантные белки практически отсутствуют) и не содержат компонент убиквитин-подобного белка. На это указывает электрофоретическая подвижность анализируемых белков и отсутствие в геле полос, соответствующих по подвижности слитым белкам (убиквитин-1F9 и убиквитин-2Е12). Аналогичные результаты получены для рекомбинантных белков, выделенных и очищенных из водонерастворимой фракции хозяйских клеток Saccharomyces cerevisiae, продуцирующих рекомбинантные белки паутины, слитые с белком SUMO. Продукция рекомбинантных белков клетками Saccharomyces cerevisiae составляет не менее 100 мг/л ферментационной культуры.
Отсутствие рекомбинантных белков, получаемых в соответствии с предложенным изобретением, в водорастворимой фракции позволяет практически избежать потери белка в процессе выделения и очистки в отличие от известного способа [Богуш В.Г. с соавт., 2001, Биотехнология, т.2, 11-22], согласно которому только около 80% целевого белка обнаруживалось в водонерастворимой фракции.
Таким образом, при осуществлении способа получения рекомбинантного белка паутины согласно изобретению рекомбинантный белок, синтезируемый в клетках Saccharomyces cerevisiae, накапливается во фракции водонерастворимых белков в виде процессированного белка, не содержащего гибридный компонент, причем клетки, экспрессирующие рекомбинантный белок паутины, накапливают в десятки раз больше рекомбинантного белка, чем в соответствии со способами, известными из предшествующего уровня техники.
Очищенные рекомбинантные белки паутины паука-кругопряда, согласно изобретению, способны образовывать надмолекулярные структуры различных типов, в частности анализируемые белки формируют не растворяющиеся в воде нити (Пример 12, Фиг.6).
В соответствии с одним из аспектов изобретение обеспечивает клетки-хозяева дрожжей, продуцирующие рекомбинантные белки паутины пауков-кругопрядов. В качестве подходящих клеток-хозяев для получения рекомбинантных белков паутины используют клетки дрожжей, которые выбирают из группы, включающей Saccharomyces cerevisiae, Kluyveromyces lactis, Hansenula polymorpha, Pichia pastoris и Schizosaccharomyces pombe. Предпочтительными клетками-хозяевами являются клетки Saccharomyces cerevisisae. Наиболее предпочтительно, в качестве клеток-хозяев используют реципиентный штамм Saccharomyces cerevisiae D702, который является диплоидным, что обеспечивает повышенную стабильность его экспрессионных характеристик. Saccharomyces cerevisiae D702 содержит гомозиготные мутации в хромосомных аллелях структурного гена PGK1, кодирующего фосфоглицерат киназу, что обеспечивает стабильное поддержание вектора на средах, содержащих любой единственный источник углерода, усваиваемый дрожжами Saccharomyces cerevisiae, и гена GAL80, кодирующего белок - репрессор промотора GAL1, а также гомозиготную мутацию, приводящую к изменению регуляции гена GAL4, кодирующего белок - активатор промотора GAL1, вследствие чего осуществляется галактозо-регулируемая экспрессия генов, находящихся под контролем промотора GAL1.
В одном из наиболее предпочтительных воплощений изобретения клетки реципиентного штамма Saccharomyces cerevisiae D702 трансфомируют экспрессионным вектором pPDX3-HUB-1F9. Полученный в результате штамм SCR-702-1F9, продуцирующий рекомбинантный белок 1F9 каркасной нити паутины паука-кругопряда Nephila clavipes, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) как штамм Saccharomyces cerevisiae ВКПМ Y-3583.
Еще в одном из наиболее предпочтительных воплощений изобретения клетки реципиентного штамма Saccharomyces cerevisiae D702 трансфомируют экспрессионным вектором pPDX3-HUB-2E12. Полученный в результате штамм SCR-702-2E12, продуцирующий рекомбинантный белок 2Е12 каркасной нити паутины паука-кругопряда Nephila madagascariensis, депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) как штамм Saccharomyces cerevisiae ВКПМ Y-3584.
Еще в одном из наиболее предпочтительных воплощений изобретения клетки реципиентного штамма Saccharomyces cerevisiae D702 трансфомируют экспрессионным вектором pPDX3-SUMO-1F9.
Характеристика штаммов-продуцентов. Генотип:
Морфологические признаки:
При культивировании при температуре 28°С в течение 48 часов на агаризованной среде YPD следующего состава (в мас.%): пептон-2, дрожжевой экстракт - 1, глюкоза - 2, агар - 2, вода - остальное, клетки штаммов-продуцентов Saccharomyces cerevisiae имеют овальную форму, 3-7 мкм в диаметре. Клетки почкуются. Почкование истинное, многостороннее. Истинного мицелия не образуют. Колонии имеют следующий вид:
1) на агаризованной среде YPD колонии белого цвета с ровным краем, матовой поверхностью, линзовидным профилем и сметанообразной консистенцией;
2) на агаризованной среде с крахмалом (состав в мас.%: пептон - 2, дрожжевой экстракт - 1, крахмал - 1, агар - 2, вода - остальное) колонии белого цвета с узорчатым краем, матовой поверхностью, линзовидным профилем и крупчатой консистенцией.
Рост в жидкой среде с крахмалом: при 28°С в течение первых 24 ч культивирования - жидкость мутная, осадок белый, не комкуется, пристеночных пленок не образует.
Физико-химические признаки:
Оба штамма - факультативные анаэробы. Температура роста - 20-33°С (оптимум - 28°С). рН культивирования - 3,8-7,4 (оптимум - 5,0).
Ассимиляция источников углерода:
Оба штамма сбраживают глюкозу, фруктозу, мальтозу, сахарозу, декстрины, крахмал. Не сбраживают лактозу, галактозу, инулин, ксилозу, арабинозу. Ассимиляция источников азота:
Оба штамма усваивают аминокислоты, сернокислый аммоний, азотнокислый аммоний.
Хранение:
Штаммы хранят при температуре -70°С в 20% водном растворе глицерина. Возможно хранение на агаризованной богатой среде с глюкозой в течение 3 месяцев при +4°С.
Стабильность:
Стабильность заявляемых штаммов сохраняется при 20 последовательных пересевах на агаризованной среде YPD при температуре 28°С.
Патогенность:
Не являются патогененными.
Изобретение илюстрируется следующими примерами, представленными для подтверждения, но не ограничения оъема притязаний.
Еще одним аспектом изобретения является способ получения суспензий гелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины.
Другим аспектом изобретения является применение суспензий гелевых микрочастиц с заданными размерами на основе рекомбинантного белка паутины в медицинских целях.
Примеры
Пример 1. Конструирование вектора pPDX3-HUB
Структурный ген убиквитина дрожжей амплифицируют в реакции ПЦР с использованием в качестве матрицы хромосомной ДНК лабораторного штамма S.cerevisiae Y618 [Kartasheva et al, 1996, Yeast, v.l2, 1297-13], выделяемой по методу Сидорука [Сидорук с соавт., 2008, Сборник тезисов и докладов «Актуальные вопросы генетики, радиобиологии и радиоэкологии», Дубна, ОИЯИ, стр.100]. Праймерами для амплификации служат N513 (5'-ataccatggaacatcatcatcatcatcatggaggcatgcagatcttcgtcaagactttga) и N514 (5'-actggatccacctcttagccttagcacaac). Полученный в результате амплификации фрагмент ДНК размером 510 п.о. элюируют из агарозного геля с использованием набора Qiagen (Qiagen, cat. №28706), обрабатывают рестриктазами NcoI и BamHI и клонируют в расщепленной по тем же сайтам лабораторной плазмиде pUC18x-GALl-NcoI, несущей HindIII/Ncol фрагмент ДНК, кодирующий промоторную область гена GAL1 дрожжей. S.cerevisiae. В результате получают плазмиду р101-25, содержащую в своем составе нуклеотидную последовательность, кодирующую убиквитин дрожжей S.cerevisiae, слитую с нуклеотидной последовательностью промоторной области гена GAL1 дрожжей S.cerevisiae. Плазмида p101-25 содержит сайт узнавания рестриктазы XhoI в полилинкерной области следом за сайтом клонирования BamHI.
HindIII/XhoI фрагмент ДНК плазмиды р101-25, включающий промоторную область гена GAL1 и нуклеотидную последовательность, кодирующую убиквитин, клонируют в лабораторном векторе pPDX3, ДНК которого расщеплена по тем же сайтам. В результате клонирования получают вектор pPDX3-HUB, который используют для клонирования генов рекомбинантных белков паутины.
Пример 2. Конструирование экспрессионного вектора pPDX3-HUB-1F9
Экспрессионный вектор pPDX3-HUB-1F9 (Фиг.3) получают в результате клонирования BgIIIXhoI фрагмента ДНК лабораторной плазмиды pUC21-1F9 размером 3.6 т.п.н., включающего ген белка 1F9, в векторе pPDX3-HUB, ДНК которого расщеплена по сайтам BamHI и XhoI. В результате клонирования получают экспрессионный вектор pPDX3-HUB-1F9, в составе которого структурный ген белка 1F9 слит в одной рамке считывания со структурным геном, кодирующим убиквитин. Вектор используют для экспрессии белка 1F9 в клетках дрожжей S.cerevisiae.
Пример 3. Конструирование экспрессионного вектора pPDX3-HUB-2Е12
Экспрессионный вектор pPDX3-HUB-2E12 получают в результате клонирования BgIII/XhoI фрагмента ДНК лабораторной плазмиды pUC21-2Е12 размером 4.2 т.п.н., включающего ген белка 2Е12, в векторе pPDX3-HUB, ДНК которого расщеплена по сайтам BamHI и XhoI. В результате клонирования получают экспрессионный вектор pPDX3-HUB-2E12, в составе которого структурный ген белка 2Е12 слит в одной рамке считывания со структурным геном, кодирующим убиквитин. Вектор используют для экспрессии белка 2Е12 в клетках дрожжей S.cerevisiae.
Пример 4. Конструирование вектора pPDX3-SUMO.
Структурный ген SMT3 дрожжей S.cerevisiae, кодирующий белок SUMO, амплифицируют в реакции ПНР с использованием в качестве матрицы хромосомной ДНК лабораторного штамма S.cerevisiae, как в примере 1. Амплификацию проводят в две стадии. Сначала амплифицируют два перекрывающихся фрагмента ДНК, для чего используют следующие пары праймеров:
Фрагмент 1 размером 129 п.о.:
N450 (5'-atatccatggaaaagagatctgactcagaagtcaatcaagaa)
N454 (5'-cttgaagaaaatctctgaa)
Фрагмент 2 размером 230 п.о.:
N453 (5'-ttcagagattttcttcaag)
N452 (5'atatcaattggatccaccaatctgttctctgtga).
Амплифицированные фрагменты ДНК элюируют из агарозного геля и используют для ПЦР-лигирования. Для этого смесь фрагментов 1 и 2 используют в качестве матрицы для ПЦР, праймерами служат N450 и N452. Полученный в результате ПЦР фрагмент ДНК размером 290 п.о. элюируют из агарозного геля, обрабатывают рестриктазами BgIII и BamHI и клонируют в сайт BamHI лабораторной плазмиды pUC18x-GAL1-BamHI, несущей HindIII/BamHI фрагмент ДНК, кодирующий промоторную область гена GAL1 дрожжей S.cerevisiae, содержащую ATG кодон и сайт BamHI (подчеркнут) в последовательности ATGCATGGATCC. В результате осуществляют слияние последовательности гена SMT3 дрожжей S.cerevisiae и последовательности, кодирующей промоторную область гена GAL1 дрожжей S.cerevisiae. В результате получают плазмиду p101-18, в составе которой клонированный ген SMT3 секвенируют.
Полученная плазмида p101-18 содержит фрагмент ДНК, в составе которого ген SMT3 дрожжей слит с промоторной областью гена GAL1 дрожжей. В полилинкерной части плазмиды p101-18 следом за сайтом клонирования BamHI находится сайт узнавания рестриктазы XhoI. HindIII/XhoI фрагмент ДНК плазмиды p101-18, включающий промоторную область гена GAL1 и клонированный ген SMT3, клонируют в лабораторном векторе pPDX3, ДНК которого расщеплена по тем же сайтам. В результате клонирования получают вектор pPDX3-SUMO, который используют для клонирования генов рекомбинантных белков паутины.
Пример 5. Конструирование экспрессионного вектора pPDX3-SUMO-1F9.
Экспрессионный вектор pPDX3-SUMO-1F9 (Фиг.4) получают в результате клонирования BgIII/XhoI фрагмента ДНК лабораторной плазмиды pUC21-1F9 размером 3.6 т.п.н., включающего ген белка 1F9, в векторе pPDX3-SUMO, ДНК которого расщеплена по сайтам BamHI и XhoI. В результате клонирования получают экспрессионный вектор pPDX3-HUB-1F9, в составе которого структурный ген белка 1F9 слит в одной рамке считывания со структурным геном, кодирующим убиквитин. Вектор используют для экспрессии белка 1F9 в клетках дрожжей S.cerevisiae.
Пример 6. Конструирование штамма SCR-702-1F9 - продуцента белка 1F9(ВКПМ Y-3583).
Штамм SCR-702-1F9 получают в результате трансформации лабораторного штамма D702 экспрессионным вектором pPDX3-HUB-1F9. Для осуществления трансформации клетки штамма D702 подращивают в течение 18-24 часов при температуре 28°С на агаризованной среде YPGE следующего состава в мас.%: бактопептон - 2, дрожжевой экстракт - 1, бактоагар - 2, этанол - 2, глицерин - 3, вода - остальное. Трансформацию выращенных клеток штамма D702 проводят по методу Ito с соавт. [Ito et al., 1983, J.BacterioL, v.153, 163-168]. Трансформанты отбирают по способности расти на среде YPD следующего состава в мас.%: бактопептон - 2, дрожжевой экстракт - 1, глюкоза - 2, бактоагар - 2, вода - остальное. Один из полученных трансформантов называют SCR-702-1F9.
Пример 7. Конструирование штамма SCR-702-2E12 - продуцента белка 2Е12.
Штамм SCR-702-2E12 получают в результате трансформации лабораторного штамма D702 экспрессионным вектором pPDX3-HUB-2E12. Трансформацию осуществляют, как в примере 6. Штамм SCR-702-2E12 депонирован во Всероссийской Коллекции Промышленных Микроорганизмов как штамм Saccharomyces cerevisiae ВКПМ Y-3584.
Пример 8. Конструирование штамма D702-SUMO-1F9 - продуцента белка 1F9.
Штамм D702-SUMO-1F9 получают в результате трансформации лабораторного штамма D702 экспрессионным вектором pPDX3-SUMO-1F9. Трансформацию осуществляют, как в примере 4, за исключением того, что используют плазмиду pPDX3-SUMO-1F9.
Пример 9. Анализ экспрессии рекомбинантных белков 1F9 и 2Е12 в клетках штаммов Saccharomyces cerevisiae.
Клетки S.cerevisiae ВКПМ Y-3583, ВКПМ Y-3584 или D702-SUMO-1F9 культивируют в колбах при 30°С на ротационной качалке со скоростью 250 об/мин на жидкой среде YPD состава, в мас.%: бактопептон - 2, дрожжевой экстракт - 1, глюкоза - 2, вода - остальное, засевая в титре 5×105-5×106 мл-1. Образцы для анализа отбирают через 46 часов роста культуры. Конечная оптическая плотность культуры составляет ОД600=40-45. Клетки отделяют от среды культивирования осаждением с помощью центрифугирования при 10000 g в течение 1 мин и используют для последующего анализа экспрессии белков 1F9 и 2Е12 микрометодом в пробирке на 1,5 мл. Для этого осадок клеток суспендируют в "буфере для разрушения" (0,05 М фосфата натрия, 2,5 мМ ЭДТА, 5% глицерина) из расчета 100 мкл буфера на 100 мкл влажного осадка клеток. Разрушение клеток осуществляют с помощью стеклянных шариков (d=0,45-0,65 мм) на встряхивателе для пробирок типа «Вортекс». Для этого 570 мг шариков смешивают с 200 мкл суспензии клеток, смесь встряхивают при 0°С в течение 90 сек, к содержимому пробирок добавляют 250 мкл «буфера для разрушения» и встряхивание повторяют еще 60 сек. В пробирки вносят 500 мкл «буфера для разрушения», содержимое пробирок перемешивают, после чего полученные образцы центрифугируют в течение 10 мин при 16000 g. В супернатанте, содержащем водорастворимые белки дрожжевых клеток, с помощью 1М раствора ацетата натрия доводят рН до 4,0 и выпавший материал удаляют центрифугированием в течение 5 мин при 16 тыс.об/мин; супернатант затем прогревают при 65°С 20 минут и выпавшие в осадок балластные белки удаляют центрифугированием; полученный раствор диализуют 40 минут против 10 мМ ацетата натрия, рН 4,0. Осадок водонерастворимых белков суспендируют в 750 мкл «буфера для разрушения», переносят в новые пробирки и центрифугируют в течение 15 мин при 16000 g. Полученный осадок (100 мкл), содержащий целевые белки, суспендируют в 400 мкл буфера «6,5G» (6,5 М раствор гуанидин гидрохлорида или гуанидин тиоцианата в буфере, содержащем 0.1 М фосфата натрия, 0.01 М Tris-HCl, рН 6.5) и целевые белки экстрагируют в течение ночи на магнитной мешалке при температуре +4°С. Зат