Способ повышения эффективности вирусной трансдукции
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Эукариотические клетки трансдуцируют ретровирусом в присутствии гистонного белка бис-мет-гистона И 1.3. Способ позволяет повысить эффективность ретровирусной трансдукции и избежать недостатков аналогов. Изобретение может быть использовано в медицине, ветеринарии, биологии для получения лекарственных препаратов для генной терапии и для генетической модификации клеток in vitro/ex vivo. 6 ил., 4 пр.
Реферат
Изобретение относится к способу увеличения частоты ретровирусной трансдукции эукариотических клеток и может быть использовано в медицине, ветеринарии, биологии для получения лекарственных препаратов для генной терапии.
Известен способ [1] повышения эффективности ретровирусной трансдукции (инфекции, трансфекции генетического материала) с помощью поликатиона - декстрана. Недостатком способа является высокая токсичность и низкая эффективность декстрана. Кроме того, декстран не разрешен для клинического применения.
Известен способ [2] повышения эффективности ретровирусной трансдукции с помощью поликатиона - полибрена. Недостатком способа (Manning, Hackett et a1. 1971) является высокая токсичность и низкая эффективность полибрена. Кроме того, полибрен не разрешен для клинического применения.
Известен способ [3] «Опосредованный вирусом усиленный перенос ДНК». Способ также направлен на повышения эффективности ретровирусной трансдукции. Усиление ретровирусного переноса ДНК достигают инфицированием клеток в присутствии фибронектина или его фрагментов. Недостатком известного способа является высокая себестоимость фибронектина. Кроме того, инфицирование в присутствии фибронектина по указанному способу возможно только in vitro/ex vivo, так как фибронектин является одним из основных компонентов плазмы крови (300 мкг/мл). Таким образом, способ теряет смысл при применении in vivo, при котором фибронектин присутствует в больших количествах в организме в норме.
Наиболее близким изобретением является известный способ [4] повышения эффективности ретровирусной трансдукции с помощью протамин сульфата-специфического антагониста гепарина. Недостатком способа является низкая эффективность повышения ретровирусной трансдукции и возможные побочные эффекты при клиническом применении протамин сульфата. Например, внутривенное введение может вызвать артериальную гипотензию, брадикардию, чувство жара и покраснение кожи. У больных, принимавших протамин-цинк инсулин для лечения сахарного диабета, возможны анафилактические реакции на протамина сульфат. Противопоказанием к применению протамин сульфата является гиперчувствительность, идиопатическая или врожденная гипергепаринемия. Может взаимодействовать с другими лекарственными веществами, например с растворами цефалоспоринов и пенициллином, что может привести к снижению эффективности лекарственной терапии.
Способ позволяет повысить эффективность ретровирусной трансдукции и избежать недостатков аналогов.
Технический результат достигают тем, что эукариотические клетки трансдуцируют ретровирусом в присутствии гистонного белка - бис-мет-гистона Н 1.3 [5]. Под определением РЕТРОВИРУС подразумевают любой вирус семейства Retroviridae. Все представители семейства Retroviridae обладают схожим строением и жизненным циклом. Это семейство РНК-содержащих вирусов, представляющих из себя сферические вирионы сферической формы размером 80-100 нм, покрытые внешней липопротеиновой оболочкой, содержащие оболочечные гликопротеины. После инфицирования клетки ретровирусом в цитоплазме начинается синтез вирусного ДНК-генома с использованием вирионной РНК в качестве матрицы. Все ретровирусы используют для репликации своего генома механизм обратной транскрипции: вирусный фермент обратная транскриптаза (или ревертаза) синтезирует одну нить ДНК на матрице вирусной РНК, а затем уже на матрице синтезированной нити ДНК достраивает вторую, комплементарную ей нить. Образуется двунитевая молекула ДНК, которая, проникнув через ядерную оболочку, интегрируется в хромосомную ДНК клетки и далее служит матрицей для синтеза молекул вирусных РНК. Эти РНК выходят из клеточного ядра и в цитоплазме клетки упаковываются в вирусные частицы, способные инфицировать новые клетки. Наиболее известным представителем семейства Retroviridae является вирус иммунодефицита человека (ВИЧ). В качестве примера метода повышения эффективности вирусной трансдукции, мы используем репликационно дефектный рекомбинантный лентивирус (GFP-RV), сконструированный на основе генома ВИЧ и сохранившего основные свойства ВИЧ дикого типа: способность взаимодействовать с клеточными мембранами посредством поверхностных гликопротеинов, проникать внутрь клетки-хозяина, осуществлять реакцию обратной транскрипции, транспорта в ядро клетки и интеграции в геном клетки-хозяина. Так как подобные стадии жизненного цикла присущи всем представителям семейства Retroviridae, то предложенный метод будет эффективным и для других представителей семейства.
Возможность осуществления изобретения иллюстрируют примеры. Способ производят последовательно, например, в четыре этапа.
Пример 1
Первый этап.
Культивирование клеток.
Все работы с культурой клеток проводят в стерильном ламинарном боксе согласно общепринятым правилам работы в лаборатории 2-го класса био-безопасности.
Эмбриональные клетки почки человека НЕК-293Т (АТСС, CRL-11268) и HeLa (АТСС, CCL-2) культивируют в среде DMEM с добавлением 10% сыворотки крови плодов коровы (англ. Fetal Bovine Semm, FBS) и пенстрепа (фирма-производитель - Sigma, Великобритания). Клетки инкубируют при плюс 37°С, во влажной атмосфере, содержащей 5% СО2. Пересев клеток проводят при плотности клеточного монослоя 90% с применением 0,25% раствора трипсина-ЭДТА (фирма-производитель - БиоЛот, Санкт Петербург).
Таким путем завершают получение клеточных культур НЕК-293Т и HeLa и приступают ко второму этапу.
Второй этап. Получение рекомбинантного лентивируса (GFP-RV).
Рекомбинантный лентивирус получают с помощью котрансфекции культуры клеток плазмидами, кодирующими разные компоненты рекомбинантного вируса. Например плазмидами, полученными из некоммерческой организации AddGene (www.addgene.org): pCMV-VSV-G (плазмида №8454), psPAX2 (плазмида №12260) и pWPT-GFP (плазмида №12255). Клетки НЕК-293Т культивируют в культуральном флаконе Т75 до плотности клеточного монослоя 70%. Трансфекцию проводят, например через 2 часа после смены среды трансфекционной смесью: 112,5 мкг векторной плазмиды pWPT-GFP, 39,5 мкг оболочечной плазмиды pCMV-VSV-G, 75 мкг упаковочной плазмиды psPAX2, 3,3 мл ТЕ 0, 1X (10 мМ Трис + 1 мМ ЭДТА рН 8,0), 1,75 мл дистиллированной воды, 565 мкг 2,5 М раствора CaCl2, 5,7 мл 2х HBS (0,280 М NaCl, 0,1 М Hepes, 0,0015 М Na2HPO4, рН 7,12). Через 17 часов после трансфекции заменяют среду на свежую. Сбор содержащего вирус супернатанта проводят 3 раза, через каждые 12 часов. Супернатанты объединяют и хранят при плюс 4°С. По завершению сбора супернатанты центрифугируют в течение 5 минут, при 1500 об/мин и фильтруют через фильтр 0,22 мкм. Очищенные супернатанты хранят в аликвотах при минус 80°С.
Таким путем завершают получение раствора рекомбинантного лентивируса GFP-RV и приступают к третьему этапу.
Третий этап. Приготовление раствора бис-мет-гистона H 1.3.
Для приготовления препаратов гистона (гистонного белка) делают навеску бис-мет-гистона Н 1.3, растворяют в стерильной воде MilliQ до концентрации 50 мкг/мкл. Рабочий раствор бис-мет-гистона Н 1.3 хранят при плюс 4°С.
Четвертый этап. Трансдукция клеток HeLa рекомбинантным лентивирусом GFP-RV.
Эксперименты проводят, например - в 24-луночных культуральных планшетах. Клетки HeLa культивируют в 24-луночном планшете до плотности клеточного монослоя 50%. Далее клетки инфицируют рекомбинантным лентивирусом GFP-RV, экспрессирующим GFP. Для этого к клеткам HeLa добавляют рекомбинантный лентивирус с протамин сульфатом в количестве 5 мкг на 500 мкл среды (конечная концентрация 10 мкг/мл).
Клетки инкубируют в течение 48 часов при плюс 37°С, во влажной атмосфере, содержащей 5% СO2, после чего определяют степень инфицирования клеток рекомбинантным лентивирусом.
Инфицирование клеток определяют по экспрессии и флуоресценции GFP, например - на проточном цитометре Becton Dickinson FACSCalibur (Becton Dickinson, San Jose, CA, USA) согласно инструкциям производителя.
Пример 2
Отличается от примера 1 тем, что на 4 этапе клетки (вместо протамин сульфата) предобрабатывают бис-мет-гистоном Н 1.3. и затем добавляют рекомбинантный лентивирус.
Пример 3
Отличается от примера 1 тем, что на 4 этапе клетки (вместо протамин сульфата) обрабатывают рекомбинантным лентивирусом и затем бис-мет-гистоном H 1.3.
Пример 4
Отличается от примера 1 тем, что на 4 этапе клетки (вместо протамин сульфата) обрабатывают смесью рекомбинантного лентивируса и бис-мет-гистона H 1.3.
Бис-мет-гистон Н 1.3 (в примерах 2-4) добавляют в лунку в количестве 125 мкг на 500 мкл среды (конечная концентрация 250 мкг/мл).
Концентрация 250 мкг/мл - максимально нетоксичная концентрация гистона для клеток HeLa (на сроках 24, 48 и 72 часа после добавления бис-мет-гистона Н 1.3), то есть была выбрана максимально безопасная (с точки зрения цитотоксичности) концентрация гистона, которая является эффективной в данном случае. В каждом конкретном случае количество бис-мет-гистона Н 1.3 будет зависеть от клеточной культуры, от используемого ретровируса и возможно других факторов.
На Фигурах приведены данные проточной цитофлуориметрии клеток, трансдуцированных рекомбинантным лентивирусом, экспрессирующим зеленый флуоресцентный белок GFP. Культуру клеток или раствор лентивируса обрабатывали рекомбинантным бис-мет-гистоном Н 1.3 в различных вариантах. Эффективность вирусной трансдукции по экспрессии репотерного гена, например - GFP. Ген GFP входит в состав генома рекомбинантного лентивируса и, таким образом, ведет себя как типичный вирусный ген. Для экспрессии лентивирусных генов необходимо, чтобы провирус встроился (интегрировался) в геном клетки хозяина. После встраивания в геном клетки хозяина начинается экспрессия вирусных генов - транскрипция мРНК и трансляция белка. Таким образом, наличие зеленой флуоресценции клеток свидетельствует об успешной вирусной трансдукции.
Фиг.1. Не трансдуцированные клетки (контроль фоновой флуоресценции). В связи с тем, что популяция клеток обладает естественной гетерогенностью по уровню автофлуоресценции, пороговое значение флуоресценции было выбрано таким образом, что 99,5% клеток считались не флуоресцирующими, а 0,5% клеток, соответственно, считались ложно-положительными по флуоресценции.
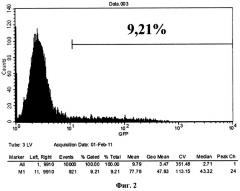
Фиг.2. - Клетки, трансдуцированные рекомбинантным лентивирусом GFP-RV. 9,21% клеток обладали флуоресценцией, что свидетельствует о трансдукции GFP-RV.
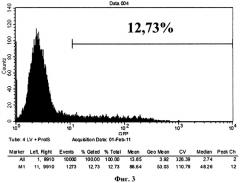
Фиг.3. - Клетки, трансдуцированные рекомбинантным лентивирусом GFP-RV с добавлением протамин сульфата. 12,73% клеток обладали флуоресценцией, что свидетельствует о трансдукции GFP-RV. Таким образом, добавление протамин сульфата повысило эффективность вирусной трансдукции на 38,22% по отношению с GFP-RV без дополнительных добавок.
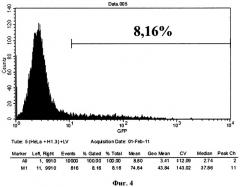
Фиг.4. - Клетки, предобработанные рекомбинантным бис-мет-гистоном Н 1.3 и затем трансдуцированные рекомбинантным лентивирусом GFP-RV. 8,16% клеток обладали флуоресценцией, что свидетельствует о трансдукции GFP-RV. Таким образом, предобработка клеток бис-мет-гистоном Н 1.3 не привела к увеличению эффективности лентивирусной трансдукции.
Фиг.5. - Клетки, трансдуцированные рекомбинантным лентивирусом GFP-RV и затем обработанные рекомбинантным бис-мет-гистоном Н 1.3. 27,19% клеток обладали флуоресценцией, что свидетельствует о трансдукции GFP-RV. Таким образом, обработка бис-мет-гистоном Н 1.3 повысила эффективность вирусной трансдукции на 213,59% по отношению с GFP-RV без дополнительных добавок.
Фиг.6. - Клетки, трансдуцированные смесью рекомбинантного лентивируса GFP-RV и рекомбинантного бис-мет-гистона Н 1.3. 23,75% клеток обладали флуоресценцией, что свидетельствует о трансдукции GFP-RV. Таким образом, смесь GFP-RV с бис-мет-гистоном Н 1.3 повысила эффективность вирусной трансдукции на 186,57% по отношению с GFP-RV без дополнительных добавок.
Приведенные примеры показывают полезность способа для повышения эффективности ретровирусной трансдукции. Способ повышения эффективности вирусной трансдукции может найти применение в клеточной биологии, биотехнологии и генной терапии для создания препаратов, повышающих эффективность ретровирусной трансдукции, что применимо, в частности, для генетической модификации клеток in vitro.
Данное техническое решение также может найти применение для лечения наследственных заболеваний, посредством использования известных стандартных технических устройств и оборудования.
Источники информации
1. Duc-Nguyen, H. (1968). "Enhancing effect of diethylaminoethyl-dextran on the focus-forming titer of a murine sarcoma virus (Harvey strain)." J Virol 2(6): 643-644.
2. Manning, J.S., A.J.Hackett, et al. (1971). "Effect of polycations on sensitivity of BALD-3T3 cells to murine leukemia and sarcoma virus infectivity." Appl Microbiol 22(6): 1162-1163.
3.Патент RU 2174846. Опосредованный вирусом усиленный перенос ДНК.
4. Cornetta, K. and W.F.Anderson (1989). "Protamine sulfate as an effective alternative to polybrene in retroviral-mediated gene-transfer: implications for human gene therapy." J Virol Methods 23(2): 187-194.
5. WO 2008122434, 16.10.2008.
Способ увеличения частоты трансдукции эукариотических клеток с помощью ретровируса, отличающийся тем, что эукариотические клетки инфицируют ретровирусом в присутствии бис-мет-гистона Н 1.3 в эффективном количестве.