Способ оценки течения раневого процесса и эффективности лечения кожных ран различного генеза
Иллюстрации
Показать всеИзобретение относится к области медицины. Предложен способ оценки течения раневого процесса и эффективности лечения кожных ран различного генеза. Берут соскобы с поверхности раны, выделяют ДНК с помощью реагента ДНК-ЭКСПРЕСС с красителем для электрофоретической детекции, полученный супернатант, содержащий ДНК, вносят в лунку длиной 4 мм 2% агарозного геля с бромистым этидием и подвергают горизонтальному электрофорезу в течение 15 минут. На полученных электрофореграммах измеряют длину полученных треков. При длине трека, превышающей длину лунки в 4,7-5,6 раз и более, диагностируют I фазу раневого процесса. При длине трека, превышающей длину лунки в 3,8-4,6 раз, диагностируют II фазу раневого процесса. При длине трека, превышающей длину лунки в 2,6-3,7 раза и менее, диагностируют III фазу раневого процесса. Укорочение длины трека в динамике раневого процесса оценивают как положительное течение заживления раны, лечение считают эффективным, удлинение трека или отсутствие изменений его длины оценивают как отрицательное течение заживления раны, лечение считают неэффективным и изменяют тактику лечения. Изобретение позволяет в короткие сроки определить эффективность лечения кожных ран и правильно определить врачебную тактику, выбрать средства и методы лечения и своевременно скорректировать лечебное воздействие. 5 ил., 2 табл., 5 пр.
Реферат
Изобретение относится к медицине и молекулярной биологии, а именно к молекулярной медицине, и может быть использовано в экспериментальной и клинической хирургии для объективной оценки динамики раневого процесса и эффективности лечения.
Известно, что в структуре хирургических болезней раны составляют около 70%. Раневой процесс - это комплекс закономерных, сменяющих друг друга изменений (некролиз, ангиогенез, образование коллагена и контракция раны, раневая эпителизация и рубцевание). Для оценки раневого процесса в настоящее время используется условное деление его на три стадии (фазы): I - фаза экссудации или фаза воспалительного периода, II - фаза регенерации и пролиферации, III - фаза эпителизации и реорганизации рубца. I фаза характеризуется последовательно переходящими процессами гемостаза, образованием фибринной пленки, закрывающей рану, развитием воспалительного процесса с выходом лейкоцитов из сосудистого русла и фагоцитозом бактерий, ферментативным лизисом мертвых тканей. Появление грануляций, которые, заполняя рану из глубины, обеспечивают ее заживление, открывает II фазу раневого процесса. III фаза начинается, как только растущие грануляции из глубины раны доходят до росткового слоя эпителия и обеспечивают его питание и рост (http://www.ruhirurg.ru. Клиника раневого процесса). При отсутствии отягощающих моментов ориентировочно I фаза имеет продолжительность 1-4 сут., II фаза - 1-14 сут., III фаза - 3-21 суток. Продолжительность фаз подвержена колебаниям в зависимости от различных факторов, как эндо-, так и экзогенных. Для подбора обоснованной тактики и методов воздействия на раны с целью их лечения необходима объективная оценка течения раневого процесса. Она осуществляется в процессе клинического наблюдения за состоянием раны во время перевязок, когда врачом-хирургом оценивается выраженность симптомов воспаления, характер и количество экссудата, наличие и внешний вид грануляций, наличие признаков раневой эпителизации и рубцевания. Недостатком такой диагностики является то, что клинические критерии, используемые для динамической оценки раневого процесса, основаны на визуальной, тактильной и органолептической оценке, и могут трактоваться произвольно, то есть являются субъективными, что обусловливает трудности в лечении ран.
Объективными методами оценки раневого процесса являются измерение размеров и площади раны, бактериологический метод и цитологический метод.
Измерение размеров и площади раны может производиться непосредственным измерением размеров раны с помощью линейки или копированием контуров раны на бумагу через прозрачную пленку (А.Д.Тараско. Раны: Учебно-методическое пособие для врачей-курсантов. - Новокузнецк, 2007. - С.8-10).
Непосредственное измерение размеров раны с помощью линейки - самый старый и наиболее широко используемый метод. Измеряют длину и ширину раны во взаимно перпендикулярных плоскостях. Измерение проводится в динамике раневого процесса. Уменьшение размеров раны чаще всего расценивается как динамика, направленная в сторону заживления раны.
Недостатки:
1) необходимость измерений одним и тем же инструментом;
2) инструмент необходимо подвергать стерилизации, чтобы предотвратить контактное распространение инфекции, из-за чего инструмент быстро выходит из строя;
3) метод позволяет определить только размеры раны, но не дает характеристику раневого процесса.
Копирование контуров раны на бумагу - в настоящее время очень распространенный метод контроля течения раневого процесса, особенно за рубежом. Чаще всего используют метод очерчивания контуров раны через прозрачную пленку. Пленку прикладывают к ране, поверх нее накладывают кальку и очерчивают контуры маркером. Пленку после этого выбрасывают. Лучше применять двухслойную пленку. При этом верхний слой с рисунком остается, а нижний выбрасывается. Размеры раны могут измеряться вручную, с помощью масштабной бумаги путем подсчета квадратов известной площади внутри контура, площадь рассчитывается по специальным формулам. Можно воспользоваться гравиметрическим методом, когда участок бумаги, очерченный контуром, вырезается, взвешивается на аналитических весах и выстраивается пропорция с весом кусочка той же бумаги известной площади. Вместо бумаги можно использовать рентгеновскую пленку. Измерения выполняются в динамике, уменьшение площади раны свидетельствует о тенденции к заживлению раны. Рисунки фиксируются в медицинской документации друг над другом, что позволяет проводить их визуальное сравнение.
Недостатки:
1) комплекс пленка-бумага должны быть стерильны, но медицинская промышленность в РФ такие приспособления не производит, в импровизированных приспособлениях пленка должна подвергаться дезинфекции до измерения и после измерения перед утилизацией;
2) метод не позволяет регистрировать глубину раны;
3) при перерисовывании маркер может оставить слишком жирный контур, из-за чего точность измерения снижается;
4) метод не дает информации о характере раневого процесса.
Бактериологический метод («Раны и раневая инфекция» / Под ред. Академика АМН СССР проф. М.И.Кузина и проф. Б.М.Костючонок.- М.: Москва, 1981. - С.187-193.) включает в себя качественное и количественное изучение раневой микрофлоры в динамике раневого процесса, идентификацию возбудителя инфекции и определение его чувствительности к антибиотикам.
Качественное определение микрофлоры производится следующим образом. Хирург стерильным тампоном производит мазок со стенок раны и помещает этот тампон в питательную среду. Затем материал транспортируется в бактериологическую лабораторию, где производится культивирование микроорганизмов на питательных средах, выращиваются их колонии. Затем производится идентификация микроорганизмов под световым микроскопом. При необходимости определяются биохимические свойства микроорганизмов, их ферментативная активность и определяется их чувствительность к антибиотикам. Весь этот процесс осуществляется в течение 2-4 суток.
В настоящее время считается недостаточным определение качественного микробиологического исследования и рекомендуется проводить количественную оценку микроорганизмов из тканей, образующих стенки раны. Для этого во время операции иссекается участок ткани на всю глубину раны. Полученный материал растирают в ступке со стерильным изотоническим раствором хлорида натрия из расчета 1:10 и далее готовят десятикратные разведения, которые засевают на чашки с питательной средой. После суточной инкубации при температуре 37ºC и суточной - при комнатной температуре проводят количественный учет выросших колоний в различных разведениях и вычисляют среднее количество микробов в пересчете на 1 г ткани.
Недостатки:
1) метод не позволяет оценить направленность раневого процесса, так как на протяжении всего периода лечения с раны могут выделяться патогенные микроорганизмы. При этом количество микроорганизмов в динамике чаще всего уменьшается и микрофлора переходит в латентную фазу;
2) процесс проведения микробиологических исследований трудоемок;
3) результаты микробиологических исследований становятся известны клиницисту только через 2-3 суток.
Наиболее близким к заявляемому способу является способ цитологического исследования отпечатков с раневой поверхности, который позволяет оценить клеточные изменения, закономерно возникающие в течение раневого процесса (Камаев М.Ф. Инфицированная рана и ее лечение. - М., 1970. - 159 с. - С.57-82). Этот метод в настоящее время является неотъемлемой процедурой для объективной диагностики стадии раневого процесса.
В основе метода лежит изготовление мазка, содержащего клетки со стенок раны, посредством приготовления отпечатков со стенки раны на стекло либо изготовления мазка из содержимого соскоба со стенок и дна раны. Мазки высушиваются на воздухе, фиксируются этиловым спиртом и окрашиваются по Романовскому-Гимза. После высыхания мазки подвергаются микроскопии в режимах: окуляр 15 - объектив 8 и окуляр 10 - объектив 90.
М.Ф.Камаев выделяет следующие периоды заживления раны вторичным натяжением: I - ранний период; II - дегенеративно-воспалительный период; III - регенеративный период, в пределах последнего выделяется первая, вторая и третья фазы. Данная классификация позволяет детально описать цитологическую картину ран в течение раневого процесса. В ранний период в цитограмме преобладают клетки нормальной крови и фибрин. В дегенеративно-воспалительный период в цитограмме преобладают полиморфно-ядерные лейкоциты, большей частью дегенеративно измененные, эозинофилы, не детрит, единичные лимфоциты; иногда встречаются тучные клетки, макрофаги, гигантские клетки. В первой фазе регенеративного периода в цитограмме выявляются малоизмененные полиморфноядерные лейкоциты в значительном или умеренном количестве, полибласты (3-5 в поле зрения). Во второй фазе регенеративного периода в цитограмме продолжается дальнейшее снижение числа лейкоцитов, их фрагментация, появляются клетки типа фибробластов и макрофагов. В третьей фазе регенеративного периода полиморфноядерных лейкоцитов мало, клеточные элементы представлены в основном профибробластами, обнаруживаются волокнистые структуры.
Таким образом, исследуя цитограммы в динамике, можно судить о направленности раневого процесса.
Недостатки:
1) необходимость изготовления 3-5 цитограмм из разных участков раны для оценки раневого процесса в случае его неоднородности;
2) необходимость специализации врача-лаборанта для оценки раневого процесса;
3) дополнительная нагрузка на членов хирургической бригады (изготовление отпечатков, их сушка и фиксация).
4) нередко мазки получаются неинформативными из-за невозможности дифференцировать клеточные элементы.
Задача изобретения заключается в создании объективного способа оценки течения раневого процесса и эффективности лечения кожных ран различного генеза, который позволяет сократить сроки диагностики.
Поставленная задача достигается способом, включающим забор биологического материала из раны в течение раневого процесса и его исследование. Берут соскобы с поверхности раны, из которых выделяют ДНК с помощью реагента ДНК-ЭКСПРЕСС с красителем для электрофоретической детекции. Полученный супернатант, содержащий ДНК, вносят в лунку длиной 4 мм 2% агарозного геля с бромистым этидием и подвергают горизонтальному электрофорезу. На полученных электрофореграммах измеряют длину полученных треков, которую соотносят с длиной лунки в качестве стандарта и между собой. При длине трека, превышающей длину лунки в 4,7-5,6 раз и более, диагностируют I фазу раневого процесса. При длине трека, превышающей длину лунки в 3,8-4,6 раз, диагностируют II фазу раневого процесса. При длине трека, превышающей длину лунки в 2,6-3,7 раза и менее, диагностируют III фазу раневого процесса. Укорочение длины трека в динамике раневого процесса оценивают как положительное течение заживления раны, лечение считают эффективным. Удлинение трека или отсутствие изменений его длины в динамике раневого процесса оценивают как отрицательное течение заживления раны, лечение считают неэффективным и изменяют тактику лечения.
Новизна изобретения.
- Берут соскобы с поверхности раны, из которых выделяют ДНК с помощью реагента ДНК-ЭКСПРЕСС с красителем для электрофоретической детекции.
- Полученный супернатант, содержащий ДНК, вносят в лунку длиной 4 мм 2% агарозного геля с бромистым этидием и подвергают горизонтальному электрофорезу.
- На полученных электрофореграммах измеряют длину полученных треков, которую соотносят с длиной лунки и между собой. При длине трека, превышающей длину лунки в 4,7-5,6 раз и более, диагностируют I фазу раневого процесса. При длине трека, превышающей длину лунки в 3,8-4,6 раз, диагностируют II фазу раневого процесса. При длине трека, превышающей длину лунки в 2,6-3,7 раза и менее, диагностируют III фазу раневого процесса.
- Укорочение длины трека в динамике раневого процесса оценивают как положительное течение заживления раны, лечение считают эффективным. Удлинение трека или отсутствие изменений его длины в динамике раневого процесса оценивают как отрицательное течение заживления раны, лечение считают неэффективным и изменяют тактику лечения.
В патентной и научной литературе отсутствуют сведения об аналогичном способе, обладающем такой же совокупностью признаков.
Совокупность существенных признаков изобретения позволяет получить новый технический результат, заключающийся в быстрой и объективной оценке течения раневого процесса, на основании которого выбираются средства и методы лечения, своевременно производится корректировка лечебного воздействия, что улучшает качество лечения и сокращает его сроки, особенно в случае длительно незаживающих ран.
Известно, что в основе регенерации ран лежит баланс между конкурирующими процессами - пролиферации, дифференцировки и гибели клеток. Недавние исследования продемонстрировали, что апоптотическая гибель играет основную роль при заживлении кожных ран, регулируя как воспалительную фазу заживления ран, так и регенеративные процессы. Апоптоз и некроз клеток могут быть выявлены по картине повреждения ДНК. При апоптозе ДНК расщепляется в местах, связывающих отдельные нуклеосомы, что приводит к возникновению большого количества фрагментов, длина которых кратна 200 п.н. Эти фрагменты ДНК выявляются в виде "лесенки" при электрофорезе ДНК, при некрозе же длина фрагментов деградированной ДНК варьирует, и электрофореграммы ДНК имеют "размазанный" характер ее миграции. Электрофоретический метод выявления деградации ДНК погибших клеток описан (Н.Н.Мушкамбаров, С.Л.Кузнецов Молекулярная биология. Учебное пособие для студентов медицинских вузов. - М: ООО «Медицинское информационное агентство», 2003. - 544 с. - С.460-461.). Метод не использовался для ДНК, выделяемой с кожных ран, для оценки течения раневого процесса и для оценки эффективности лечения.
Способ осуществляется следующим образом.
Забирается материал из раны путем соскоба при первичном обращении, а затем через 3-5 суток, когда под влиянием лечения должны произойти положительные изменения в ране, а также при смене метода лечения, например при долго незаживающих и хронических ранах. Соскоб проводят после туалета раны по ее дну крестообразно с последующим окаймляющим движением по стенкам или периферии урогенитальным зондом или ложкой Фолькмана. Взятый материал помещают в пластиковую одноразовую пробирку с крышкой и замком и проводят выделение ДНК из собранного материала с помощью ДНК-ЭКСПРЕСС (производство НПФ «Литех», Москва), реагента для выделения ДНК из биопроб с красителем. Этот реагент наливают в пробирки предварительно в количестве 300 мкл согласно инструкции использования (www.lytech.ru). Пробирки с биоматериалом либо сразу используют для дальнейшего исследования, либо замораживают при -20ºC до использования. Для исследования содержимое пробирок размораживают, пробирку встряхивают на вортексе в течение 10-15 сек и помещают в твердотельный термостат на 20-30 минут при 98-99ºC для выделения ДНК. Затем пробирку центрифугируют при 12000 об/мин в течение 30 секунд, забирают около 25-30 мкл супернатанта с выделенной ДНК и заливают в лунку размером 4 мм × 1 мм 2% агарозного геля на 20 мл ТАЕ-буфера с предварительно добавленными в гель 10 мкл 1% бромистого этидия. Результат регистрируют после горизонтального электрофореза ДНК, контролируя его длительность визуально по движению полосы красителя, которая должна пройти от лунки 1,5 см в течение 15 минут. После электрофореза гель помещают на стекло УФ-трансиллюминатора и анализируют результат в проходящем ультрафиолетовом свете с длиной волны 310 нм. На электрофореграммах выявляют свечение ДНК в виде отходящих от лунок треков разной длины, которые сопоставляют между собой. Длину треков и их укорочение, удлинение или отсутствие изменений длины оценивают визуально или электрофореграммы фотографируют и снимки переносят в персональный компьютер, где длину треков измеряют, соотносят с длиной лунки в качестве стандартной длины, и треки сравнивают между собой. При длине трека, превышающей длину лунки в 4,7-5,6 раз и более, диагностируют I фазу раневого процесса, при длине трека, превышающей длину лунки в 3,8-4,6 раз, диагностируют II фазу раневого процесса, при длине трека, превышающей длину лунки в 2,6-3,7 раза и менее, диагностируют III фазу раневого процесса. Укорочение трека ДНК в динамике исследования говорит о положительном течении раневого процесса и об эффективности проводимого лечения. Удлинение трека или отсутствие изменений его длины свидетельствуют о неэффективности проводимого лечения, о затяжном характере раневого процесса, что говорит в пользу изменения лечебной тактики. Проведение исследования занимает около 1 часа.
Было обследовано 49 пациентов в возрасте от 18 до 74 лет обоего пола, обратившихся в Центр амбулаторной хирургии МЛПУ ГКБ №2 г.Новокузнецка по поводу первичных и вторичных гнойных ран - фурункулов, карбункулов, абсцессов, флегмон, инфицированных ран, трофических язв, пролежней. Метод отработан на 133 соскобах из вышеперечисленных типов ран. Для статистического анализа (результаты представлены в таблице 1) использованы параметры электрофореграмм ДНК, выделенных из 23 соскобов из ран, находящихся в I фазе раневого процесса (наличие гнойного экссудата, влажного некроза и фибринозных наложений), 28 соскобов во II фазе раневого процесса (отсутствие гноения, гранулирование раны); 19 соскобов в III фазе раневого процесса (полное очищение раны, ее контракция, выраженная краевая эпителизация и признаки формирования рубца). Для оценки течения раневого процесса использовался количественный показатель - длина трека относительно длины лунки (Д). Изменение Д между фазами раневого процесса (∆Д) оценивали по результатам, полученным в динамическом наблюдении раневого процесса у нескольких пациентов (результаты представлены в таблице 2).
Стандартная статистическая обработка включала подсчет средних арифметических величин (М), стандартной ошибки среднего (SEM, standard error of mean) и 95%-ного доверительного интервала значений (95% CI, 95% confidence interval). Значимость различий полученных количественных показателей оценивали с помощью непараметрического критерия Манна-Уитни. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимался равным 0,05.
Результаты измерения длины треков ДНК в различные фазы раневого процесса представлены в таблице 1.
| Таблица 1 | ||
| Отношение длины трека к длине лунки (Д) в различные фазы раневого процесса | ||
| Фазы раневого процесса | Показатели | Значения |
| I фаза | M±SEM | 5,2±0,2 |
| n | 23 | |
| 95% CI | 4,7-5,6 | |
| II фаза | M±SEM | 4,2±0,2 |
| n | 28 | |
| 95% CI | 3,8-4,6 | |
| PI | 0,0011 | |
| III фаза | M±SEM | 3,0±0,2 |
| n | 19 | |
| 95% CI | 2,6-3,7 | |
| PI | < 0,0001 | |
| PII | < 0,001 | |
| Примечание: | ||
| n - количество образцов ДНК; | ||
| Р - критерий достоверности различий Манна-Уитни; | ||
| цифра рядом с Р - номер сравниваемой фазы |
Результаты показывают, что длина трека ДНК превосходит длину лунки в I фазе раневого процесса, в среднем, в 5 раз, при этом 95% значений укладываются в интервал 4,7-5,6. Во II фазе длина трека ДНК больше длины лунки в среднем в 4 раза, при этом 95% полученных значений были в интервале 3,8-4,6. В III фазе длина треков была минимальна, т.к. в среднем превышала длину лунки только в 3 раза, а 95% полученных значений были в интервале 2,6-3,7.
В таблице 2 показаны результаты сравнения изменения длины треков между фазами раневого процесса. Они показывают, что наибольшее укорочение длины треков образцов ДНК наблюдалось в III фазе по сравнению с I (примерно на 50%) и со II фазой (около 40%). Во II фазе по сравнению с I фазой укорочение составило в среднем около 20%.
| Таблица 2 | |||
| Изменение длины трека ДНК (ДД) между фазами при положительной динамике раневого процесса (в %) | |||
| № п/п | Сравниваемые фазы | Показатели | Значения (в %) |
| 1 | I фаза - II фаза | M±SEM | 19±4 |
| n | 11 | ||
| 95% CI | 12-27 | ||
| 2 | II фаза - III фаза | M±SEM | 36±3 |
| n | 18 | ||
| 95% CI | 29-44 | ||
| P1 | 0,0024 | ||
| 3 | III фаза - I фаза | M±SEM | 49±5 |
| n | 8 | ||
| 95% CI | 37-61 | ||
| P1 | 0,0003 | ||
| P2 | 0,0303 | ||
| Примечание: | |||
| ∆Д=(Дn1-Дn2)/Д1×100%; | |||
| n - количество образцов ДНК; | |||
| Р - критерий достоверности различий Манна-Уитни; | |||
| цифра рядом с Р - номер сравниваемой строки |
Следовательно, по мере последовательного прохождения фаз раневого процесса, т.е. при его положительной динамике и эффективном лечении треки образцов ДНК, выделенных из ран, на электрофореграммах укорачиваются.
Таким образом, положительная динамика раневого процесса сопровождается количественными изменениями фракции ДНК, выделенной с поверхности ран. Эти изменения отражаются на электрофореграммах образцов ДНК в укорочении соответствующих треков, на 10% и более процентов, что может свидетельствовать об уменьшении количества низкомолекулярных фрагментов ДНК в образцах ДНК, т.е. о снижении степени разрушения клеток и ДНК, что сопряжено с уменьшением воспалительных и усилением регенеративных процессов, максимальных в III фазе раневого процесса.
Изобретение иллюстрируется фотографиями фиг.1-фиг.5, на которых представлены результаты эффективного и неэффективного лечения ран различного генеза и локализации.
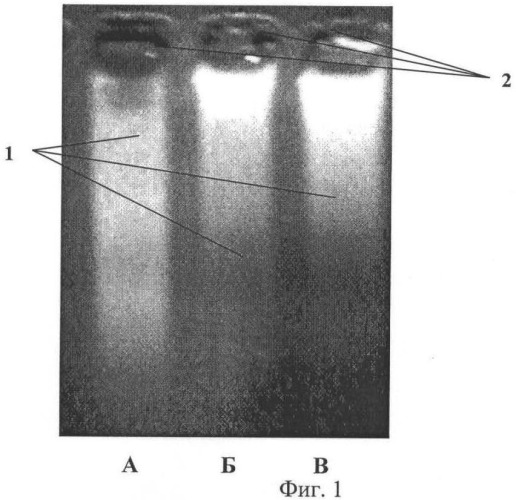
На фиг.1 представлена фотография электрофореграммы образцов ДНК, выделенных из соскоба диабетической язвы пятки.
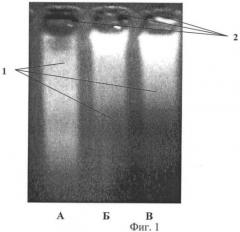
На фиг.2 представлены фотографии электрофореграмм образцов ДНК, выделенных из соскоба укушенной раны предплечья, осложненной рожистым воспалением.
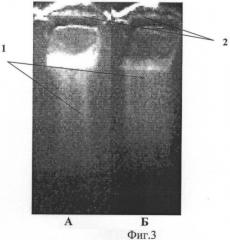
На фиг.3 представлены фотографии электрофореграмм образцов ДНК, выделенных из соскоба трофической язвы.
На фиг.4 представлены фотографии электрофореграмм образцов ДНК, выделенных из соскоба диабетической некрофлегмоны.
На фиг.5 представлены фотографии электрофореграмм образцов ДНК, выделенных из соскоба с диабетической язвы подошвы.
Треки образцов ДНК - 1, лунки для внесения образцов ДНК - 2.
Пример 1. Больная Б., 1952 г.р. Обратилась в хирургический кабинет 17.09.09 после лечения в хирургическом стационаре горбольницы №22 (г.Новокузнецк) по поводу наличия трофической язвы в области пятки левой стопы (после вскрытия некрофлегмоны). Продолжительность существования язвы на пятке 2 месяца. При обращении на левой пятке дефект кожи 2×1 см, края раны слегка подрыты. Стенки и дно раны выполнены водянистыми синюшными грануляциями, некротических тканей нет, признаков эпителизации и рубцевания нет. Такая картина позволила сделать заключение, что имеется II фаза раневого процесса. При первичном обращении у больной выполнен соскоб из раны для выявления ДНК (Фиг.1, А). Определен ярко светящийся трек, длина которого превышает длину лунки в 4,6 раза. Назначено лечение: перевязки с мазями, содержащими стимуляторы регенерации: метилурацил, солкосерил. Больная направлена в физиоотделение для проведения курса низкоэнергетической лазерной терапии. При повторном осмотре после окончания лазеротерапии 29.09.09 выявлено, что грануляции стали плотнее, красного цвета, рана несколько сократилась и имеет размеры 1,5×0,8 см. Данная картина раны позволила сделать заключение, что продолжается II фаза раневого процесса. Произведен соскоб со стенок раны для выявления ДНК (Фиг.1, Б). Выявлено укорочение трека на 5% по сравнению с предыдущим исследованием, длина трека превышает длину лунки в 4,38 раз. С целью стимуляции процесса регенерации больной выполнена поясничная блокада слева 0,25% раствором новокаина в количестве 100 мл, в дальнейшем продолжались редкие перевязки с применением мазей со стимуляторами регенерации. При осмотре 02.11.09 язва имеет щелевидную форму, 1×0,2 см, то есть имеются выраженные явления раневой контракции, грануляции яркие, имеются признаки краевой эпителизации. Данная картина расценена как III фаза раневого процесса. Произведен соскоб из раны на ДНК (Фиг.1, В). Выявлено укорочение трека на 38% по сравнению с предыдущим исследованием, трек превышает длину лунки в 2,7 раза. 10.11.09 язва полностью зажила, больная выписана под наблюдение эндокринолога.
Пример 2. Больной П., 1966 г.р. Обратился в хирургический кабинет 02.09.10. по поводу укушенной раны левого предплечья через 4 дня после травмы. Клинически выявлены выраженные признаки воспаления: гиперемия кожи вокруг раны, отек, рана на левом предплечье неправильной формы 1,5×0,5 см, выделение гнойного экссудата, лихорадка с повышением температуры тела до 39ºC. Данная клиническая картина позволяет говорить о наличии I фазы раневого процесса. Взят соскоб для выявления ДНК (Фиг.2, А). На электрофореграмме ДНК ярко светящийся трек, длина которого превышает длину лунки в 5,3 раза. Произведена хирургическая обработка раны: рассечение, некрэктомия, вскрытие затеков, дренирование. Назначена антибиотикотерапия. Проводились ежедневные перевязки. Рана очистилась, температура тела нормализовалась. Рана постепенно стала заполняться грануляциями, появились признаки контракции, что клинически расценено как II фаза раневого процесса. 10.09.10, через 8 дней после начала лечения, произведен электрофорез выделенной из раны ДНК (Фиг.2, Б). Длина трека в 3,1 раз превышает длину лунки, что соответствует III фазе. Укорочение трека ДНК в III фазе по сравнению с I фазой составило 42%. Данные изменения позволяют сделать заключение, что лечение больного адекватное.
Пример 3. Больной М., 1936 г.р. обратился в хирургический кабинет с жалобами на наличие трофической язвы на левой голени в течение 4-х лет. Страдает варикозным расширением вен. На левой голени в нижней трети на внутренней поверхности язва неправильной формы. Кожные покровы вокруг язвы гиперпигментированы, имеется индурация подкожной клетчатки, признаки экзематизации. На поверхности язвы некротический налет, язва резко болезненна. Д-з: Варикозное расширение вен левой голени, стадия декомпенсации с осложнениями: трофическая язва, дерматоцеллюлит, микробная экзема. Взят соскоб для электрофореза ДНК (Фиг.3, А). Трек ДНК превышал длину лунки в 4,3 раза, что соответствует II фазе раневого процесса.
Больному назначена флеботропная терапия, эластическая компрессия, учитывая нетолерантность его к оперативному лечению из-за сопутствующих заболеваний: гипертоническая болезнь 3 ст, ожирение 3 ст., двусторонний коксартроз II-III ст. Для стимуляции процесса очищения язвы и подавления воспалительного процесса выполнена поясничная блокада 0,25% раствором новокаина 100,0 мл слева. После контрольного взятия материала с язвы через 1 час после блокады (Фиг.2, Б) длина трека ДНК в 3,7 раза превышала длину лунки. Укорочение трека ДНК после блокады составило 15%. Это свидетельствует об эффективности лечебного воздействия на рану поясничной блокады уже через 1 час после ее проведения, хотя клинических проявлений улучшения еще не отмечалось. Клинические проявления эффективности действия блокады проявились через три дня, когда произошел лизис некроза, поверхность язвы покрылась яркими сочными грануляциями. Такое яркое проявление действия лечебного фактора позволило применить его курсом.
Пример 4. Больной П., 1947 г.р. обратился в хирургический кабинет 02.04.11. после выписки из хирургического отделения, где он лечился в течение 1 месяца по поводу диабетической некрофлегмоны правой пятки. Выписан при наличии клинических проявлений I фазы раневого процесса - проникающая язва на правой пятке овальной формы 2×1 см, отек, наличие некротических масс и гнойного отделяемого из раны. У больного взят материал для электрофореза ДНК (Фиг.4, А). Трек плохо окрашен, превышает длину лунки в 4,7 раза. Больному выполнена поясничная новокаиновая блокада 0,25% раствором новокаина 100,0 мл справа. Через 1 час материал для электрофореза ДНК взят повторно (Фиг.4, Б). На электрофореграмме обращает внимание более яркое свечение трека, что говорит о провокации воспаления проведенной блокадой, т.е. о сдвиге раневого процесса в положительную сторону, при этом длина трека ДНК относительно длины лунки составила 4,4. Положительная динамика позволила применить поясничную новокаиновую блокаду в виде курса. Через 5 дней, в течение которых выполнялись также ежедневные перевязки с гиперосмолярными растворами (10% раствор NaCl), больному в рамках динамического контроля выполнено очередное исследование электрофореза ДНК (Фиг.4, В). Клинически при этом отмечалось очищение раны от некротических масс и выполнение раны грануляциями. На электрофореграмме выявилось яркое свечение трека, длина трека сократилась, превысив длину лунки в 4 раза. Больному повторно выполнена поясничная блокада справа в прежней дозировке и через 1 час произведено контрольное взятие материала на ДНК (Фиг.4, Г). Длина трека сократилась, и отношение его длины к длине лунки составило 3. В дальнейшем проводились, наряду с блокадами, перевязки с использованием мазей на гидрофильной основе (левомеколь, левосин), гигиенические ванны. Рана стала поверхностной и заметно меньше. 19.04.11 выполнено контрольное исследование ДНК из раны (Фиг.4, Д). Свечение трека стало менее ярким, его длина сократилась до 2,5 относительно лунки, что было сопряжено с III фазой раневого процесса.
Пример 5. Больной С., 1969 г.р., обратился в хирургический кабинет 14.10.10 с жалобами на наличие дефекта кожи на подошве левой стопы. Страдает сахарным диабетом I типа. Дефект кожи существует 2 месяца и не заживает. Объективно: на подошве левой стопы дефект кожи до 1,5 см, овальной формы с ровными краями. Дно раны выполнено грануляционной тканью. Признаков рубцевания и эпителизации нет. Д-з: Проникающая диабетическая язва подошвы левой стопы. Учитывая резистентность процессов данного рода к лечению, решено изучить динамику электрофореграмм ДНК. На Фиг.5, А представлена электрофореграмма ДНК в день обращения до применения лечебных мероприятий. Отношение длины трека к длине лунки составило 3,9. Больному выполнена поясничная новокаиновая блокада 0,25% раствором новокаина 100,0 мл справа с последующим забором материала на ДНК через 1 сутки. Трек ДНК не изменился через сутки после ее проведения (Фиг.5, Б). Через двое суток после блокады трек ДНК остался таким же по длине (Фиг.5, В).
Таким образом, установлено отсутствие изменения длины трека, что позволило сделать предположение о неэффективности блокады для данного пациента. Далее больному проводились перевязки с гиперосмолярными растворами, с субстанциями, содержащими стимуляторы регенерации, физиолечение с применением низкоэнергетического лазерного излучения (ежедневно, 10 раз). Контрольное исследование ДНК 29.10.10 (Фиг.5, Г) показало, что трек ДНК остался прежним по длине. Клинических признаков заживления раны у больного не было. Таким образом, отсутствие динамики в изменении длины треков ДНК находится в корреляции с клиническими проявлениями и позволяет прогнозировать хроническое течение раневого процесса и отсутствие положительных сдвигов при использовании различных средств местного воздействия.
Таким образом, предложенный способ позволяет в максимально короткие сроки определить эффективность проводимых лечебных мероприятий и правильно определить врачебную тактику, выбрать средства и методы лечения, своевременно корректировать лечебное воздействие.
Способ оценки течения раневого процесса и эффективности лечения кожных ран различного генеза, включающий забор биологического материала из раны в течение раневого процесса и его исследование, отличающийся тем, что берут соскобы с поверхности раны, из которых выделяют ДНК с помощью реагента ДНК-ЭКСПРЕСС с красителем для электрофоретической детекции, полученный супернатант, содержащий ДНК, вносят в лунку длиной 4 мм 2% агарозного геля с бромистым этидием и подвергают горизонтальному электрофорезу в течение 15 мин, на полученных электрофореграммах измеряют длину полученных треков, которую соотносят с длиной лунки и между собой и при длине трека, превышающей длину лунки в 4,7-5,6 раз и более, диагностируют I фазу раневого процесса, при длине трека, превышающей длину лунки в 3,8-4,6 раз, диагностируют II фазу раневого процесса, при длине трека, превышающей длину лунки в 2,6-3,7 раза и менее, диагностируют III фазу раневого процесса; укорочение длины трека в динамике раневого процесса оценивают как положительное течение заживления раны, лечение считают эффективным, удлинение трека или отсутствие изменений его длины в динамике раневого процесса оценивают как отрицательное течение заживления раны, лечение считают неэффективным и изменяют тактику лечения.