Электрохимический способ получения азотных удобрений
Иллюстрации
Показать всеИзобретение относится к электрохимическому способу и установке для синтеза азотных удобрений. Способ получения азотных удобрений, выбранных из группы, состоящей из: нитрата аммония, мочевины, смеси мочевины и нитрата аммония, аммиака и их комбинаций, причем способ включает подготовку по меньшей мере одного реактора, включающего по меньшей мере одну реакционную камеру и по меньшей мере один анод и по меньшей мере один катод; размещение по меньшей мере одного электролита между каждым по меньшей мере одним анодом и каждым по меньшей мере одним катодом; подведение в реактор газообразных или жидких реагентов, выбранных из группы, состоящей из: источников азота, источников углерода, источников водорода, и их комбинаций; и подачу электрической энергии для проведения анодной и катодной реакций. Изобретение позволяет упростить сложный способ, условия эксплуатации, сократить объем и габариты системы, а также снизить себестоимость производства азотных удобрений. 23 з.п. ф-лы, 12 ил., 4 пр.
Реферат
Настоящее изобретение было выполнено при поддержке Правительства США в рамках Контракта № DE-FC36-03GO13055, предоставленного Министерством Энергетики США, и Контрактов № 2003-38819-02014, 2004-38819-02182, 2005-38819-02311 и 2006-38819-03470, предоставленных Министерством сельского хозяйства США. Правительство обладает определенными правами на настоящее изобретение.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Настоящее изобретение относится к электрохимическому способу и установке для синтеза азотных удобрений, включающих нитрат аммония, мочевину, аммиак и смесь мочевины и нитрата аммония. В частности, изобретение относится к установке и способу, в которых (1) используют источник азота для получения нитрата аммония; (2) источник азота и источник углерода взаимодействуют с использованием жидкого электролита при низкой температуре или твердого электролита при высокой температуре с образованием мочевины; (3) источник азота и источник эквивалента водорода взаимодействуют с образованием аммиака; и (4) источник азота и источник углерода взаимодействуют с получением смеси мочевины и нитрата аммония.
Уровень техники
Нитрат аммония (AN, 34% N), мочевина (46% N), аммиак (82% N) и смесь мочевины и нитрата аммония (UAN, 28~32% N) представляют собой широко используемые удобрения с высоким содержанием азота. Способы промышленного производства этих удобрений главным образом основываются на процессе Габера, который включает гетерогенную реакцию азота и водорода в присутствии катализатора на основе железа при высоком давлении (например, 200-300 бар (20-30 МПа)) и высокой температуре (например, 430-480ºС) для получения аммиака следующим путем:
| N2 (газ) + 3Н2 (газ) 2NH3 (газ) | (Реакция 1) |
Преобразование в аммиак, показанное в реакции 1, ограничено термодинамическими параметрами. По мере протекания реакции объем газа сокращается. Поэтому для смещения положения равновесия реакции 1 вправо, т.е. в направлении образования газообразного аммиака, нужно применять очень высокое давление. Проведение синтеза аммиака при очень высоком давлении необходимо также для предотвращения разложения синтезированного аммиака на азот и водород и для обеспечения практически приемлемых скоростей реакции. В дополнение, реакция 1 является экзотермической, и образование аммиака стимулируется понижением температуры. Однако снижение температуры нежелательно сокращает скорость реакции. Поэтому выбирают промежуточный уровень температуры так, чтобы реакция протекала с приемлемой скоростью, но температура не была высокой настолько, чтобы стимулировать обратную реакцию. Равновесная конверсия газообразного водорода и газообразного азота в аммиак в основном достигает порядка всего 10~15%. Низкие степени конверсии вынуждают применять дорогостоящие крупногабаритные химические установки и дорогостоящие условия эксплуатации, необходимые для промышленного производства от сотен до тысяч тонн аммиака в день на предприятии для синтеза аммиака.
Нитрат аммония (AN) получают кислотно-основной реакцией аммиака с азотной кислотой согласно уравнению:
| NH3 + HNO3 → NH4NO3 | (Реакция 2) |
В промышленности азотную кислоту получают высокотемпературным каталитическим окислением аммиака. Этот процесс типично состоит из трех стадий: во-первых, аммиак взаимодействует с воздухом на катализаторе из платино-иридиевого (PtIr) сплава при температуре около 750~800ºС с образованием монооксида азота согласно следующей реакции:
| 4NH3 + 5O2 → 4NO + 6H2O | (Реакция 3) |
Затем монооксид азота окисляется до диоксида азота и жидкого димера следующим образом:
| 2NO + O2 → 2NO2 N2O4 | (Реакция 4) |
И, наконец, смесь диоксида азота/димера вводят в абсорбционный процесс с использованием воды в соответствии со следующей реакцией:
| 3NO2 + H2O → 2HNO3 + NO | (Реакция 5) |
На первой стадии окисление аммиака до монооксида азота протекает в экзотермической реакции с выходом в диапазоне от 93% до 98%. Температуры реакции могут варьировать от 750ºС до 900ºС. Более высокие температуры увеличивают селективность реакции в отношении образования NO. Реакции 3 благоприятствуют низкие давления. На второй стадии реакция 4 является медленной и в высокой степени зависит от температуры и давления. Проведение процесса при низких температурах и высоких давлениях способствует максимальному формированию NO2 в пределах минимальной продолжительности реакции. На конечной стадии реакция 5 является экзотермической и поэтому внутри поглотительного аппарата требуется непрерывное охлаждение. Поскольку конверсии NO в NO2 благоприятствует низкая температура, эта реакция будет протекать по существу до тех пор, пока газы не покинут поглотительную колонну.
Промышленное производство мочевины основывается на взаимодействии диоксида углерода с аммиаком при высоком давлении (например, 140 бар (14 МПа)) и высокой температуре (например, 180~185ºС) с образованием карбамата аммония (реакция 6), который затем дегидратируют до мочевины и воды (реакция 7):
| 2NH3 + CO2 → NH2COONH4 | (Реакция 6) |
| NH2COONH4 → NH2CONH2 + H2O | (Реакция 7) |
Реакция 6 является быстрой и высокоэкзотермичной и протекает по существу до конца при нормальных условиях реакции, тогда как реакция 7 медленная и эндотермическая и обычно не достигает термодинамического равновесия при условиях обработки. Степень конверсии, которую достигает реакция 7, зависит, помимо прочих факторов, от температуры и используемого количества избыточного аммиака. Степень конверсии СО2 в мочевину могут увеличивать повышение температуры и соотношения NH3:CO2.
Различные технологии получения мочевины главным образом различаются в том, как отделяют мочевину от реагентов и как вовлекают в рециркуляцию аммиак и диоксид углерода. Усовершенствования в технологии производства обычно сосредоточиваются на увеличении степени конверсии СО2, оптимизации рекуперации тепла, снижении потребления расходных материалов и извлечении остаточного NH3 и мочевины из производственных стоков установки.
Нитрат аммония и мочевину применяют в качестве сырьевых материалов в производстве жидких удобрений на основе смеси мочевины и нитрата аммония (UAN). Большинство растворов UAN типично содержат 28%, 30% или 32% N, но производят продукты и с другими концентрациями, изготовленные по техническим условиям заказчика (в том числе с дополнительными питательными веществами). Добавление ингибиторов коррозии или применение коррозионно-устойчивых покрытий позволяет применять углеродистую сталь для оборудования, предназначенного для хранения и транспортировки.
Используют процессы непрерывного и периодического типа, и в обоих процессах концентрированные растворы мочевины и нитрата аммония дозируют, смешивают и затем охлаждают. В непрерывном процессе ингредиенты раствора UAN непрерывно подают и смешивают в серии статических смесителей с надлежащими размерами. Непрерывно измеряют и регулируют поток сырьевого материала, а также поток конечного продукта, величину рН и плотность. Конечный продукт охлаждают и направляют в резервуар-хранилище для продажи. В периодическом процессе сырьевой материал последовательно подают в смесительный резервуар, оборудованный мешалкой и смонтированный на датчиках нагрузки. Растворение твердого(ых) сырьевого(ых) материала(ов) может быть интенсифицировано рециркуляцией и теплообменом, как требуется. Значение рН UAN как продукта корректируют перед добавлением ингибитора коррозии.
Как описано выше, получение удобрений с высоким содержанием азота включает многостадийные реакции и весьма ограничено процессом Габера. Равновесная конверсия газообразного водорода и газообразного азота в аммиак в процессе Габера в общем достигает порядка всего 10~15%. Такие низкие степени конверсии вынуждают применять дорогостоящие крупногабаритные химические установки и дорогостоящие условия эксплуатации, необходимые для промышленного производства от сотен до тысяч тонн аммиака в день на предприятии для синтеза аммиака. Поэтому производственный интерес представляет разработка упрощенных подходов к получению удобрений с высоким содержанием азота, в особенности в масштабах от малых до средних. Одностадийный способ, который может преобразовывать источники углерода, источники азота и/или источники водорода в удобрение с высоким содержанием азота при пониженных давлении и/или температуре, потенциально в состоянии соответствовать таким требованиям мало- и среднемасштабного производства удобрений с высоким содержанием азота.
Лишь недавно была исследована осуществимость использования электрохимических процессов для синтеза мочевины. Наиболее очевидные преимущества электрохимических процессов над вышеупомянутыми традиционными способами включают (1) упрощение сложного способа ввиду возможности одностадийного процесса, (2) упрощение условий эксплуатации, поскольку электрохимическая реакция могла бы быть проведена даже при комнатной температуре и атмосферном давлении, и (3) сокращение объема и габаритов системы. Однако для промышленной реализации опубликованного электрохимического способа получения мочевины существует ряд проблем. Одна из таких проблем состоит в высокой стоимости источника азота, так как типично используют нитрит и нитрат. Еще одна из таких проблем заключается в высокой стоимости источника водорода, поскольку требуется большее количество газообразного водорода вследствие применения вышеупомянутых нитрита и нитрата по сравнению с использованием источника азота с меньшей степенью окисления, такого как газообразный азот или монооксид азота. Промышленному применению способа препятствует также тот факт, что коэффициент использования тока при формировании мочевин был низким, и процесс не был оптимизирован. Способ включает восстановление диоксида углерода и азотсодержащих соединений. Две реакции, соответствующие (1) электрохимическому восстановлению СО2 и (2) электрохимическому восстановлению азотсодержащих соединений, различаются термодинамически и кинетически. Для стимулирования образования мочевины скорости этих двух реакций должны быть отрегулированы с высокой точностью, и это требует разработки электрокатализаторов, подбора электролитов, регулирования состава реагентов и скоростей подачи реагентов и электролитов, выбора режима регулирования величин тока и напряжения и выполнения температурного контроля. В дополнение, для улучшения производительности процесса и сокращения сложности условий эксплуатации должны быть оптимизированы конструкции электродов и электрохимических ячеек. Наконец, для промышленного производства должны быть разработаны батареи, включающие несколько блоков электрохимических ячеек, и необходимо разработать контрольные системы для этих батарей.
Недавно большое внимание привлекло удаление СО2 и оксидов азота из окружающей среды, так как предполагается, что эти соединения сопряжены с серьезными проблемами, включающими «парниковый эффект» и кислотные дожди.
Настоящее изобретение включает электрохимические процессы для получения азотных удобрений, в том числе нитрата аммония, мочевины, аммиака и смеси мочевины и нитрата аммония, с использованием экономически выгодных источников углерода и водорода или эквивалента водорода, такого как монооксид углерода. Один вариант осуществления настоящего изобретения представляет низкотемпературный электрохимический процесс при низком давлении для получения азотного удобрения без необходимости введения водорода. Еще один вариант осуществления представляет электрохимический способ получения мочевины с использованием экономически эффективных источника азота, источников углерода и скорее недорогого эквивалента водорода, нежели высокочистого водорода, который необходим для процесса Габера и других способов. Еще один вариант осуществления состоит в электрохимическом способе получения аммиака с использованием экономически выгодного источника азота и недорогого эквивалента водорода. Еще один вариант осуществления представляет электрохимический способ получения смеси мочевины и нитрата аммония с использованием экономически эффективных источников азота и углерода. В еще одном варианте осуществления для получения азотных удобрений в электрохимическом процессе используют парниковые газы. Настоящее изобретение также охватывает электрохимические реакторы и компоненты реакторов, разработанные специально для вышеописанных вариантов осуществления.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение охватывает способы и установки для получения азотных удобрений при низких температуре и/или давлении, предпочтительно при температуре и давлении окружающей среды, с использованием источника азота, источника углерода и источника водорода или эквивалента водорода и электрической энергии. При применении электролита, служащего в качестве носителя ионного заряда, (1) нитрат аммония получают восстановлением источника азота на катоде и окислением источника азота на аноде; (2) мочевину или изомеры мочевины получают одновременным катодным восстановлением источника углерода и источника азота; (3) аммиак получают гидрированием источника азота с использованием экономически выгодного источника водорода или эквивалента водорода; и (4) смесь мочевины и нитрата аммония получают одновременным катодным восстановлением источника углерода и источника азота и анодным окислением источника азота.
Источник азота может представлять собой азотсодержащее соединение в электролите, азотсодержащий газ, подаваемый на катодную сторону, или их комбинацию. Источник углерода может представлять собой углеродсодержащее соединение в электролите, углеродсодержащий газ, подаваемый на катод, или их комбинацию. Подобным образом, источник водорода может быть водородсодержащим соединением в электролите, газом, содержащим водород или монооксид углерода, подводимым к анодной стороне, или их комбинацией. Соответственно этому существуют разнообразные комбинации источников азота и углерода в сочетании с одним или более источниками водорода или эквивалента водорода, такого как монооксид углерода. Электролит может быть водным, неводным или твердым.
Здесь представлен способ получения азотных удобрений, выбранных из группы, состоящей из нитрата аммония, мочевины, аммиака, смеси мочевины и нитрата аммония и их комбинаций, причем способ включает приготовление по меньшей мере одного реактора, включающего по меньшей мере одну реакционную камеру и по меньшей мере один анод и по меньшей мере один катод; размещение по меньшей мере одного электролита между каждым по меньшей мере одним анодом и каждым по меньшей мере одним катодом; подведение в реактор газообразных или жидких реагентов, выбранных из источников азота, источников углерода, источников водорода или эквивалента водорода, и их комбинаций; и подачу электрической энергии для проведения анодной и катодной реакций, тем самым получая нитрат аммония при подведении источника азота по меньшей мере к одному катоду и источника азота по меньшей мере к аноду; мочевину при подведении источника углерода и/или источника азота по меньшей мере к одному катоду и источника водорода по меньшей мере к одному аноду; аммиак при подведении источника азота по меньшей мере к одному катоду и источника водорода или эквивалента водорода по меньшей мере к одному аноду; смесь мочевины и нитрата аммония подведением источника азота и источника углерода по меньшей мере к одному катоду и источника азота по меньшей мере к одному аноду; или их комбинации.
Источник углерода может быть выбран из группы, состоящей из диоксида углерода, углеродсодержащих органических соединений, углеродсодержащих газов и их комбинаций. В конкретных вариантах осуществления источник углерода представляет собой углеродсодержащий газ. В вариантах осуществления углеродсодержащий газ включает диоксид углерода, который может быть получен от предприятия для производства этанола, бродильного завода, системы сжигания угля, газификации, поглотительной системы, промывной системы, процессов физической сорбции “Selexol” (поглощение СО2 диметиловым эфиром полиэтиленгликоля), “Rectisol” (поглощение СО2 метанолом), системы поглощения аминами, реформинга природного газа, или их комбинации.
Источник азота может быть выбран из группы, состоящей из азотсодержащих солей, азотсодержащих газов и их комбинаций, в котором азотсодержащие газы включают оксид азота с химической формулой NxOy, где х=1 или 2 и y=0, 1, 2, 3, 4, 5. В вариантах осуществления источник азота представляет собой жидкую форму оксида азота, поглощенного с использованием раствора металлических комплексов. В вариантах осуществления оксид азота поступает из установки для сжигания угля, процесса газификации, процесса обработки воздуха электрическими разрядами или их комбинации.
Источник водорода может быть выбран из группы, состоящей из водородсодержащих солей, водородсодержащих соединений и водородсодержащих газов. Источником эквивалента водорода может быть монооксид углерода или смесь монооксида углерода и водорода. В вариантах осуществления источник водорода включает водородсодержащую соль, выбранную из группы, состоящей из гидроксида аммония (NH4OH) и боргидрида натрия (NaBH4). В вариантах осуществления источник водорода включает водородсодержащий газ, выбранный из группы, состоящей из Н2 и NH3. В некоторых вариантах осуществления источник водорода включает водородсодержащее соединение, выбранное из группы, состоящей из воды, спиртов и сахаров. В вариантах осуществления источник водорода включает газообразный водород из электролиза водородсодержащего соединения, в котором электролиз выполняют с использованием электроэнергии от ветроэнергетической установки, энергии солнечной батареи или их комбинации, и электролиз воды происходит в присутствии деполяризаторов, таких как уголь, сера или диоксид серы, для получения водорода. В некоторых вариантах осуществления газообразный водород или эквивалент водорода поступает из процесса газификации угля, процесса газификации биомассы, реформинга природного газа или их комбинации.
В вариантах осуществления способа по меньшей мере один электролит выбирают из группы, состоящей из водных электролитов, включающих водный раствор, неводных электролитов и твердых электролитов. В вариантах осуществления, включающих водный электролит, водный раствор может быть выбран из группы, состоящей из неорганических кислот, щелочных или нейтральных солей, растворенных в воде, щелочных или нейтральных солей, растворенных в смеси воды и по меньшей мере одного органического растворителя, и их комбинаций. В вариантах осуществления реактор включает по меньшей мере один неводный электролит, выбранный из группы, состоящей из органической соли, растворенной в органическом растворителе, расплавленной кислоты, щелочи и соли, ионной жидкости или их комбинаций. В вариантах осуществления реактор включает по меньшей мере один твердый электролит, выбранный из группы, состоящей из полимерных электролитов, неорганических твердых электролитов и их комбинаций. В некоторых вариантах осуществления по меньшей мере один твердый электролит выбирают из группы, состоящей из неорганических протонных проводников, неорганических ион-кислородных проводников и их комбинаций.
В вариантах осуществления анодные и катодные реакции проводят при температуре в диапазоне от около 0ºС до около 1000ºС. В определенных вариантах осуществления электрохимические реакции проводят при температуре в диапазоне от около 0ºС до около 100ºС, и по меньшей мере один электролит является жидким электролитом. В конкретных вариантах осуществления электрохимические реакции проводят при температуре ниже 200ºС, и по меньшей мере один электролит выбирают из группы, состоящей из твердых полимерных электролитов. В альтернативных вариантах осуществления электрохимические реакции проводят при температуре в диапазоне от около 200ºС до около 600ºС, и по меньшей мере один электролит выбирают из группы, состоящей из неорганических протонных проводников. В других вариантах осуществления представленного способа электрохимические реакции проводят при температуре выше, чем температура в диапазоне от 600ºС до около 1000ºС, и по меньшей мере один электролит выбирают из группы, состоящей из неорганических ион-кислородных проводников.
В некоторых вариантах осуществления анодные и катодные реакции проводят при давлении в диапазоне от около 1 атмосферы до около 200 атмосфер (101,3 кПа - 20,26 МПа).
В некоторых вариантах осуществления подведение по меньшей мере одного газообразного реагента производят с величиной расхода от около 0 см3/мин (SCCM) до около 10000 см3/мин (SCCM). В некоторых вариантах осуществления подачу по меньшей мере одного жидкого реагента или подведение по меньшей мере одного электролита выполняют с величиной расхода от около 0 мл/мин до около 10000 мл/мин.
В некоторых вариантах осуществления способа реагенты включают по меньшей мере один источник углерода и по меньшей мере один источник азота, и молярное отношение источника углерода к источнику азота в реагентах во время электрохимической реакции изменяется от 0,1 до 20. По меньшей мере один анод может включать по меньшей мере один катализатор, выбранный из группы, состоящей из драгоценных металлов, сплавов драгоценных металлов, нанесенных на носитель аналогов таковых и их комбинаций. По меньшей мере один катод может включать по меньшей мере один катализатор, выбранный из группы, состоящей из переходных металлов без носителя, переходных металлов на носителе, их сплавов, органических макромолекулярных соединений, электропроводных полимеров и их комбинаций.
В вариантах осуществления реактор представляет собой электрохимический реактор. Электрохимический реактор может включать одну камеру, которая содержит реагенты, электролит и электроды. Альтернативно, электрохимический реактор может включать одну газовую камеру и одну жидкостную камеру, и один пористый электрод или два пористых электрода. В еще других вариантах осуществления электрохимический реактор может включать три камеры, выбранные из группы, состоящей из двух газовых камер и одной жидкостной камеры, одной газовой камеры и двух жидкостных камер, и другие комбинации трех камер. В некоторых вариантах осуществления электрохимический реактор включает более чем три камеры, выбранные из группы, состоящей из двух газовых камер и двух жидкостных камер или двух газовых камер и трех жидкостных камер.
В вариантах осуществления электрохимический реактор включает одну газовую камеру и одну жидкостную камеру, и реактор далее включает по меньшей мере один газодиффузионный электрод, разделяющий газовую камеру и жидкостную камеру.
Электрохимический реактор может не включать жидкостную камеру и содержит по меньшей мере один электролит, выбранный из группы, состоящей из твердых электролитов. В вариантах осуществления оба из катодного слоя катода и анодного слоя анода являются пористыми, и реагенты являются газообразными.
В некоторых вариантах осуществления, в которых реактор включает три или более камер, реактор далее включает мембрану, разделяющую по меньшей мере один анод и по меньшей мере один катод. Мембрана может быть выбрана из группы, состоящей из ионообменных мембран, пористых полимерных мембран, неорганических пористых мембран и их комбинаций.
В некоторых вариантах осуществления способ включает по меньшей мере два реактора, составляющих батарею. В этих вариантах осуществления два или более реакторов могут быть соединены последовательно, соединены параллельно, или, в случае трех или более реакторов, в любой их комбинации.
В вариантах осуществления по меньшей мере один электролит является жидким, получается нитрат аммония, и способ далее включает нейтрализацию избыточной азотной кислоты, образующейся в реакторе, взаимодействием с аммиаком во внешнем нейтрализационном резервуаре. В некоторых вариантах осуществления нитрат аммония получается вне реактора взаимодействием аммиака, образованного на катоде, и азотной кислоты, образованной на аноде. В вариантах осуществления образуется нитрат аммония, и по меньшей мере один электролит представляет собой жидкий электролит. В определенных вариантах осуществления нитрат аммония получается в реакторе, и по меньшей мере один электролит представляет собой твердый электролит.
В вариантах осуществления способ далее включает взаимодействие аммиака и азотной кислоты в реакционном резервуаре, соединенном с реактором. В вариантах осуществления способ далее включает преобразование в поглотительной колонне оксидов азота с высокой степенью окисления в азотную кислоту путем контактирования оксидов с водой.
В вариантах осуществления получают мочевину, и способ включает подведение источника углерода и источника азота по меньшей мере к одному катоду, подачу водорода или эквивалента водорода по меньшей мере к одному аноду и размещение по меньшей мере одного жидкого электролита между по меньшей мере одним катодом и по меньшей мере одним анодом. В альтернативных вариантах осуществления получается мочевина, по меньшей мере один электролит является твердым, и реактор представляет собой высокотемпературную электрохимическую ячейку.
В некоторых вариантах осуществления способ далее включает применение охлаждаемой ловушки для улавливания мочевины или изомера мочевины.
В вариантах осуществления получают аммиак, и способ включает подведение источника азота по меньшей мере к одному катоду, подачу источника водорода или эквивалента водорода по меньшей мере к одному аноду, и размещение по меньшей мере одного электролита между по меньшей мере одним катодом и по меньшей мере одним анодом.
В некоторых вариантах осуществления получают смесь мочевины и нитрата аммония, реактор представляет собой электрохимическую ячейку; по меньшей мере один электролит является твердым; смесь мочевины и аммиака образуется по меньшей мере на одном катоде; диоксид азота, образующийся по меньшей мере на одном аноде, преобразуют в азотную кислоту действием воды; и мочевина, аммиак и азотная кислота взаимодействуют с образованием смеси мочевины и нитрата аммония.
В некоторых вариантах осуществления получают смесь мочевины и нитрата аммония, причем способ включает подведение источника углерода и источника азота по меньшей мере к одному катоду для образования смеси мочевины и аммиака, подачу источника азота по меньшей мере к одному аноду для образования азотной кислоты; и способ далее включает взаимодействие аммиака и образованной азотной кислоты с дополнительным количеством аммиака для получения нитрата аммония в реакционном резервуаре, внешнем относительно реактора.
В вариантах осуществления анодную и катодную реакции проводят в режиме постоянного тока, в режиме постоянного напряжения, в режиме пульсирующего тока или в режиме линейно изменяющегося напряжения.
Вышеизложенным обрисованы, скорее в общих чертах, признаки и технические преимущества настоящего изобретения, чтобы нижеследующее подробное описание было более понятным. Далее будут описаны дополнительные признаки и преимущества установки и способа, которые составляют предмет пунктов формулы настоящего изобретения. Специалисту в данной области техники будет понятно, что представленные концепция и конкретные варианты осуществления могут быть без труда использованы в качестве основы для модифицирования или разработки других конструкций для достижения тех же целей, что и в настоящем изобретении. Специалисту в данной области техники также должно быть понятно, что такие конструкции не выходят за пределы замысла и области установки и способа, которые изложены в прилагаемых пунктах формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Для подробного описания предпочтительных вариантов исполнения установки и способов использования этой установки для получения азотных удобрений теперь будут привлечены сопроводительные чертежи, на которых
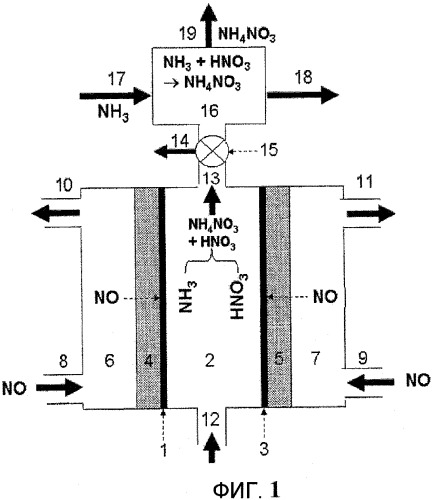
Фиг.1 схематически показывает установку для электрохимического получения нитрата аммония из газообразного источника азота, включающую электрохимическую ячейку без мембранного сепаратора и реакционный резервуар для нейтрализации избыточной азотной кислоты с использованием аммиака, согласно одному варианту осуществления настоящего изобретения.
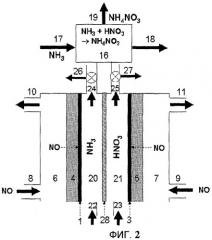
Фиг.2 схематически показывает установку для электрохимического получения нитрата аммония из газообразного источника азота, которая включает электрохимическую ячейку с мембранным сепаратором и реакционный резервуар для нейтрализации избыточной азотной кислоты с использованием аммиака, согласно еще одному варианту осуществления настоящего изобретения.
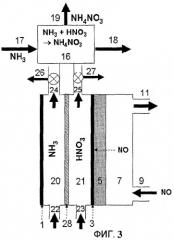
Фиг.3 схематически показывает установку для электрохимического получения нитрата аммония из жидкого источника азота, которая включает электрохимическую ячейку с мембранным сепаратором и реакционный резервуар для нейтрализации избыточной азотной кислоты с использованием аммиака, согласно еще одному варианту осуществления настоящего изобретения.
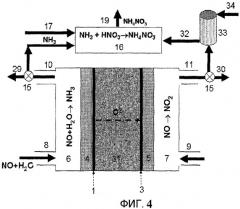
Фиг.4 схематически показывает установку для электрохимического получения нитрата аммония из газообразного источника азота и с использованием твердого электролита, которая включает высокотемпературную электрохимическую ячейку, реакционный резервуар для нейтрализации избыточной азотной кислоты с использованием аммиака и поглотительную колонну для получения азотной кислоты, согласно еще одному варианту осуществления настоящего изобретения.
Фиг.5 схематически показывает электрохимическую ячейку без мембранного сепаратора для получения мочевины в жидком электролите с использованием газообразного источника азота, газообразного источника углерода и газообразного источника водорода, согласно еще одному варианту осуществления настоящего изобретения.
Фиг.6 схематически показывает электрохимическую ячейку с мембранным сепаратором для получения мочевины в жидком электролите с использованием газообразного источника азота, газообразного источника углерода и газообразного источника водорода, согласно еще одному варианту осуществления настоящего изобретения.
Фиг.7 схематически показывает электрохимическую ячейку для получения мочевины в жидком электролите с использованием газообразного источника азота, газообразного источника углерода и жидкого источника водорода, согласно еще одному варианту осуществления настоящего изобретения.
Фиг.8 схематически показывает электрохимическую ячейку для получения мочевины в жидком электролите с использованием всех жидких форм источника азота, источника углерода и источника водорода, согласно еще одному варианту осуществления настоящего изобретения.
Фиг.9 схематически показывает установку для электрохимического получения мочевины из газообразного источника азота и с использованием плотного твердого электролита, включающую высокотемпературную электрохимическую ячейку и охлаждаемую ловушку для улавливания мочевины и/или изомеров мочевины как реакционных продуктов, согласно одному варианту осуществления настоящего изобретения.
Фиг.10 схематически показывает установку для электрохимического получения мочевины из газообразного источника азота и с использованием пористого твердого электролита, включающую высокотемпературную электрохимическую ячейку и охлаждаемую ловушку для улавливания мочевины и/или изомеров мочевины как реакционных продуктов, согласно одному варианту осуществления настоящего изобретения.
Фиг.11 схематически показывает электрохимическую ячейку для получения аммиака из газообразного источника азота и экономически выгодного источника водорода или эквивалента водорода с использованием протонного проводника в качестве электролита, согласно еще одному варианту осуществления настоящего изобретения.
Фиг.12 схематически показывает установку для электрохимического получения смеси мочевины и нитрата аммония из газообразного источника азота, которая включает электрохимическую ячейку с мембранным сепаратором и реакционный резервуар для нейтрализации избыточной азотной кислоты с использованием аммиака, согласно еще одному варианту осуществления настоящего изобретения.
Для обозначения одинаковых/сходных компонентов установки на всех чертежах используются одинаковые номера позиций.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. ОБЗОР
Здесь представлены экономичные установка и способ получения азотных удобрений. Установка включает по меньшей мере один анод и по меньшей мере один катод, в которой реагенты, выбранные из источников азота, источников углерода, источников водорода или эквивалента водорода и их комбинаций, преобразуют в азотные удобрения. В вариантах осуществления установка включает электрохимический реактор. В вариантах осуществления электрохимический реактор включает поле течения газа. Альтернативные варианты осуществления включают жидкостную камеру.
В вариантах осуществления электрохимический реактор включает по меньшей мере один катод, один анод и один электролитный компонент. Для улучшенного регулирования и использования газообразных источников, вовлеченных в реакцию синтеза азотных удобрений, в вариантах осуществления электрохимический реактор включает по меньшей мере поле течения газа и один газодиффузионный электрод. Для регулирования жидких компонентов, включающих источники реагентов и/или электролит, которые участвуют в синтезе азотных удобрений, в вариантах осуществления электрохимический реактор включает жидкостную камеру для обеспечения жидким компонентам возможности протекать через промежуток между катодом и анодом.
В вариантах осуществления раскрытый здесь способ получения азотных удобрений является экономически более выгодным по сравнению с традиционными способами получения азотных удобрений. В вариантах исполнения установки источник углерода, источник азота, источник водорода или эквивалента водорода или их комбинацию выбирают, основываясь на доступности и экономических преимуществах. В предпочтительных вариантах осуществления источник азота включает оксид азота, и утилизация этого оксида азота для получения азотных удобрений может удалять это потенциально опасное соединение из окружающей среды. Сокращение потребления энергии и повышение коэффициента использования тока и селективности для образования азотных удобрений достигаются оптимизацией процесса получения азотных удобрений. Оптимизация процесса включает любое сочетание: (1) применения эффективных электрокатализаторов, (2) выбора подходящих электролитов, (3) регулирования состава реагентов и скоростей подачи реагентов и электролитов, (4) выбора режима контроля величины тока или напряжения, (5) реализации температурного контроля и (6) оптимизации конструкции электрода и электрохимического реактора.
В вариантах осуществления дополнительные экономические преимущества реализуются внедрением процесса со сдвоенным анодом, который производит прибыльный продукт, тем самым улучшая экономические показатели процесса получения азотных удобрений. В вариантах осуществления, более подробно обсуждаемых здесь ниже, анодный реагент образует водородсодержащие или эквивалентные водороду частицы на поверхности раздела анода и электролита и окисляется, повышая стоимость продукта. Эта стоимость, добавленная обработкой на анодной стороне, может частично или по