4-(1-циклогепта-2,4,6-триенил)анилин и его соляно-кислая соль, проявляющие антимикробную активность
Иллюстрации
Показать всеИзобретение относится к новым соединениям: 4-(1-циклогепта-2,4,6-триенил)анилина формулы I и его солянокислой соли формулы II
Соединения обладают антимикробной активностью в отношении ряда условно патогенных микроорганизмов: Staphylococcus aureus, Staphylococcus epidermis, Staphylococcus saprophyticus, Escherichia coli и Candida albicans, а также в отношении дрожжеподобных грибков Candida albicans. Предлагаемые соединения значительно превышают активность известных аналогов, в частности фенилсалицилата, по противомикробному действию, а также активность известного ближайшего аналога по структуре аналога в отношении дрожжеподобных грибков Candida albicans. 1 табл., 3 пр.
Реферат
Изобретение относится к области органической химии, а именно к новым биологически активным соединениям класса замещенных анилинов, содержащих биогенный 1,3,5-циклогептатриенильный (тропилиевый) фрагмент.
Известен в практической медицине препарат фенилсалицилат, аналогичный по фармакологическому (противомикробному) действию предлагаемым соединениям. (Машковский М.Д. Лекарственные средства. М.: Медицина, 1986, т.2, с.406).
Наиболее близким аналогом по структуре к предлагаемым соединениям является N-(41-метоксифенилметил)-4-(1-циклогепта-2,4,6-триенил)анилин формулы III,
получаемый реакцией гидроалкилирования иминов в системе катион тропилия - тетрагидроборат натрия (Юнникова Л.П., Акентьева T.A. / Естественные и технические науки, №6(50), 2010, с.86-90).
Структурный аналог проявляет антимикробную активность (Акентьева Т.А., Юнникова Л.П., Кирьянова И.Н. // Сборник научных трудов SWorld по материалам международной научно-практической конференции «Научные исследования и их практическое применение. (Современное состояние и пути развития 2011». 041 - 5 октября 2011 года. Том 28. Медицина, ветеринария и фармацевтика. Химия. Сельское хозяйство - Одесса: Черноморье, 2011, - с.26). Недостатком указанного соединения является низкая ингибирующая активность в отношении дрожжеподобных грибков Candida albicans в концентрации 1000 мкг/мл.
Технический результат изобретения - получение нового малотоксичного соединения класса замещенных анилинов, а именно 4-(1-циклогепта-2,4,6-триенил)анилина формулы I и его водорастворимой формы - солянокислой соли [4-(1-циклогепта-2,4,6-триенил)анилина]·HCl формулы II, обладающих более высокой антимикробной активностью и более широким спектром действия.
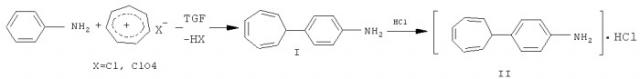
Соединение I получают взаимодействием перхлората тропилия с анилином в среде тетрагидрофурана при выдерживании смеси при комнатной температуре в течение 2 часов с последующим выделением целевого продукта известными приемами. Солянокислую соль II получают путем пропускания сухого хлористого водорода через эфирный раствор соединения формулы I до выпадения осадка, получающийся твердый продукт выделяют известными приемами. Реакции идут по схеме:
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез 4-(1-циклогепта-2,4,6-триенил)анилин (соединение формулы I): Растворили 0,14 г (1,5 ммоль) анилина в 3 мл тетрагидрофурана и добавили 0,19 г (1 ммоль) перхлората тропилия. Смесь выдержали при комнатной температуре в течение 2 часов. Реакционную массу разбавили водой, выделившиеся кристаллы отфильтровали, получили 0,15 г, выход продукта 82%, желтые кристаллы, Т.пл. 50-51°С (гаксан). ИК-спектр: νNH 3472, 3349 см-1. Спектр ЯМР1H (CDCl3): 2.59 (1Н, т, J=5.4, C1H циклогептатриенил); 3.60 (2Н, уш. с, NH2); 5.35-5.40 (2Н, т.т., J1,2=5.4, J2,3=5.4 С2,7Н циклогептатриенил); 6.19-6.24 (2Н, м, С3,6H циклогептатриенил); 6.68-6.73 (4Н, м, Ar+С4,5H циклогептатриенил); 7.13-7.16 (2Н, д, J1,2=8.1, о-Н фенилен). Масс-спектр, м/z (Iотн.%): 183(100) [М]+; 182(81); 106(5); 90(12); 77(7). Найдено, %: С 84.81, Н 7.12, N 7.57. C13H13N. Вычислено %: С 85.24, Н 7.10, N 7.65. М 183.
Пример 2. Солянокислая соль [4-(1-циклогепта-2,4,6 триенил) анилин]·HCl (соединение формулы II): 1,83 г соединения I растворили в 20 мл диэтилового эфира и через полученный раствор пропустили сухой хлористый водород до выпадения осадка соединения II. Выход продукта 2,1 г (96%), желто-зеленый порошок, Т.пл. 170°С (с разложением). ИК-спектр: νNH 3460 см-1. Найдено, %: С 67.12, Н 6.25, N 6.07. C13H14NCl. Вычислено %: С 71.06, Н 6.42, N 6.37. При обработке соединения формулы II водным раствором щелочи выделяется 4-(1-циклогепта-2,4,6-триенил)анилин (соединение формулы I) с количественным выходом, что подтверждает структуру соединения формулы II.
Пример 3. Антимикробная активность и токсичность
4-(1-Циклогепта-2,4,6-триенил)анилин формулы I и его водорастворимую форму - солянокислую соль [4-(1-циклогепта-2,4,6-триенил)анилин]·HCl формулы II, исследовали на антимикробную активность. Исследования проводились по методу двукратных серийных разведений (Першин Г.Н. Методы экспериментальной химиотерапии, 1971, с.109) с использованием музейных условно-патогенных штаммов микроорганизмов: Staphylococcus aureus (штамм 906), Staphylococcus epidermis (штамм 52186), Staphylococcus saprophyticus (штамм 15305), Candida albicans (№24433 ATCC), Escherichia coli (штамм 1257), полученных в ФГУН ГИСК им. Л.А.Тарасевича Роспотребнадзора.
Эксперименты на биологическую активность начинали с подготовки исходных разведений химических соединений, предварительно растворив их в диметилсульфоксиде (вещество формулы I) и воде (вещество формулы II), далее в питательном бульоне. Музейные штаммы готовили из суточной агаровой культуры по оптическому стандартному образцу мутности на 10 ME. Микробная нагрузка соответствовала 2,5×105 микробных тел в 1 мл. Микробную взвесь вносили в приготовленные разведения препаратов в питательной среде. Факт ингибирования (торможения) роста бактерий и дрожжеподобных грибков отмечали после 20-часового термостатирования при 37°С. Окончательные результаты фиксировали через 7 суток при 37°С и пересевов на твердый скошенный агар (РПА). Максимально испытанная концентрация соединений соответствовала 1000,0 мкг/мл. Противомикробную (ингибирующую и бактерицидную) активность оценивали по минимальной действующей концентрации. Острую токсичность соединения формулы I определяли путем однократного введения препарата в брюшную полость восьми белым беспородным мышам с последующим наблюдением за поведением и гибелью животных в течение 7 дней. Были исследованы дозы 155,0 и 500,0 мг/кг массы тела животных.
Результаты исследований антимикробной активности приведены в таблице.
| Таблица | ||||||||||
| Соединения | Антимикробная активность | |||||||||
| Е.coli | St.avreus | St.epidermis | St.saprophyticus | Cand.albicans | ||||||
| МИК∗ | МБК∗∗ | МИК∗ | МБК∗∗ | МИК∗ | МБК∗∗ | МИК∗ | МБК∗∗ | МИК∗ | МБК∗∗ | |
| Аналог по фармакологическому действию Фенилсалицилат - соединение формулы IV | - | - | 750 | 2000 | - | - | - | - | - | - |
| Прототип по структуре, соединение формулы III | - | - | - | - | - | - | - | - | 1000 | - |
| Предлагаемое соединение формулы I | - | - | 62,5 | 125 | <125 | 125,0 | <62,5>31,2 | 62,5 | <31,2>15,6 | 31,2 |
| >62,5 | ||||||||||
| Предлагаемое соединение формулы II | 500 | 1000 | 31,2 | 62,5 | >125 | 500 | ||||
| <250 | ||||||||||
| Примечание: | ∗МИК - минимальная ингибирующая концентрация, мкг/мл; | |||||||||
| ∗∗МБК - минимальная бактерицидная концентрация, мкг/мл; | ||||||||||
| (-) - отсутствие противомикробного действия |
Как видно из таблицы соединение формулы I обладает ингибирующим действием в отношении St.aureus (Staphylococcus aureus) в концентрации 62,5 мкг/мл и бактерицидным 125 мкг/мл, что превышает активность эталона фенилсалицилата (750 мкг/мл и 2000 мкг/мл) соответственно в 12 и 16 раз. Кроме того, выявлена ингибирующая активность соединения формулы I в отношении St. epidermis (Staphylococcus epidermis) в концентрации <125 >62,5 мкг/мл и бактерицидная в концентрации 125,0 мкг/мл. В отношении St. saprophyticus (Staphylococcus saprophyticus) соответственно ингибирующая и бактерицидная концентрации составляют -<62,5 >31,2 и 62,5 мкг/мл. Аналог по фармакологическому действию фенилсалицилат (вещество формулы IV) не обладает противомикробным действием в отношении бактерий рода Staphylococcus, таких как Staphylococcus saprophyticus и Staphylococcus epidermis.
Концентрации <31,2 >15,6 мкг/мл заявленного соединения формулы I тормозят рост дрожжеподобных грибков Cand. albicans (Candida albicans), а концентрации 31,2 мкг/мл вызывают их гибель, что в 32-64 раза превышает ингибирующее действие вещества формулы III как прототипа по структуре.
Вещество формулы I - 4-(1-циклогепта-2,4,6-триенил)анилин относится к малотоксичным в соответствии с принятой классификацией (Сидоров К.К. Токсикология новых промышленных химических веществ. 1973. Вып.13, с.47-51). Гибель животных не наблюдалась от введения доз 155,0 мг/кг и 500,0 мг/кг в брюшную полость белым мышам.
Соединение формулы II в отличие от вещества формулы I проявляет ингибирующее действие в концентрации 500 мкг/мл и бактерицидное 1000 мкг/мл, в отношении Е.coli (Escherichia coli). Также соединение формулы II проявляет ингибирующее действие в отношении Staphylococcus aureus в концентрации 31,2 мкг/мл и бактерицидное действие в концентрации 62,5 мкг/мл, что превышает в 24 раза ингибирующее и в 32 раза бактерицидное действие фенилсалицилата. Кроме того, соединение формулы II проявляет ингибирующее действие в отношении дрожжеподобных грибков Candida albicans - 125-250 мкг/мл и вызывает гибель грибков в концентрации 500 мкг/мл, что в 4-8 раз превышает микостатическое действие прототипа по структуре вещества формулы III.
В связи с тем, что вещества формул I и II обладают выраженным противомикробным действием в отношении ряда бактерий и дрожжеподобных грибков они могут найти применение в практической медицине.
4-(1-Циклогепта-2,4,6-триенил)анилин формулы I и его соляно-кислая соль формулы II, проявляющие антимикробную активность относительно бактерий: Staphylococcus aureus, Staphylococcus epidermis, Staphylococcus saprophyticus, Escherichia coli, а также дрожжеподобных грибков Candida albicans.