Получение и применение производных фенилциклобутиламида и их стереоизомеров
Иллюстрации
Показать всеИзобретение относится к производным фенилциклобутиламида формулы (I), его стереоизомеру или фармацевтически приемлемой соли. В формуле (I) R - это Н, формацил, ацетил, галоацетил, бензоил, бензилоксикарбонил (Cbz), t-бутоксикарбонил (Boc) или 9-флуоренилметоксилкарбонил (Fmoc). Производное фенилциклобутиламида формулы (I), где R - Н, используют для приготовления лекарства и фармацевтической композиции, предназначенных для снижения веса. Производные фенилциклобутиламида формулы (I) получают путем растворения рацемического или разделенного 1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламина и R-защищенного рацемического или D- или L-изолейцина в безводном ТГФ, затем добавляют по каплям конденсирующий агент в раствор, перемешивают при комнатной температура в течение ночи, отфильтровывают осадки и промывают осадки безводным диэтиловым эфиром несколько раз. Собирают фильтрат и элюат безводного диэтилового эфира, затем получают сырой продукт выпариванием, отделением и очисткой посредством колоночной хроматографии с получением рацемического или оптически изомерного соединения, 2-(R-амино)-N-{1-[1-(4-хлорофенил)циклобутил]-3-метилбутил}-3-метилпентанамид; удаляют R-защищающую группу с получением рацемического и оптически изомерного соединения: 2-амино-N-{1-[1-(4-хлорофенил)циклобутил}-3-метилбутил}-3-метилпентанамид; используют фармацевтически приемлемую кислоту для приготовления его соли. Технический результат - производные фенилциклобутиламида, пригодные для лечения ожирения. 5 н. и 2 з.п. ф-лы, 1 табл., 12 пр.
Реферат
Область изобретения
Изобретение относится к области химической медицины и, в частности, связано с новыми стереоизомерами производных фенилциклобутиламида и их фармацевтически приемлемыми солями. Настоящее изобретение также относится к методам приготовления стереоизомеров и их солей, фармацевтических композиций, содержащих эти стереоизомеры и их соли, а также к использованию этих стереоизомеров, солей и композиций при изготовлении препаратов для лечения ожирения.
Предпосылки изобретения
С улучшением качества жизни людей ожирение вследствие неправильного питания становится все более и более острой проблемой в повседневной жизни. Эксперты Общества против ожирения считают ожирение глобальной эпидемией со все возрастающей скоростью распространения. Согласно документу ВОЗ один миллиард людей имеют лишний вес и, по меньшей мере, 300 миллионов тучны. Ожирение встречается не только в развитых странах, но и в развивающихся. На 11 Европейском конгрессе по ожирению Китай впервые был включен в рейтинг скорости распространения ожирения. Ожирение, а также СПИД, наркотики и алкоголизм, считаются четырьмя опасными социальными проблемами для здоровья человека в мире. Оно может провоцировать или усугублять течение некоторых общих хронических заболеваний, особенно диабета, расстройств сердечно-сосудистой системы и синдрома апноэ во сне. Статистика показывает, что в последние 10-20 лет от ожирения или его осложнений умирает 280-325 тыс. человек в год. Хотя развитие чувства заботы о себе предполагает использование многих способов контроля веса, включая регулярные упражнения в сочетании с диетой, лишь некоторые из них имеют долгосрочный эффект. Таким образом, все более и более нарастает желание получить снижающее вес лекарство, так что развитие безопасных и эффективных снижающих вес препаратов принесет чрезвычайный социальный и экономический эффект.
Фирма Konll Company (концерн BASF, Германия) разработала препарат для снижения веса Сибутрамин гидрохлорид, 1-(4-хлорофенил)-N,N-диметил-α-(2-метилпропил)циклобутанметанамин гидрохлорид моногидрат, являющийся ингибитором обмена серотинина - норадреналина. В ноябре 1997 г. Сибутрамин гидрохлорид получил признание FPA (Администрации США по пищевым продуктам и лекарствам) как весоснижаюший препарат и появился на рынке в феврале 1998 г. под торговой маркой Меридиа (Meridia). В том же 1998 г. объемы продаж Meridia составили 194 млн долларов США, и выросли до более чем 300 млн долларов, в 1999 г. Meridia является одним из главных товаров на европейском и американском рынке весоснижающих препаратов и хорошо продается в ~20 странах. Meridia является одним их четырех главных продуктов фирмы BASF. В мае 2000 г. он получил признание SDA в Китае и марку QuMei. До настоящего времени около 3 млн человек принимают Сибутрамин гидрохлорид по всему миру.
Сибутрамин HCl является ингибитором обмена серотинина - норадреналина (Buckett, W.R., Thomas, P.C., Luscombe, G.P., Prog. Neuropsychopharmacol. Biol. Psychiat, 1988, 12: 575-584; Luscombe, G.P., Hopcroft, R.H., Thomas, P.C., Buckett, W.R., Neuropharmacology, 1989, 28: 129-134). Подтверждено, что Сибутрамин гидрохлорид может снижать вес двояким образом. С одной стороны, он может повышать чувство насыщения, сокращая потребление пищи (Fantino, M., Souquet, A.-M., Int. J. Ожирение, 1995, 19: 145; Halford, J.С.G., Heal, D.J., Blundell, J.E., Brit. J. Pharmacol, 1995, 114: 387P; Stricker-Krongrad, A., Souquet, A.-M., Burlet, C., Int. J. Obrsity, 1995, 19: 145). С другой стороны, может стимулировать выработку тепла, увеличивая потребление энергии (Connoley, I.P., Heal, D.J., Stocl, M.J., Brit. J. Pharmacol, 1995, 114: 388P; Connoley, I.P., Frost, I., Heal, D.J., Stocl, M.J., Brit. J. Pharmacol, 1996, 117: 170P). Кроме того, Сибутрамин гидрохлорид может уменьшать отношение талия-бедро, и в то же время понижать концентрацию триглицерида, общего холестерина и LDL-ch в крови, увеличивать концентрацию of HDL-ch в крови (Qifu Lee, et al., Chinese Journal of Endocrinology and Metabolism, 2002, 18(3): 204-205; Jian Wu, et al., Medical Journal of Chinese People's Liberation Army, 2002, 27(2):172-176; Jian Wu, et al., Chinese Journal of Endocrinology and Metabolism, 2001, 18(3): 201-202).
Было обнаружено, что Сибутрамин HCl может на 5-10% снижать основной вес и удерживать потерю веса очень хорошо. Сибутрамин гидрохлорид не показывал очевидных седативного, стимулирующего и адренергетического эффектов, и имел хорошую толерантность к другими лекарствам. Однако наблюдались побочные явления - сухость во рту, головная боль, анорексия, запор и бессонница.
Впоследствии было обнаружено, что Сибутрамин HCl и его деметилированное производное могут лечить нервные и психические расстройства, такие как ожирение, бессонница, чувство усталости, депрессия и т.п.; метаболические расстройства и болезни сердечно-сосудистой системы. Для Сибутрамина HCl, его стереоизомеров и деметилированного производного, из заявок PCT/US2000/007202 известно, что они могут уменьшать набор веса после беременности; PCT/US2000/007255 - что они могут снижать адгезию тромбоцитов; PCT/US2000/007122 - их лечебное действие на синдром хронической усталости; PCT/US2000/007123 - их лечение метаболического синдрома; PCT/US2000/007361 - их лечебный эффект к опухолям, связанным с ожирением; PCT/US2000/007124 - их лечебный эффект к легочной гипертензии; PCT/US2000/007177 - лечебный эффект к синдрому сна; PCT/US2000/001217 - их содействие прекращению курения; патент США 6046242 открыл лечение ими недержания мочи. Были выработаны методы для разделения энантиомеров Сибутрамина HCl в крупном масштабе (Tetra Asymm 2003, 14(25): 3553-3556).
Кроме того, исследователи в области химического синтеза развили много методов модифицирования Сибутрамина HCl, такие как пути асимметричного синтеза R-Сибутрамина (Organic process research and development 2006, 10(2): 327-333); методы деметилирования Сибутрамина (патент США 6399826); асимметричный синтез деметилированного R-Сибутрамина (Tetra Lett, 2002, 43(13): 2331-2333). Проводились также исследования индивидуального модифицирования метил-, амино- и циклобутил-производных деметилированного Сибутрамина и приготовления чистого оптического изомера этих производных (J. Chem. Soc. Perkin Trans. 1; EN; 21; 1996; 2583-2590). В литературе (Org. Lett. 2005: 2599-2602) описано модифицирование метил- и амино-производных деметилированного Сибутрамина с разделением оптических изомеров.
Однако названные исследования относятся только к химическому аспекту производных, модифицированного Сибутрамина. Не обнаружено данных по ацидификации амино-производных двойного деметилированного Сибутрамина. Далее, нет работ, сфокусированных на глубоком изучении эффекта снижения веса производными Сибутрамина и сравнении между их энантиомерами.
Сущность изобретения
Задачей настоящего изобретения является предложение новых производных фенилциклобутиламида. Получены новые соединения и их оптические изомеры посредством аминокислотного ацилирования свободных аминогрупп двойного деметилированного Сибутрамина, с оценкой весоснижающего эффекта новых соединений методами фармакодинамики.
Производные фенилциклобутиламида по настоящему изобретению включают соединения (I), чистые стереоизомеры и их фармацевтически приемлемые соли.
Как видно из формулы (I), молекула имеет три асимметричных центра. Кроме рацемических смесей, боковые аминокислотные остатки соединения по настоящему изобретению - это (D)- или (L)-изолейциновое производное. Следовательно, изобретение включает четыре новых стереоизомера:
где R - это Н, формацил, ацетил, галоацетил, бензоил, бензилоксикарбонил (Cbz), t-бутилоксикарбонил (Boc) и 9-флуоренилметоксикарбонил (Fmoc).
Настоящее изобретение также включает фармацевтическую композицию вышеуказанных производных фенилциклобутиламида, фармацевтическую композицию, содержащую вышеуказанные производные фенилциклобутиламида как активный компонент в комбинации с другими, вспомогательными фармацевтическими ингредиентами, БАД, включающий вышеуказанные производные фенилциклобутиламида как активный компонент в комбинации с другими ингредиентами, функциональную пищу или напиток, содержащие вышеуказанные производные фенилциклобутиламида как функциональные компоненты в комбинации с другими ингредиентами, смешанное лекарство, смешанный БАД, функциональное питание или напиток, комбинирующие вышеуказанные производные фенилциклобутиламида и другие фармацевтически активные вещества.
Кроме того, в настоящем изобретении использовалась модель ожирения крыс для изучения эффекта снижения веса теституемых соединений и различий в содержании жира в крови, биохимии крови и тесты на патологию органов (сердца, печени, почек) и т.п. по сравнению с контрольными группами, принимавшими Сибутрамин HCl. Было показано, что все испытуемые соединения оказывают весоснижающее действие на тучных крыс в различной степени, и что значительное влияние на общий протеин плазмы и сахар в крови экспериментальных животных не обнаружено, и что также не обнаружено видимых патологических изменений жизненно важных органов.
Таким образом, соединения, защищаемые данным изобретением, подходят для предотвращения и лечения ожирения и смежных болезней. Далее, настоящее изобретение защищает соединения с формулой (I), их чистые стереоизомеры, их фармацевтически приемлемые соли, а также влияние на ожирение и смежные болезни фармацевтических композиций, содержащих указанные вещества и другие фармацевтически активные вещества. Под смежными заболеваниями понимаются те, которые связаны с ожирением и известны специалистам в этой области. Этот термин включает, не ограничиваясь этим списком: гапертензия, коронарный тромбоз артерий, апоплексия, меланхолия, беспокойство, психозы (например, шизофрения), медлительная дискинезия, наркомания, злоупотребление лекарствами, ухудшение когнитивных способностей, болезнь Альцгеймера, церебральная ишемия, афрения, синдром Паркинсона, синдром забывчивости, компульсивное поведение (compulsion), паника, социофобия, расстройства питания, липидный синдром, избыточный сахар в крови, избыточный жир в крови и стрессовые реакции.
В настоящем изобретении деметилированные D- и L-Сибутрамины конденсируются с D/L-изолейцином в мягких условиях с получением нового фармацевтически активного соединения. Названное соединение - это новый амид, чья структура отличается от таковой алкиламинозамещенного Сибутрамина HCl. На основе опытов на животных мы предполагаем, что все соединения по настоящему изобретению обладают весоснижающим эффектом в различной степени по модели ожирения крыс, и этот эффект выражен даже сильнее, чем у Сибутрамина HCl. Таким образом, лекарственное средство, изготовленное из соединений по настоящему изобретению или их фармацевтически приемлемых солей, или лекарство, изготовленное из композиции, содержащей соединения по настоящему изобретению и других фармацевтически активных соединений, могут быть использованы в лечении ожирения.
Подробное описание предпочтительных реализации.
Для приготовления соединений по изобретению может быть применена следующая общая методология.
Метод А: Приготовление рацемических производных фенилциклобутиламида.
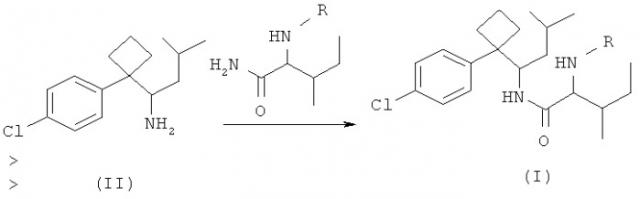
Рацемический 1-[1-(4-хлорофенил)-циклобутил]-3-метилбутиламин (соединение II), синтезированный по методу, описанному в Chinese Journal of Pharmaceutivals, 2001, 32(8): 337-339, конденсировали с R-изолейцином> в мягких условиях для получения аминомодифицированных производных фенилциклобутиламида (формула I).
где R - формации, ацетил, галоацетил, бензоил, бензилоксикарбонил (Cbz), t-бутилоксикарбонил (Boc) или 9-флуоренилметоксикарбонил (Fmoc).
> Соединения формулы (I) независимо отщепляют формацил, ацетил, галоацетил, бензоил, Cbz, Boc и Fmoc в кислотных, основных или каталитических условиях гидрогенирования с получением продукта, который все еще имеет основную структуру формулы (I), но где R - это Н. Конкретная структура такова:
Метод В: Приготовление оптических изомеров производных фенилциклобутиламида.
Соединение формулы (I), приготовленное выше, является рацемической смесью, которая может быть разделена с использованием известных химических, биологических или физических методов для получения соответствующих оптических изомеров (Ye L.X., Stereochemisty, Perking University Press, 1999).
Приготовление оптических изомеров производных фенилциклобутиламида исходя из хиральных материалов
1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламин (II) имеет асимметричный центр и может быть подвергнут разделению с использованием винной или яблочной кислоты как хирального агента с получением оптических изомеров 1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламина (II-R или II-S), например, путем образования разделимых диастереотопных солей или сложного (комплексного) кристалла, или путем образования диастереотопных производных, которые могут быть разделены кристаллизацией, газожидкостной или жидкостной хроматографией.
Один энантиомер селективно реагирует с хиральным агентом по методу, такому как ферментное окисление или восстановление, и затем модифицированный энантиомер отделяется от немодифицированного; или эта реакция проводится в хиральных условиях, например, с использованием хирального носителя (например, связанного на силикагеле хирального лиганда) или используя метод разделения газожидкостной или жидкостной хроматографией в хиральном растворителе. Легко понять, что какой бы метод разделения ни использовался, нужна дополнительная стадия для высвобождения соответствующего энантиомера.
1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламин (II-R или II-S) конденсируется с L/D-изолейцином в мягких условиях с получением одиночного энантиомера с формулой (I), где R - формацил, ацетил, галоацетил, бензоил, Cbz, Boc и Fmoc.
Соединения формулы (I) независимо отщепляют формацил, ацетил, галоацетил, бензоил, Cbz, Boc и Fmoc в условиях кислотного, основного или каталитического гидрогенирования с получением продукта, который все еще имеет главную структуру формулы (I), но где R - Н. Конкретные структуры оптических изомеров следующие:
В процессе приготовления рацемических смесей и энантиомеров вышеуказанных производных фенилциклобутиламида имеется стадия реакции конденсации. Эксперты знают, что для образования соединений по изобретению пригодны многие известные конденсирующие агенты, такие как DCC, DIC, BDP, BDP, EDC, АОР, РуАОР, РРАА, TOTU, HATU, HAPyU, HAMDU, HBTU, HBTyU, HBMDU, HBPyU, DEPBT, HOAT, HOBT, PyBOP, TATU, TBTU, PyBrop, PyCloP, CIP, TFFH, BTFFH, PyCIU, CDTP, BOP-Cl, DPPA, DEPC, BOMI, BDMP, и т.п.
Соединения, защищаемые настоящим изобретением, также включают фармацевтически приемлемые соли соединений формулы (I) и их энантиомеры. В сравнении с исходными или основными соединениями эти соли лучше растворимы в воде и тем самым пригодны для медицинских применений. Соединения по настоящему изобретению содержат основные атомы азота, так что их соли могут быть получены реакцией с неорганическими кислотами (соляной, бромистоводородной, иодоводородной, фосфорной, метафосфорной, азотной, серной, сернистой и т.п.) или с органическими кислотами (карбоновая, уксусная, щавелевая, бензолсульфокислота, п-толуолсульфокислота, п-бромобензолсульфокислота, янтарная, бензойная, лимонная, этансульфоновая, фумаровая, глюконовая, гликолевая, изэтионовая, молочная, лактозная, малеиновая, малоновая кислота, метансульфоновая, сукциновая, п-толуолсульфоновая, винная и трифторуксусная кислоты, аминокислоты и т.п.), предпочтительно с соляной кислотой. Таким образом, эти фармацевтически приемлемые соли включают сульфат, пиросульфат, бисульфат, сульфит, гидросульфит, фосфат, бифосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, каприлат, акрилат, формиат, изобутират, гептилат, капрат, пропиолат, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, 2-бутин-1,4-дионат, 3-циклогексин-2,5-дионат, бензоат, хлорбензоат, фенилацетат, фенпропионат, фенилбутират, цитрат, лактат, гиппурат, β-гидроксибутират, глюконат, малеат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат, глютамин, аргинин, лизин и т.д. В плане медицинского применения предпочтительны хлориды.
Соединения по настоящему изобретению также включают различные полиморфы, такие как аморфная и кристаллическая формы. Все формы соединений по настоящему изобретению подпадают под его защиту, что составляет еще один аспект настоящего изобретения.
Другой аспект этого изобретения - применение соединений по настоящему изобретению, включая рацемические смеси, оптические изомеры и фармацевтически приемлемые соли, в приготовлении лекарств. На практике, чтобы получить желаемый биологический эффект, требуемое количество зависит от различных факторов, таких как выбор конкретного соединения, ожидаемое приложение, тип введения в организм и клиническое состояние больного. В общем, терапевтически эффективное количество соединения для ввода в организм варьируется от 0.3 до 100 мг (предпочтительно от 3 до 50 мг) на 1 кг веса тела в день, то есть 3-10 мг/кг/день. Доза при внутривенном введении может быть в диапазоне, например, от 0.3 мг/кг до 1.0 мг/кг. Следует применять подходящую методику вливания со скоростью между 10 нг/кг/мин до 100 нг/кг/мин. Раствор для вливания, подходящий для этих целей, должен содержать, например, от 0.1 нг/мл до 10 мг/мл, предпочтительно от 1 нг/мл до 10 мг/мл. Одиночная доза может содержать, например, от 0.1 нг до 10 г активных соединений. Таким образом, ампула для инъекции может содержать, например, от 1 мг до 100 мг активного вещества. Одиночная доза для перорального введения, например таблетка или капсула, может содержать от 1.0 мг до 1000 мг, обычно 10-600 мг. В случае фармацевтически приемлемых солей количество, потребное для терапевтического эффекта, связано с качеством соответствующего свободного основания. Соединения, используемые для профилактики или лечения болезней, упомянутых выше, могут быть соединениями формулы (I) сами по себе, однако они предпочтительно комбинируются с приемлемыми носителями, образуя форму фармацевтических композиций. Носители должны быть совместимы, другими словами, они должны быть совместимы с другими компонентами фармацевтических композиций и быть неопасными для больных. Носители могут быть твердыми, жидкими или обоих видов, и предпочтительно комбинироваться с соединением, обеспечивая одиночную дозу, типа таблетки, содержащей 0.05-95 вес.% активного соединения. Могут также наличествовать другие фармацевтически активные соединения, включая другие соединения формулы (I). Фармацевтические композиции по настоящему изобретению могут быть приготовлены по любому известному в фармацевтике методу, который обычно включает комбинирование каждого компонента с фармацевтически приемлемыми носителями и/или адъювантами.
Способ приготовления производных фенилциклобутиламида включает следующие стадии: растворение рацемического или разделенного 1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламина и R-защищенного рацемического или D- или L-изолейцина в безводном ТГФ, затем добавление по каплям конденсирующего агента в раствор, перемешивание при комнатной температура в течение ночи, отфильтровывание осадков и промывание осадков безводным диэтиловым эфиром несколько раз; сбор фильтрата и элюата безводного диэтилового эфира, затем получение сырого продукта выпариванием, отделением и очисткой посредством колоночной хроматографии с получением рацемического или оптически изомерного соединения, 2-(R-амино)-N-{1-[1-(4-хлорофенил)циклобутил]-3-метилбутил}-3-метилпентанамид; удаление R-защищающей группы с получением рацемического и оптически изомерного соединения: 2-амино-N-{1-[1-(4-хлорофенил)циклобутил]-3-метилбутил}-3-метил пентанамид; использование фармацевтически приемлемой кислоты для приготовления его соли.
Подходящие пути введения в организм могут включать, без ограничения, пероральное, ректальное, местное, сублингвальное и парентеральное (например, инъекционное: подкожное, внутримышечное, трансдермальное и внутривенное) введение. Предпочтительные пути введения будут зависеть от состояния больного, тяжести болезни и типа используемого соединения формулы (I). Покрытые сахаром формы и покрытые сахаром медленно высвобождающиеся формы также подпадают под настоящее изобретение. Предпочтительные формы - кислотоустойчивые и устойчивые к желудочному соку препараты. Подходящее покрытие, устойчивое к желудочному соку, включает ацетат-фталат целлюлозы, поливинилацетат-фталат, фталат гидроксипропилметилцеллюлозы и анионный полимер метилкротоната.
Фармацевтические композиции, подходящие для перорального введения, обычно представляют собой независимые единицы, типа капсулы, облатки или таблетки, троше-таблетки, при любых обстоятельствах эта единица включает определенное количество соединения формулы (I); порошок или гранула; раствор или суспензия в воде или неводном растворителе; или органически-водная или водно-органическая эмульсия. Как упоминалось выше, эти композиции можно приготовить по любому известному фармацевтическому методу, который включает стадию контакта активного соединения с носителем (может также включать один и более других компонентов). Обычно фармацевтические композиции готовятся так: активные соединения равномерно смешивают с жидкостью и/или мелкодисперсным твердым носителем, и затем, если необходимо, формуют формы, например, пилюля может быть приготовлена так: спрессовывают порошок или гранулы соединения (с подходящими одним или более дополнительных компонентов) с получением формы. Спрессованные таблетки можно получить так: спрессовывают соединения (соответствующим образом смешанное с адгезивами, высвобождающими агентами, инертными разбавителями и/или одним или более ПАВ/дисперганта) в форме свободного потока (например, порошок или гранулы) в соответствующей машине. Матричную ленту можно приготовить так: порошкообразное соединение формуется с использованием инертного жидкого разбавителя в подходящей машине.
Фармацевтическая композиция, пригодная для перорального (сублингвального) введения, включает таблетку, которая содержит соединения формулы (I) и коррективы, такие как сахароза/акация или трагакантовая смола/камедь; и пастилки, включающие соединения формулы (I) в инертной матрице, такой как желатин/глицерин или сахароза/акация.
Соединения по настоящему изобретению (формула I) могут быть формулированы для парентерального введения. Парентеральные формы - это обычно стерильные водные растворы, изотоничные с кровью больного. Подходящие средства для парентерального введения включают внутривенное, внутримышечное, трансдермальное и подкожное. Соединения (формула I) смешивались с водой с получением стерильных водных растворов, изотоничных с кровью. Водные растворы для инъекций по настоящему изобретению обычно содержат 0.1-5 вес.% активных соединений.
Соединения по настоящему изобретению (формула I) могут также формулироваться как однодозовые суппозитарии, с использованием одной или более обычных суппозитарных основ, например какао-масло.
Соединения по изобретению могут вводиться местно на кожу. Типичные формы для этой цели включают мази, крем-мази, лосьоны, пасты, спреи, аэрозоли и масла. Подходящие носители включают космолин, агнолин, полиэтиленгликоль, спирты и/или комбинацию двух и более вышеперечисленных. Концентрация активного соединения обычно составляет 0.1-15 вес.%, предпочтительно 0.5-2 вес.%.
Соединения по изобретению могут также вводиться трансдермально. Формы, годящиеся для трансдермального введения, - это обычно порционный пластырь, который может плотно контактировать с кожей больного. Для этого вида пластыря подходят любые буферные водные растворы, в которых соединения растворены и/или распределены в адгезивах или полимере. Подходящие активные соединения могут высвобождаться электронным транспортом или ионтофорезом, как описано, например, в Phanneceutical Research, 2(6), 318(1986).
Соединения по настоящему изобретению (формула I) особенно эффективно влияют на липидный метаболизм, что особенно подходит для похудания млекопитающих и поддержания веса после его потери, а также используются как аноректик. Соединения по настоящему изобретению (формула I) также эффективны из-за их гипотоксичности и низких побочных эффектов. Соединения по настоящему изобретению (формула I) могут вводиться в одиночку или в комбинации с одним и более другими весоснижающими или аноректически активными соединениями.
Другие аноректически активные соединения, использующиеся в настоящем изобретении, могут включать соединения, описанные в главе 1, весоснижающие агенты/подавители аппетита Roten Liste или соединения, которые усиливают преобразования энергии в организме, таким образом снижая вес; или соединения, которые влияют на основной метаболизм организма, тем самым возросшее потребление калорий не ведет к накоплению отложений жира, и нормальное поступление калорий ведет к уменьшению жировых отложений. Указанные соединения подходят для профилактики избыточного веса или ожирения, особенно для лечения избыточного веса или ожирения. Кроме того, указанные соединения подходят для профилактики диабета типа II и атеросклероза, особенно для лечения диабета типа II и атеросклероза; и подходят для нормализации липидного метаболизма и лечения гипертензии. Соединения могут служить МСН-антагонистами и подходят для лечения сенсорных расстройств и других психиатрических симптомов, таких как депрессия, апарионевроз и шизофрения, и лечения расстройств циркадного ритма и злоупотребления лекарствами.
Еще одним аспектом этого изобретения является то, что соединения (формула I) описанные в нем, могут комбинироваться с одним и более других фармакологически активных веществ типа антидиабетиков, репеллентов жира, антигипертензически активных соединений, антилипемическими агентами и активными соединениями, используемыми для лечения и/или профилактики осложнений диабета или связанных с ним болезней.
Подходящие антидиабетики могут включать, не ограничиваясь этим, инсулин, амилин, GLP-1 и/или GLP-2 производные, например антидиабетики, заявленные в W098/08871 фирмой Novo Nordisk A/S, и гипогликемически активные соединения для перорального введения.
Для перорального введения гипогликемически активные соединения включают, в частности, сульфонилмочевину, бигуанид, меглитинид, диоксазолидиндион, тиазолидиндион, ингибиторы глюкозидазы, антагонист рецепторов глюкагона, GLP-1-агонист, открыватели каналов калия (например, по патентам WO 97/26265 и WO 99/03861, опубликованным фирмой Novo Nordisk A/S), сенсибилизаторы инсулина, активаторы киназы инсулин-рецепторов, ингибиторы относящиеся к гликонеогенезису и/или печеночным ферментам, стимулируемым посредством гликогенолиза (например, ингибиторы гликоген фосфорилазы), модуляторы, связанные с обменом глюкозы, соединения, связанные с регуляцией липидного метаболизма (например, активные соединения ингибиторов редуктазы антигиперлипемии или антилипемии и HMGCoA), ингибиторы транспорта холестерина/потребления холестерина, ингибиторы реабсорбции желчной кислоты или ингибиторы протеина передачи микросомного триглицерида (МТР), соединения, связанные с уменьшением потребления нутриционных агентов, PPAR/RXR-агонист и активные соединения, нацеленные на β-клеточные АТФ-зависимые каналы калия.
В одной из реализаций настоящего изобретения соединения по изобретению вводятся в комбинации с инсулином.
В другой реализации настоящего изобретения соединения по изобретению вводятся в комбинации с сульфонилмочевиной, толбутамидом, глибенкламидом, глимепиридом, гоипизидом, гликвидоном, глисоксепидом, глиборнуридом или гликлазидом.
В другой реализации настоящего изобретения соединения по изобретению вводятся в комбинации с бигуанидом, например метформинметформином.
В другой реализации настоящего изобретения соединения по изобретению вводятся в комбинации с меглитинидом, например репаглинидом.
В другой реализации настоящего изобретения соединения по изобретению вводятся в комбинации с каким-либо тиазолидендионом, таким как троглитазон, циглитазон, пиоглитазон, розиглитазон или соединением, опубликованном в патенте WO 97/41097 фирмой Dr. Reddy's Research Foundation, особенно соединением 5-[[4-[(3,4-2Н-3-метил-4-кето-2-метоксихизолин)фенил]метил]-2,4-тиазолидендионом.
В другой реализации настоящего изобретения соединения по изобретению вводятся в комбинации с ингибитором α-сукрозидазы, таким как миглтол или акарбоза.
В другой реализации настоящего изобретения соединения по изобретению вводятся в комбинации с β-клеточными АТФ-зависимыми каналами калия, таким как толбутамид, глибенкламид, глимепирид, глипизид, гликлазид или репаглинид.
В другой реализации настоящего изобретения соединения по изобретению вводятся в комбинации с активными соединениями антигипертензии или антилипидемии, такими как колестирамин, колестипол, клофибрат, фенофибрат, гемфиброзил, ловастатин, правастатин, симвастатин, аторвастатин, церивастатин, ловастатин, пробукол, эзетимиб или холаксин.
В другой реализация настоящего изобретения соединения по изобретению вводятся в комбинации с одним или более лекарствами, описанными выше, такими как сульфонилмочевина и метформин, сульфонилмочевина и акарбоза, репаглитинид и метформин, инсулин и сульфонилмочевина, инсулин и метформин, инсулин и троглитазон, инсулин и ловастатин, и др.
Кроме того, соединения по этому изобретению могут также вводиться в комбинации с одним и более репеллентов жира или активными соединениями, контролирующими аппетит, которые включают, в частности, CART-агонисты, NPY-антагонисты, МС4-агонисты, антагонисты оксексина, Н3-агонисты, TNF-агонисты, CRF-агонисты, CRF ВР-антагонисты, агонисты урокотина, β3-агонисты, MSH-агонисты, ССК-агонисты, SSRIs, ингибиторы обратного захвата серонина и NE, 5НТ-модуляторы, МАО-ингибиторы, агонисты эпибатидина, антагонисты галанина, гормон роста, соединения, высвобождающие гормон роста, TRH-агонисты, модуляторы разъединения протеина 2/3, агонисты лептина, агонисты допамина (напр. допрексин), ингибиторы эстеразы/амилазы, антагонисты рецепторов каннагина, ASP-модуляторы, PPAR-модуляторы, RXR-модуляторы, hCNTF стимулятор или TR-β-агонисты.
В одной реализации настоящего изобретения репеллент жира - это лептин или модифицированный лептин.
В другой реализации настоящего изобретения репеллент жира - это дексамин или фенамин.
В другой реализации настоящего изобретения,репеллент жира - это фенфлурамин или изомерид.
В другой реализации настоящего изобретения репеллент жира - это Сибутрамин или моно-/ди-деметилированный активный метаболит Сибутрамина.
В другой реализации настоящего изобретения репеллент жира - это орлистат.
В другой реализации настоящего, изобретения репеллент жира - это мазиндол, амфепрамон или фентермин.
Далее, соединения по настоящему изобретению могут вводиться в комбинации с антигипертензивными соединениями. Например, антигипертензивные соединения могут включать β-блокаторы, такие как алпренолол, атенолол, тимолол, пиндолол, пропранолол и метопролол; иди ингибиторы фермента конверсии ангиотензина (АСЕ), такие как беназеприл, каптоприл, эналаприл, фосиноприл, лизиноприл и рамиприл; или блокаторами каналов кальция, таким как нифелипин, фелодипин, никардипин, испрадипин, нимодипин, дилтиазем и верапамил; или α-блокаторами, такими как доксазозин, урапидил, празозин и теразозин. В дополнении к вышеназванным комбинациям, см. ссылки в книге: The Science and Practice of Pharmacy, 19th edition, Gennaro, editor. Mack Publishing Co., Easton, PA, 1995 edited by Remington.
Без дальнейшего уточнения следует заметить, что любая подходящая комбинация стереоизомеров по настоящему изобретению с одним и более вышеназванных соединений и, возможно, одним и более другими фармакологически активными веществами подпадают под действие настоящего изобретения.
Примеры
Следующие подробные примеры даны для описания, как приготовить различные соединения и/или провести различные процессы по изобретению, и должны рассматриваться как только лишь иллюстрационные, но ни в коей мере не ограничивающие. Специалисты в соответствующей области быстро распознают подходящие вариации этих процедур как в отношении реагентов, так и в отношении условий реакции и методики.
Пример 1: синтез 1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламина и его оптических изомеров
1. Синтез рацемического 1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламина (II) Как описано в статье (Chinese Journal of Pharmaceuticals, 2001, 32(8): 337-339), цианид п-хлоробензила конденсировали с 1,3-дибромопропаном, циклировали с получением интермедиата циклобутила и затем через реакцию Гриньяра и реакцию восстановления с получением титульного соединения (выход 56.2%).
2. Пример разделения
20.3 г рацемического 1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламина, полученного на стадии 1, растворяли в 300 мл смешанного растворителя ацетон/вода/метанол (1:0.13:0.7 об.). L(+)-винная кислота (12.1 г) добавлялась к смеси и перегонялась с обратным холодильником в течение 0.5 ч. Смесь охлаждали до комнатной температуры и держали при ней в течение 2-4 суток для кристаллизации. Кристаллы отфильтровывали, промывали холодной смесью ацетон/вода (100 мл/13 мл) и сушили до твердого состояния (10.3 г, выход 33%).
25 г вышеполученных кристаллов в смешанном растворителе ацетонитрил/вода/этанол (300 мл/65 мл/30 мл) перегоняли с обратным холодильником в течение 1 ч и затем охлаждали до комнатной температуры с получением белого твердого вещества (18 г, выход 72%). Твердое вещество было обработано щелочью с получением свободного основания (S)-1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламина (II-S) (оптическая чистота 99.7%).
Как описано выше, D-(-)-винная кислота была использована для разделения рацемического соединения II с получением другого оптического изомера (выход 75.2%). Эти оптические изомеры были обработаны щелочью с получением свободного основания (R)-1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламина (II-R) (оптическая чистота 99.4%).
В примерах 1, 3-6 и 8-11, была использована хиральная колонка для определения оптической чистоты оптических изомеров, и было показано, что оптическая чистота всех соединений была выше 99.0%. Использовали хиральную колонку ULTRON ES-OVM (150 мм × 4.6 мм), подвижная фаза 0.01 М KH2PO4/CH3OH (70:30), и мерили УФ = поглощение при 200 нм.
Пример 2: синтез of 2-(Вос-амино)-N-{1-[1-(4-хлорофенил)циклобутил]-3-метилбутил}-3-метилвалерамида
250 мг 1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламина (II) и 210 мг Вос-изолейцина (R в формуле - это Boc) растворили в безводном ТГФ (5 мл). 220 мг DCC растворили в 25 мл безводного ТГФ. Раствор DCC в ТГФ по каплям добавляли к реакционному раствору и затем перемешивали в течение ночи при комнатной температуре с получением белого осадка. Твердый осадок отфильтровывали и промывали, по меньшей мере, трижды безводным этиловым эфиром. Фильтрат и отработанный этиловый эфир собирали, выпаривали и очищали колоночной хроматографией с получением соединения 2-(Boc-амино)-N-{1-[1-(4-хлорофенил)циклобутил]-3-метилбутил}-3-метилвалерамида (формула I, где R - это Boc).
Молекулярный вес: 465.07 (C26H41ClN2O3).
Масс-спектрометрия (ESI) 465(М+).
Элементный анализ
Теоретические значения: С(%) 67.15; Н(%) 8.88; N(%) 6.02; Cl(%) 7.62
Измеренные значения: С(%) 67.05; Н(%) 8.76; N(%) 6.01; Cl(%) 7.55.
Пример 3: Синтез (2S,3S)-2-(Вос-амино)-N-{(S)-1-[1-(4-хлорофенил)циклобутил]-3-метилбутил}-3-метилвалерамида
По методу, аналогичному примеру 2, выделенный (S)-1-[1-(4-хлорофенил)циклобутил]-3-метилбутиламин (II-S) (250 мг) конденсировали с Boc-L-изолейцином (210 мг) с получением соединения (2S,3S)-2-(Вос-амино)-N-{(S)-1-[1-(4-хлорофенил)циклобутил]-3-метилбутил}-3-метилвалерамид.
Молекулярный вес: 465.07 (C26H41ClN2O3).
Масс-спектрометрия (ESI) 465(М+).
Формула такова:
Элементный анализ.
Теоретические значения: С (%) 67.15; Н (%) 8.88; N (%) 6.02; Cl (%) 7.62
Измеренные значения: С (%) 66.98; Н (%) 8.92; N (%) 6.15; Cl (%) 7.48.
Пример 4: Синтез (2S,3S)-2-(Вос-а