Азосоединения на основе 4-амино-2,3',4'-трицианодифенила
Иллюстрации
Показать всеИзобретение относится к области химии, конкретно к азосоединениям на основе 4-амино-2,3',4'-трицианодифенила общей формулы I, которые могут найти применение в синтезе фталоцианинов и их комплексов. В формуле I
R означает
8 пр.
Реферат
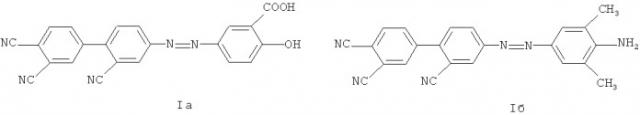
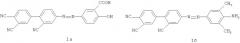
Изобретение относится к органической химии, конкретно к азосоединениям на основе 4-амино-2,3',4'-трицианодифенила общей формулы I:
где R= , , ,
,
которые могут использоваться в качестве промежуточных соединений в синтезе фталоцианинов и их комплексов, содержащих дополнительный к фталоцианиновому ядру хромофорный фрагмент.
Фталоцианины представляют большой интерес для многочисленных приложений в современных технологиях и областях техники благодаря их высокой стабильности и уникальным фотохимическим и электронным свойствам [Phthalocyanines: Properties and Applications, Eds. C.C.Leznoff, A.B.P.Lever, Vols.1-4, 1989-1996, VCH, N.Y.; P.Erk, H.Hengelsberg, in Porphyrin Handbook, Eds E.Kadish, K.M.Smith, R.Guilard, Academic Press, New York, 2003, 19, p.105; G.de la Torre, G.Bottari, U.Hahn, T.Torres, Struct. Bond. 2010, 135, 1]. Наибольшее значение имеет присутствие в электронных спектрах фталоцианинового хромофора поглощения на краях видимой области, а именно Q-полосы в области 650-670 нм и В-полосы при ~350 нм, и практически отсутствие поглощения в остальной части видимого спектра. С точки зрения расширения возможностей использования фталоцианинов как фотоактивных веществ, интерес представляют их структурные модификации, приводящие, во-первых, к красному сдвигу Q-полосы и обусловленные, например, периферийным увеличением протяженности π-электронной системы путем сопряжения фталоцианинового ядра с дополнительным хромофором, и, во-вторых, сопряжением не взаимодействующих с макрокольцом хромофорных систем (с использованием спейсеров либо пространственных помех для их взаимодействия). В последнем случае возможно появление дополнительного поглощения в промежуточной между Q- и В-полосами области 400-600 нм. Перспективными здесь являются наличие фрагмента азоарена, обеспечивающего поглощение в указанной области, и широкие возможности влияния на положение его максимума путем варьирования типа присутствующих в этом фрагменте заместителей.
Примеры фталоцианинов, содержащих арилазогруппы, немногочисленны. Таковыми являются тетра(арилазо)производные фталоцианина и их металлокомплексы, строительными блоками для которых являются азокрасители из 4-аминофталонитрила (диазосоставляющая) и N,N-диалкиланилины [Y-F.Li, S-L.Li, K.Jian Jiang, L.-M.Yang, Chem. Letters, 2004, 33, №11, 1450-1451; Y-F.Li, T-F.Jiao, M-H.Liu, L-M.Yang, J Dispersion Science and Technology, 2007, 28, №4, 603-605] или этиловый эфир пара-(диметиламино)бензойной кислоты (азосоставляющая) [Y.Liu, Н.Lin, X.Li, J.Li, H.Nan, Inorganic Chem. Comm., 2010, 13, 187-190]; бис-фталоцианины, в которых линкерами являются азогруппа [A.Yazici, D.Ates, O.Bekaroglu, N.Kobayashi, J.Porphyrins and Phthalocyanines 2006, 10, №9-10, 1140-1144] или фрагмент из трех азогрупп и двух разделяющих их ядер хиноксалина [Ü, Salan, N.Kobayashi, Ö.Bekaroglu, Tetrahedron Lett., 2009, 50, №49, 6775-6778].
В электронных спектрах поглощения упомянутых выше соединений, ядро фталоцианина в которых включено во фрагмент моноазокрасителя, помимо Q- и В-полос наблюдается поглощение, не имеющее четко выраженного максимума и, очевидно, по причине непосредственного сопряжения фталоцианинового ядра с азогруппой, охватывающее практически всю промежуточную область 400-600 нм, что делает неочевидной возможность его направленного использования. Наоборот, в спектре соединения, являющегося трисазокрасителем, поглощение в указанной области отсутствует, очевидно, из-за отсутствия заместителей в линкерном трисазофрагменте.
В свете сказанного можно было полагать, что спектральные характеристики фталоцианинов с арилазофрагментами будут улучшены путем разделения ядра фталоцианина и азогруппы фрагментом, не прерывающим единую систему сопряжения, например бензольным ядром, что должно способствовать красному смещению Q-полосы, и введением во фрагмент азокрасителя электронодонорного заместителя, обуславливающего наличие поглощения в области 400-600 нм.
Задачей заявляемого технического решения является создание новых соединений типа фталонитрилов, сочлененных с фрагментом азокрасителя, имеющего электронодонорный заместитель, которые могут быть использованы в качестве промежуточных соединений для синтеза фталоцианинов с улучшенными параметрами УФ-видимых спектров.
Поставленная задача решается азосоединениями общей формулы I, являющимися промежуточными соединениями для получения фталоцианинов, содержащих дополнительный хромофорный фрагмент, на основе 4-амино-2, 3',4'-трицианодифенила II. Нитрильная группа, находящаяся в орто-положении пара-аминофенильного радикала соединения II, создает определенные пространственные препятствия эффективному сопряжению азофрагмента с макрокольцом, превращая их в квазиавтономные системы, и предоставляет потенциальные возможности дальнейшей функционализации и структурной модификации синтезируемых из соединений I фталоцианинов.
Соединения I получают азосочетанием соли диазония III, образующейся в результате диазотирования аминодифенила II [Г.А.Селиванова, Е.В.Амосов, Л.И.Горюнов, С.В.Балина, В.Г.Васильев, Г.Е.Сальников, Е.А.Лукьянец, В.Д.Штейнгарц, ЖОрХ, 2011, 47, №8, 1222-1227], с азосоставляющими, содержащими гидрокси- или аминогруппу.
Диазотирование 4-амино-2,3',4'-трицианодифенила II проводят в серной кислоте при низкой температуре (-5°С) и далее осуществляют сочетание генерируемого гидросульфата диазония III с салициловой кислотой, 2,6-ксилидином, N,N-дибутиланилином, β-нафтолом и 3-окси-2-нафтойной кислотой при 0÷5°С, получая соответственно 2-гидрокси-5-((2,3',4'-трицианодифенил-4-ил)диазенил)бензойную кислоту Ia (60%), 4-((амино-3,5-диметилфенил)диазенил)дифенил-2,3',4'-трикарбонитрил Iб (62%), 4-((4-(дибутиламино)фенил)диазенил)дифенил-2,3',4'-трикарбонитрил Iв (73%), 4-(2-гидрокси-1-нафтил)диазенилдифенил-2,3',4'-трикарбонитрил Iг (62%) и 3-гидрокси-4-((2,3',4'-трицианодифенил-4-ил)диазенил)-2-нафтойную кислоту Iд (60%).
В ИК-спектрах соединений Iа-Iд присутствуют полосы, характерные для валентных колебаний соответствующих функциональных групп: 2233-2231 (C≡N), 1361-1506 (N=N), 3435-3467 (O-H) и 1627-1594 (C=O в СООН). В электронных спектрах соединений Iа, Iв-Iд присутствуют максимумы поглощения при 478-502 нм.
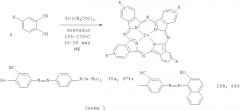
Применимость заявляемых соединений для синтеза фталоцианинов иллюстрируется получением цинковых комплексов тетра-4-(-(2-циано-4-(4-(дибутиламино)фенилдиазенил)фенил)фталоцианина IVa и тетра-4-(2-циано-4-(2-гидрокси-1-нафтилдиазенил)фенил)фталоцианина IVб по реакции нитрилов Iв и Iг с ацетатом цинка с выходами 67% и 84% соответственно (схема 1). В их электронном спектре наблюдается небольшой батохромный сдвиг полосы Q и появление интенсивной полосы в промежуточной между Q- и В-полосами области спектра, обусловленное поглощением квазиавтономного фрагмента тетра-4-[2-циано-4-(4-дибутиламинофенилдиазенил)фенил]фталоцианина.
Изобретение иллюстрируется следующими примерами.
Пример 1. Типовая методика приготовления раствора гидросульфата 2,3',4'-трицианодифенил-4-диазония III. К раствору амина II (0.020 г, 0.08 ммоль) в 50%-ной H2SO4 (1 мл), охлажденному до -5°С, при перемешивании приливают охлажденный раствор NaNO2 (0.007 г, 0.10 ммоль) в H2O (0.5 мл) и выдерживают 30 минут.
Пример 2. Получение 2-гидрокси-5-((2,3',4'-трицианодифенил-4-ил)диазенил)-бензойной кислоты Iа.
К охлажденному до -5°С раствору салициловой кислоты (0,056 г, 0,41 ммоль) в H2O (4 мл) попеременно добавляют порциями охлажденные растворы гидросульфата диазония III, раствор, приготовленный из амина II (0.100 г, 0.41 ммоль) в 50%-ной H2SO4 (4 мл) и NaNO2 (0.034 г, 0.49 ммоль) в H2O (3 мл), и NaOH (7.0 г) в Н2О (15 мл) для поддержания рН 7. Смесь перемешивают при 5°С в течение 3 ч, затем прекращают охлаждение и по достижении комнатной температуры приливают Н2О (10 мл). Из осадка, отделенного центрифугированием и высушенного в вакууме над P2O5, экстрагируют кипящим этанолом (8×15 мл). К охлажденному спиртовому экстракту добавляют гексан (15 мл), осадок отфильтровывают, промывают спиртом (10 мл), сушат в вакууме над P2O5 и получают 0.080 г кислоты 2-гидрокси-5-((2,3',4'-трицианодифенил-4-ил)диазенил)-бензойной кислоты (выход 60%), не плавящейся до 350°С. ИК-спектр, KBr, ν, см-1: 2231 (C≡N), 3419-3467 (ОН), 1486-1430 (N=N) 1627-1594 (C=O в СООН). Электронный спектр, KBr, λмакс, нм (относительная интенсивность): 205 (1.00), 285 (0.42), 381 (0.42).
Спектр ЯМР 1Н (400 МГц, ДМСО-d6, δ, м.д.): 6.77 д (Н, 3JHH 9.0 Гц), 7.87 д.д (Н, 3JHH 9.0. 4JHH 2.7 Гц), 7.89 д (Н, 3JHH 8.0 Гц), 8.19 д.д (Н. 3JHH 8.0, 4JHH 2.0 Гц), 8.24 д.д (Н, 3JHH 8.0, 4JHH 1.8 Гц), 8.33 д (Н, 3JHH 8.0 Гц), 8.34 д (Н, 4JHH 2.7 Гц), 8.35 д (Н,4JHH 2.0 Гц) 8.51 д (Н, 4JHH 1.8 Гц), 16.40 уш.с, 18.26 уш.с. ЯМР 13С (400 МГц, ДМСО-d6, δ, м.д.): 111.51, 114.61, 115.12, 115.54, 115.65, 117.43, 118.52, 119.03, 126.28, 126.91, 127.17, 127.33, 131.66, 134.13, 134.24, 140.67, 141.90, 142.46, 152.43, 170.20, 171.71, 192.12. ВЭЖХ-МС: Найдено М-Н+ 392.087. C22H10N5O3. Вычислено 392.079.
Пример 3. Получение 4-((амино-3,5-диметилфенил)диазенил)дифенил-2,3',4'-трикарбонитрила Iб.
К охлажденному до -5°С раствору 2,6-ксилидина (0,05 г, 0,20 ммоль) в H2O (1,5 мл) добавляют порциями охлажденный раствор гидросульфата диазония III, приготовленный по типовой методике. Смесь перемешивают 2 ч при 0÷5°С, затем прекращают охлаждение и по достижении комнатной температуры перемешивают 96 ч. Добавляют H2O (5 мл), осадок отделяют центрифугированием, промывают 30%-ным NaOH (6 мл), H2O (4×6 мл) до нейтральной реакции и сушат в вакууме над P2O5. Получают 0.050 г 4-((амино-3,5-диметилфенил)диазенил)дифенил-2,3',4'-трикарбонитрила (СОВ 95%). Выход 62%. Т.пл. 305-306°С. ИК-спектр, KBr, ν, см-1: 526, 840, 898, 1126, 1206, 1252, 1310, 1383, 1400, 1483, 1599, 1624, 2231 (C=N), 2853-3071, 3395, 3479, 3543. Электронный спектр, KBr, λмакс, нм (относительная интенсивность): 224 (0.82), 285 (0,65), 303 (0.66), 432 (1.00), 480 (0.92). Спектр ЯМР 1Н (300 МГц, ДМСО-d6, δ, м.д.): 2.18 уш.с (6Н, 2СН3), 5.86 уш.с (2Н, NH2), 7.55 уш.с (2Н), 7.85 д (Н, 3JHH 8.4 Гц), 8.11 д.д (Н, 3JHH 8.4, 4JHH 1.2 Гц), 8.22 уш.м (2Н), 8.32 д (Н, 3JHH 8.2 Гц), 8.48 д (Н, 4JHH 1.2 Гц). ЯМР 13С (400 МГц, ДМСО-d6, δ, м.д.): 17.71(2С), 111.26, 114.42, 115.00, 115.54, 115,64, 117.50, 120.58(2С), 120.61, 124.50, 126.12, 126.55, 131.57, 133.99(2С), 134.15, 140.02, 142.26, 142.38, 150.17, 152.37. ВЭЖХ-МС: Найдено М-Н+ 375.130. C23H15N6. Вычислено 375.136.
Пример 4. Получение 4-((4-(дибутиламино)фенил)диазенил)дифенил-2,3',4'-трикарбонитрила Iв.
К охлажденному до -5°С раствору соли III, приготовленному аналогично описанному выше в типовой методике из растворов амина II (0.05 г, 0.20 ммоль) в 50%-ной H2SO4 (3 мл) и NaNO2 (0.017 г, 0.24 ммоль) в H2O (2 мл), добавляют охлажденный раствор N,N-дибутиланилина (0.042 г, 0.20 ммоль) в Н2О (1 мл). Смесь перемешивают 4 ч при 0÷5°С, затем прекращают охлаждение и по достижении комнатной температуры перемешивают 16 ч. Добавляют Н2О (4 мл), осадок отделяют центрифугированием, промывают Н2О (5×8 мл) до нейтральной реакции и сушат в вакууме над P2O5. В объединенный раствор добавляют 30-ный NaOH до pH 3-4, осадок отделяют центрифугированием, сушат в вакууме над P2O5 Получают 0.069 г 4-((4-(дибутиламино)фенил)диазенил)дифенил-2,3',4'-трикарбонитрила (СОВ 98%), выход 73%. т.пл. 58-60°С. ИК-спектр, KBr, ν, см-1: 526, 827, 1137, 1244, 1309, 1361, 1394, 1556, 1599, 2231 (C≡N), 2868, 2929, 2956, 3435. Электронный спектр, KBr, λмакс, нм (относительная интенсивность): 210 (1.00), 294 (0.45), 494 (0.72). Спектр ЯМР 1Н (400 МГц, ДМСО-d6, δ, м.д.): Спектр ЯМР 1Н (400 МГц, ДМСО-d6, δ, м.д.): 0.93 т (6Н, 3JHH 7.4 Гц), 1.35 м (4Н), 1.56 м (4Н), 3.42 т (4Н, 3JHH 7.4 Гц), 6.82 д (2Н, 3JHH 9.2 Гц), 7.82 д (2Н, 3JHH 9.2 Гц), 7.87 д (Н, 3JHH 8.4 Гц), 8.13 д.д (Н, 3JHH 8.4, 4JHH 2.0 Гц), 8.24 д.д (Н, 3JHH 8.2, 4JHH 1.5 Гц), 8.28 д (Н, 3JHH 2.0 Гц), 8.35 д (Н, 3JHH 8.2 Гц), 8.51 д (Н, 4JHH 1.5 Гц). ЯМР 13С (400 МГц, ДМСО-d6, δ, м.д.): 13.86(2С), 19.61(2С), 29.08(2С), 50.12(2С), 111.31(2С), 111.45, 114.59, 115.17, 115.68, 115.77, 117.59, 126.04(2С). 126.18, 126.82, 131.72, 134.12, 134.19, 134.30, 140,19, 142.04, 142.38. 151.51, 152.51. ВЭЖХ-МС: Найдено М+Н+ 461.247. C29H29N6. Вычислено 461.245.
Пример 5. Получение 4-(2-гидрокси-1-нафтил)диазенилдифенил-2,3',4'-трикарбонитрила 1 г.
К охлажденному до -5°С раствору соли III, приготовленному аналогично описанному выше в типовой методике из растворов амина II (0.200 г, 0.82 ммоль) в 50%-ной H2SO4 (8 мл) и NaNO2 (0.070 г, 1.00 ммоль) в H2O (5 мл), добавляют порциями охлажденный раствор β-нафтола (0.118 г, 0.82 ммоль) и NaOH (0.180 г, 4.5 ммоль) в H2O (4 мл). Через 3 мин прекращают охлаждение и перемешивают смесь в течение 2 ч до достижения комнатной температуры, разбавляют H2O (60 мл) и добавляют 30%-ный раствор NaOH до рН 7. Осадок отделяют центрифугированием, сушат в вакууме над P2O5, перекристаллизовывают из этанола (20 мл) и получают 0.20 г 4-(2-гидрокси-1-нафтил)диазенилдифенил-2,3',4'-трикарбонитрила (выход 62%), т.пл. 308-309°С. ИК-спектр, KBr, ν, см-1: 505, 836, 1123, 1201, 1252, 1403, 1452, 1504 (N=N), 1601, 1620, 2233 (C≡N), 3437 (O-Н). Электронный спектр, KBr, λмакс, нм (относительная интенсивность): 213 (1.00), 321 (0.37), 410 (0.28), 490 (0,46), 530 (0.39). Спектр ЯМР 1Н (400 МГц, ДМСО-d6, δ, м.д.): 6.83 д (Н, 3JHH 9.5 Гц), 7.49 т.д (Н, 3JHH 7.5, 4JHH 1.0 Гц), 7.63 т.д (Н, 3JHH 7.5, 4JHH 1.0 Гц), 7.75 д (Н, 3JHH 7.5 Гц), 7.85 д (Н, 3JHH 8.5 Гц), 7.96 д (Н, 3JHH 9.5 Гц), 8.20 д.д (Н, 3JHH 8.0, 4Jн 1.5 Гц), 8.24 д.д, (Н, 3JHH 8.5, 4JHH 2.0 Гц), 8.30 д (Н, 3JHH 8.0 Гц), 8.45 д (Н, 4JHH 1.5 Гц), 8.46 д (Н, 4JHH 2.0 Гц), 8.56 д (Н, 3JHH 8.2 Гц), 15.50 уш.с. ЯМР 11С (400 МГц, ДМСО-d6, δ, м.д.): 111.7, 114.4, 115.1, 115.6, 115.7, 117.4, 122.1, 122.6, 122.8, 124.9, 126.9, 128.2, 128.2, 129.1, 129.6, 130.5, 131.8, 132.5, 134.0, 134.2, 137.9, 142.2, 142.4, 145.0, 174.1. Найдено М+ 399.1112. C25H13N5O. Вычислено 399.1115. Масс-спектр (EI), m/z. (Iотн., %): 399 (69) [M+], 271 (28), 244 (43), 171 (28), 143 (100), 115 (65), 28 (25).
Пример 6. Получение 3-гидрокси-4-((2,3',4'-трициандифенил-4-ил)диазенил)-2-нафтойной кислоты Iд. К охлажденному до -5°С раствору соли III, приготовленному аналогично описанному выше в типовой методике, добавляют порциями охлажденный раствор 3-окси-2-нафтойной кислоты (0.015 г, 0.08 ммоль) и NaOH (0.018 г, 0.45 ммоль) в H2O (1 мл). Твердый остаток после обработки, аналогичной описанной выше для соединения 1 г, перекристаллизовывают из этанола (8 мл) и получают 0.022 г 3-гидрокси-4-((2,3',4'-трициандифенил-4-ил)диазенил)-2-нафтойной кислоты (выход 60%), т.пл. 292-294°С. ИК-спектр, KBr, ν, см-1: 1506 (N=N), 2233 (C≡N), 3388-3500 (ОН). Электронный спектр, KBr, λмакс, нм (относительная интенсивность): 212 (1.00), 345 (0.46), 502 (0.35). Спектр ЯМР 1Н (400 МГц, ДМСО-d6, δ, м.д.): 7.32 т (Н, 3JHH 7.5 Гц), 7.57 т (Н, 3JHH 7.5 Гц), 7.90 д (2Н, 3JHH 7.0 Гц), 8.22 д.д (Н, 3JHH 7.0, 4JHH 2.0 Гц), 8.27 д.д, (Н, 3JHH 7.0, 4JHH 2.0 Гц), 8.36 д (Н, 4JHH 2.0 Гц), 8.36 д (Н, 3JHH 8.0 Гц), 8.52 с(Н), 8.54 д (Н, 4JHH 2.0 Гц), 8.98 д (Н, 3JHH 8.0 Гц). ЯМР 13С (300 МГц, ДМСО-d6, δ, м.д.): 111.43 (2С), 114.59, 115.22 (2С), 115.76, 115,87, 117.84,122.59, 123.27, 124.90, 126.25, 126.58, 129.83, 130.02, 131.64, 131.74, 134.24, 134.27, 134.38, 137.2, 140.04, 142.67, 154.00, 161.82, 169.58. ВЭЖХ-МС: Найдено М-Н+ 442.092. C26H12N5O3. Вычислено 442.095.
Пример 7. Получение тетра-4-[2-циано-4-(4-(дибутиламинофенилдиазенил)фенил]-фталоцианина цинка IVa. Кварцевую пробирку с крышкой-мембраной, содержащую смесь нитрила Iв (0.02 г, 0.043 ммоль), ацетата цинка (0.0066 г, 0.030 ммоль) и пентанола (0.5 мл), нагревают СВЧ-облучением в микроволновой печи (Discover SP, мощность облучения 200 Вт) до 155°С при перемешивании и выдерживают 20 минут. Испаряют пентанол, твердый остаток промывают серным эфиром (3×7 мл), этанолом (2×2 мл), H2O (6 мл) и сушат над P2O5. Получают 0.0142 г коричневых кристаллов тетра-4-[2-циано-4-(4-(дибутиламинофенилдиазенил)фенил]-фталоцианина цинка (67%). ИК-спектр, KBr, ν, см-1: 1513 (N=N), 2225 (C≡N). Электронный спектр, KBr, λмакс, нм (относительная интенсивность): 208 (1.00), 285 (0.55), 350 (0.45), 479 (0.73), 648 (0.27), 712 (0.47). MALDI-TOF: Найдено m/z M+ 1907.53. C116H112N24Zn. Вычислено 1907.70.
Пример 8. Получение тетра-4-[2-циано-4-(2-гидрокси-1-нафтил-диазенил)фенил]фталоцианина цинка IVб. Аналогично описанному в предыдущем опыте из смеси нитрила Iг (0.02 г, 0.050 ммоль), ацетата цинка (0.0066 г, 0.030 ммоль) и пентанола (0.5 мл) получают 0.0178 г коричневых кристаллов тетра-4-[2-циано-4-(2-гидрокси-1-нафтил-диазенил)фенил]фталоцианина цинка (84%). ИК-спектр, KBr, ν, см-1: 1504 (N=N), 2228 (C≡N), 3435 (O-H). Электронный спектр, KBr, λмакс, нм (относительная интенсивность): 211 (1.00), 340 (0.35), 393 (0.30), 499 (0.39), 653 (0.06), 717 (0.20). MALDI-TOF: Найдено m/z М+ 1660.23. C100H52N20O4Zn. Вычислено 1660.37.
Таким образом, заявляемые новые соединения формулы I могут быть использованы в синтезе новых фталоцианиновых комплексов с улучшенными спектральными характеристиками.
Азосоединения на основе 4-амино-2,3',4'-трицианодифенила общей формулы I где R=