Способ моделирования антиперистальтики кишечника
Иллюстрации
Показать всеСпособ относится к медицине, а именно к патологической физиологии, и может быть использован при изучении периферического механизма рвоты. Для моделирования антиперистальтики кишечника изолируют участок тонкой кишки у мелкого лабораторного животного. Затем вводят серотонина адипинат. Доза вводимого 1% раствора серотонина адипината составляет 0,7-1,5 мг. При этом указанную дозу вводят двумя путями, сначала часть дозы вводят в брыжейку дистального конца изолированного участка тонкой кишки, а затем оставшуюся часть - в его стенку. Способ, являясь простым и дешевым в исполнении, обеспечивает достоверность модели, при упрощении набора однородных групп, использовании меньшего числа лабораторных животных путем двойного пути введения моделирующей субстанции. 4 ил., 2 пр.
Реферат
Изобретение относится к медицине, а именно к экспериментальной медицине и патологической физиологии, и может быть использовано при изучении периферического гуморального механизма рвоты у мелких лабораторных животных (например, крысы).
Известно, что антиперистальтика является одним из элементов сложного, многокомпонентного акта рвоты. Участие серотонинергических структур ЦНС в реализации рвоты представляется в значительной степени изученным (Долженко А.Т., Налетов С.В. Фармакологические пути устранения рвоты как осложнения противоопухолевой химиотерапии // Вопр. онкологии. - 1992. - Т.38, №5. - С.527-533. Engel G., Richardson B.P., Donatsch P., Stadler P. A new class of drugs: 5-HT3 receptor antagonists // Triangle. - 1986. - Vol.25. - P.123-130). Имеются также единичные данные об исследовании периферических гуморальных механизмов, направленных на обеспечение рвотной реакции, и роли серотонинергических структур тонкого кишечника в акте рвоты.
В качестве прототипа способа моделирования антиперистальтики кишечника нами выбран способ того же назначения, предполагающий введение в брыжеечную артерию дистального конца изолированного участка подвздошной кишки крупного животного - собаки 5 мг серотонина адипината (Патент РФ на изобретение №2077076, 10.04.1997).
Недостатком известного способа является то, что он не позволяет изучать периферические гуморальные механизмы, направленные на обеспечение рвотной реакции, а также достоверно выявить роль серотонинергических структур тонкого кишечника в реализации рвоты у мелких лабораторных животных (крысы). Причиной этого является чрезвычайно малый диаметр брыжеечных сосудов у крысы, которые невозможно катетеризировать для введения серотонина адипината и моделирования антиперистальтики кишечника.
Между тем проведение экспериментов на животных регламентируется международным стандартом Надлежащей лабораторной практики (Good Laboratory Practice - GLP). В соответствии с GLP:
- животные должны иметь высокую степень генетической и микробиологической чистоты;
- условия их содержания должны соответствовать установленным требованиям.
С марта 2010 года в России также введены в действие Принципы надлежащей лабораторной практики (Национальный стандарт Российской Федерации ГОСТ Р 53434-2009), предусматривающие проведение всех доклинических, внеклинических и экспертных исследований в соответствии с международными стандартами GLP.
Выбор вида животного осуществляется исследователем. Говоря языком этих документов это выбор биологической тест-системы, который нужно обосновать в плане и отчете об исследовании. Естественно, этот вид животного должен быть как можно ближе к человеку по биологическим характеристикам. Генетически близки приматы и мини-свиньи. Однако они практически недоступны, но даже в отдельных лабораториях, где они используются, с ними работают на втором этапе доклинических исследований - после экспериментов на мышах и крысах.
Подавляющее же большинство исследований выполнены на мышах и крысах, то есть мелких лабораторных животных.
В монографии (под ред. Н.Н.Каркищенко, С.В.Грачева. - М.: Профиль, 2010. - 354 с.) приводится ссылка на книгу У.Рассела и Р.Берча «Принципы гуманной экспериментальной техники» (1959 г.), в которой обоснована концепция гуманного использования животных в экспериментах - «Концепция трех R», суть которой состоит в следующем:
1. Replacement - замена в опыте, когда это возможно, высокоорганизованных животных менее развитыми живыми объектами, альтернативными методами: экспериментами на культуре клеток и тканей, изолированными органами, физико-химическими и биохимическими системами, экспериментами на микроорганизмах и растительных объектах, компьютерными и математическими моделями.
2. Reduction - адекватность и стандартизация: это достижение воспроизводимых результатов с использованием минимального количества животных; адекватный выбор лабораторных животных; использование стандартных по микробиологическим, генетическим и экологическим параметрам животных. Одним из наиболее надежных путей снижения количества животных, используемых в экспериментах, является дальнейшее развитие и осуществление стандартизации лабораторных животных по генотипу, микрофлоре и экологическим параметрам. Благодаря уменьшению количества переменных факторов стандартизация может помочь в получении более надежных результатов на меньшем количестве животных.
3. Refinement - это улучшение условий содержания лабораторных животных и использования их в экспериментах, уменьшение дистресса животных во время экспериментов и применение обезболивающих средств, но не в ущерб цели эксперимента.
Стандартизацию крыс осуществить гораздо легче, чем стандартизацию собак. Они более плодовиты. Группу крыс, однородную по биологическим параметрам, набрать проще, чем группу собак. Кроме того, каждая крыса дешевле собаки, при этом крыс потребуется меньше, что делает исследования не только дешевле, но и гуманнее, а также упрощает статистическую обработку результатов.
Кроме того, по биоэтическим соображениям в последнее время крупные животные (собаки и приматы) обычно выводятся из острых опытов.
Таким образом, преимущества использования мелких лабораторных животных заключаются в следующем:
- удешевление исследований,
- возможность обойтись меньшим количеством лабораторных животных,
- упрощение обеспечения однородности экспериментальных групп,
- повышение статистической достоверности получаемых результатов,
- соблюдение принципов гуманного отношения к лабораторным животным, что актуально в настоящее время.
Задача изобретения - создание модели антиперистальтики кишечника у мелких лабораторных животных (крысы) для изучения периферических гуморальных механизмов, направленных на обеспечение рвотной реакции.
Технический результат заключается в удешевлении моделирования антиперистальтики у мелких лабораторных животных, обеспечении возможности соблюдения принципов гуманного отношения к животным, упрощении исследований при сохранении их достоверности за счет упрощения набора однородных групп, использования при этом меньшего числа лабораторных животных путем двойного пути введения моделирующей субстанции, а также профилактике осложнений, обусловленных таким введением (перфорация кишки), за счет ограничения объема серотонина адипината, вводимого в стенку кишки.
Созданная в результате использования предлагаемого способа модель может служить биологической тест-моделью для оценки лекарственных препаратов, способных корректировать антиперистальтику (или взаимодействовать с серотонинреактивными структурами), отвечающей современным требованиям российских и международных стандартов исследований.
Учитывая то обстоятельство, что у мелких лабораторных животных объем вводимого лекарственного вещества очень ограничен (это обусловлено небольшими размерами стенки кишки и ее брыжейки), для получения выраженной антиперистальтики нами предложено последовательное введение серотонина адипината и в брыжейку, и в стенку тонкой кишки.
У мелких лабораторных животных объем вводимого лекарственного вещества очень ограничен (это обусловлено небольшими размерами стенки кишки и ее брыжейки). Необходимую для получения желаемого эффекта (адекватной антиперистальтики) дозу серотонина адипината предложено вводить, используя «двойной путь введения»: в брыжейку и стенку тонкой кишки. В этом случае, как было установлено нами эмпирически, можно обеспечить необходимый объем вводимого препарата. Причем первоначально предложено вводить агент в брыжейку дистального конца изолированного отдела тонкой кишки, а после введения максимально возможного объема в брыжейку остальное количество препарата вводить в стенку кишки в области ее брыжеечного края.
Введение препарата по заявляемому способу позволяет создать необходимую локальную концентрацию препарата в стенке дистального конца изолированного участка тонкой кишки за счет разделения всей дозы вводимого препарата на два пути его введения.
Указанная последовательность введений позволяет ограничить объем серотонина адипината, вводимого в стенку кишки, и обеспечить тем самым профилактику осложнений, обусловленных таким введением (перфорация кишки).
Сущность изобретения заключается в следующем.
Для моделирования антиперистальтики кишечника изолируют участок тонкой кишки у лабораторного животного и вводят серотонина адипинат. Применялся 1% раствор в ампулах по 1 мл. При этом в качестве лабораторного животного используют мелкое лабораторное животное. Доза вводимого серотонина адипината составляет 0,7-1,5 мг. Введение препарата осуществляют последовательно: сначала в брыжейку, а затем в стенку дистального конца изолированного участка тонкой кишки.
В результате осуществления предлагаемого способа возникает антиперистальтика кишечника, что может быть подтверждено уменьшением расстояния между метками на изолированном участке кишки в области введения серотонина адипината, а на электромиограммах, полученных с помощью электроэнцефалографа RFT BIOSCRIPTBST - 1, последовательным изменением миоэлектрической активности участка тонкой кишки от дистального его конца к проксимальному. Регистрация низкочастотных биопотенциалов желудочно-кишечного тракта достигалась путем установки дополнительных фильтров с полосой пропускания частот в диапазоне от 0 до 0,2 Гц.
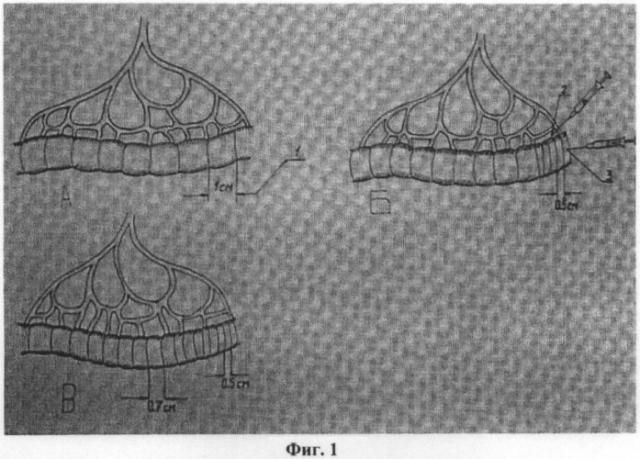
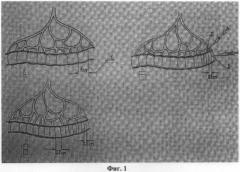
На фиг.1. представлен вид изолированного участка тонкой кишки: а) до введения серотонина адипината, где 1 - разметка равнозначных участков кишки длиной 1 см; б) в момент введения серотонина адипината, где 2 - введение серотонина адипината в брыжейку в области брыжеечного края проксимального конца изолированного участка тонкой кишки и 3 - введение серотонина адипината в стенку кишки; в) после введения серотонина адипината.
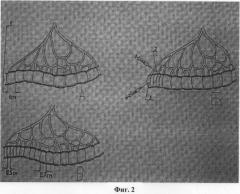
На фиг.2. изображен вид изолированного участка тонкой кишки: а) до введения серотонина адипината, где 1 - разметка равнозначных участков кишки длиной 1 см; б) в момент введения серотонина адипината, где 2 - в брыжейку в области брыжеечного края дистального конца изолированного участка тонкой кишки и 3 - введение серотонина адипината в брыжеечный край дистального конца изолированного участка тонкой кишки; в) после введения серотонина адипината.
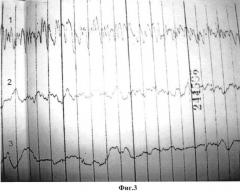
На фиг.3 представлены электромиограммы после введения серотонина адипината в брыжейку в области брыжеечного края проксимального конца изолированного участка тонкой кишки и в стенку кишки в области брыжеечного края проксимального конца изолированного участка тонкой кишки. Электроды (1, 2, 3) расположены последовательно, начиная от места введения лекарственного препарата.
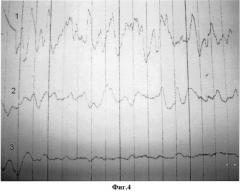
На фиг.4 представлены электромиограммы после введения серотонина адипината. Серотонина адипинат введен в брыжейку в области брыжеечного края дистального конца изолированного участка тонкой кишки и в стенку кишки в области брыжеечного края проксимального конца изолированного участка тонкой кишки. Электроды (1, 2, 3) расположены последовательно, начиная от места введения лекарственного препарата.
Способ осуществляется следующим образом.
Экспериментальному животному (крыса) под хлоралгидратным наркозом (300 мг/кг внутрибрюшинно) выполняют лапаротомию. Участок тонкой кишки длиной 40 см с двух сторон изолируют путем ее перевязки с последующим пересечением между лигатурами с каждой стороны. Затем размечают кишку на равнозначные участки длиной 1 см каждый, для лучшей визуализации перистальтической активности кишечника при внутрибрыжеечном и внутристеночном введении серотонина адипината. Последовательно на расстоянии 10 см друг от друга подшивают к кишке три электрода, соединенные с электроэнцефалографом RFT BIOSCRIPT BST - 1. Вводят 0,7-1,5 мг серотонина адипината. Указанную дозу вводят, используя два пути введения: брыжейку в области брыжеечного края дистального конца изолированного участка тонкой кишки и стенку кишки в области брыжеечного края дистального конца изолированного участка тонкой кишки. При этом сначала вводят препарат в брыжейку, а затем в стенку кишки.
Это сопровождается усилением перистальтической активности кишечника, уменьшением расстояния между метками на кишечнике на стороне введения серотонина адипината, а на электромиограммах, полученных с помощью электроэнцефалографа RFT BIOSCRIPT BST - 1, происходит последовательное изменение миоэлектрической активности участка тонкой кишки от дистального к проксимальному (Фиг.4).
Примеры конкретного выполнения.
Первое экспериментальное животное - крыса N1 - 180 г. Операция 25.03.11. Наркоз - хлоралгидрат - 300 мг/кг внутрибрюшинно. Регистрационный прибор - электроэнцефалограф RFT BIOSCRIPT BST - 1. Выполнили лапаротомию. Участок тонкой кишки длиной 40 см с двух сторон изолировали путем его перевязки лигатурами, с последующим отсечением. Произведена разметка кишки на равнозначные участки длиной 1 см каждый, для лучшей визуализации перистальтической активности кишечника при внутрибрыжеечном и внутристеночном введении серотонина адипината. Последовательно на расстоянии 10 см друг от друга подшиты к кишке три электрода, соединенные с электроэнцефалографом. Ввели 1 мг серотонина адипината. При этом в брыжейку в области брыжеечного края проксимального конца изолированного участка тонкой кишки ввели 0,6 мг серотонина адипината, а в стенку кишки области брыжеечного края проксимального конца изолированного участка тонкой кишки ввели 0,4 мг лекарственного препарата. Это сопровождалось усилением перистальтической активности кишечника, уменьшением расстояния между метками на кишечнике на стороне введения лекарственного препарата, а на электромиограммах происходило последовательное изменение миоэлектрической активности участка тонкой кишки от проксимального его конца к дистальному (фиг.3).
Второму экспериментальному животному (крыса N2 - 170 г) под хлоралгидратным наркозом (300 мг/кг внутрибрюшинно), выполнили лапаротомию. Участок тонкой кишки длиной 40 см с двух сторон изолировали путем ее перевязки лигатурами и отсечения. Произвели разметку кишки на равнозначные участки длиной 1 см каждый. Последовательно на расстоянии 10 см друг от друга подшили к кишке три электрода, соединенные с электроэнцефалографом. Ввели 1 мг серотонина адипината. При этом в брыжейку в области брыжеечного края дистального конца изолированного участка тонкой кишки ввели 0,6 мг серотонина адипината, а в стенку кишки области брыжеечного края дистального конца изолированного участка тонкой кишки ввели 0,4 мг лекарственного препарата. Это сопровождалось антиперистальтикой кишки, уменьшением расстояния между метками на кишечнике на стороне введения серотонина адипината, а на электромиограммах, происходило последовательное изменение миоэлектрической активности участка тонкой кишки от дистального ее конца к проксимальному (фиг.4).
Таким образом, изменение концентрации серотонина в дистальных отделах тонкого кишечника, а именно ее повышение, приводит к возникновению антиперистальтики. Предложенная нами модель антиперистальтики кишечника у мелких лабораторных животных (крысы) позволяет изучить периферические гуморальные механизмы, направленные на обеспечение рвотной реакции, и убедительно доказать участие серотонинергических структур желудочно-кишечного тракта в реализации рвоты.
Способ моделирования антиперистальтики кишечника, включающий изоляцию участка тонкой кишки у лабораторного животного и введение серотонина адипината, отличающийся тем, что в качестве лабораторного животного используют мелкое лабораторное животное, а доза 1%-ного раствора серотонина адипината составляет 0,7-1,5 мг, при этом указанную дозу вводят двумя путями, сначала часть дозы вводят в брыжейку дистального конца изолированного участка тонкой кишки, а затем оставшуюся часть - в его стенку.