Система доставки с контролируемым высвобождением для назального применения нейротрансмиттеров
Иллюстрации
Показать всеИзобретение относится к гелевой композиции для назального введения нейротрансмиттеров. Композиция включает, по меньшей мере, один нейротрансмиттер, например такой, как допамин; по меньшей мере, один липофильный или частично липофильный носитель и соединение или смесь соединений, обладающих активностью по снижению поверхностного натяжения, в количестве, эффективном для образования in situ эмульсии при контакте композиции с водой. Композиция обеспечивает высокие биоактивность и биодоступность нейротрансмиттера в плазме и головном мозге. 13 з.п. ф-лы, 2 ил., 2 табл, 1 пр.
Реферат
Область техники, к которой относится изобретение
Данное изобретение, в общем, относится к композиции с контролируемым высвобождением нейротрансмиттеров в большом круге кровообращения и/или в головном мозге после назального применения. Точнее, изобретение относится к доставке допамина к мозгу назальным введением.
Уровень техники
Растущее количество данных свидетельствует о модуляторной роли соединений, действующих на головной мозг, таких как нейростероиды (например, андрогены, прогестины) или нейротрансмиттеры (например, допамин, 3,4-дигидроксифенилаланин (L-DOPA)), в регулировании расстройств под влиянием рецепторов в головном мозге, таких как депрессия, болезнь Паркинсона, Альцгеймера или даже потеря либидо.
Нейростероиды действуют как модуляторы некоторых нейротрансмиттеров, либо в качестве стимуляторов, либо в качестве ингибиторов. Нейротрансмиттеры представляют собой химические вещества, которые переключают, повышают и модулируют электрические сигналы между нейроном и другой клеткой. Некоторые нейротрансмиттеры являются возбуждающими, другие в основном ингибирующими. Во многих случаях, как с допамином, имеется рецептор, который определяет, является ли трансмиттер возбуждающим или ингибирующим.
Головной мозг плавает примерно в 150 мл цереброспинальной жидкости (ЦСЖ), которая медленно циркулирует вниз через четыре желудочка, через субарахноидальное пространство и выходит в церебральные вены через арахноидальные ворсинки. Так как головной мозг не имеет лимфатической системы, ЦСЖ служит в качестве частичного заменителя. Хотя мозг и ЦСЖ отделены несколько проницаемой мягкой мозговой оболочкой, барьер гематоцереброспинальной жидкости и гематоэнцефалический барьер (ГЭБ) представляют существенную защиту против нежелательных для крови веществ.
ГЭБ создает защищенную от химических соединений окружающую среду для мозга, в которой некоторые молекулы могут выполнить функции, независимые от функций, которые те молекулы выполняют в остальной части организма. Это особенно важно, например, для нейротрансмиттера допамина, который при введении посредством инфузии показан при сердечных приступах или почечной недостаточности, но не подходит для лечения болезни Паркинсона, так как примененный данным способом введения (или перорально) не способен пересекать ГЭБ.
Для достижения эффективного лечения расстройств центральной нервной системы (ЦНС/CNS) была исследована назальная доставка. Происходит ли после назального применения поглощение молекул через гематоэнцефалический барьер или через непосредственный транспорт между назальной полостью и ЦСЖ или через оба пути, находится все еще на стадии обсуждения. В первом случае молекула должна проникать в ГЭБ из большого круга кровообращения после абсорбции из назальной слизистой оболочки. Так как существует также отток молекул из головного мозга, молекула может появиться в мозге или в крови в разные периоды времени с разной кинетикой или метаболизированная разными путями.
Назальная доставка лекарственного средства обеспечивает многие преимущества, которые включают по возможности прямой доступ в мозг, быструю адсорбцию благодаря обильному присутствию капиллярных сосудов в носу, быстрое начало действия, отмену первичного метаболизма в печени, длительное медикаментозное лечение и легкость введения. Также известно, что в противоположность большим и/или ионизированным молекулам липофильные фармацевтические соединения, имеющие достаточно низкую молекулярную массу, обычно легко абсорбируются слизистой мембраной носа.
Так как диффузия лекарственных средств в мозг, по-видимому, зависит главным образом от их физико-химических свойств, для большинства лекарственных средств, изученных к настоящему времени, общее количество, определенное в мозговой ткани, обычно составляет только 2-3% от назально введенной дозы. Таким образом имеется давно ощущаемая потребность в исследовании влияния композиций на данное поглощение, чтобы идентифицировать композиции, которые могут повышать доступность мозга.
Однако поддержание постоянными терапевтических концентраций лекарственного средства in vivo, особенно в мозге, в течение длительного периода времени является проблематичным. Быстрое выведение терапевтического средства от места введения с помощью реснитчатого эпителия и присутствие ферментов в назальной полости (которое может вызвать разложение терапевтического средства) приводит к короткому времени, относящемуся к доступной абсорбции. Кроме того, механизмы и предпосылки, управляющие непосредственной доставкой молекул в мозг, абсолютно неясны.
В данной области были предприняты многие усилия в попытках по преодолению этих ограничений. В GB 19877000012176 описывается применение биоклейких микросфер для увеличения времени пребывания в назальной полости. Также было установлено, что применение усилителей улучшает проницаемость назальной мембраны и стабилизаторы предотвращают разложение лекарственного средства. В PCT/GB98/01147 (U.S. Patent № 6432440) описывается применение in situ желатинирующих пектиновых композиций.
В документе Bayne, U.S. Reissue Patent № RE29892 раскрывается способ повышения концентрации допамина в ткани мозга путем введения композиции, содержащей допамин и гидразиновое производное. Раскрытый способ допускает введение композиции местным, ректальным, пероральным или парентеральным путем. Предпочтительные композиции включают гидразиновые производные, такие как L-α-гидразино-α-низший алкил-3,4-дигидроксифенилпропионовая кислота и L-dopa и их фармацевтически приемлемые соли.
В документе Haffner et al., U.S. Patent № 4826852 раскрывается способ введения эрголиниловых производных, чтобы увеличить концентрации допамина в ткани мозга млекопитающих. Особый интерес из работы Haffner представляет собой лечение психозов, таких как шизофрения.
Кроме того, Wenzel et al., U.S. Patent № 5624960 раскрывает лечение болезни Паркинсона посредством перорального введения композиции, содержащей композиции леводопа и карбидопа. Mandel et al., U.S. Patent № 6319905 раскрывает сильно модулированное образование L-DOPA в мозге млекопитающих посредством генной терапии. Модуляторы, такие как тетрагидроптерин (PH4), использованы, чтобы контролировать генерирование допамина.
Существует потребность в том, чтобы идентифицировать композицию, которая повышает доступность мозга к нейротрансмиттерам, особенно к допамину. Нейротрансмиттеры могут модулировать или контролировать регуляцию эмоциональности и сопутствующих психиатрических расстройств, таких как депрессия. Идентификация композиции, которая могла бы повышать биодоступность допамина в головном мозге, открыла бы возможности для лечения заболеваний, связанных с дефицитом допамина в головном мозге, таких как депрессия, болезнь Паркинсона, синдром дефицита внимания и гиперактивности (ADHD) или привыкание к наркотическим средствам или алкоголю наряду с прочими.
Сущность изобретения
Заявитель данного изобретения неожиданно установил, что включение различных нейротрансмиттеров в определенную липофильную или частично липофильную систему ведет к более высокой биодоступности, в основном вызываемой поддерживаемыми уровнями сыворотки в плазме и ЦСЖ.
Данное изобретение относится к композиции для назального применения, включающей: (a) по меньшей мере, один активный нейротрансмиттер; (b) по меньшей мере, один липофильный или частично липофильный носитель и (c) соединение или смесь соединений, обладающих активностью по снижению поверхностного натяжения, в количестве, эффективном для образования in situ эмульсии при контакте композиции с водой.
В одном аспекте изобретения активный ингредиент представляет собой нейротрансмиттер. Предпочтительно нейротрансмиттер является допамином. Предпочтительно, чтобы допамин был включен в композицию в количестве от 0,5 до 6 мас.%, предпочтительно от 2 до 4 мас.%, предпочтительнее от 0,5 до 2 мас.%, и наиболее предпочтительно около 2 мас.%.
Предпочтительно липофильный носитель содержит масло. Предпочтительнее масло представляет собой растительное масло. Наиболее предпочтительно масло представляет собой касторовое масло.
Предпочтительный вариант осуществления изобретения включает масло в количестве от 30 до 98 мас.%, предпочтительно от 60 до 98 мас.%, предпочтительнее от 75 до 95 мас.%, еще предпочтительнее от 85 до 95 мас.%, и наиболее предпочтительно около 90 мас.% от композиции.
Следующий вариант осуществления отличается тем, что компонент (c) содержит, по меньшей мере, одно поверхностно-активное вещество, выбираемое из группы, состоящей из лецитина, жирно-кислотного сложного эфира многоатомных спиртов, сорбитанов, полиоксиэтиленсорбитанов, полиоксиэтилена, сахарозы, полиглицерина, и/или, по меньшей мере, один увлажнитель, выбираемый из группы, состоящей из сорбита, глицерина, полиэтиленгликоля и жирно-кислотного сложного эфира макроголглицерина или их смесей. Предпочтительно, компонент (c) содержит олеоилмакроголглицерид или смесь олеоилмакроголглицеридов.
Компонент (c) содержится внутри композиции в количестве от 1 до 20 мас.%, предпочтительно от 1 до 10 мас.%, предпочтительнее от 1 до 5 мас.%, и наиболее предпочтительно около 4 мас.%.
Следующий вариант осуществления включает средство, регулирующее вязкость. Предпочтительно регулятор вязкости содержит загуститель или желатинирующее средство, выбираемое из группы, состоящей из целлюлозы и производных целлюлозы, полисахаридов, карбомеров, поливинилового спирта, повидона, коллоидного диоксида кремния, цетиловых спиртов, стеариновой кислоты, пчелиного воска, петролатума, триглицеридов и ланолина или их смесей. Предпочтительнее регулятор вязкости представляет собой коллоидный диоксид кремния.
Регулятор вязкости содержится внутри композиции в количестве от 0,5 до 10 мас.%, предпочтительно от 0,5 до 5 мас.%, предпочтительнее от 1 до 3 мас.%, и наиболее предпочтительно около 3 мас.%.
Не желая быть связанными с теорией, полагают, что назальное введение галеновой композиции по изобретению может способствовать тому, чтобы ускорять селективные действия молекулы, которая, в свою очередь, может обеспечить новые клинические применения. Предполагают, что данный эффект является результатом проникновения в мозг, что возможно благодаря галеновой гелевой композиции по изобретению. Введение галеновой гелевой композиции по изобретению через нос приводит к неожиданному и отличающемуся действию соединений на мозг по сравнению с тем, которое наблюдают с обычными композициями.
Краткое описание чертежей
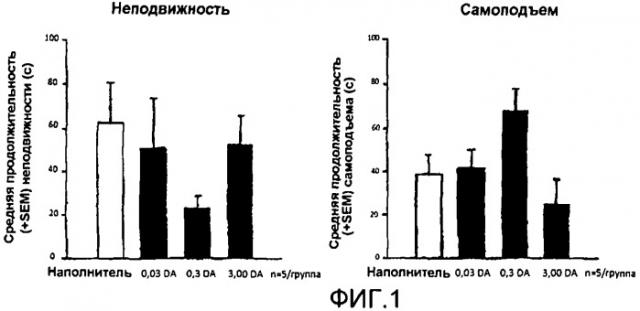
На Фиг.1 показан эффект геля допамина для назального применения на неподвижность и самоподъем крыс с депрессией.
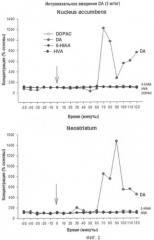
На Фиг.2 показана концентрация допамина и метаболитов в nucleus accumbens и neostriatum после назального введения допамина.
Подробное описание изобретения
Галеновая гелевая композиция данного изобретения является химически и физически устойчивой и может иметь форму суспензии или раствора фармакологически активного вещества. Предпочтительно, галеновая гелевая композиция по изобретению помещается в устройство, не содержащее консерванты и способное точно доставлять дозы указанной композиции даже при более высоких вязкостях.
После назального введения галеновой гелевой композиции по изобретению активный ингредиент или частицы активного ингредиента эффективно улавливаются в месте отложения и абсорбируются с предсказуемой скоростью вдоль слизистой мембраны пациента, тем самым ограничивая возможную деактивацию метаболизирующими ферментами и/или белковым связыванием.
Будет также ясно, что термины и выражения, применяемые в настоящем описании, имеют обычное значение, которое согласуется с такими терминами и выражениями, относящимися к их соответствующим связанным областям обследования и изучения, кроме случаев, где определенные значения были представлены в настоящем описании иным образом.
Термин "более высокая доступность" будет обозначать, что после применения нейротрансмиттера значительные и постоянные терапевтические концентрации лекарственного средства in vivo, особенно в мозге, поддерживаются в течение длительного периода времени.
A. Нейротрансмиттеры
Композиция по изобретению содержит нейротрансмиттер. По определению нейротрансмиттер вызывает быстрый коротко живущий и резкий ответ. Нейротрансмиттеры имеют тенденцию быстро распадаться, приводя к восстановлению мембранного потенциала покоя. Общим для многих трансмиттеров является наличие группировки катехина.
Нейротрансмиттеры, такие как эпинефрины и допамин, содержат группировку катехина, обычно синтезируемую из аминокислоты триозин.
Один нейротрансмиттер, обычно ассоциированный с любым показателем ответов, представляет собой допамин или 4-(2-аминоэтил)-1,2-бензолдиол. Допамин обычно рассматривают как эндогенный катехоламин с α и β эндренергической активностью.
Допамин или L-DOPA обычно синтезируют из аминотирамина.
Другие нейротрансмиттеры обычно определяются синаптическими везикулами на концах пресинаптического нейрона и содержат агент, высвобождающий его в соответствующее время в ответ на стимуляцию в достаточном количестве, чтобы вызывать ответ в постсинаптической клетке; ионофорез агента в синаптической щели вызывает такой же эффект; и данное вещество деградирует быстро, приводя к восстановлению потенциала.
Другие катехоламины, известные для различных применений, включают эпинефрин, норэпинефрин, серотонин.
Лекарственное средство, такое как нейротрансмиттер, содержится внутри композиции в количестве от 0,2 до 6 мас.%, предпочтительно от 0,2 до 4 мас.%, предпочтительнее от 0,2 до 2 мас.% и наиболее предпочтительно около 2 мас.%.
B. Липофильный носитель
Носитель по изобретению существует, чтобы эмульгировать или иным образом поддерживать различные компоненты изобретения. Для этой цели носитель имеет липофильную природу или свойства. Подходящие семейства масел включают жирные кислоты и масла, такие как минеральные и растительные масла. В частности, особенно применимы жирные кислоты и масла, полученные из растительной биомассы. Возможно применение как линейных, так и разветвленных цепочечных кислот и масел, включая такие масла и кислоты с разными уровнями насыщения и замещения. Размер цепей, включая муравьиную, уксусную, пропионовую, масляную, валериановую, капроновую, энантовую, каприловую, лауриновую, миристиновую, пальмитиновую и стеариновую, среди прочих, все представляют применимые группировки масел и кислот.
Термин "липофильный носитель" будет включать, но без ограничения только ими, растительное масло, такое как касторовое масло, соевое масло, кунжутное масло или арахисовое масло, сложные эфиры жирных кислот, такие как этил- и олеилолеат, изопропилмиристат, триглицериды со средней длиной цепи, глицериновые сложные эфиры жирных кислот или полиэтиленгликоль, фосфолипиды, белый мягкий парафин или гидрированное касторовое масло, или их смесь. В одном аспекте активный ингредиент может быть также включен в смесь масел. В предпочтительном аспекте растительное масло представляет собой касторовое масло.
Данное количество липофильного носителя, которое составляет эффективное количество, зависит от конкретного регулятора вязкости, используемого в композиции. Поэтому неудобно пересчитывать определенные количества для применения с определенными композициями по изобретению. Большей частью, однако, липофильный носитель присутствует в композиции в количестве от 30 до 98 мас.%, предпочтительно от 60 до 98 мас.%, предпочтительнее от 75 до 95 мас.%, еще предпочтительнее от 85 до 95 мас.% и наиболее предпочтительно около 90 мас.% от композиции.
C. Поверхностно-активное вещество
Поверхностно-активное вещество, или сурфактант, по изобретению существует, чтобы снижать поверхностное натяжение в композиции по изобретению. Сурфактанты обычно являются соединениями, которые обладают и гидрофильной, и липофильной природой. Липофильная природа сурфактанта имеет тенденцию принимать форму свисающих групп, имеющих малый заряд, или вообще без заряда. В свою очередь, гиброфильная природа сурфактанта имеет тенденцию быть заряженной и также определяет класс, в который попадает сурфактант. Например, сурфактанты, применимые в данном изобретении, включают неионогенные сурфактанты, анионогенные сурфактанты, амфотерные сурфактанты и катионогенные сурфактанты.
Компонент (c), соединение или смесь соединений, обладающие активностью по снижению поверхностного натяжения, содержит, по меньшей мере, сурфактант, такой как, но без ограничения только им, лецитин, жирно-кислотный сложный эфир многоатомных спиртов, жирно-кислотный сложный эфир сорбитанов, жирно-кислотный сложный эфир полиоксиэтиленсорбитанов, жирно-кислотный сложный эфир полиоксиэтилена, жирно-кислотный сложный эфир сахарозы, жирно-кислотный сложный эфир полиглицерина, и/или, по меньшей мере, один увлажнитель, такой как сорбит, глицерин, полиэтиленгликоль или жирно-кислотный сложный эфир макроголглицерина. Особенно применимыми, однако, являются олеоилмакроголглицериды (такие, как LABRAFIL®M 1944 CS, доступный от фирмы Gattefosse (Saint-Priest, Франция)).
В другом аспекте активный ингредиент может быть включен в смесь сурфактантов. Данное количество липофильного сурфактанта, которое является эффективным количеством, зависит от конкретного масла или смеси масел, используемых в композиции. Поэтому неудобно пересчитывать определенные количества для применения с определенными композициями по изобретению. Большей частью, однако, сурфактант присутствует в композиции в количестве от 1 до 20 мас.%, предпочтительно от 1 до 10 мас.%, предпочтительнее от 1 до 5 мас.% и наиболее предпочтительно около 4 мас.%.
D. Регулятор вязкости
Термин "регулятор вязкости" будет обозначать загуститель или желатинирующее средство. Примеры без ограничения представляют собой целлюлозу и ее производные, полисахариды, карбомеры, поливиниловый спирт, повидон, коллоидный диоксид кремния, цетиловые спирты, стеариновую кислоту, пчелиный воск, петролатум, триглицериды, ланолин или тому подобное. Предпочтительный регулятор вязкости представляет собой коллоидный диоксид кремния (такой, как ACROSIL 200®, который доступен от фирмы Degussa).
Также возможно включение активного ингредиента в смесь загустителей или желатинирующих средств. Данное количество загустителя/желатинирующего средства, которое составляет эффективное количество, зависит от конкретного масла или смеси масел, используемых в композиции. Поэтому неудобно пересчитывать определенные количества для применения с определенными композициями по изобретению. Большей частью, однако, загуститель/желатинирующее средство(а) присутствует в композиции в количестве от 0,5 до 10 мас.%, предпочтительно от 0,5 до 5 мас.%, предпочтительнее от 1 до 3 мас.% и наиболее предпочтительно около 3 мас.%.
| Таблица 1 | |||
| Компоненты мас.% | |||
| Применимый | Предпочтительный | Более предпочтительный | |
| Нейротрансмиттер | от 0,5 до 6 | от 2 до 4 | от 0,5 до 2 |
| Липофильный носитель | от 30 до 98 | от 60 до 98 | от 85 до 95 |
| Сурфактант | от 1 до 20 | от 1 до 10 | от 1 до 5 |
| Регулятор вязкости | от 0,5 до 10 | от 0,5 до 5 | от 1 до 3 |
Композиция
Большей частью галеновая композиция по изобретению может быть приготовлена очень легко следующим обычным способом.
Липофильный носитель и эмульгатор помещают в сосуд с мешалкой, данную массу смешивают в нем с примерно 75% регулятора вязкости. Активный ингредиент добавляют при перемешивании для получения гомогенной дисперсии активного ингредиента. Затем композицию доводят до необходимой вязкости с помощью остатка регулятора вязкости.
Композицией предпочтительно заполняют контейнер без консерванта.
Так как нейротрансмиттеры могут иметь более низкие уровни растворимости в воде, высвобождение из композиции представляет собой стадию с ограниченной скоростью абсорбции. Было неожиданно установлено, что включение активного агента в масляную композицию, содержащую подходящий сурфактант согласно данному изобретению, приводит к физиологическим уровням в сыворотке и к постоянному пролонгированному действию гормона по прошествии длительного времени.
Высвобождение нейротрансмиттера поддерживается благодаря его растворимости в маслянистом носителе, так как композиция остается на слизистой мембране в течение пролонгированного периода времени из-за ее вязкости.
При контакте композиции с влагой слизистой мембраны осаждение активного ингредиента блокируется способностью сурфактанта образовывать масляные капли, содержащие активный ингредиент. Таким образом, при добавлении подходящего сурфактанта к композиции образец для растворения активного ингредиента становится более податливым и эффективным, так как нет большой разницы в растворении и это обеспечивает биоэквивалентность.
Активный ингредиент по изобретению может быть введен в композицию также в обработанном виде, например, как микросферы, липосомы, среди прочих.
Композиция согласно данному изобретению может быть также получена в порошковой форме, а именно лиофилизацией или распылительной сушкой.
| Таблица 2 | ||
| Наиболее предпочтительная композиция | ||
| Соединение | Количество на контейнер | Доставка на спрэй |
| Допамин | 2% | ≈2,8 мг |
| Коллоидный диоксид кремния | 3% | ≈4,2 мг |
| Олеоилмакроголглицериды | 4% | ≈5,6 мг |
| Касторовое масло | 91% | ≈127,4 мг |
Примеры
Следующие примеры предназначены для того, чтобы иллюстрировать, но не ограничивать варианты осуществления в соответствии с данным изобретением.
Пример 1: Назальное введение допамина крысам
Гель допамина (DA) патентоспособной композиции вводили назальным путем крысам, используемым в контролируемом "тесте усиленного плавания" ("forced swimming test"). Как показано на фиг.1, введение допамина приводит к эффектам, подобным антидепрессивным. Как показано на фиг.2, сильная допаминергическая активность в neostriatum и ventral striatum (nucleus accumbens) наблюдалась после назального применения допамина с патентоспособной композицией.
Обычно антидепрессанты должны расходоваться в течение более долгого времени, прежде чем будут видны антидепрессивные эффекты. Неожиданно после назального применения гелевой композиции допамина на крысах антидепрессивные эффекты имели место в пределах часов и без каких-либо побочных эффектов, а именно тех побочных эффектов, которые, как известно, происходят при действии дезипрамина (апатия) или флуоксетина (потеря массы).
После назального применения допамина в патентоспособной гелевой композиции по изобретению на крысах неожиданно было установлено, что концентрация допамина в nucleus accumbens и уровень neostriatum повышается очень быстро на более чем 1000 процентов. Данные результаты отличаются от результатов, описанных ранее. После назального применения водного раствора допамина на мышах Bjorn Jansson, Comprehensive Summaries of Uppsala Dissertations from the Faculty of Pharmacy 305 (2004) выявил допамин в обонятельной луковице, но соединение достигло максимума спустя четыре часа. После назального применения водного раствора допамина на мышах Maria Dahlin, Comprehensive Summaries of Uppsala Dissertations from the Faculty of Pharmacy 240 (2000), выявила допамин в цереброспинальной жидкости (ЦСЖ) спустя короткий период времени, но повышение соединения от предельно допустимого содержания в организме является намного меньшим, чем с назальным гелем по изобретению. Ikeda et al., Chem Pharm. Bull. 40(8): 2155-2158 (1992), увеличили биодоступность назально введенного допамина до некоторой степени, применяя эксципиенты гидроксипропилцеллюлозу (HPC) и азон (1-додецилазациклогептан-2-он) соответственно. De Souza Silva et al., Synapse 27: 294-302 (1997), показали, что при назальном применении водного раствора L-DOPA метилового сложного эфира на крысах (50 мг/кг) уровень допамина в neostriatum мог быть повышенным на примерно 130%. Метаболиты, 3,4-дигидроксифенилуксусная кислота (DOPAC) и гомованилиновая кислота (HVA) слабо повышались в контрасте с тем, что наблюдалось после ip применения L-DOPA метилового сложного эфира в публикации De Souza Silva et al., J. Neurochem. 68(1): 233-239 (1997).
Кроме того, метаболизм допамина оказывается достаточно отличным от метаболизма, описанного ранее. Очень неожиданно, как показано на фиг.2, допамин в церебральной спинальной жидкости (ЦСЖ) не метаболизируется до 3,4-дигидроксифенилуксусной кислоты (DOPAC) или гомованилиновой кислоты (HVA), как обычно наблюдается. Данные результаты показывают, что назальное применение допамина в заявленной гелевой композиции может, следовательно, применяться для лечения заболеваний, связанных с недостаточностью допамина в головном мозге, таких как болезнь Паркинсона, расстройство дефицита внимания и гиперактивности (ADHD) или привыкание к наркотическим средствам или хронический алкоголизм.
Свойства, раскрываемые в представленном выше описании, в формуле изобретения и/или в чертежах как по отдельности, так и в любой их комбинации, являются материалом для реализации данного изобретения в разнообразных его формах.
1. Гелевая композиция для назального применения, включающая: (a) по меньшей мере, один нейротрансмиттер; (b) по меньшей мере, один липофильный или частично липофильный носитель; и (c) соединение или смесь соединений, обладающих активностью по снижению поверхностного натяжения, в количестве, эффективном для образования in situ эмульсии при контакте композиции с водой.
2. Композиция по п.1, в которой липофильный носитель содержит масло.
3. Композиция по п.2, в которой масло представляет собой растительное масло.
4. Композиция по п.2 и 3, в которой масло представляет собой касторовое масло.
5. Композиция по п.2, в которой количество масла включает от 30% до 98 мас.%, предпочтительно от 60% до 98 мас.%, предпочтительнее от 75% до 95 мас.%, еще предпочтительнее от 85% до 95 мас.% и наиболее предпочтительно около 90 мас.% от композиции.
6. Композиция по п.1, в которой компонент (c) содержит, по меньшей мере, одно поверхностно-активное вещество, выбранное из группы, состоящей из лецитина, жирно-кислотного сложного эфира многоатомных спиртов, сорбитанов, полиоксиэтиленсорбитанов, полиоксиэтилена, сахарозы, полиглицерина, и/или, по меньшей мере, один увлажнитель, выбранный из группы, состоящей из сорбита, глицерина, полиэтиленгликоля и жирно-кислотного сложного эфира макроголглицерина или их смесей.
7. Композиция по п.6, в которой компонент (c) содержит олеоилмакроголглицерид или смесь олеоилмакроголглицеридов.
8. Композиция по п.6, в которой компонент (c) содержится внутри композиции в количестве от 1 до 20 мас.%, предпочтительно от 1 до 10 мас.%, предпочтительнее от 1 до 5 мас.%, и наиболее предпочтительно около 4 мас.%.
9. Композиция по п.1, дополнительно содержащая регулятор вязкости.
10. Композиция по п.9, в которой указанный регулятор вязкости содержит загуститель или желатинирующее средство, выбираемое из группы, состоящей из целлюлозы и производных целлюлозы, полисахаридов, карбомеров, поливинилового спирта, повидона, коллоидного диоксида кремния, цетиловых спиртов, стеариновой кислоты, пчелиного воска, петролатума, триглицеридов и ланолина, или их смесей.
11. Композиция по п.10, в которой регулятор вязкости представляет собой коллоидный диоксид кремния.
12. Композиция по п.9, в которой регулятор вязкости содержится внутри композиции в количестве от 0,5 до 10 мас.%, предпочтительно от 0,5 до 5 мас.%, предпочтительнее от 1 до 3 мас.%, и наиболее предпочтительно около 3 мас.%.
13. Композиция по п.1, в которой нейротрансмиттер представляет собой допамин.
14. Композиция по п.1, в которой нейротрансмиттер содержится внутри композиции в количестве от 0,2 до 6 мас.%, предпочтительно от 0,2 до 4 мас.%, предпочтительнее от 0,2 до 2 мас.%, и наиболее предпочтительно около 2 мас.%.