Способ стимуляции регенерации тканей
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для стимуляции роста или регенерации тканей. Для этого проводят контактирование указанной ткани с активатором сигнального пути простагландина и активатором пути wnt. Активатор сигнального пути простагландина выбран из группы, состоящей из простагландина Е2 (PGE2), простагландина 12 (PG12), 16-фенилтетранор РGЕ2, 16,16-диметил PGE2, 19(R)-гидрокси-РGЕ2, 16,16-диметил РGЕ2 п-(п-ацетамидобензамидо)фенилового эфира, О-дезокси-9-метилен-16,16-диметил PGE2, сложного метилового эфира PGE2, бутрапроста, 15(S)-15-метил PGE2, 15(R)-15-метил PGE2, 20-гидрокси РGЕ2, 11-дезокси-16,16-диметил PGE2, 9-дезокси-9-метилен PGE2, РGЕ2 сериноламида и сулпростона. Активатор пути wnt выбран из группы, состоящей из 6-броминдирубин-3'-оксима (BIO), LiCl и растворимого полипептида Wnt8. Также предложена фармацевтическая композиция для стимуляции роста/регенерации ткани у субъекта. Группа изобретений обеспечивает синергетически увеличенный рост и регенерацию тканей за счет использования комбинации активатора сигнального пути простагландина и активатора пути wnt. 4 н. и 7 з.п. ф-лы, 12 ил., 2 пр.
Реферат
ГОСУДАРСТВЕННАЯ ПОДДЕРЖКА
Изобретение выполнено при частичной поддержке гранта NIH No. CA103846-02 Национального Института Здоровья. Правительство Соединенных Штатов обладает определенными правами на настоящее изобретение.
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительным заявкам на патент США № 60/853351, озаглавленной «Способ модуляции роста стволовых клеток крови», поданной 20 октября 2007 г., и № 60/853202, озаглавленной «Способ стимуляции регенерации тканей», поданной 20 октября 2007 г., а также испрашивается приоритет перед заявкой на международный патент WO 2007/112084 A2, озаглавленной «Способ модуляции роста стволовых клеток крови», поданной 26 апреля 2007 г. Все заявки поданы Леонардом И. Зоном, Тристой Е. Норт и Вольфрамом Гесслингом, полностью включены в настоящую заявку в виде ссылок.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение связано с модуляторами, стимулирующими или ингибирующими развитие или регенерацию тканей in vitro, in vivo и ex vivo. В частности, например, модуляторы, взаимодействующие с сигнальными путями простагландина или wnt, могут использоваться для стимуляции регенерационного ответа тканей в таких органах, как печень, стволовые клетки крови, кожа, сосуды и другие органы, способные к регенерации.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Регенеративная медицина обладает исключительным потенциалом для развития способов лечения, способных изменить будущее пациентов, утративших органы в результате несчастного случая, дефекта или заболевания. Понимание сигнальных путей, связанных с развитием, может оказаться ключом не только к регенерации тканей, но и к ингибированию рака.
Например, в процессе развития ткани печени из разных участков недифференцированного слоя зародышевой энтодермы формируются печень, кишечник, поджелудочная железа и вспомогательные органы благодаря действию различных сигнальных путей. Пластичность энтодермальных предшественников на ранних стадиях развития, а также механизмы, регулирующие судьбу клеток энтодермы и последующий рост органов, полностью не исследованы. Печень сохраняет способность к заживлению и регенерации и во взрослом организме, и, таким образом, исследование сигнальных путей, регулирующих развитие печени, может прояснить механизмы гомеостаза и регенерации тканей. Поскольку ступенчатая прогрессия заболевания включает реакцию базовых клеточных программ пролиферации и дифференцировки, углубленное понимание тканевого органогенеза может привести к обнаружению мишеней для фармацевтического вмешательства, воздействие на которые приведет к ингибированию канцерогенеза или, напротив, к усилению регенерации тканей.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Композиции и способы согласно настоящему изобретению связаны с модуляторами тканевого роста, представляющими собой агенты, стимулирующие рост и развитие тканей либо ингибирующие развитие тканей сообразно конкретным показаниям. Эти модуляторы действуют путем стимуляции или подавления сигнальных путей, играющих важную роль в росте или регенерации.
Например, воздействие на сигнал wnt может привести к стимуляции регенерации тканей, в особенности регенерации печени, репопуляции крови, роста сосудов и заживления ран. Активаторы сигнального пути wnt могут использоваться для стимуляции этих процессов во время развития и регенерации, такой модулятор может представлять собой синтетический или растворимый лиганд wnt, ингибитор деградации β-катенина или ко-активатор транскрипции.
Сигнальный путь простагландина взаимодействует с сигнальным путем wnt и, таким образом, может использоваться для изменения активности wnt c целью воздействия на развитие и регенерацию тканей. Модулятор согласно изобретению может представлять собой вещество, воздействующее на сигнал простагландина или его низлежащих эффекторов, и может использоваться для модификации сигнала wnt во время развития органов и регенерации. Например, можно напрямую воздействовать на низлежащие эффекторы активации простагландинового рецептора, такие как цикло-АМФ, PIЗ-киназа и протеинкиназа А, с целью воздействия на сигнальный путь wnt.
Модуляторы простагландинового сигнального пути также могут использоваться в качестве механизма регуляции активности wnt, что дает возможность «тонкой настройки» сигналов роста и регенерации. Например, усиление сигнала wnt может стимулировать рост тканей, и для ослабления или прекращения этого эффекта по достижению желаемого результата может использоваться индометацин.
Кроме того, модуляторы сигнальных путей простагландина и wnt могут использоваться совместно для повышения/стимуляции тотальной активности wnt, что позволяет избежать токсических эффектов высоких доз или повторного дозирования вещества/способа, необходимых для прямой активации сигнального пути wnt. Настоящее изобретение подтвердило каждое из этих положений как для эмбрионов рыб, так и для взрослых рыб, а также для взрослых млекопитающих.
Модуляторы сигнальных путей wnt или простагландина могут использоваться для стимуляции регенерации печени после токсического повреждения, такого как отравление ацетаминофеном, после хирургической резекции опухолей или болезненной ткани печени, или после резекции части здоровой печени донора для трансплантации органа. Эти модуляторы могут вводиться системно или путем прямого введения в печень, такого как инфузия в воротную вену. Далее модификаторы простагландина могут использоваться ex vivo и in vitro для стимуляции роста стволовых клеток печени и гепатоцитов в культуре при подготовке трансплантатов гепатоцитов или аппаратов «искусственная печень» для пациентов с фульминантной печеночной недостаточностью.
Далее модуляция сигнала wnt напрямую или с помощью воздействия на сигнальный путь простагландина может использоваться в других тканях для стимуляции заживления и регенерации органов, в особенности для роста и гомеостаза стволовых клеток крови, заживления ран, роста и регенерации сосудов, а также заживления и регенерации других органов, таких как сердце и нервная система.
В общем случае вещества согласно изобретению могут вводиться в организм пациента системно, направленно в конкретный орган или ex vivo в клетки или ткань органа.
Воздействие на сигнальный путь простагландина может осуществляться фармацевтическим способом, таким как направленное применение активаторов или ингибиторов различных компонентов сигнального пути простагландина. В качестве альтернативы может применяться генная терапия требуемого органа с помощью вирусов или других способов с целью регуляции сигнального пути простагландина.
В одном воплощении предоставляется способ стимуляции роста тканей в организме субъекта, включающий введение как минимум одного модулятора и фармацевтически приемлемого носителя.
Например, модуляторы, стимулирующие развитие тканей и гомеостаз тканей во взрослом организме, включают диметилпростагландин-Е2 (dmPGE2) и агенты, стимулирующие сигнальный путь PGE2.
В другом воплощении модулятор развития тканей стимулирует рост путем воздействия на сигнальный путь Wnt. Модуляторы, стимулирующие рост тканей, например регенерацию печени, восстановление стволовых клеток крови, заживление ран или восстановление тканей других органов путем прямого воздействия на сигнальный путь wnt, включают, например, BIO, или LiCl, или другие вещества, воздействующие на сигнальный путь wnt на любом уровне сигнального каскада wnt.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
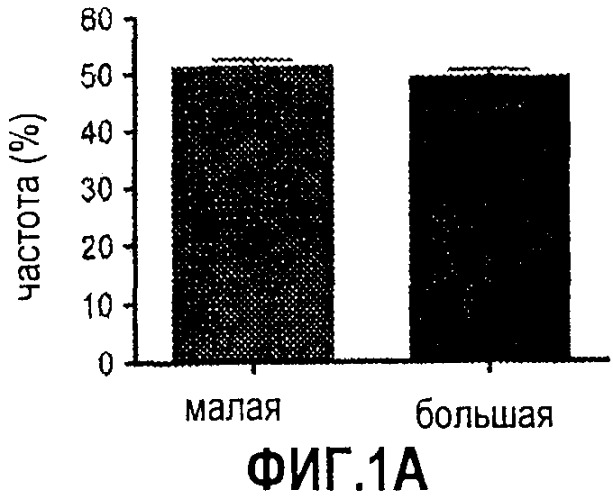
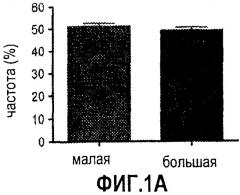
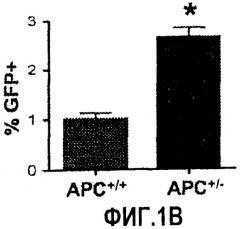
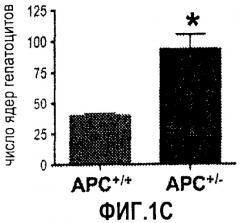
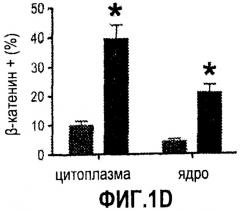
Фиг. 1. Усиление сигнала wnt/β-катенина влияет на размер печени. На фиг. 1А сравнивается размер развивающейся печени у данио рерио дикого типа (нормальных) и мутантов APC +/-. На фиг. 1В сравнивается число GFP-положительных гепатоцитов у гибридов APC +/-/LFABP:GFP по данным цитометрического анализа. Фиг. 1С иллюстрирует увеличение количества гепатоцитов на гистологических срезах мутантов APC +/- по сравнению с контрольными рыбками. На фиг. 1D приведены данные иммуногистохимического анализа β-катенина через 96 часов после оплодотворения (hours post-fertilization, hpf), показывающие усиление как ядерной, так и цитоплазматической окраски в мутантах APC +/- по сравнению с диким типом. На фиг. 1Е показано, что у эмбрионов APC +/- наблюдается усиленное включение BrdU на соответствующих срезах печени. *= статистически достоверная разница.
Фиг. 2. Повышенная активность wnt ускоряет регенерацию печени. На фиг. 2А показаны границы резекции у взрослых данио, подвергнутых частичной гепатэктомии. На фиг. 2B приведен график результатов морфометрического анализа регенерации нижней доли печени, показывающих, что активация wnt дает преимущество в регенерации по сравнению с рыбками дикого типа, а ингибирование wnt ослабляет регенерацию печени.
Фиг. 3. Ускорение регенерации печени, опосредованное wnt, является эволюционно консервативным. Гетерозиготность по гену APC у мышей APC Min/+ приводит к преимуществу в росте при регенерации печени после частичной гепатэктомии (2/3 печени). *= статистически достоверная разница.
Фиг. 4. Диаграмма сигнального пути wnt, показывающая потенциальные точки взаимодействия с сигнальным путем простагландина.
Фиг. 5. Вляние модулирования простагландина на активность wnt у развивающихся данио. На фиг. 5А показана схема эксперимента, позволяющего определить активность wnt у рыбок TOP:dGFP. На фиг. 5B показано усиление активности wnt в мозге после введения PGE2 и ослабление активности wnt после воздействия индометацина. На фиг. 5C и 5D показаны сходные эффекты, наблюдаемые в развивающихся печени и кишечнике, соответственно.
Фиг. 6. Влияние модуляции простагландина, активации цАМФ и активности wnt на развитие энтодермы и печени. На фиг. 6А приведены эффекты индометацина и форсколина (активатора цАМФ) у данио дикого типа и APC +/- на популяцию энтодермальных клеток-предшественников, показывающие, что низлежащие медиаторы сигнала простагландинов могут вызывать эффекты, сходные с эффектами самих простагландинов. Фиг. 6B иллюстрирует влияние PGE2 и индометацина на морфологию печени.
Фиг. 7. Модуляторы сигнального пути простагландина модифицируют влияние активности wnt на экспрессию генов-мишеней. На фиг. 7А показан один подход к анализу модуляторов сигнального пути простагландина с использованием модели данио. Фиг. 7B иллюстрирует влияние модуляторов простагландина на экспрессию мишеней wnt и энтодермальных генов у рыбок дикого типа, wnt8 и dkk по данным количественной ПЦР.
Фиг. 8. Сигнал простагландина модифицирует регенерацию печени. На фиг. 8A и 8B показаны подходы к анализу модуляторов сигнального пути простагландина с использованием модели данио путем измерения размера печени во время регенерации или анализа экспрессии генов, участвующих в этом процессе. На фиг. 8C показано, что ингибирование синтеза простагландинов ослабляет экспрессию мишеней wnt при регенерации печени.
Фиг. 9A и 9B. Модуляция простагландина и активности wnt влияет на регенерацию печени. На этих фигурах показано, как простагландин и активация wnt, а также вещества, воздействующие на эти сигнальные пути и их эффекторы, могут влиять на регенерацию печени у данио.
Фиг. 10. Влияние ингибирования простагландинов на рост опухоли печени. На фиг. 10A и 10B показаны подходы к анализу модуляторов сигнального пути простагландина на примере канцерогенеза у данио. На фиг. 10B приведена модель анализа возможного предотвращения формирования опухоли у рыбок APC +/- с помощью ингибирования синтеза простагландинов. На фиг. 10C показано снижение частоты возникновения опухолей, вызванное ингибированием синтеза простагландинов на этой модели.
Фиг. 11. Влияние одновременной модуляции сигнальных путей wnt и простагландина на трансплантацию костного мозга мыши. На этой фигуре показано, что активация wnt с помощью BIO усиливала образование ранних колоний в селезенке вслед за трансплантацией костного мозга. Индометацин блокирует этот эффект.
Фиг. 12. Влияние модуляции простагландина и активации wnt на заживление ран у данио. Раны на коже после частичной гепатэктомии заживают быстрее и лучше в присутствии PGE2, а также у рыбок APC +/-. Воздействие индометацина резко угнетает заживление ран.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если в тексте не указано иначе, научные и технические термины, употребляющиеся в связи с настоящей заявкой, имеют значения, общепринятые среди специалистов в уровне техники. Далее, если из контекста не следует иначе, термины в единственном числе могут включать объекты во множественном числе, а термины во множественном числе могут включать объекты в единственном числе.
Следует понимать, что настоящее изобретение не ограничивается конкретной методологией, протоколами, реагентами и т.д., описанными в настоящей заявке, и, следовательно, может варьировать. Приведенная в настоящей заявке терминология используется исключительно для описания конкретных воплощений и не ограничивает намеренно объем настоящего изобретения, который задается исключительно формулой изобретения.
За исключением рабочих примеров или если не указано иначе, все значения, выражающие количества ингредиентов или условия реакции, используемые в тексте настоящей заявки, следует понимать во всех случаях как модифицированные термином «приблизительно». Термин «приблизительно» при употреблении с процентными соотношениями может означать ±1%.
Содержание всех обозначенных патентов и других публикаций включено в текст настоящего документа путем отсылки с целью описания и раскрытия, например, методологий, описанных в таких публикациях, которые могут быть использованы в связи с настоящим изобретением. Эти публикации приведены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в этой связи не должно истолковываться как признание того, что авторы изобретения не имеют права датировать задним числом такое раскрытие на основании предшествующего изобретения или по каким-либо другим причинам. Все утверждения, касающиеся даты представления или содержания этих документов, основываются на информации, доступной для заявителей и не содержат признания истинности дат или содержания этих документов.
Сигнальные пути, участвующие в развитии, представляют собой ключ к раскрытию возможностей регенерации тканей взрослого организма и ингибирования канцерогенеза. Настоящее изобретение дает представление о регуляции роста стволовых клеток крови у эмбрионов и взрослых организмов. Настоящее изобретение также дает представление о регуляции роста печени у эмбрионов и взрослых организмов, включая рост печени после резекции органа.
В воплощении настоящего изобретения представлена манипуляция генетическим взаимодействием между сигнальными путями PGE2 и wnt/β-катенина, которые регулируют специализацию стволовых клеток во время развития, а также регенерацию. Вкратце, простагландин (PG) E2 необходим для образования и функционирования стволовых клеток крови (hematopoietic stem cells, HSC) in vivo, однако механизм его действия на эти клетки не раскрыт полностью (см. North et al., 447(7147) Nature 1007-11 (2007)). Исходя из клинических наблюдений пациентов с мутациями APC, основного регулятора сигнального пути wnt/β-катенина (Cruz-Correa et al., 122(3) Gastroenterology 641-45 (2002)) и данных, полученных in vitro (Castellone et al., 310 Science 1504-10 (2005)), можно предположить, что сигнальные пути простагландина и wnt/β-катенина взаимодействуют. Сигнальный путь wnt осуществляет положительную регуляцию гомеостатической функции HSC во взрослом организме (Reya et al., 423 Nature 409-14 (2003)), но его роль в формировании HSC не исследована. Чтобы продемонстрировать прямое взаимодействие сигнальных путей PGE2 и wnt in vivo, на эмбрионы данио TOP:dGFP-репортер wnt воздействовали стабильным dmPGE2 (10 мкМ), производным PGE2, и индометацином (10 мкМ), неселективным ингибитором циклооксигеназ (cyclooxygenases, cox). Гибридизация GFP in situ показала резкое повышение активности wnt во всем эмбрионе в ответ на воздействие dmPGE2 (в 99/111 случаев), в особенности в области «аорта-гонады-мезонефрос» (AGM), где формируются дефинитивные HSC (12±3,4 против 3±1,8 клеток). Воздействие индометацина ингибировало активность wnt в области AGM и значительно ослабляло экспрессию GFP во всем эмбрионе (72/87). Эти результаты подтвердились с помощью количественного ПЦР-анализа экспрессии GFP, при котором обнаружилось двукратное повышение активности wnt в экстрактах целых эмбрионов после воздействия dmPGE2, что свидетельствует о прямом влиянии PGE2 на сигнальный путь wnt.
Функциональные следствия взаимодействия PGE2 и wnt во время формирования HSC в эмбриональном развитии исследовали путем анализа экспрессии маркеров HSC runx1 и c-myb. Индукция wnt8, классического лиганда wnt, с помощью теплового шока на стадии десяти сомитов приводила к усиленному образованию HSC через 36 часов после оплодотворения (hpf; 47/54). Если после индукции wnt8 на эмбрионы воздействовали индометацином (10 мкМ, 16-36 hpf), формирование HSC снижалось до уровня дикого типа или ниже (43/46). Эти результаты показывают, что активность PGE2 необходима для проявления влияния активации wnt на развитие HSC.
Для локализации точки взаимодействия сигнальных путей PG и wnt использовались индуцируемые негативные регуляторы активности wnt в комбинации с воздействием dmPGE2. Dkk1 служит антагонистом сигнального пути wnt на уровне связывания с мембраной и инициализацией сигнального каскада wnt. Индукция Dkk в трансгенных эмбрионах hs:dkk1 приводила к ингибированию развития HSC (34/49). Добавление экзогенного dmPGE2 отменяло опосредованное dkk1 воздействие на формирование HSC (28/51, 10 мкМ, 16-36 hpf). Аксин представляет собой основной компонент комплекса деградации β-катенина и, таким образом, является негативным регулятором сигнального каскада wnt в цитозоле. При индукции на стадии десяти сомитов аксин в значительной степени ингибировал формирование HSC (47/52). Кроме того, воздействие dmPGE2 не отменяло этот эффект. Аналогичным образом, доминантно-негативная форма TCF, транскрипционного коактиватора β-катенина, ингибировала формирование HSC (60/62), и воздействие dmPGE2 не отменяло этот эффект. Из этих результатов видно, что сигнальные пути PG и wnt взаимодействуют на уровне комплекса деградации β-катенина, и это взаимодействие регулирует формирование дефинитивных HSC у эмбриона.
Сигнальный путь wnt может активно ускорять пролиферацию HSC путем сигнала в нише HSC, а также в самих HSC. PGE2 регулирует формирование HSC на уровне сосудистой ниши, а также в самих HSC (North et al., 2007). Для идентификации транскрипционных программ, которые регулирует сигнальный путь wnt, с помощью количественного ПЦР анализировали гены, участвующие в развитии HSC. Экспрессия маркеров стволовых клеток runx1 и cmyb значительно усиливалась в результате индукции wnt8, что соответствует данным по экспрессии, полученным способом гибридизации in situ. Напротив, в ответ на индукцию dkk1 наблюдалось значительное ослабление экспрессии runx1 и cmyb. Аналогичным образом уровни неспецифического сосудистого маркера flk1, а также специфического для аорты сосудистого маркера ephB2 повышались в ответ на wnt8 и понижались в ответ на индукцию dkk1. Эти эффекты в отношении сосудистой ниши и развивающихся в ней HSC можно модифицировать путем добавления соответствующего модулятора простагландинового сигнального пути: индометацина для wnt8 и dmPGE2 для dkk1, соответственно. Исходя из этих данных, можно предположить, что взаимодействие PGE2 и wnt, по крайней мере, частично влияет на формирование HSC путем регуляции уровня потенциала развития гематопоэтической ниши. Кроме того, анализ циклина D1, гена-мишени wnt, с помощью гибридизации in situ в области AGM, а также количественный ПЦР, выявил, что взаимодействие wnt и PGE2 также активируется и в самих HSC, что, по всей вероятности, влияет на их пролиферацию и самообновление.
Было высказано предположение, что активация wnt регулирует самообновление и репопуляцию HSC. Однако также считается, что активация wnt участвует в процессе канцерогенеза, что делает концепцию прямого усиления сигнала wnt сомнительной. Путем анализа восстановления кроветворения после облучения у данио определяли, может ли регуляция активности wnt с помощью простагландина эффективно влиять на гомеостаз HSC у взрослых организмов. Ранее было показано, что воздействие PGE2 значительно усиливает регенерацию и что его эффекты в отношении количества стволовых клеток и клеток-предшественников легко обнаруживаются через 10 дней после облучения; отсутствие PGE2 подавляло пролиферацию стволовых клеток и клеток-предшественников. По данным FACS-анализа на рыбках TOP:dGFP-репортер после облучения активность wnt в мозговом веществе почки повышается в 2 раза. Кроме того, индукция wnt8 через 24-36 часов после облучения приводила к 2,5-кратному увеличению популяции стволовых клеток и клеток-предшественников через 10 дней после облучения. Ингибирование cox индометацином значительно ослабляло этот эффект. Консервативность этого взаимодействия у позвоночных была показана на мышиной модели конститутивной активации wnt. У мышей APC Min/+ наблюдается повышенный уровень β-катенина из-за потери функции APC в комплексе деградации. Перед началом эксперимента у таких мышей наблюдается нормальная лейкоцитарная формула, так же как у контрольных сибсов. После воздействия 5-FU у мышей APC Min/+ наблюдалась усиленная регенерация костного мозга по сравнению с контрольной группой. Воздействие индометацина (1 мг/кг каждые 48 часов) значительно уменьшало пролиферативное преимущество у мышей APC Min/+. Эти данные подтверждают, что взаимодействие PG и wnt регулирует гематопоэтический гомеостаз у позвоночных.
Чтобы оценить возможное влияние уровня простагландинов на активность wnt в HSC, проводили трансплантационный анализ на мышах с использованием выделенных HSC. Клетки костного мозга cKit+Sca1+Lineage- (KSL), изолированные с помощью проточной цитометрии, трансплантировали реципиентам, получившим смертельную дозу радиации. На мышей-реципиентов воздействовали BIO (ингибитор GSK; 0,05 мг/кг), индометацином (1 мг/кг и 2,5 мг/кг) или обоими веществами в комбинации для одновременного воздействия на активность wnt и уровень PG. В ответ на воздействие BIO наблюдался статистически значимый прирост CFU-S12 (p=0,03), однако одновременное воздействие индометацина уменьшало количество CFU-S до контрольных значений. Эти результаты свидетельствуют о прямом взаимодействии PGE2 и wnt в HSC.
Чтобы определить, насколько консервативна регуляция популяции стволовых клеток и клеток-предшественников путем взаимодействия сигнальных путей PGE2 и wnt/β-катенина, исследовали энтодермальные клетки и клетки-предшественники печени у развивающихся данио. После воздействия индометацином у эмбрионов данио наблюдалась пониженная экспрессия foxA3 - маркера клеток-энтодермальных предшественников (67/71). В частности, наблюдалось заметное уменьшение развивающегося зачатка печени, что обусловливало меньший размер печени к 72 hpf (51/56), по данным анализа экспрессии белка печени, связывающего жирные кислоты (lfabp). Воздействие dmPGE2 приводило к увеличению популяции foxA3, увеличению зачатка печени (75/83) и увеличению размера печени (88/92), что указывает на неизвестную ранее роль сигнального пути PGE2 в развитии энтодермы. В foxA3-положительных клетках обнаруживаются различные компоненты сигнального пути PGE2, что подтверждает предыдущие данные.
Было показано, что сигнал wnt необходим для развития энтодермы и печени. Чтобы смоделировать конститутивную активацию сигнального пути wnt, использовались данио, мутантные по APC, чтобы охарактеризовать эффекты взаимодействия wnt и PG в foxA3+ энтодермальных предшественниках через 48 hpf. У эмбрионов APC +/- наблюдались повышенная экспрессия foxA3, увеличение зачатка печени (88/93) и увеличенный размер печени (68/75) по сравнению с сибсами дикого типа. Индометацин вызывал уменьшение количества foxA3-положительных клеток-предшественников (33/39) и размера печени (61/67) у эмбрионов APC +/- до уровней, наблюдаемых у необработанных контролей дикого типа, в то время как dmPGE2 чрезмерно увеличивал количество энтодермальных предшественников (47/54) и размер печени (75/81). Использование трансгенных линий с генами, индуцируемыми тепловым шоком, подтвердило, что, как и в HSC, взаимодействие сигнальных путей PG и wnt во время развития энтодермы имеет место на уровне комплекса деградации. Анализ способом количественного ПЦР выявил, что регулируются как маркеры энтодермальных предшественников (foxA3), так и маркеры предшественников печени (hhex), что позволяет предположить, что взаимодействие PG и wnt задействовано в разных популяциях клеток-предшественников во время развития энтодермы. Модуляция сигнального пути PG не влияет на экспрессию инсулина, что показывает, что регуляция PG/wnt не является общим регулятором для различных линий энтодермальной дифференцировки. Циклин D1 и cmyc регулировались во время развития как wnt, так и простагландином, что свидетельствует о том, что PGE2 может влиять на стволовые клетки путем стимуляции клеточного цикла и пролиферации.
На модели резекции печени у данио было четко показано, что и во взрослом организме сигнальные пути PG/wnt продолжают играть важную роль в гомеостазе печени. После частичной гепатэктомии (1/3 органа) печень данио регенерирует в течение 5-7 дней. У рыбок APC +/- этот процесс протекает быстрее. Воздействие индометацина в период 6-18 часов после резекции значительно понизило индекс регенерации как у контрольных рыбок, так и рыбок, мутантных по APC. Иммуногистохимическое окрашивание на β-катенин выявило усиление ядерной окраски у рыбок APC +/- после резекции. Индометацин приводил к падению общего уровня β-катенина а также к отсутствию ядерной окраски у рыбок дикого типа и APC +/-.
Для дальнейшего выяснения механизма влияния PGE2 на уровень β-катенина и подтверждения сохранения этого механизма в регенерации печени млекопитающих проводили опыты по частичной гепатэктомии у мышей дикого типа и APC Min/+. В этом случае мутация APC приводит к повышению уровня тотального и ядерного 2-катенина, в особенности в перипортальной области. Воздействие индометацина (2,5 мг/кг, два раза в день подкожно) приводило к значительному падению уровней β-катенина у обоих генотипов. Исследования клеток в культуре позволяют предположить, что PGE2 может повышать уровни β-катенина путем фосфорилирования и инактивации GSK3b с помощью активации аденилатциклазы и протеинкиназы А (PKA); иммуногистохимический анализ P-GSK3B (по Ser9) выявил понижение уровня фермента после воздействия индометацином у мышей как дикого типа, так и APC +/-. Эти данные были подтверждены с помощью вестерн-блот анализа. β-катенин может усиливать пролиферацию клеток путем воздействия на свою мишень - циклин D1. У мышей APC Min/+ наблюдался повышенный уровень циклина D1 и, следовательно, ускоренная пролиферация клеток, измеренная путем анализа включения BrdU, которые резко падали после воздействия индометацина.
Функциональное взаимодействие сигнальных процессов у данио ниже PG исследовали путем повышения продукции цАМФ с помощью форсколина и ингибирования PKA с помощью H89. Как в HSC, так и в энтодермальных предшественниках форсколин оказывал стимулирующее воздействие, сходное с воздействием dmPGE2. Как у рыбок дикого типа, так и у трансгенных рыбок wnt8 форсколин оказался способным обратить ингибирующий эффект индометацина. Ингибирование PKA с помощью H89 ослабляло усиленное образование HSC, индуцированное dmPGE2. Кроме того, восстановления эффектов dkk dmPGE2 не происходило в присутствии H89. Исходя из этих данных, можно предположить, что действие PGE2 путем активации цАМФ и PKA и последующей инактивации GSK3b приводит к повышению уровня β-катенина в различных популяциях стволовых клеток и клеток-предшественников.
В другом воплощении настоящего изобретения рассматривается роль сигнального пути wnt/β-катенина в процессах развития и роста печени. Вкратце, у эмбрионов, гетерозиготных по гену adenomatous polyposis coli (APC +/-), который является центральным регулятором сигнального пути wnt, развивается печень большего размера. Напротив, у эмбрионов APC -/- печень не закладывалась. Оба APC-фенотипа печени опосредованы усилением сигнала wnt и повышенным внутриклеточным уровнем β-катенина. С помощью трансгенных данио, экспрессирующих индуцируемые активаторы и репрессоры сигнального пути wnt/β-катенина, удалось показать, что зависимость от wnt в процессе эмбриогенеза имеет двухфазный характер: подавление сигнала wnt необходимо после завершения гаструляции для спецификации судьбы клеток печени; напротив, активация сигнала wnt необходима для нормального роста печени. Для выявления функциональной необходимости сигнала wnt при регенерации печени проводили резекцию печени у данио и мышей. Примечательно, что у гетерозигот по APC наблюдалась ускоренная регенерация печени, в то время как ингибирование сигнала wnt резко ослабляло рост органа. В настоящем изобретении описывается эволюционно консервативная роль сигнального пути wnt/β-катенина в процессах закладки энтодермальных органов, роста гепатоцитов и регенерации печени, что может иметь значение для регенеративной медицины.
В другом воплощении настоящего изобретения рассматривается роль сигнального пути простагландина в качестве мощного модулятора роста печени. Инкубация эмбрионов данио с ингибиторами cox1, cox2 или обоих ферментов (например, индометацин) приводила к выраженному уменьшению размера печени через 72 часа после оплодотворения по сравнению с контролем. Напротив, воздействие диметил-простагландина E2 (dmPGE2) стимулировало развитие печени. Нокдаун cox1 или cox2 с помощью морфолино также приводил к ингибированию роста, однако рост полностью возобновлялся при воздействии экзогенного dmPGE2. У взрослых данио, подвергнутых частичной гепатэктомии, в присутствии индометацина регенерация печени значительно ослаблена по сравнению с контролем. При ингибировании cox также не происходило заживления ран. Напротив, воздействие dmPGE2 после резекции вело к усилению регенерации печени с заметно улучшенной васкуляризацией печени по сравнению с контрольными рыбками. У рыбок, обработанных dmPGE2, также наблюдали ускоренное заживление ран. Сходные эксперименты на данио показали, что dmPGE2 может ускорять репопуляцию мозгового вещества почки после травмы. Таким образом, регуляция простагландинового сигнального пути может влиять на заживление и регенерацию в разных типах тканей, таких как сердечная, костная и поврежденная ткани.
Участки недифференцированного энтодермального зародышевого слоя, из которого формируются почки, кишечник, поджелудочная железа и вспомогательные органы, определяются действием различных сигнальных путей (Cui et al., 180 Dev. Biol. 22-34 (1996); Zaret, 3 Nat. Rev. Genet. 499-512 (2002)). Сигнал wnt, передающийся через его главный транскрипционный медиатор β-катенин, играет важную роль в определении характера закладки тканей, судьбы клеток, а также пролиферации клеток во многих эмбриональных контекстах, включая развитие и дифференцировку органов (Clevers, 127 Cell 365-69 (2006)). В отсутствие сигнала wnt β-катенин фосфорилируется комплексом деградации, состоящим из аксина, APC и киназы гликогенсинтазы (GSK) 3β, и направляется на деградацию. Связывание лиганда wnt c поверхностными рецепторами приводит к аккумуляции β-катенина в цитоплазме и транслокации его в ядро, где он регулирует экспрессию генов.
В новообразованиях желудочно-кишечного тракта часто обнаруживаются мутации различных компонентов сигнального пути wnt/β-катенина. Наиболее известны мутации в гене APC, ведущие к развитию рака кишечника в молодом возрасте (Kinzler et al., 251 Sci. 1366-70 (1991)). У детей, несущих мутацию APC, вероятность развития эмбриональной формы рака печени (гепатобластомы) повышена в 1000 раз (Hirschman et al., 147 J. Pediatr. 263-66 (2005)). В гепатоцеллюлярной карциноме (HCC) обнаруживаются мутации β-катенина, а также AXIN-1 и AXIN-2 (Taniguchi et al., 21 Oncogene 4863-71 (2002)). Исходя из распространенности дефектов компонентов сигнального пути wnt, обнаруживаемых как в недифференцированных, так и в дифференцированных новообразованиях печени, можно предположить, что сигнал β-катенина регулирует различные аспекты развития печени.
В процессе эмбриогенеза печень развивается из клеток-предшественников передней энтодермы. Вслед за схождением энтодермальных предшественников к средней линии начинается пролиферация и спецификация клеток энтодермального выроста. У эмбриона данио энтодермальные предшественники, позже развивающиеся в печень, идентифицируются через 22-24 часа после оплодотворения (hpf) в виде утолщения передней энтодермы (Field et al., 253 Dev. Bio. 279-90 (2003)). При дальнейшем развитии энтодермы появляется эмбриональная печень в виде почки, выступающей влево от средней линии поверх желточного мешка. Транскрипция печень-специфических генов начинается в клетках-предшественниках печени между 28 hpf и 30 hpf. К 48 hpf печень сформирована полностью, и в ней экспрессируются гены, специфичные для зрелой печени, такие как ген белка печени, связывающего жирные кислоты (LFABP; Her et al., 538 FEBS Lett 125-33 (2003)). Развитие печени продолжается по мере роста печени данио вперед и влево. Механизмы инициации и регулирования спецификации клеток, формирования зачатка и роста печени высоконсервативны у позвоночных.
Сигнал wnt необходим для развития энтодермы, что впервые было показано для C. Elegans, и это требование является эволюционно консервативным (Lin et al., 83 Cell 599-609 (1995)). Гомозиготная делеция β-катенина у мышей приводила к гибели эмбрионов на ранних стадиях развития, что замедлило прогресс исследования роли сигнального пути Wnt/β-катенина в развитии энтодермы позвоночных (Haegel et al., 121 Devel. 3529-37 (1995)). Мутация APCMin также приводит к гибели эмбрионов мышей-гомозигот, однако гетерозиготы жизнеспособны и склонны к образованию опухолей во взрослом состоянии (Su et al., (1992)). У Xenopus wnt необходим во время гаструляции для правильной закладки органов (Heasman et al., (2000)). Используя индуцируемую инактивацию β-катенина, удалось показать, что сигнальный путь wnt/β-катенина необходим для развития кишечника и формирования архитектуры кишечника (Ireland et a., (2004)). Кроме того, Wnt-зависимая регуляция анатомии кишечных крипт также продолжается и во взрослом состоянии (Pinto et al., (2003)). Результаты недавних исследований роли сигнала Wnt во время развития печени противоречивы. Последние данные, полученные на Xenopus, позволяют предположить, что репрессия wnt в клетках-ранних энтодермальных предшественниках необходима для спецификации печени. Напротив, на данио, несущих мутацию wnt2b (prometheus), была показана необходимость мезодермальных сигналов wnt для регуляции роста печени (Ober et al., (2006)). Гомозиготные мутанты prometheus жизнеспособны, и у них в конечном итоге развивается печень. Это позволяет предположить, что корректная спецификация предшественников печени может происходить и без wnt2b, однако отсутствие сигнала wnt2 в мезодерме ослабляет начальную волну роста печени. Неизвестно, могут ли другие факторы wnt компенсировать отсутствие wnt2b в отношении спецификации печени или wnt не является необходимым для дальнейших фаз пролиферации гепатоцитов.
С помощью метода TILLING (targeting induced local lesion in genomes, направленное индуцирование локальных повреждений генома) ранее были идентифицированы данио, несущие мутацию в гене APC (Hurlstone et al., 425 Nature 633-37 (2003)). Мутанты APC +/- гибнут к 96 hpf, но рыбки APC +/- жизнеспособны, однако имеют повышенную склонность к образованию спонтанных опухолей желудочно-кишечного тракта (Haramis et al., (2006)). Опухоли печени, возникающие у данио, несущих мутацию APC +/-, напоминают гепатобластомы, что позволяет предположить, что мутация APC приводит к дефектной wnt-зависимой дифференцировке предшественников печени.
Путем использования данио, мутантных по APC, а также трансгенных данио, экспрессирующих индуцируемые активатор и репрессоры сигнала wnt/β-катенина, в настоящем изобретении описывается необходимость сигнала wnt/β-катенина в разные периоды времени в течение эмбрионального развития и при поддержании гомеостаза тканей во взрослом организме. Наблюдается дифференциальный эффект потери APC, что обусловливается изменением зависимости гепатогенеза от сигнала wnt в разные периоды времени. Активация Wnt влияет на судьбу энтодермальных предшественников, что приводит к усиленному развитию печени и кише