Производные изоксазола в качестве модуляторов 11-бета-гидроксистероиддегидрогеназы 1 типа
Иллюстрации
Показать всеИзобретение относится к производным изоксазола формулы (I) и их фармацевтически приемлемым солям, где X-Y является N-O или O-N; R1 независимо выбирают из группы, включающей галоген и С1-4алкил; или два заместителя R1 вместе с атомами углерода, с которыми они связаны, образуют 6-членный ароматический цикл; R представляет собой гидрокси-С1-8алкил; а равно 1, каждый из m и n независимо равен 0, 1 или 2. Также изобретение относится к фармацевтической композиции, обладающей ингибирующей активностью в отношении 11β-гидроксистероид дегидрогеназы 1 типа, содержащей соединения формулы (I), к применению указанных соединений для получения лекарственного средства для лечения или предупреждения глаукомы, а также к способу лечения глаукомы. Технический результат - соединения формулы (I) в качестве ингибиторов 11β-гидроксистероид дегидрогеназы 1 типа. 4 н. и 5 з.п. ф-лы, 2 сx., 28 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым производным изоксазола формулы (I), которые являются модуляторами 11β-гидроксистероиддегидрогеназы 1 типа (11β-HSD1) и могут использоваться для лечения медицинских состояний, связанных с активностью 11β-HSD1. Изобретение относится также к фармацевтическим композициям, содержащим данные изобретения, к применению данных соединений при получении лекарственного средства для лечения глаукомы, а также к способу получения данных соединений.
Уровень техники
Глаукома, гетерогенная группа заболеваний, в которой первичная открытоугольная глаукома (POAG) является наиболее распространенной, представляет собой основную причину необратимой потери зрения, ответственной за 14% слепоты в мировом масштабе. Она характеризуется оптической невропатией с соответствующей потерей визуальной области, связанной с рядом факторов риска, включая повышенное внутриглазное давление (IOP), которое можно лечить и контролировать. IOP регулируется тонким равновесием между выработкой внутриглазной жидкости (АН) мерцательным эпителием и оттоком через трабекулярную сеть (ТМ), канал Шлемма и пути увеосклерального оттока. Этот процесс можно регулировать при помощи кортикостероидов, поскольку у одной трети нормального народонаселения, принимающего местные кортикостероиды, развивается умеренное повышение IOP, тогда как, фактически, у всех пациентов с POAG развивается повышенное IOP после местной терапии кортикостероидами [Armaly, Arch. Ophthalmol. 1963, 70, 483-491; Armaly, Arch. Ophthalmol. 1963, 70, 492-499; Becker, Invest. Ophthalmol. 1965, 4, 198-205; Armaly, Arch. Ophthalmol. 1967, 77, 747-751].
Кроме того, у пациентов, страдающих синдромом Кушинга, развивается повышенное IOP [Sayegh et al., Ophtalmic Res. 1975, 7, 390-394]. Занятость и активация рецепторов стероидных гормонов регулируется гидроксистероидными дегидрогеназами (HSDs), которые переводят стероидные гормоны в их неактивные метаболиты [по поводу недавнего обзора смотри Nobel et al., Eur. J. Biochem. 2001, 268, 4113-4125]. Существует множество классов HSDs, среди которых 11β-гидроксистероиддегидрогеназы (11β-HSD1) катализируют взаимопревращение активных глюкокортикоидов (таких как кортизол и кортикостерон), и их инертных форм (таких как кортизон и 11-дегидрокортикостерон). Изоформная 11β-гидроксистероиддегидрогеназа 1 типа (11β-HSD1), активирующая превращение кортизона в кортизол, вырабатывается, помимо прочего, в печени, жировой ткани, мозгу, легких и другой глюкокортикоидной ткани и является потенциальной мишенью для терапии, направленной на многочисленные нарушения, которые можно улучшить за счет снижения глюкокортикоидного действия, такие как диабет, ожирение и возрастная когнитивная дисфункция [Seckl et al., Endocrinology 2001, 142, 1371-1376].
Интересно, что в предварительном неконтролируемом исследовании на здоровых добровольцах было показано, что неселективный ингибитор 11β-HSD1/11β-HSD2 карбеноксолон (СВХ) снижает внутриглазное давление (IOP) на 20% при пероральном введении [Rauz et al., Invest. Ophtalmol. Vis. Sci. 2001, 42, 2037-2042]. Аналогичным образом, в плацебо-контролируемом исследовании пациентов с окулярной гипертензией перорально вводимый СВХ вызывал 10%-ное снижение IOP [Rauz et al., Q. J. Med. 2003, 96, 481-490]. Исследования экспрессии тканей показали наличие в клетках мерцательного эпителия человека 11β-HSD1, но не 11β-HSD2. Эта преобладающая экспрессия 11β-HSD1 в тканях глаза подтверждается избыточными уровнями кортизола по сравнению с кортизоном при АН как у здоровых людей, так и у пациентов, тогда как в моче наблюдался противоположный эффект, что отражает активность 11β-HSD1 в почках. При совместном рассмотрении данные результаты позволяют предположить, что селективное ингибирование 11β-HSD1 в глазе может быть действенным подходом к снижению уже повышенного IOP и, следовательно, к лечению глаукомы [US 6548053, смотри также Walker et al., постер Р3-698 на конференции Эндокринного общества, 12-15 июня, Сан Диего].
Местное применение к глазу представляет собой предпочтительный способ фармакологического вмешательства при глазных заболеваниях, поскольку это приводит к высоким концентрациям активного соединения на требуемом участке воздействия, снижая в то же самое время риск системных побочных эффектов. В качестве предпочтительного состава для глаукомных лекарственных средств общепринятыми являются водные растворы.
Из предшествующего уровня техники известно несколько замещенных соединений изоксазола. В WO 01/29015 описаны производные изоксазола с повышенной селективностью по отношению к α1а адренергическим рецепторам для применения при лечении обструктивных синдромов нижних мочевыводящих путей. В WO 2007/114124 описаны замещенные производные изоксазола в качестве ингибиторов 11β-HSD1 для лечения ожирения.
Однако ранее не было показано, что замещенные соединения изоксазола подходят для местного применения для глаз при лечении глаукомы.
Описание изобретения
Неожиданно было найдено, что соединения изоксазола формулы (I), являющиеся эффективными и селективными ингибиторами 11β-HSD1, обладают физиологическими свойствами, которые делают их особенно подходящими для местного применения для глаз при лечении глаукомы.
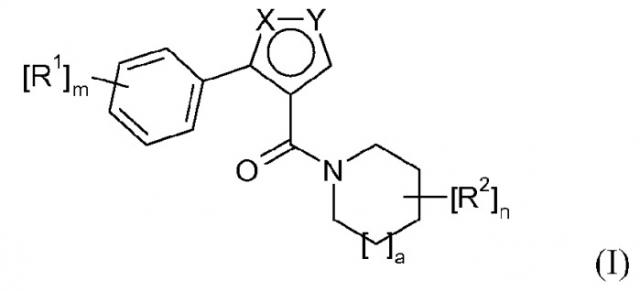
В первом аспекте данное изобретение относится к соединению формулы (I)
или к его фармацевтически приемлемой соли, сольвату, гидрату, геометрическому изомеру, таутомеру, оптическому изомеру или N-оксиду, где:
X-Y является N-O или O-N;
R1 независимо выбирают из группы, включающей галоген, циано, CF3, OCF3, С1-4алкил, гидрокси-С1-4алкил, С1-4алкокси-С1-4алкил и С1-4алкокси;
или два заместителя R1 вместе с атомами углерода, с которыми они связаны, образуют 5- или 6-членный ароматический или неароматический цикл, который необязательно содержит один или более гетероатомов, выбранных из О и N, и который необязательно замещен одним или более заместителями, выбранными из группы, включающей галоген, циано, CF3, OCF3, С1-4алкил, гидрокси-С1-4алкил, С1-4алкокси-С1-4алкил и С1-4алкокси;
R2 независимо выбирают из группы, включающей С1-8алкил, гидрокси-С1-8алкил, С1-8алкокси-С1-8алкил, С1-8алкокси, гидрокси-С1-8алкокси, С1-8алкокси-С1-8алкокси, С3-8циклоалкил, гидрокси-С3-8циклоалкил, С1-8алкокси-С3-8циклоалкил, С3-8циклоалкокси, гидрокси-С3-8циклоалкокси и С1-8алкокси-С3-8циклоалкокси;
а равно 0, 1 или 2, и
каждый из m и n независимо равен 0, 1 или 2;
при условии, что данное соединение не выбирают из группы, включающей:
• 1-[(5-фенил-4-изоксазолил)карбонил]пиперидин;
• 5-фенил-4-(пирролидин-1-илкарбонил)изоксазол;
• 5-(4-фторфенил)-4-(пирролидин-1-илкарбонил)изоксазол;
• 5-(4-хлорфенил)-4-(пирролидин-1-илкарбонил)изоксазол;
• 5-(4-бромфенил)-4-(пирролидин-1-илкарбонил)изоксазол;
• 5-(4-метилфенил)-4-(пирролидин-1-илкарбонил)изоксазол;
• 5-(4-метоксифенил)-4-(пирролидин-1-илкарбонил)изоксазол;
• 4-{[2-(метоксиметил)пирролидин-1-ил]карбонил}-5-(4-метилфенил)изоксазол;
• 4-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил}-5-(4-метилфенил)изоксазол;
• 4-{[(2R)-2-(метоксиметил)пирролидин-1-ил]карбонил}-5-(4-метилфенил)изоксазол;
• 5-(2-хлорфенил)-4-{[2-(метоксиметил)пирролидин-1-ил]карбонил}изоксазол;
• 5-(2-хлорфенил)-4-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил}изоксазол;
• 5-(2-хлорфенил)-4-{[(2R)-2-(метоксиметил)пирролидин-1-ил]карбонил}изоксазол;
• 4-{[(2S)-2-(метоксиметил)пирролидин-1-ил]карбонил}-5-[4-(трифторметил)фенил]изоксазол;
• 4-{[(2R)-2-(метоксиметил)пирролидин-1-ил]карбонил}-5-[4-(трифторметил)фенил]изоксазол;
• 5-(4-хлорфенил)-4-{[2-(изопропил)пирролидин-1-ил]карбонил}изоксазол;
• 2-(1-{[5-(4-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-(1-{[5-(2-хлорфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-[1-({5-[4-(трифторметил)фенил]изоксазол-4-ил}карбонил)пиперидин-3-ил]пропан-2-ол;
• 2-((3R)-1-{[3-(4-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[5-(4-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[3-(4-метоксифенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[3-(3-хлор-4-метоксифенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 3-(1-{[5-(4-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пентан-3-ол;
• 3-(1-{[3-(4-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пентан-3-ол;
• 3,5-диметил-1-{[5-(4-метилфенил)изоксазол-4-ил]карбонил}пиперидин;
• 1-{[5-(2-хлорфенил)изоксазол-4-ил]карбонил}-3,5-диметилпиперидин;
• 3,5-диметил-1-({5-[4-(трифторметил)фенил]изоксазол-4-ил}карбонил)пиперидин;
• 5-этил-2-метил-1-{[5-(4-метилфенил)изоксазол-4-ил]карбонил}пиперидин;
• 1-{[5-(2-хлорфенил)изоксазол-4-ил]карбонил}-5-этил-2-метилпиперидин; и
• 5-этил-2-метил-1-({5-(4-трифторметил)фенил]изоксазол-4-ил}карбонил)пиперидин.
В предпочтительном варианте осуществления изобретения R1 представляет собой галоген или С1-4алкил, или два заместителя R1 вместе с атомами углерода, с которыми они связаны, образуют 5- или 6-членный цикл. В наиболее предпочтительном варианте осуществления изобретения R1 представляет собой F, Cl или метил, или два заместителя R1 вместе с атомами углерода, с которыми они связаны, образуют 6-членный ароматический цикл.
В следующем предпочтительном варианте осуществления изобретения гетероциклическое кольцо, содержащее заместитель(ли) R2, представляет собой пиперидиновый цикл. Следовательно, а предпочтительно равно 1.
В еще одном предпочтительном варианте осуществления изобретения пиперидиновый цикл замещен одним заместителем R2. Следовательно, n предпочтительно равно 1.
В еще одном предпочтительном варианте осуществления изобретения R2 представляет собой гидрокси-С1-8алкил или С1-8алкокси-С1-8алкокси. В наиболее предпочтительном варианте осуществления изобретения R2 представляет собой 1-гидроксиэтил, 2-гидроксиэтил или 1-гидрокси-1-метилэтил.
Конкретными предпочтительными соединениями согласно данному изобретению являются соединения, выбранные из группы, включающей:
• 2-(1-{[5-(2-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[5-(2-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3S)-1-{[5-(2-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-(1-{[5-(3-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3S)-1-{[5-(4-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[5-(2-хлорфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3S)-1-{[5-(2-хлорфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3S)-1-{[5-(3-хлорфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[5-(4-хлорфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3S)-1-{[5-(4-хлорфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-(1-{[5-(2-хлорфенил)изоксазол-4-ил]карбонил}пиперидин-2-ил)этанол;
• 2-(1-{[5-(3-хлор-2-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-(1-{[5-(3,4-диметилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[5-(3,4-диметилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3S)-1-{[5-(3,4-диметилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[5-(2,4-диметилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3S)-1-{[5-(2,4-диметилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[5-(2-фторфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[5-(4-фторфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3S)-1-{[5-(4-фторфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[5-(1-нафтил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3S)-1-{[3-(2-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[3-(2-метилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[3-(2-хлорфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3S)-1-{[3-(2-хлорфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 2-((3R)-1-{[3-(2,4-диметилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол;
• 1-(1-{[3-(2-хлорфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)этанол; и
• 2-((3S)-1-{[3-(2,4-диметилфенил)изоксазол-4-ил]карбонил}пиперидин-3-ил)пропан-2-ол.
Следующий аспект изобретения представляет собой соединение формулы (I) для применения в терапии. Определенные выше соединения являются эффективными и селективными ингибиторами 11β-HSD1. В качестве таковых они применимы для лечения или предупреждения глаукомы. Таким образом, изобретение включает соединения формулы (I) для применения при лечении или предупреждении глаукомы.
В следующем аспекте изобретение включает применение соединений формулы (I) для получения лекарственного средства для лечения или предупреждения глаукомы.
В еще одном аспекте изобретение включает способ лечения или предупреждения глаукомы, включающий введение человеку, нуждающемуся в подобном лечении, эффективного количества соединения формулы (I).
В еще одном аспекте изобретение представляет фармацевтическую композицию, содержащую соединение формулы (I) в качестве активного ингредиента, в сочетании с фармацевтически приемлемым разбавителем или носителем. Указанная фармацевтическая композиция применима для лечения или предупреждения глаукомы.
Описанные здесь в общих чертах способы включают способы, в которых определяют, что субъект нуждается в конкретном установленном лечении. Установление субъекта, нуждающегося в подобном лечении, может быть основано на мнении субъекта или профессионала в области здравоохранения и может быть субъективным (например, мнение) или объективным (например, определяемым при помощи теста или метода диагностики).
Определения
На протяжении описания и прилагаемой формулы изобретения будут использованы следующие определения.
Если не установлено или не указано иначе, термин «С1-8-алкил» означает линейную или разветвленную алкильную группу, содержащую от 1 до 8 атомов углерода. Примеры указанного С1-8-алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил и линейный и разветвленный пентил, гексил, гептил и октил. В качестве частей интервала «С1-8алкила» рассматриваются все его подгруппы, такие как С1-7алкил, С1-6алкил, С1-5алкил, С1-4алкил, С1-3алкил, С1-2алкил, С2-8алкил, С2-7алкил, С2-6алкил, С2-5алкил, С2-4алкил, С2-3алкил, С3-8алкил, С3-7алкил и так далее.
Если не установлено или не указано иначе, термин «гидрокси-С1-8-алкил» означает линейную или разветвленную С1-8-алкильную группу, в которой атом водорода замещен ОН. Примеры указанного гидрокси-С1-8алкила включают гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 2-гидрокси-2-метилпропил и 1-гидрокси-1-метилэтил.
Если не установлено или не указано иначе, термин «С1-8алкокси» означает линейную или разветвленную С1-8алкильную группу, связанную с остатком молекулы через атом кислорода. Примеры указанного С1-8алкокси включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси и линейные и разветвленные пентилокси, гексилокси, гептилокси и октилокси. В качестве частей интервала «С1-8алкокси» рассматриваются все его подгруппы, такие как С1-7алкокси, С1-6алкокси, С1-5алкокси, С1-4алкокси, С1-3алкокси, С1-2алкокси, С2-8алкокси, С2-7алкокси, С2-6алкокси, С2-5алкокси, С2-4алкокси, С2-3алкокси, С3-8алкокси, С3-7алкокси и так далее.
Если не установлено или не указано иначе, термин «С1-8алкокси-С1-8алкил» означает линейную или разветвленную С1-8алкильную группу, в которой атом водорода замещен линейной или разветвленной С1-8алкоксигруппой. Примеры указанного С1-8алкокси-С1-8алкила включают метоксиметил, 1-метоксиэтил, 2-метоксиэтил и 2-этоксиэтил.
Если не установлено или не указано иначе, термин «гидрокси-С1-8алкокси» означает линейную или разветвленную С1-8алкоксильную группу, в которой атом водорода замещен ОН. Примеры указанного гидрокси-С1-8алкокси включают гидроксиметокси, 2-гидроксиэтокси и 2-гидроксипропокси.
Если не установлено или не указано иначе, термин «С1-8алкокси-С1-8алкокси» означает линейную или разветвленную С1-8алкоксигруппу, в которой атом водорода замещен линейной или разветвленной С1-8алкоксигруппой. Примеры указанного С1-8алкокси-С1-8алкокси включают метоксиметокси, 2-метоксиэтокси и 3-метоксипропокси.
Если не установлено или не указано иначе, термин «С3-8циклоалкил» означает моноциклическую насыщенную углеводородную кольцевую систему, содержащую от 3 до 8 атомов углерода. Примеры С3-8циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. В качестве частей интервала «С3-8циклоалкила» рассматриваются все его подгруппы, такие как С3-7циклоалкил, С3-6циклоалкил, С3-5циклоалкил, С3-4циклоалкил, С4-8циклоалкил, С4-7циклоалкил, С4-6циклоалкил, С4-5циклоалкил, С5-8циклоалкил, С5-7циклоалкил, С6-8циклоалкил и С6-7циклоалкил.
Если не установлено или не указано иначе, термин «гидрокси-С3-8циклоалкил» означает С3-8циклоалкильную группу, в которой атом водорода замещен ОН. Примеры указанного гидрокси-С3-8циклоалкила включают 3-гидроксициклопентил и 4-гидроксициклогексил.
Если не установлено или не указано иначе, термин «С1-8алкокси-С3-8циклоалкил» означает С3-8циклоалкильную группу, в которой атом водорода замещен линейной или разветвленной С1-8алкоксигруппой. Примеры указанного С1-8алкокси-С3-8циклоалкила включают 3-метоксициклопентил и 4-метоксициклогексил.
Если не установлено или не указано иначе, термин «С3-8циклоалкокси» означает С3-8циклоалкильную группу, связанную с остатком молекулы через атом кислорода. Примеры указанного С3-8циклоалкилокси включают циклопропилокси, циклопентилокси и циклогексилокси.
Если не установлено или не указано иначе, термин «гидрокси-С3-8циклоалкилокси» означает С3-8циклоалкилоксигруппу, в которой атом водорода замещен ОН. Примеры указанного гидрокси-С3-8циклоалкилокси включают 3-гидроксициклопентилокси и 4-гидроксициклогексилокси.
Если не установлено или не указано иначе, термин «С1-8алкокси-С3-8циклоалкилокси» означает С3-8циклоалкилоксигруппу, в которой атом водорода замещен линейной или разветвленной С1-8алкоксигруппой. Примеры указанного С1-8алкокси-С3-8циклоалкилокси включают 3-метоксициклопентилокси и 4-метоксициклогексилокси.
Когда два описанных здесь заместителя R1, вместе с атомами углерода, с которыми они связаны, образуют 5- или 6-членный ароматический или неароматический цикл, указанный цикл может необязательно содержать один или более гетероатомов, выбранных из О и N. Примеры подобных двухвалентных заместителей R1 включают -СН=СН-СН=СН-, -О-СН2-О (метилендиокси) и -О-СН2-СН2О- (этилендиокси).
«Галоген» относится к фтору, хлору, брому или йоду.
«Гидрокси» относится к радикалу -ОН.
«Циано» относится к радикалу -CN.
«CF3» относится к трифторметильному радикалу.
«OCF3» относится к трифторметокси радикалу.
«Необязательный» или «необязательно» означает, что описанное впоследствии событие или обстоятельство может, но не должно произойти, и что описание включает случаи, в которых данное событие или обстоятельство происходит, и случаи, в которых оно не происходит.
«Фармацевтически приемлемый» означает применимость при получении фармацевтической композиции, которая, в общем, является безопасной, нетоксичной и ни биологически, ни каким-либо иным образом нежелательной, и применимой для фармацевтического применения для человека.
«Лечение», как использовано здесь, включает профилактику названного нарушения или состояния, или улучшение, или устранение нарушения, как только оно установлено.
«Эффективное количество» относится к количеству соединения, которое оказывает терапевтический эффект (например, лечит, регулирует, улучшает, предупреждает, задерживает начало или уменьшает риск развития заболевания, нарушения или состояния или его симптомы) у подлежащего лечению субъекта. Терапевтический эффект может быть объективным (то есть определяемым при помощи какого-нибудь теста или маркера) или субъективным (то есть субъект дает указание или ощущение какого-либо эффекта).
«Пролекарства» относятся к соединениям, которые можно превратить в биологически активное соединение изобретения в физиологических условиях или путем сольволиза. Пролекарство может быть неактивным при введении нуждающемуся в этом субъекту, но превращается in vivo в активное соединение изобретения. Пролекарства обычно быстро превращаются in vivo в исходное соединение изобретения, например, путем гидролиза. Соединение пролекарства обычно имеет преимущества в смысле растворимости, совместимости с тканями или замедленного высвобождения в организме млекопитающего (см. Silverman, R.B., The Organic Chemistry of Drug Design and Drug Action, 2nd Ed., Elsevier Academic Press (2004), pp. 498-549). Пролекарства на основе соединений изобретения можно получить, модифицируя функциональные группы, такие как гидроксигруппы, присутствующие в соединении изобретения таким образом, что данные модификации расщепляются либо путем обычной манипуляции, либо in vivo, с образованием исходного соединения изобретения. Примеры пролекарств включают, но не ограничиваются ацетатными, формиатными или сукцинатными производными гидроксильных функциональных групп.
На протяжении описания и прилагаемой формулы изобретения данная химическая формула или название будут также включать все формы их солей, гидратов, сольватов, N-оксидов и пролекарств. Кроме того, данная химическая формула или название будут также включать все их таутомерные и стереоизомерные формы. Стереоизомеры включают энантиомеры и диастереомеры. Энантиомеры могут присутствовать в виде своих чистых форм или в виде рацемических (равных) или неравных смесей двух энантиомеров. Диастереомеры могут присутствовать в виде своих чистых форм или в виде смесей диастереомеров. Кроме того, диастереомеры включают геометрические изомеры, которые могут присутствовать в виде своих чистых цис- или транс-форм или в виде их смесей.
Соединения формулы (I) можно применять как таковые или, где это уместно, в виде их фармакологически приемлемых солей (солей присоединения кислоты или основания). Подразумевается, что упомянутые ниже фармакологически приемлемые соли присоединения включают терапевтически активные формы соли присоединения нетоксичной кислоты и основания, которые способны образовывать данные соединения. Соединения, обладающие основными свойствами, можно превратить в их фармакологически приемлемые соли присоединения кислоты, обрабатывая форму основания соответствующей кислотой. Типичные кислоты включают неорганические кислоты, такие как хлористый водород, бромистый водород, иодистый водород, серная кислота, фосфорная кислота и органические кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, гидроксиуксусная кислота, молочная кислота, пировиноградная кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, щавелевая кислота, бензолсульфокислота, толуолсульфокислота, метансульфокислота, трифторуксусная кислота, фумаровая кислота, янтарная кислота, яблочная кислота, винная кислота, лимонная кислота, салициловая кислота, п-аминосалициловая кислота, памовая кислота, бензойная кислота, аскорбиновая кислота и так далее. Типичные соли присоединения основания представляют собой соли натрия, калия, кальция и соли с фармацевтически приемлемыми аминами, например, такими как аммиак, алкиламины, бензатин и аминокислоты, например, такие как аргинин и лизин. Использованный здесь термин соль присоединения также включает сольваты, которые способны образовывать соединения и их соли, например, такие как гидраты, алкоголяты и так далее.
Композиции
Для клинического применения на основе соединений изобретения можно составить фармацевтические композиции для глазного введения. Понятно, что соединения данного изобретения можно вводить вместе с физиологически приемлемым носителем, эксципиентом или разбавителем.
Получение фармакологической композиции, содержащей растворенные, диспергированные или суспендированные в ней активные ингредиенты, хорошо известно в данной области. Обычно подобные композиции получают в виде стерильных композиций для инстилляции (глазные капли) либо в виде жидких растворов или суспензий, водных или неводных, однако можно приготовить твердые формы, подходящие для получения раствора, дисперсии или суспензий в жидкости перед применением. Препарат может быть также эмульгирован.
Активный ингредиент можно смешать с эксципиентами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом, и взятыми в количествах, подходящих для использования в описанных здесь терапевтических способах. При желании, данные композиции могут содержать вспомогательные вещества, такие как смачивающие или эмульгирующие вещества, рН буферирующие вещества и так далее, повышающие эффективность активного ингредиента.
Фармацевтически приемлемые носители хорошо известны в данной области. Примерами жидких носителей являются стерильные водные растворы, не содержащие веществ, помимо активных ингредиентов и воды, или содержащие буферный раствор, такой как фосфат натрия при значении физиологического рН, физиологический раствор соли или и тот, и другой, такой как раствор соли с фосфатным буфером. Еще одни водные носители могут включать более одной буферной соли, а также такие соли, как хлориды натрия и калия, декстрозу, пропиленгликоль, полиэтиленгликоль и другие растворенные вещества.
Жидкие композиции могут также содержать жидкие фазы, помимо воды, и за ее исключением. Примерами подобных дополнительных жидких фаз являются глицерин, растительные масла, органические сложные эфиры и эмульсии воды в масле.
Предпочтительно фармацевтическая композиция содержит одно или более веществ, применимых в качестве солюбилизатора, эмульгатора, и/или усилители проникновения. Подобные вещества, хорошо известные в данной области, включают, например, вещества, продаваемые под названием Cremophor® (BASF). Примером является Cremophor® RH 40 (полиоксоловое касторовое масло; CAS № 61788-85-0).
Получение соединений изобретения
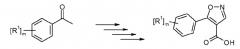
Соединения приведенной выше формулы (I) можно получить по аналогии со стандартными способами. Получение промежуточных соединений и соединений в соответствии с примерами настоящего изобретения, в частности, можно прояснить при помощи следующих схем 1 и 2. Определения переменных параметров в структурах на приведенных здесь схемах соответствуют переменным параметрам в соответствующих положениях в описанных здесь формулах.
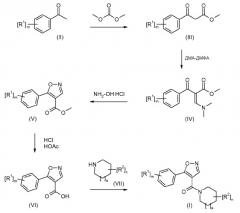
Исходя из соответствующего ацетофенона (II), метиловый эфир 5-(фенил)изоксазол-4-карбоновой кислоты (V) можно легко получить в несколько синтетических стадий. После гидролиза сложного эфира карбоновую кислоту (VI) активируют обработкой TBTU или переводят в соответствующий хлорангидрид кислоты и дают возможность взаимодействовать с соответствующим циклическим амином (VII), что приводит к образованию требуемого соединения формулы (I). Это в общих чертах представлено на схеме 1.
Схема 1
где R1-R2, а, n и m определены в формуле (I).
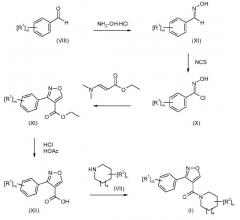
На схеме 2 показано получение изомерных соединений изоксазола формулы (I). Исходя из соответствующего замещенного бензальдегида (VII), этиловый эфир 3-(фенил)изоксазол-4-карбоновой кислоты (XI) получают в три стадии. Затем соединения формулы (I) легко получаются при гидролизе сложного эфира (XI) и конденсации полученной кислоты (XII) с соответствующим циклическим амином (VII) в присутствии TBTU в качестве активирующего агента или путем превращения кислоты в соответствующий хлорангидрид кислоты.
Схема 2
где R1-R2, а, n и m определены в формуле (I).
Необходимые исходные вещества для получения соединений формулы (I) являются либо коммерчески доступными, либо их можно получить способами, которые известны в данной области.
Описанные далее в экспериментальной части способы можно осуществить для получения соединения изобретения в форме свободного основания либо в виде соли присоединения кислоты. Фармацевтически приемлемую соль присоединения кислоты можно получить, растворяя свободное основание в подходящем органическом растворителе и обрабатывая данный раствор кислотой, в соответствии со стандартными методиками получения солей присоединения кислоты из основных соединений. Примеры кислот, образующих соли присоединения, упомянуты выше.
Соединения формулы (I) могут обладать одним или более хиральными атомами углерода, и, следовательно, они могут быть получены в виде оптических изомеров, например, в виде чистого энантиомера, или в виде смеси энантиомеров (рацемата) или в виде смеси, содержащей диастереомеры. Разделение смесей оптических изомеров для получения чистых энантиомеров хорошо известно в данной области и может быть осуществлено, например, дробной кристаллизацией солей с оптически активными (хиральными) кислотами или при помощи хроматографического разделения на хиральных колонках.
Реагенты, используемые в описанных здесь способах синтеза, могут включать, например, растворители, реагенты, катализаторы и реагенты для введения и снятия защитных групп. Примерами защитных групп являются трет-бутоксикарбонильная (Вос), бензильная и тритильная (трифенилметильная). Описанные выше способы могут также включать стадии, либо перед, либо после конкретно описанных здесь стадий, для введения или снятия подходящих защитных групп, чтобы сделать синтез соединений окончательно возможным. Кроме того, для получения требуемых соединений различные стадии синтеза можно осуществить в порядке чередования. Синтетические химические превращения и методологии защитных групп (защита и снятие защиты), применимые при синтезе подходящих соединений, известны в данной области и включают, например, синтетические химические превращения и методологии, описанные у R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); and L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и в их последующих изданиях.
Были использованы следующие сокращения:
| DMA-ДМФА | Диметилацеталь диметилформамида |
| EtOAc | Этилацетат |
| ESI | Ионизация электроспреем |
| Час | Часы |
| HPLC | Высокоэффективная жидкостная хроматография |
| HRMS | Масс-спектрометрия высокого разрешения |
| LCMS | Хроматомасс-спектрометрия |
| M | Молярный |
| MeCN | Ацетонитрил |
| MeOH | Метанол |
| Мин | Минуты |
| MC | Масс-спектрометрия |
| NCS | N-хлорсукцинимид |
| NEt3 | Триэтиламин |
| TBTU | Тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония |
| THF | Тетрагидрофуран |
Приведение списка химических групп в любом определении описанного здесь переменного параметра включает определения этого переменного параметра в виде какой-либо одной группы или сочетания перечисленных групп. Приведение описанного здесь варианта осуществления включает этот вариант осуществления в виде какого-либо одного варианта осуществления или в виде сочетания с любыми другими вариантами осуществления или их частями.
Теперь данное изобретение будет дополнительно иллюстрировано следующими неограничивающими примерами. Приведенные далее конкретные примеры следует истолковывать лишь как иллюстративные и не ограничивающие оставшуюся часть описания каким бы то ни было образом. Предполагается, что, исходя из приведенного здесь описания, специалист в данной области сможет использовать настоящее изобретение в его наиболее полной степени, без дополнительного уточнения. Все цитированные здесь ссылки и публикации включены посредством ссылки во всей ее полноте.
Примеры и промежуточные соединения
Экспериментальные методы
Все реагенты имели промышленное качество и использовались без дополнительной очистки, если не указано иначе. Во всех остальных случаях использовали растворители ч.д.а., если не указано иначе. Препаративную ВЭЖХ/МС осуществляли в системе Waters/Micromass Platform ZQ, а препаративную ВЭЖХ/УФ осуществляли на аппарате Гилсона в соответствии с деталями эксперимента, подробно описанными в примерах. Аналитическую ВЭЖХ/МС осуществляли с использованием селективного детектора для хроматомасс-спектрометра (MSD) серии Agilent 1100/1200 (Single Quadrupole) (1946A/1946C/1956C/6110), снабженного электроспреевым интерфейсом. Препаративную флэш-хроматографию осуществляли на силикагеле 60 фирмы Merck (230-400 меш). Реакции под микроволновым облучением проводили при помощи Personal Chemistry Smith Creator или Personal Chemistry Smith Optimizer с использованием сосудов Smith Process на 0,5-2 мл или на 2-5 мл, снабженных алюминиевыми крышками и перегородками. Масс-спектры высокого разрешения (HRMS) получали на Agilent MSD-TOF, соединенном с системой Agilent 1100 ВЭЖХ. Во время анализа калибровку проверяли при помощи двух масс и автоматически корректировали при необходимости. Спектры получали положительным электроспреевым методом. Полученный массовый интервал представляет собой m/z 100-1100. Использовали профильное детектирование массовых пиков. Соединения называли с использованием ACD Name 6.0.
ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ 1
5-(2-Метилфенил)изоксазол-4-карбоновая кислота
Стадия 1: Метил 3-(2-метилфенил)-3-оксопропаноат
2-Метилацетофенон (20 г, 149 ммоль) растворяли в толуоле (20 мл) и медленно прибавляли к перемешиваемой суспензии NaH (7,16 г, 298 ммоль) и диметилкарбоната (14,8 г, 164 ммоль) в толуоле (примерно 150 мл) при комнатной температуре. Контроль за ходом реакции осуществляли методом LCMS. После расходования исходного ацетофенона добавляли МеОН (примерно 10 мл) приблизительно в течение 10 минут при перемешивании, после чего добавляли приблизительно 50 мл колотого льда. Смесь разбавляли CH2Cl2 и подкисляли водной HCl (9-12М). Органическую фазу отделяли, а водную фазу экстрагировали CH2Cl2. Объединенные органические фазы сушили (Na2SO4) и выпаривали растворитель, получая 27,2 г указанного в заголовке соединения (чистота >95%). МС m/z 193 [m+1].
Стадия 2. Метил (2Z)-3-(диметиламино)-2-(2-метилбензоил)акрилат
Метил 3-(2-метилфенил)-3-оксопропаноат (27,1 г, 141 ммоль) растворяли в толуоле (100 мл). Прибавляли ДМА-ДМФА (17,6 г, 148,0 ммоль) и перемешивали реакционную смесь при 70°С. После расходования исходного соединения (мониторинг методом LCMS) реакционной смеси давали остыть до комнатной температуры и выпаривали растворитель, получая 34,1 г указанного в заголовке соединения (чистота >95%), которое использовали на следующей стадии. МС m/z 248 [m+1].
Стадия 3. Метил 5-(2-метилфенил)изоксазол-4-карбоксилат
Метил (2Z)-3-(диметиламино)-2-(2-метилбензоил)акрилат (34,0 г, 138 ммоль) и гидрохлорид гидроксиламина (10,1 г, 145 ммоль) растворяли в МеОН (150 мл) и перемешивали полученный раствор при комнатной температуре. Контроль за ходом реакции осуществляли методом ВЭЖХ. Спустя 18 ч 90% растворителя выпаривали и растворяли остаток в CH2Cl2, промывали водой и сушили (Na2SO4). Растворитель выпаривали, получая 28,5 г (чистота >95%) указанного в заголовке соединения. МС m/z 218 [m+1].
Стадия 4. 5-(2-Метилфенил)изоксазол-4-карбоновая кислота