Конструкция на основе белковой пары барназа-барстар и способ ее получения
Иллюстрации
Показать всеИзобретение относится к области нанотехнологии и биотехнологии. Предложен способ создания указанной конструкции, включающий: а) создание, по меньшей мере, двух модулей, где каждый из модулей независимо выполняют в виде ядра, несущего на поверхности молекулы первого белка или второго белка, где в качестве первого белка выбирают барназу, а в качестве второго белка выбирают барстар, причем первый или второй белок для связывания с каждым из модулей выбирают следующим образом: первый модуль выполняют несущим на поверхности молекулы белка, выбранного из первого белка или второго белка; второй модуль выполняют несущим на поверхности молекулы белка, выбранного из первого белка или второго белка и отличного от белка, содержащегося в первом модуле; третий и каждый последующий модуль несет на поверхности молекулы либо первого, либо второго белка; б) комбинирование первого, второго и последующих модулей, в котором модули самособираются в конструкции за счет взаимодействия молекул барназы и барстара, причем ядра, по крайней мере, двух из указанных модулей выполняют частицами надмолекулярной природы. Описана конструкция для диагностики и терапии, полученная указанным способом. Изобретение позволяет получить конструкции, включающие ядра различной природы и размеров, соединенные между собой с помощью функциональной пары барназа-барстар, обеспечивающей прочное соединение указанных ядер. 2 н. и 18 з.п. ф-лы, 5 ил., 8 пр.
Реферат
Изобретение относится к области нанотехнологии, белковой инженерии и биотехнологии, обеспечивает создание новых материалов со специальными свойствами за счет процессов самосборки на основе взаимодействия белков «барназа» и «барстар», и может быть использовано для получения монофункциональных или многофункциональных структур различного строения.
В последнее время наблюдается неуклонный рост использования нанотехнологии в биологии и медицине. Наночастицы представляют большой интерес для медицины XXI века из-за принципиально новых возможностей по сравнению с существующими лекарствами в молекулярной форме. Особый интерес вызывает применение различных наночастиц для лечения и диагностики таких заболеваний, как рак, инсульт, атеросклероз, а также инфекционных заболеваний (McAteer, М.А., et al. In vivo magnetic resonance imaging of acute brain inflammation using microparticles of iron oxide, Nat Med. 13 1253-8, 2007). На данный момент существует несколько основных типов наночастиц, обладающих различными физико-химическими свойствами: полимерные (Yang J, et al. Development of aliphatic biodegradable photo luminescent polymers, Proc Natl Acad Sci. 106 10086-91, 2009), золотые (Qian, X., et al. In vivo tumor targeting and spectroscopic detection with surface-enhanced Raman nanoparticle tags., Nat Biotechnol. 1, 83-90, 2008) и магнитные (Lubbe A.S., Alexiou C, Bergemann C. Clinical Applications of Magnetic Drug Targeting, Journal of Surgical Research 95, 200-206, 2001) частицы (МЧ), квантовые точки (KT) (Michalet, X., et al. Quantum dots for live cells, in vivo imaging, and diagnostics. Science 307, 538-44, 2005), наноалмазы (Chang, Y.R., et al. Mass production and dynamic imaging of fluorescent nanodiamonds. Nat Nanotechnol. 3, 284-288, 2008) и некоторые другие.
Различные полимерные частицы могут быть использованы в качестве «транспорта» различных молекулярных лекарственных препаратов как гидрофильных, так и гидрофобных, для их направленной доставки к клеткам-мишеням, чтобы уменьшить системную интоксикацию организма (Yang J, et al. Development of aliphatic biodegradable photoluminescent polymers, Proc Natl Acad Sci. 106 10086-91, 2009).
Золотые наночастицы представляют интерес из-за явления, называемого поверхностным плазмонным резонансом, позволяющего детектировать такие частицы в организме или нагревать их светом для уничтожения раковых клеток (т.е. для гипертермии опухолей) (Qian, X., et al. In vivo tumor targeting and spectroscopic detection with surface-enhanced Raman nanoparticle tags., Nat Biotechnol. 1, 83-90, 2008, Rayavarapu, R.G., et al., Synthesis and bioconjugation of gold nanoparticles as potential molecular probes for light-based imaging techniques. Int J Biomed Imaging. Article ID 29817, 2007).
Квантовые точки способны флуоресцировать с квантовым выходом близким к единице. Основное их преимущество перед другими флуорофорами - это узость полосы испускания, причем средняя длина волны испускания зависит от размера самой квантовой точки (Michalet, X., et al. Quantum dots for live cells, in vivo imaging, and diagnostics. Science 307, 538-44, 2005; Zdobnova, T.A. Fluorescent immunolabeling of cancer cells by quantum dots and antibody scFv fragment. J Biomed Opt. 14, 2009).
Мицеллы и липосомы, состоящие из различных липидов, в т.ч. присутствующих в мембранах клеток человека, обладают уникальными способностями для доставки лекарств непосредственно внутрь клеток-мишеней, а не только к их мембране (Euliss, L.E., DuPont, J.A., Gratton, S., DeSimone, Imparting size, shape, and composition control of materials for nanomedicine. J. Chem Soc Rev. 35 1095-104, 2006; Moghimi, S.M., Hunter, A.C., Murray, J.C. Long-circulating and target-specific nanoparticles: theory to practice. Pharmacol Rev. 53 283-318, 2001).
Магнитные наночастицы (Lubbe A.S., Alexiou C, Bergemann C. Clinical Applications of Magnetic Drug Targeting, Journal of Surgical Research 95, 200-206, 2001) обладают наиболее широким спектром возможностей за счет их уникальной физической природы. Такие частицы можно детектировать с высокой чувствительностью даже на значительном расстоянии от детектора, при этом пара- и диамагнитные окружающие материалы, такие как ткани организма, пластик и т.п., не вносят вклада в регистрируемый сигнал (Nikitin, М.Р., Vetoshko, P.M., Brusentsov, N.A., Nikitin, P.I., Highly sensitive room-temperature method of non-invasive in vivo detection of magnetic nanoparticles, J. Magn. Magn. Mat. 321, 1658-1661, 2009; Nikitin, M.P., Torno, M., Chen, H., Rosengart, A., Nikitin, P.I., Quantitative real-time in vivo detection of magnetic nanoparticles by their nonlinear magnetization, J. Appl. Phys. 103, 07A304, 2008), т.е. сигнал от немагнитных материалов равен нулю. Кроме того, такие частицы можно передвигать с помощью внешних магнитных полей, что открывает возможности для магнитной доставки лекарственных препаратов в определенную точку организма, предотвращая системную интоксикацию организма. В-третьих, магнитные наночастицы можно индукционно нагревать в переменных магнитных полях, что используется для гипертермии опухолей (Lubbe A.S., Alexiou С, Bergemann С.Clinical Applications of Magnetic Drug Targeting, Journal of Surgical Research 95, 200-206,2001).
Для биомедицины могут также оказаться чрезвычайно полезными вирусы и бактерии в качестве токсичных агентов или для генной доставки.
Кроме наночастиц существует большое количество необходимых и важных молекулярных соединений, без которых наномедицина не сможет справиться с поставленными перед ней задачами.
К наиболее важным следует отнести нацеливающие агенты, позволяющие избирательно направлять структуры к определенным клеткам. К этим соединениям относятся полноразмерные антитела и миниантитела (Weisser, N.E., Hall, J.C. Applications of single-chain variable fragment antibodies in therapeutics and diagnostics. Biotechnol Adv 27 502-20, 2009). Кроме того, нацеливание может быть осуществлено при помощи аптамеров (Levy-Nissenbaum, Е., Radovic-Moreno, A.F., Wang, A.Z., Langer, R., Farokhzad, O.C. Nanotechnology and aptamers: applications in drug delivery. Trends Biotechnol. 26 442-9, 2008), фолиевой кислоты (Low, P.S., Kularatne, S.A. Folate-targeted therapeutic and imaging agents for cancer, Curr Opin Chem Biol. 13 256-62, 2009), RGD-пептида (Temming, K., Schiffelers, R.M., Molema, G., Kok, R.J. RGD-based strategies for selective delivery of therapeutics and imaging agents to the tumour vasculature. Drug Resist Updat. 8 381-402, 2005), и др.
Следующий класс - это давно разрабатываемые цитотоксические вещества для поражения клеток. Большое количество допущенных для введения человеку лекарств, применяющихся в химиотерапии - как раз являются токсичными веществами, например, доксорубицин. Помимо этого, существует класс агентов для фотодинамической терапии (O'Connor, А.Е., Gallagher, W.M., Byrne, AT. Porphyrin and nonporphyrin photosensitizers in oncology: preclinical and clinical advances in photodynamic therapy. Photochem Photobiol. 85 1053-74, 2009). Такие вещества вырабатывают токсичный синглетный кислород или перекись водорода под действием света. За счет четкой фокусировки световых пучков можно добиться локализованного действия препарата.
Другой, не менее важный класс соединений взаимодействует с молекулами и клетками крови, тем самым увеличивая или сокращая время циркуляции по кровотоку. К таким соединениям, например, относится полиэтиленгликоль (ПЭГ) (Jain, A., Jain, S.K. PEGylation: an approach for drug delivery. A review. Crit Rev Ther Drug Carrier Syst. 25 403-47, 2008; Kang, J.S., Deluca, P.P., Lee, K.C. Emerging PEGylated drugs. Expert Opin Emerg Drugs. 14 363-80,2009).
Применения наночастиц in vivo требуют многофункциональности частиц, например сочетания способностей к диагностике заболевания и его терапии (Ito, A., Shinkai, М., Honda, Н., Kobayashi, Т. Medical application of functionalized magnetic nanoparticles. J Biosci Bioeng. 100, 1-11, 2005, Kim, J., Piao, Y., Hyeon, T. Multifunctional nanostructured materials for multimodal imaging, and simultaneous imaging and therapy. J. Chem Soc Rev. 38, 372-390, 2009; Nikitin, M.P., Zdobnova, T.A., Lukash, S.V., Stremovskiy, O.A., Deyev, S.M., Protein-assisted self-assembly of multifunctional nanoparticles. Proc Natl Acad Sci USA, 107, 5827-32 2010). Так, для лечения онкозаболеваний были бы полезны частицы, способные одновременно подтвердить злокачественную природу опухоли (за счет иммунохимии), визуализировать распространение опухоли (за счет, например, флуоресцентного сигнала) и убить раковые клетки (за счет токсичных веществ, нагрева и т.п.). Принципиально новые возможности для применения указанных агентов могут быть достигнуты путем объединения двух или нескольких агентов в единую структуру. Для решения таких задач чрезвычайно необходим способ, позволяющий осуществлять контролируемую, надежную и технологически простую сборку структур из заданных компонентов.
Известен способ (Заявка на патент США №2008/0261006 А1, дата публикации 23 октября 2008 г.), в котором получают структуры различного размера и функциональности за счет последовательного, слой за слоем, налипания веществ с противоположными зарядами на затравочную поверхность.
Недостатки известного способа заключаются в:
- невозможности получения структур из веществ, в роли которых выступают наночастицы, а не молекулярные соединения, т.к. заряд наночастицы недостаточен для удержания наночастицы на затравке;
- трудоемкость, связанная с необходимостью на каждом шаге отделять несвязавшееся вещество от получаемой структуры методами хроматографии.
Известен наиболее близкий к заявленному способ самосборки частиц, используемый при сепарации биомолекул из раствора (Заявка на патент США №2009/0182120 А1, дата публикации 16 июля 2009 г.), в котором первая частица связывает искомые биомолекулы, а затем сорбируется на второй большей частице, как правило, магнитной, т.е. образуется комплекс из двух частиц и биомолекул.
Недостатки этого известного способа состоят в:
- слабой и неспецифичной связи между двумя частицами;
- жестком ограничении, накладываемом на размер второй частицы, а именно, она должна быть больше микрона.
Изобретение решает задачу получения структур, собранных из частиц разных размеров, опосредующих различные функции (магнитные частицы, флуоресцентные, обладающие поверхностным-плазмонным резонансом, и др.), а также различной природы (неорганические кристаллы, ДНК, углеводы, бактерии, вирусы и др.), в которых обеспечено удерживание составных компонентов с повышенной силой и специфичностью. Такие структуры могут быть востребованы в качестве диагностических и терапевтических агентов, а их многофункциональность позволит использовать одну и ту же структуру как для диагностики, так и для терапии, а также обеспечить возможность комбинированного воздействия на патогенные ткани с помощью агентов различного механизма действия, то есть реализовать принцип «когда целое больше, чем сумма составляющих».
Изобретение позволяет получать моно- и многофункциональные структуры способом, отличающимся простотой получения структур, воспроизводимостью, возможностью включения в состав структур широкого набора компонентов различной природы, надежностью контроля за процессом самосборки. Получаемые структуры, в свою очередь, отличаются постоянством состава и стабильностью в широком диапазоне условий.
Поставленная задача решается за счет присоединения к составляемым компонентам белков пары барназа-барстар, отличающейся исключительно высокой силой и специфичностью взаимодействия, и дальнейшей самосборки компонентов в единую структуру.
Авторами настоящего изобретения установлено, что для преодоления недостатков способов предшествующего уровня техники могут быть использованы уникальные свойства пары белков: секретируемой рибонуклеазы барназы из Bacillus amyloliquefaciens (110 а.о.) и ее природного ингибитора - цитоплазматического белка барстара (89 а.о.). Эти белки способны быстро образовывать очень прочный комплекс, так как обладают уникально высоким сродством друг к другу (Kd~10-14 M) (Hartley R.W., Methods Enzymol. 2001. V.341. P.599-611.; Schreiber G., Mol. Biol. 2001. V.160. P.213-226.), сравнимым только с афинностью взаимодействия компонентов в стрептавидин-биотиновой системе (Kd~10-15 M) (Green N.M., Methods Enzymol. 1990. V.184. Р.51-67.). Барназа и барстар стабильны, хорошо растворимы и устойчивы к протеазам, что делает их совместимыми с бактериальной системой экспрессии и позволяет получать как в индивидуальном виде, так и в виде рекомбинантных белков (Hartley R.W., Methods Enzymol. 2001. V.341. P.599-611.; Schreiber G., Mol. Biol. 2001. V.160. P.213-226.). По данным рентгеноструктурного анализа N- и С-концы обоих белков расположены вне области их взаимодействия (Buckle А.М., Schreiber G., Fersht A.R., Biochemistry. 1994. V.33. P.8878-8889) и потому доступны для генно-инженерного слияния с нацеливающими мини-антителами и цитотоксическими агентами. В то же время, как показано с помощью динамического метода спин-метки, барстар и его комплекс с барназой являются «жесткими» белковыми образованиями (В.П.Тимофеев, Т.Г.Баландин, Я.В.Ткачев, В.В.Новиков, В.А.Лапук, С.М.Деев., Биохимия. 2007. Т.72. С.1220-1230.; Timofeev V.P., Novikov V.V., Tkachev Y.V., Balandin T.G., Makarov A.A., Deyev S.M., J. Biomol. Struct. Dyn. 2008. V.25. P.525-534.).
В отличие от других самоассоциирующихся (поли)пептидов и барназа, и барстар хорошо растворимы и стабильны в индивидуальном состоянии (без образования комплекса), что позволяет раздельно хранить указанные белки и получать на их основе надмолекулярные комплексы только по желанию исследователя. Более того, продемонстрировано, что в составе рекомбинантных белков барназа выступает в роли внутримолекулярного шаперона, увеличивая их растворимость и стабильность (Martsev S.P., Tsybovsky Y.I., Stremovsky О.А., Odincov S.G., Balandin T.G., Arosio P., Kravchuk Z.I., Deyev S.M., 2004. V.17. P.85-93.). Высокая конформационная стабильность барназы (температура плавления, Тм=54°С) обеспечивает также ее устойчивость к протеолитической деградации.
Сущность изобретения заключается в создании структур, содержащих в себе частицы разных размеров, опосредующих различные функции (магнитные частицы, флуоресцентные, обладающие поверхностным-плазмонным резонансом, и др.), а также различной природы (неорганические кристаллы, ДНК, углеводы, бактерии, вирусы и др.), а также в создании способа получения таких структур.
Для этого на первом этапе синтезируются блоки из указанных элементов и одного из комплементарных белков - барназы или барстара. Затем производится связывание двух блоков, на одном из которых барстар, а на втором - барназа. К полученной структуре может быть добавлен третий блок и т.д.
Уникальная сила взаимодействия (сродства) между барназой и барстаром делает связывание частиц необратимым даже в высокосолевых буферных средах, что позволяет в том числе получать стабильные многофункциональные структуры для различных биоприменений. Уникальная специфичность взаимодействия делает возможным строгий контроль состава и строения получаемых структур.
Кроме того, использование нового способа получения самособирающихся структур на основе белковой пары барназа-барстар оставляет возможность использовать предложенный способ не только сам по себе, но и в сочетании с уже известными способами получения комплексов (ДНК-ДНК комплементарное взаимодействие, стрептавидин-биотиновая система, электростатическая сорбция и др.)
Кроме того, исследование и оптимизация протоколов связывания белков барназы и барстара с частями структуры (частицами) может быть осуществлено по количественной оценке поверхностной плотности посадки белков на частицах по ферментативной активности барназы на частицах или по ингибированию свободной барназы барстаром на поверхности частиц.
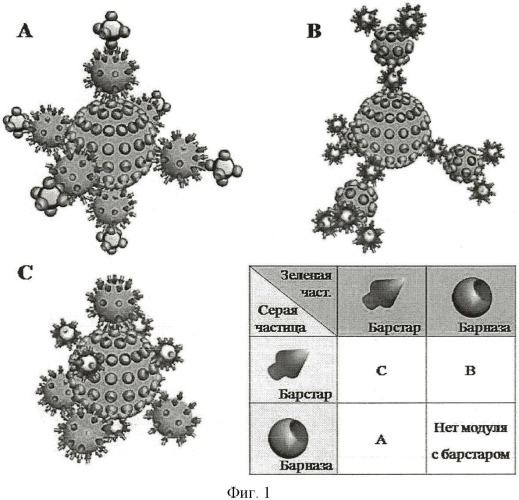
Строение получаемых структур зависит от алгоритма сборки. Выбирая различные комбинации частиц, конъюгированных с барназой или барстаром, а также, изменяя порядок их инкубации друг с другом, можно получать различные сложно устроенные структуры. Например, если есть три различные частицы, которые надо соединить, можно получить три принципиально различные структуры, показанные на фигуре 1. Структуры изображены схематически для более наглядного пояснения строения. Предположим, что наночастица-ядро покрыта барназой. Тогда, существует четыре комбинации покрытия белками двух других частиц, отображенные на таблице фигуры 1. Однако в случае, когда все частицы покрыты барназой, структура не может быть собрана: должен присутствовать хотя бы один модуль с барстаром. На самом деле, N модулей могут быть собраны не менее чем 2(N-1)-1 разными комбинаторными путями. Но, конечно, существует намного больше вариаций, если использовать какие-то частицы несколько раз с разными белками.
Кроме того, необходимо отметить, что размер стабильной структуры зависит от соотношения смешиваемых модулей. Легко пояснить это следующим образом. Если взять соотношение 1:∞ двух различных модулей, тогда «уникальная» частица будет быстро покрыта защитным слоем избыточного модуля и структура станет стабильное, т.е. не будет взаимодействовать с другими частицами. Однако, если взять, для простоты, два модуля из одинаковых частиц, один из которых покрыт барназой, а другой - барстаром, в соотношении 1:1, то модули начнут быстро аггломерировать, т.к. как только два различных модуля соберутся вместе, им будет одинаково легко присоединить как один, так и второй модуль, т.е. защитный слой из одних частиц не будет образовываться. Таким образом, данное изобретение может быть использовано для получения структур не только с настраиваемой функциональностью, но и размером.
Фигура 1. Возможные пути объединения трех наночастиц в суперструктуру. Полагая, что частица-ядро структуры покрыта барназой, таблица показывает соответствие вариаций покрытия двух других частиц барназой и барстаром номеру структуры (а, b, с). Структуры нарисованы схематически, для наглядности принципа строения.
Фигура 2. Фотографии собранных бифункциональных структур из 0,5-мкм магнитных частиц «Carboxyl 0.5-µm magnetic particles» (MagSense) и 53-нм полистирольных флуоресцентных частиц «Carboxyl Fluorescent Pink» (Spherotech). (А, В) Структуры собирали из модулей указанных магнитных частиц, конъюгированных с барназой, и полистирольных частиц, конъюгированных с барстаром, и фотографировали после отмывания несвязавшихся флуоресцентных частиц. (С, D) Контрольный эксперимент. Структуры собрали из модулей указанных магнитных частиц, конъюгированных с бычьим сывороточным альбумином, и полистирольных частиц, конъюгированных с барстаром, и фотографировали после отмывания несвязавшихся флуоресцентных частиц. (А, С) фотографии в белом свете, (В, D) - фотографии, сделанные при возбуждении флуорофора на полистирольных частицах. Флуоресценция полученных структур, собранных на основе пары барназа-барстар, оказалась намного сильнее, чем для пары БСА-барстар. Масштаб - 10 мкм.
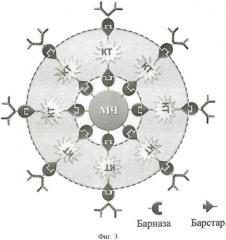
Фигура 3. Трифункциональные структуры были собраны из бифункциональных частиц, собранных как описано в примере 1, смешивая с генно-инженерной конструкцией [антитело-барназа] при комнатной температуре и инкубирую в течение 30 минут при комнатной температуре в фосфатно-солевом буфере с 0.5% Tween 20. Несвязавшиеся со структурами белки [антитело-барназа] отмывали, удерживая структуры магнитным полем.
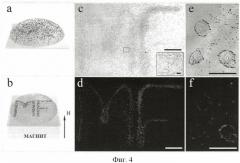
Фигура 4. Локализация клеток, меченных трифункциональными структурами, по контуру букв «MF» с помощью магнитного поля: (а) каплю суспензии клеток рака яичников (SKOV-3) после мечения собранными трифункциональными структурами наносили на покровное стекло, расположенное над ферромагнитной фольгой; (b) К фольге подносили магнит для намагничивания фольги так, чтобы создать градиент магнитного поля, который тянул клетки, меченные магнитными структурами, к контуру букв "MF"; (с) фотография образца в видимом свете без возбуждения квантовых точек; (d) - с возбуждением. Вставка фотографии (с) показывает ~30 клеток в поле зрения; (e, f) - фотография 3 индивидуальных клеток, меченных трифункциональными структурами. Масштаб: (c, d) - 1 мм, вставка (с), (e, f) - 50 мкм.
Фигура 5. Зависимость среднего размера полученных структур от отношения концентраций смешиваемых модулей. Модули 0.5-мкм магнитных частиц (MagSense), конъюгированных с барназой, и 53-нм флуоресцентных полистирольных частиц (Spherotech), конъюгированных с барстаром, инкубировали в течение ночи в различных соотношениях, но при постоянной концентрации магнитных частиц в растворе. Полученные структуры фотографировали и измеряли размер. При определенных соотношениях наблюдалось ограниченное агрегирование частиц в большие структуры. Приведены характерные фотографии частиц при трех отношениях модулей. Масштаб - 10 мкм.
Следующие далее примеры раскрывают наиболее предпочтительные воплощения данного изобретения и приведены исключительно с целью лучшего пояснения его сущности. Специалисту в данной области будет понятно, что можно осуществить множество модификаций как в отношении используемых средств и материалов, так и в отношении используемых способов без отступления за рамки изобретения.
Примеры:
Пример 1. Бифункциональные структуры, обладающие одновременно магнитными и флуоресцентными свойствами, полученные за счет сборки магнитных частиц с квантовыми точками
Для получения бифункциональных структур, обладающих одновременно магнитными и флуоресцентными свойствами, объединяли в единую структуру магнитные частицы на основе оксида железа с флуоресцентными квантовыми точками. В качестве ядра структуры были выбраны магнитные частицы, конъюгированные с барназой [МЧ-Бн]. Для простоты наблюдения структур в оптический микроскоп были использованы частицы SiMAG размером 500 нм и 1 мкм (Chemicell). В качестве второго модуля были использованы квантовые точки Q605 (Invitrogen), конъюгированные с барстаром [КТ-Бс]. Данные частицы были выбраны из-за их высокого квантового выхода и устойчивости к выгоранию. После ковалентного конъюгирования частиц с белками при помощи карбодиимидного метода (Hermanson, G.T., Bioconjugate Techniques (Academic, London), 2nd Ed., 2008) смешивали оба модуля при комнатной температуре и инкубировали в течение 30 минут при комнатной температуре в фосфатно-солевом буфере с 0.5% Tween 20. Квантовые точки были в 50-кратном мольном избытке по сравнению с МЧ. Структуры {[МЧ-Бн]+[КТ-Бс]}, удерживаемые магнитным полем, были отмыты от несвязанных модулей [КТ-Бс]. Для контрольных экспериментов МЧ конъюгировали с бычим сывороточным альбумином [МЧ-БСА] вместо барназы и использовали такие конъюгаты для проверки неспецифического связывания. Было показано, что специфическая самосборка двух модулей эффективнее неспецифического, по-крайней мере, в 256 раз, учитывая, что измерение интенсивности флуоресценции проводилось 8-битной ПЗС-матрицей.
Пример 2. Бифункциональные частицы, обладающие одновременно магнитными и флуоресцентными свойствами, полученные за счет сборки магнитных частиц с флуоресцентными полистирольными наночастицами
Подобные вышеописанным эксперименты были проведены и для другой пары частиц для демонстрации универсальности метода для сборки частиц разных размеров и химических свойств. Для этого использовались магнитные частицы диаметром 0,5 мкм «Carboxyl 0.5-µm magnetic particles» (MagSense) или 3-µm carboxyl magnetic beads (Spherotech), конъюгированные с барназой и флуоресцентные полистирольные частицы диаметром 53 нм «Carboxyl Fluorescent Pink» (Spherotech), конъюгированные с барстаром. В качестве контрольного эксперимента, смешивали магнитные частицы диаметром 0,5 мкм «Carboxyl 0.5-µm magnetic particles» (MagSense) или 3-µm carboxyl magnetic beads (Spherotech), конъюгированные с бычьим сывороточным альбумином (БСА), и флуоресцентные полистирольные частицы диаметром 53 нм «Carboxyl Fluorescent Pink» (Spherotech), конъюгированные с барстаром. Флуоресценция полученных структур, собранных на основе пары барназа-барстар, оказалась намного сильнее, чем для пары БСА-барстар, как показано на фигуре 2.
Пример 3. Оптимизация протоколов конъюгации частиц с барназой и барстаром за счет ферментативной активности барназы
Для ускорения самосборки и увеличения прочности связи между модулями важно увеличить содержание активных белков на поверхности. Под активными в настоящем описании понимаются белки, которые могут связываться с комплементарным белком, т.е. они находятся в нативной конформации и их центры связывания стерически доступны. Принимая во внимание тот факт, что барназа-барстар представляет собой пару РНКазы и ее ингибитора, использовали ферментную активность барназы для оценки поверхностной плотности активных белков на частицах. Для этого применяли дрожжевую РНК, поглощение которой при 260 нм возрастает при гидролизе барназой на поверхности частиц. По ингибированию барстаром гидролиза РНК барназой, определяли содержание барстара на поверхности частиц. С помощью данного метода контроля, протокол конъюгации был оптимизирован для увеличения плотности белков на поверхности частиц. Средняя плотность активной барназы на магнитных и полистирольных частицах была не менее чем 1 молекула на 640 нм2, т.е. среднее расстояние меду двумя активными молекулами было не более чем 25 нм.
Пример 4. Трифункциональные частицы, обладающие магнитными, флуоресцентными свойствами и сродством к раковому антигену: применение в качестве диагностического агента.
Для сборки более сложных структур используют большее количество различных модулей. В качестве другого примера были собраны трифункциональные структуры, содержащие третий противоопухолевый модуль на основе антитела. Такие структуры могут быть использованы для узнавания (с помощью антитела), мечения (квантовой точкой) и для разрушения (нагреванием магнитной частицы переменным магнитным полем) раковых клеток. В качестве третьего модуля был использован бифункциональный белок антитело-барназа-антитело (модуль [антитело-барназа]). В данном белке домен антитела представлен миниантителом 4D5, распознающим рецептор HER2/neu.
Трифункциональные структуры были собраны из бифункциональных частиц, описанных выше, путем связывания дополнительного слоя модуля [антитело-барназа] как показано на фигуре 3. Т.е. бифункциональные частицы, собранные как описано в примере 1, смешивали с генно-инженерной конструкцией [антитело-барназа] при комнатной температуре и инкубировали в течение 30 минут при комнатной температуре в фосфатно-солевом буфере с 0.5% Tween 20. Несвязавшиеся со структурами модули [антитело-барназа] отмывали, удерживая структуры магнитным полем.
Пример 5. Демонстрация трифункциональности полученных комплексов
Для демонстрации многофункциональности полученных в примере 4 трифункциональных структур был предложен следующий эксперимент. На сильный неодимовый дисковый магнит (диаметром 3 см) был помещен макет латинских букв «MF» (Multi-Functional - многофункциональный, англ.), сделанный из ферромагнитной фольги шириной 3 мм. Поверх фольги положили микроскопное покровное стекло толщиной 100 мкм. При этом магнитное поле притягивало магнитные частицы к краям фольги, т.е. к контуру букв «MF».
В качестве биологической цели для структур использовались адгезионные клетки аденокарциномы яичника SKOV-3, которые гиперэкспрессируют рецептор HER2/neu на мембране. Мы добавили суспензию полученных в примере 4 трифункциональных структур в фосфатно-солевом буфере с 0.2% Tween 20 к клеткам, прикрепленным ко дну чашки Петри, и инкубировали 40 минут при 4°С. После этого мы осторожно отмыли клетки от несвязавшихся структур 3 раза 0.2% раствором Tween 20 в фосфатно-солевом буфере. После этого клетки SKOV-3, меченные трифункциональными комплексами были ресуспендированы раствором Версена. Затем капля суспензии клеток была нанесена на покровное стекло, находящееся над ферромагнитной фольгой, как показано на фигуре 4 (а, b). После 5 минут распределение клеток на покровном стекле было изучено при помощи флуоресцентного микроскопа. Фигура 4 (с, е) - фотографии, снятые без возбуждения квантовых точек, (d, f) - с возбуждением. На фигуре 4 (c, d) ясно видно, что раковые клетки преимущественно располагаются в областях сильного магнитного поля и вычерчивают контур букв «MF». Это подтверждает, что МЧ в структурах действительно направили меченые клетки к источнику магнитного поля. Фигура 4 (d) - наглядно демонстрирует содержание в структурах КТ, благодаря которым формируется высококонтрастное флуоресцентное изображение распределенных клеток. Следовательно, этот пример подтверждает одновременную трифункциональность структур: обладание флуоресцентными и магнитными свойствами и нацеленными антителами на раковые клетки.
Результаты исследования взаимодействия структур с клетками более высокого разрешения представлены на фигуре 4 (e, f), на которых видны как индивидуальные структуры, так и кластеризация суперструктур на поверхности индивидуальных клеток из-за антитело-опосредственного взаимодействия. Легко заметить, что расположение ярких флуоресцентных точек хорошо совпадает с расположением магнитных частиц (черных точек), входящих в состав трифункциональных структур.
Для проверки специфичности связывания мы использовали контрольные модули [МЧ-БСА] в качестве ядра для структур. В контрольных экспериментах, в которых были использованы те же клетки и структуры ([МЧ-БСА]+[КТ-Бс]+[антитело-барназа]) не было обнаружено ни их взаимного связывания, ни флуоресценции в тех же условиях. Проведенные исследования говорят о высокой специфичности и многофункциональности полученных суперструктур.
Пример 7. Зависимость размера суперструктур от соотношения концентраций смешиваемых модулей
Модули 0.5-мкм магнитных частиц (MagSense), конъюгированных с барназой, и 53-нм флуоресцентных полистирольных частиц (Spherotech), конъюгированных с барстаром, инкубировали в течение ночи в различных концентрационных соотношениях, но при постоянной концентрации магнитных частиц в растворе. Полученные структуры фотографировали и измеряли размер получаемых структур. При определенных соотношениях наблюдалось ограниченное агрегирование частиц в большие структуры. Однако получаемые коллоиды были полидисперсны. Т.е. наряду с агломератами присутствовали и одиночные частицы, причем их мольная концентрация была выше, чем концентрация аггломератов, массовые же концентрации были приблизительно одинаковы. Средний размер аггломератов в зависимости от массового соотношения модулей показан на фигуре 5.
Пример 8. Самосборка конструкции из 20-мкм, 3-мкм, и 460-нм модулей.
Для демонстрации применимости метода сборки к широкому диапазону размеров модулей были собраны конструкции из 20-мкм полистирольных частиц, покрытых барназой, 3-мкм магнитных частиц, покрытых барназой, и 460-нм флуоресцентных частиц, покрытых барстаром. По своему строению собранные конструкции реализовывали тип строения, указанный на фигуре 1В. Сборка была осуществлена следующим образом: сначала были собраны бифункциональные частицы из модулей 3-мкм магнитной частицы и 460-нм флуоресцентной частицы, как описано в примере 1. Затем полученные конструкции были собраны с 20-мкм модулем так, что с поверхностью 20-мкм частиц взаимодействовали 460-нм модули, покрывающие 3-мкм модули.
1. Конструкция для диагностики и терапии, содержащая, по меньшей мере, два модуля, где каждый из модулей независимо представляет собой ядро, несущее на поверхности молекулы первого белка или молекулы второго белка, где первый белок представляет собой барназу, а второй белок представляет собой барстар, причем первый или второй белок для связывания с каждым из модулей следующие:- первый модуль несет на поверхности молекулы белка, выбранного из первого белка или второго белка;- второй модуль несет на поверхности молекулы белка, выбранного из первого белка или второго белка и отличного от белка, содержащегося в первом модуле;- третий и каждый последующий модуль несет на поверхности молекулы либо первого, либо второго белка,причем ядра, по крайней мере, двух из упомянутых модулей представляют собой частицы надмолекулярной природы.
2. Конструкция по п.1, в которой третий и каждый последующий модуль несет на поверхности молекулы белка, выбранного из первого белка или второго белка и отличного от белка, содержащегося в предыдущем модуле.
3. Конструкция по п.1 или 2, в которой ядра модулей независимо выбраны из группы, включающей частицы с магнитными свойствами, частицы с флуоресцентными свойствами, частицы, обладающие поверхностным плазменным резонансом, неорганические кристаллы, молекулы белков, молекулы ДНК, молекулы углеводов, клетки бактерий и вирусы.
4. Конструкция по п.1, в которой ядро одного модуля или ядра нескольких модулей независимо выбраны из группы, включающей частицы, обладающие одновременно несколькими функциональными свойствами (например, магнитными и флуоресцентными, магнитными и обладающие поверхностным плазменным резонансом, и т.п.) или представляющие собой конструкции, составленные из двух или более компонентов, выбранных из группы, включающей частицы с магнитными свойствами, частицы с флуоресцентными свойствами, частицы, обладающие поверхностным плазмонным резонансом, неорганические кристаллы, молекулы белков, молекулы ДНК, молекулы углеводов, клетки бактерий и вирусы.
5. Конструкция по п.1, размер которой зависит от соотношения концентраций смешиваемых модулей.
6. Конструкция по п.1, в которой частицы, обладающие поверхностным плазменным резонансом, представляют собой золотые или серебряные наночастицы, или наночастицы, покрытые золотой или серебряной оболочкой.
7. Конструкция по п.1, характеризующаяся тем, что первый белок и второй белок связаны с ядрами модулей связями, независимо выбранными из группы, включающей ковалентную связь, сорбционное взаимодействие, координационную связь.
8. Конструкция по п.1, характеризующаяся тем, что одно или несколько ядер модулей имеет размер от 1 нм до 3 мкм.
9. Конструкция по п.1, характеризующаяся тем, что одно или несколько ядер модулей имеет размер от 3 мкм до 100 мкм.
10. Способ создания конструкции по п.1, включающий:А) создание, по меньшей мере, двух модулей, где каждый из модулей независимо выполняют в виде ядра, несущего на поверхности молекулы первого белка или молекулы второго белка, где в качестве первого белка выбирают барназу, а в качестве второго белка выбирают барстар, причем первый или второй белок для связывания с каждым из модулей выбирают следующим образом:- первый модуль выполняют несущим на поверхности молекулы белка, выбранного из первого белка или второго белка;- второй модуль выполняют несущим на поверхности молекулы белка, выбранного из первого белка или второго белка и отличного от белка, содержащегося в первом модуле;- третий и каждый последующий модуль несет на поверхности молекулы либо первого, либо второго белка,Б) комбинирование первого, второго и последующих модулей, в котором модули самособираются в конструкции за счет взаимодействия молекул барназы и барстара, причем ядра, по крайней мере, двух из упомянутых модулей выполняют частицами надмолекулярной природы.
11. Способ по п.10, отличающийся тем, что конструкции отделяют от модулей, не связавшихся с другими модулями, поверхностями или конструкциями.
12. Способ по п.10, отличающийся тем, что ядра модулей независимо выбраны из группы, включающей частицы с магнитными свойствами, частицы с флуоресцентными свойствами, частицы, обладающие поверхностным плазменным резонансом, неорганические кристаллы, молекулы ДНК, молекулы углеводов, клетки бактерий и вирусы.
13. Способ по п.10, в котором размер образующихся конструкций зависит от соотношения концентраций смешиваемых модулей.
14. Способ по п.10, отличающийся тем, что ядро одного модуля или ядра нескольких модулей независимо выбраны из группы, включающей частицы, обладающие одновременно несколькими функциональными свойствами (например, магнитными и флуоресцентными, магнитными и обладающие поверхностным плазменным резонансом, и т.п.) или представляющие собой конструкции, составленные из двух или более компонентов, выбранных из группы, включающей частицы с магнитными свойствами, частицы с флуоресцентными свойствами, частицы, обладающие поверхностным плазменным резонансом, неорганические кристаллы, молекулы ДНК, молекулы углеводов, клетки бактерий и вирусы.
15. Способ по п.10, отличающийся тем, что частицы, обладающие поверхностным плазменным резонансом, представляют собой золотые или серебряные наночастицы, или наночастицы, покрытые золотой или серебряной оболочкой.
16. Способ по п.10, характеризующийся тем, что первый белок и второй белок связаны с ядрами модулей связями, независимо выбранными из группы, включающей ковалентную связь, сорбционное взаимодействие, координационную связь.
17. Способ по п.10, характеризующийся тем, что одно или несколько ядер модулей имеет размер от 1 нм до 3 мкм.
18. Способ по п.10, характеризующийся тем, что одно или несколько ядер модулей имеет размер от 3 мкм до 100 мкм.
19. Способ по п.10, отличающийся тем, что процесс самосборки конструкций идет в биологической буферной системе.
20. Способ по п.10, отличающийся тем, что процесс самосборки конструкций идет в буферном солевом растворе.