Способ измерения эффектов компонентов на продукцию реакционноспособных форм кислорода в клетке
Иллюстрации
Показать всеИзобретение относится к области стоматологии, а именно к способам измерения реакционноспособных форм кислорода (ROS) в реальном времени. Способ измерения эффективности тестируемого компонента, находящегося в композиции для ухода за зубами, для уменьшения количества компонентов ROS в клетке, где клетка выбрана из группы, состоящей из лимфоцита, лимфобласта, макрофага, бактерии, факультативного анаэроба и их смесей, включающий контакт клетки с веществом, способным к флуоресценции; приведение клетки в контакт с тестируемым компонентом, выбранным из антиоксиданта; приведение клетки в контакт с ROS и стимулятором ROS; измерение флуоресценции клетки; сравнение флуоресценции клетки (варианты). Заявленный способ позволяет показать стоматологу то, насколько эффективным является средство для уменьшения образования количества ROS в клетках из ротовой полости. 2 н. и 11 з.п. ф-лы, 2 ил., 1 пр.
Реферат
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Реакционноспособные формы кислорода (ROS) представляют собой побочные продукты клетки, образованные посредством метаболизма кислорода, являются ответственными за окислительные повреждения клетки и могут являться причиной повреждения клеток, дисфункции клеток и клеточной смерти (апоптоза). Эффекты ROS на метаболизм клетки хорошо документированы. Накопление ROS в ткани может вызывать окислительное повреждение и, таким образом, может являться желательным уменьшать количества ROS в тканях. Является желательным мониторировать образование ROS в клетках, чтобы определить, являются ли ROS вовлеченными в заболевания, включая сердечно-сосудистые, воспалительные и инфекционные заболевания. Клетки в норме являются способными предотвращать окислительное повреждение от ROS с помощью ферментов, таких как супероксиддисмутаза или каталаза. Другие соединения также являются полезными для предотвращения такого повреждения, включая антиоксиданты, такие как витамины, мочевая кислота и глутатион. Такие соединения (например, антиоксиданты) могут играть важную роль в утилизации свободных радикалов и в защите организма-хозяина от патогенов.
Хотя разработано множество способов для изменения количеств ROS в ткани, существует немного способов для измерения внутриклеточных концентраций ROS в реальном времени. Возможность измерять количества ROS является важной, поскольку концентрации ROS могут изменяться, например, увеличиваться или уменьшаться, с течением времени.
Соответственно, существует постоянная заинтересованность в разработке и введении эффективных антиоксидантных композиций для предотвращения повреждения из-за ROS. Однако существует немного способов, обеспечивающих возможность измерять эффекты композиций на продукцию ROS в реальном времени. Таким образом, является желательным разработать способы, обеспечивающие возможность измерять эффекты компонентов на внутриклеточную продукцию ROS.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В соответствии с конкретными вариантами осуществления представлен способ, который можно использовать для измерения внутриклеточных концентраций ROS в реальном времени. Способ из вариантов осуществления может являться применимым для определения эффектов тестируемых компонентов на внутриклеточную продукцию ROS и окислительный стресс в клетке. Способы могут являться также применимыми для определения способности тестируемых компонентов уменьшать количество компонентов ROS в клетке, где ROS могут являться эндогенными или экзогенными для клетки.
Таким образом, конкретные варианты осуществления, описанные в настоящем документе, включают способ измерения эффекта, который тестируемый компонент оказывает на продукцию ROS в клетке. Способ включает приведение клетки в контакт с веществом, способным к флуоресценции, приведение клетки в контакт с тестируемым компонентом, приведение клетки в контакт с ROS или стимулятором ROS и измерение флуоресценции клетки. Кроме того, варианты осуществления включают измерение флуоресценции клетки после приведения клетки в контакт с веществом, способным к флуоресценции, и с ROS или стимулятором ROS, измерение флуоресценции клетки после приведения клетки в контакт с тестируемым компонентом, сравнение двух значений флуоресценции и определения, уменьшает ли тестируемый компонент количество ROS.
КРАТКОЕ ОПИСАНИЕ ФИГУР
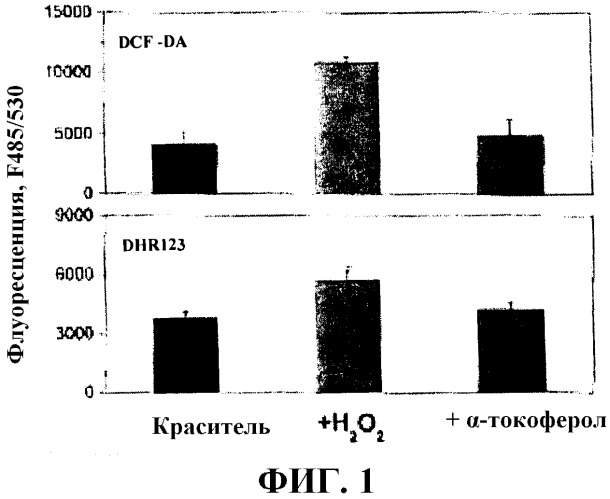
На Фиг. 1 показаны значения флуоресценции, полученные в примере 1; и
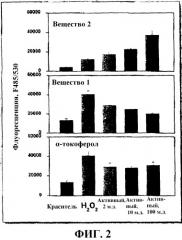
На Фиг. 2 показаны значения флуоресценции для различных тестируемых компонентов, как описано в примере 1.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как применяют на протяжении этого описания, диапазоны используют в качестве краткого обозначения для описания всех без исключения значений, находящихся в пределах диапазона. Любое значение внутри диапазона можно выбрать в качестве конца диапазона. Кроме того, полное содержание всех ссылок, процитированных в настоящем документе, таким образом приведено в качестве ссылки. В случае конфликта определения в настоящем описании и в процитированной ссылке, настоящее описание обладает преимуществом.
Если не указано иначе, все проценты и количества, указанные в настоящем документе и где-либо еще в описании, следует понимать как относящиеся к процентам по массе. Данные количества основаны на активной массе вещества.
На протяжении этого описания, использование терминов в единственном числе не предназначено для ограничения вариантов осуществления формой единственного числа предмета. Например, выражение «компонент» может обозначать отдельный компонент или множество компонентов. Компонент в вариантах осуществления включает в себя химические соединения, малые и большие пептиды и белки, ДНК, экспрессирующую малые и большие пептиды и белки, и т.п.
Способ включает в себя приведение клетки в контакт с веществом, способным к флуоресценции при окислении или восстановлении, приведение клетки в контакт с тестируемым компонентом, приведение клетки в контакт с ROS или стимулятором ROS, и измерение флуоресценции клетки. Предпочтительно, вещество, способное к флуоресценции, представляет собой краситель, флуоресцирующий при окислении, более предпочтительно, краситель, выбранный из диацетата 2,7-дихлорфлуоресцеина (DCF-DA), дигидрородамина (DHR 123) и их смеси. Способ включает в себя также применение вещества, способного к флуоресценции при восстановлении.
Предпочтительный способ включает в себя применение антиоксиданта в качестве тестируемого соединения. Другой предпочтительный способ включает в себя в качестве ROS образующее ионы кислорода соединение, образующее свободные радикалы соединение, пероксид или их сочетания. Предпочтительно, ROS представляет собой пероксид, и более предпочтительно, пероксид водорода. Другие предпочтительные способы включают в себя применение стимулятора ROS, такого как медиатор воспаления.
Способ из предпочтительных вариантов осуществления включает в себя также в качестве стимулятора ROS: (i) бактериальный эндотоксин, экзотоксин или их сочетания; или (ii) липополисахарид, липоолигосахарид, или их сочетания. Предпочтительно, ROS представляет собой липополисахарид.
Клетки, применимые в различных способах из предпочтительных вариантов осуществления, включают в себя иммунную клетку, лимфоцит, лимфобласт, макрофаг, ядросодержащую клетку, например, ее митохондрии, или их смеси. Клетка может являться иммортализованной или присутствовать в культуре клеток. Предпочтительно, клетка обладает клеточной стенкой, поддающейся проникновению красителя. Кроме того, краситель может накапливаться в митохондриях клетки. Является предпочтительным отмывать клетки от всего избытка красителя.
В способе из предпочтительных вариантов осуществления тестируемое соединение транспортируют в клетку, либо активно, либо пассивно. Предпочтительно, клетки отмывают от всего избытка тестируемого соединения. Таким же образом ROS или стимулятор ROS (например, медиатор воспаления) предпочтительно транспортируют в клетку, либо активно, либо пассивно, и является предпочтительным отмывать клетки от всего избытка ROS или стимулятора ROS.
В соответствии с различными аспектами предпочтительных вариантов осуществления клетку сначала приводят в контакт с веществом, способным к флуоресценции при окислении или восстановлении, предпочтительно, красителем. Красители, применимые в настоящих вариантах осуществления, включают в себя красители, флуоресцирующие при окислении или восстановлении. Предпочтительно, такие красители флуоресцируют при окислении или восстановлении, например, посредством ROS. Является предпочтительным использовать красители, которые контактируют с клетками в нефлуоресцентной форме, и затем флуоресцируют при реакции с ROS, например, ROS, либо продуцируемым внутри клеток, либо введенным из внешних источников. Некоторые применимые красители, обладающие этими свойствами, известны специалистам в данной области, и могут включать в себя красители типа флуоресцеина, такие как диацетат 2,7-дихлорфлуоресцеина (DCF-DA). DCF-DA представляет собой проникающий через мембрану краситель, который может диффундировать через липидную мембрану клеток. Он является нефлуоресцентным, когда не активен, и образует высокофлуоресцентный дихлорфлуоресцеин (DCF) при его окислении посредством ROS. Другие красители, применимые по настоящему изобретению, могут включать в себя производные и аналоги флуоресцеина, такие как дигидрородамин (DHR 123), который является аналогом DCF-DA. DHR123 накапливается в митохондриях и, таким образом, может являться особенно полезным для определения уровней ROS в них. Другие применимые красители могут включать в себя производные флуоресцеина, такие как Oregon Green, Tokyo Green, карбоксисеминафтофлуоресцеин (SNAFL - доступен из Molecular Probes, (Invitrogen Corp.), Carlsbad, CA), карбоксинафтофлуоресцеин, красители Alexa Fluor (например, Alexa 488 - также доступны из Molecular Probes, (Invitrogen Corp.), Carlsbad, CA), красители DyLight Fluor (например, DyLight 488, коммерчески доступный из Thermo Fisher Scientific, Waltham, MA), и красители HiLyte Fluor (коммерчески доступны из AnaSpec, San Jose, CA). Клетки можно инкубировать с красителем, чтобы позволить включение красителя в клетку. Затем клетки можно промывать для удаления остаточного красителя.
После мечения с помощью красителя клетки можно подвергать воздействию одного или нескольких тестируемых соединений. Такие тестируемые соединения предпочтительно вводят в клетку посредством активного или пассивного транспорта, например, диффузии, и они предпочтительно задерживаются внутри клетки. Клетки можно инкубировать в присутствии таких тестируемых соединений, и затем промывать для удаления остаточных тестируемых соединений.
После обработки тестируемым соединением, клетку затем предпочтительно подвергают воздействию ROS. ROS, как правило, включают в себя ионы кислорода, свободные радикалы и пероксиды как неорганические, так и органические, и соединения, образующие такие ионы кислорода и свободные радикалы внутри клетки. ROS (или агенты ROS) известны специалистам в данной области и, как правило, представляют собой малые молекулы, которые являются высокореакционноспособными из-за присутствия неспаренных электронов валентной оболочки. Примеры пероксидов включают в себя гидропероксиды, пероксид водорода, пероксиды щелочных и щелочноземельных металлов, органические пероксисоединения, пероксикислоты и их смеси. Клетки можно подвергать воздействию агентов ROS из внешнего источника, где клетку можно инкубировать в среде, содержащей агент ROS, чтобы позволить клетке включать агент ROS внутрь клетки, например, посредством активного или пассивного транспорта. Затем клетки можно промывать для удаления остаточных ROS, не включенных в клетку.
В одном варианте осуществления настоящего изобретения ROS можно приводить в контакт с клеткой в сочетании с соединением, индуцирующим продукцию ROS, например, стимулятором ROS, таким как медиатор воспаления, где медиатор вызывает или является известным как вызывающий продукцию ROS в клетке. В другом варианте осуществления клетку приводят в контакт со стимулятором ROS в отсутствие дополнительного агента ROS. Как известно в данной области, медиатор воспаления может включать в себя бактериальный токсин, например, эндотоксин или экзотоксин, такой как липополисахарид или липоолигосахарид. Клетку можно инкубировать с ROS и медиатором воспаления, так чтобы позволять ROS и медиатору воспаления входить в клетку. Затем клетку можно промывать для удаления остаточного ROS и медиатора воспаления. Альтернативно, клетку можно инкубировать с медиатором воспаления, чтобы позволять медиатору воспаления входить в клетку. Затем клетку можно промывать для удаления остаточного медиатора воспаления.
Способы из вариантов осуществления, описанных в настоящем документе, включают в себя измерение флуоресценции клеток, которые приводили в контакт с различными компонентами. Способы включают в себя измерение флуоресценции после приведения клеток в контакт с веществом, способным к флуоресценции, и ROS или стимулятором ROS, и затем измерение флуоресценции после приведения клеток в контакт с этими компонентами и тестируемым соединением. Флуоресценцию можно определять любым способом, известным в данной области и легко доступным. Такие известные и коммерчески доступные способы включают в себя оптический способ с массивом живых клеток или системы получения изображения с помощью микроскопа. Как хорошо известно, флуоресценцию, как правило, измеряют при возбуждении и при излучении. Обычные специалисты в данной области способны измерять и определять флуоресценцию с использованием руководства, представленного в настоящем документе.
Без желания быть связанными какой-либо теорией, считают, что способы по настоящему изобретению позволяют анализ в реальном времени эффектов тестируемых соединений на внутриклеточные уровни ROS. Посредством включения компонента, способного к флуоресценции, тестируемого соединения и затем ROS/медиатора воспаления в клетки, можно измерять антиоксидантную активность тестируемого соединения посредством измерения флуоресценции клетки. Компонент, способный к флуоресценции при окислении или восстановлении, предпочтительно, краситель, как правило, обладает некоторой фоновой флуоресценцией, но при связывании со свободными радикалами интенсивность флуоресценции увеличивается. Это увеличение интенсивности флуоресценции можно легко измерять. Тестируемые соединения можно добавлять к клеткам, чтобы оценить их способность уменьшать образование свободных радикалов ROS (или уничтожать их посредством реакции), и если они способны уменьшать образование свободных радикалов, интенсивность флуоресценции должна уменьшаться.
Соответственно, тестируемое соединение, обладающее большей способностью ингибировать ROS, приводит к реакции, в которой меньше ROS является способным реагировать с красителем, и таким образом, присутствует уменьшенная флуоресценция. С другой стороны, тестируемое соединение, которое не ингибирует ROS, приводит к реакции, в которой большее количество ROS является способным реагировать с красителем, и таким образом, присутствует увеличенная флуоресценция. Клеточную флуоресценцию можно мониторировать в течение периода минут, часов или суток для определения эффекта тестируемого соединения на ROS/медиатор воспаления.
В одном варианте осуществления клетку приводят в контакт с красителем перед приведением в контакт с тестируемым соединением. Необязательно, клетку приводят в контакт с тестируемым соединением перед приведением в контакт с ROS и/или стимулятором ROS. В другом варианте осуществления ROS вводят в клетку, например, ROS является экзогенным для клетки.
Клетки, применимые в предпочтительных способах, включают в себя ядросодержащие клетки, имеющие митохондрии. Клетки могут являться иммортализованными, например, клетки злокачественных опухолей, и могут являться иммунными клетками, такими как клетки лимфоциты или лимфобласты. Такие клетки можно культивировать любым числом способов, известных специалистам в данной области. Клетки можно культивировать также непосредственно на месте во время процедуры операции или обследования, и затем тестировать в реальном времени для оценки эффектов конкретных тестируемых соединений на ингибирование клеточной продукции ROS.
Способы из вариантов осуществления являются применимыми для определения эффектов, которые соединения оказывают на продукцию ROS в клетках. Как указано выше, известно, что образование свободных радикалов в клетке является нежелательным, часто приводя к клеточной смерти. Например, конкретные бактерии оказывают эффект индукции образования свободных радикалов в клетках человека и следовательно, повреждения клеток. Способы, описанные в настоящем документе, позволяют определять тестируемые соединения, которые могут уменьшать образование свободных радикалов (приводя к более низкой интенсивности флуоресценции) и, таким образом, могут являться применимыми для противодействия повреждающим эффектам бактерий.
Множество таких бактерий существует в полости рта и на слизистой оболочке полости рта. Бактерии могут вызывать любое количество повреждающих эффектов. Например, в качестве клеток в предпочтительных вариантах осуществления можно использовать бактериальные клетки, предпочтительно, факультативные анаэробные клетки. Тогда способ позволяет измерить способность конкретных тестируемых соединений уменьшать образование свободных радикалов для таких клеток.
Способы из вариантов осуществления, таким образом, можно использовать на месте для определения эффективной терапии (введения эффективного тестируемого соединения, в достаточной степени уменьшающего флуоресценцию) для лечения конкретных клеток, чувствительных к образованию свободных радикалов. Способы из вариантов осуществления являются также применимыми для демонстрации эффективности конкретных соединений (или композиций, содержащих эти соединения) для конкретных клеток, например бактериальных клеток. Например, способ можно использовать, чтобы показать стоматологу, насколько эффективным является конкретное средство для чистки зубов для уменьшения образования свободных радикалов в бактериальных клетках, обычно обнаруживаемых во рту человека. Способ можно использовать также в качестве инструмента сравнения в маркетинге продукта путем показа сравнений между продуктами (например, средствами для чистки зубов от различных конкурентов).
Предпочтительные варианты осуществления изобретения в настоящее время описаны по отношению к следующему неограничивающему примеру. Пример является только иллюстративным и никаким образом не ограничивает объем изобретения, как описано и заявлено в формуле изобретения.
ПРИМЕР
Клетки гистоцитарной лимфомы человека U937 (ATCC, Manassas, VA) первоначально культивировали в среде RPMI-1640 media (ATCC, Manassas, VA), содержащей 10% сыворотку и 1% пенициллин, и затем переносили в концентрации 2×105 клеток/мл в среду, содержащую 1 нг/мл PMA на 48 часов при 37°C. Клетки подвергали голоданию в течение ночи в бессывороточной культуральной среде перед подверганием воздействию красителя.
Клетки дважды промывали буфером PBS и разделяли на два набора для инкубации с DCF-DA или DHR123 (Calibochem, La Jolla, CA) в течение 30 минут при 30°C. Клетки дважды промывали PBS для удаления остаточного красителя. Обеспечивали также соответствующие экспериментальные контроли.
Затем клетки разделяли на несколько групп, и различные количества 1% раствора α-токоферола (Витамин E), вещества 1 или вещества 2 добавляли к каждой группе и инкубировали при 37°C в течение 15 минут. Затем клетки дважды промывали PBS для удаления остаточных количеств тестируемых соединений. Затем добавляли агенты ROS H2O2 и LPS и инкубировали в течение различных периодов времени. Затем флуоресценцию клеток считывали при возбуждении 485 нм и излучении 530 нм в течение вплоть до 5 часов.
Как показано на фиг. 1 и 2, для клеток, окрашенных только красителем, например, DCF-DA и DHR123, показали фоновую флуоресценцию. Ссылаясь на фиг. 1, через два часа инкубации, клетки, инкубированные в отсутствие тестируемого соединения, но в присутствии ROS при 2,5 мМ и стимулятора ROS, флуоресцируют сильнее, чем клетки, инкубированные в присутствии тестируемого соединения (α-токоферола) и ROS при 2,5 мМ, и стимулятора ROS.
Анализ флуоресценции клеток таким образом позволяет выполнить мониторинг внутриклеточного окислительного стресса в реальном времени, что можно использовать для скрининга тестируемых соединений. Измерение флуоресценции клеток можно осуществлять с помощью оптического способа с массивом живых клеток и/или систем получения изображения с помощью микроскопа в отдельных клетках.
Ссылаясь на фиг. 2, 2 м.д., 10 м.д., или 100 м.д. α-токоферола, вещества 1 и вещества 2 инкубировали с клетками. На фиг. 2 показано, что в присутствии 2,5 мМ пероксида водорода, 2 м.д. α-токоферола и вещества 1 вступают в реакцию с ROS и уменьшают уровень окисления приблизительно на 30%. При 10 м.д. и 100 м.д. для α-токоферола не показали увеличенной способности утилизации ROS или свободных радикалов; однако, 100 м.д. вещества 1 уменьшали уровень окисления на 50%. На фиг. 2 показано также, что вещество 2 усиливало уровень окисления и что вещество 2 увеличивало почти в 3 раза уровень свободных радикалов при 100 м.д., по сравнению с 2 м.д.
Специалистам в данной области понятно, что изменения и исправления можно вносить в варианты осуществления, описанные выше, без отклонения от идеи изобретения в широком смысле. Таким образом, понятно, что это изобретение не ограничено конкретными описанными вариантами осуществления, но предназначено, чтобы охватывать модификации в пределах сущности и объема настоящего изобретения.
1. Способ измерения эффективности тестируемого компонента, находящегося в композиции для ухода за зубами, для уменьшения количества компонентов реакционноспособных форм кислорода (ROS) в клетке, где клетка выбрана из группы, состоящей из лимфоцита, лимфобласта, макрофага, бактерии, факультативного анаэроба и их смесей, включающий:а. приведение клетки в контакт с веществом, способным к флуоресценции;b. приведение клетки в контакт с тестируемым компонентом, выбранным из антиоксиданта;c. приведение клетки в контакт с ROS и стимулятором ROS, где ROS выбрана из группы, состоящей из образующего ионы кислорода соединения, образующего свободные радикалы соединения, пероксида и их смесей, и где стимулятор ROS выбран из группы, состоящей из бактериального экзотоксина и их смесей, или стимулятор ROS содержит липополисахарид; иd. измерение флуоресценции клетки.
2. Способ по п.1, где вещество, способное к флуоресценции, представляет собой краситель, флуоресцирующий при окислении.
3. Способ по п.2, где краситель выбран из группы, состоящей из диацетата 2,7-дихлорфлуоресцеина (DCF-DA), дигидрородамина (DHR 123) и их смесей.
4. Способ по п.1, где вещество, способное к флуоресценции, представляет собой краситель, флуоресцирующий при восстановлении.
5. Способ по п.3, где ROS представляет собой пероксид.
6. Способ по п.5, где пероксид представляет собой пероксид водорода.
7. Способ по п.1, где клетка обладает стенкой, поддающейся проникновению вещества, способного к флуоресценции.
8. Способ по п.1, где тестируемый компонент транспортируют в клетку.
9. Способ по п.1, где тестируемый компонент транспортируют в клетку активно или пассивно.
10. Способ по п.1, где ROS транспортируют в клетку посредством активного или пассивного транспорта.
11. Способ по п.1, где клетка флуоресцирует.
12. Способ по п.1, где способом измеряют содержание ROS в клетке.
13. Способ измерения эффективности тестируемого компонента, находящегося в композиции для ухода за зубами, для уменьшения количества компонентов ROS в клетке человека, где клетка выбрана из группы, состоящей из лимфоцита, лимфобласта, макрофага, бактерии, факультативного анаэроба и их смесей, включающий:а. приведение клетки в контакт с веществом, способным к флуоресценции;b. приведение клетки в контакт с тестируемым компонентом, выбранным из антиоксиданта;с. измерение флуоресценции клетки;d. приведение клетки в контакт с ROS и стимулятором ROS, где ROS выбрана из группы, состоящей из образующего ионы кислорода соединения, образующего свободные радикалы соединения, пероксида и их смесей, и где стимулятор ROS выбран из группы, состоящей из бактериального экзотоксина и их смесей, или стимулятор ROS содержит липополисахарид;е. измерение флуоресценции клетки; иf. сравнение флуоресценции клетки из (с) с флуоресценцией из (е) и определение эффективности тестируемого компонента для уменьшения количества ROS.