Способы и средства
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно медицинской иммунологии. Сущность способа идентификации соединения для лечения состояния, связанного с накоплением апоптотических клеток состоит в том, что проводят определение способности белкового продукта гена ароЕ к стимулированию фагоцитоза апоптотических клеток макрофагом в присутствии тестируемого соединения. Увеличение фагоцитоза апоптотических клеток в присутствии тестируемого соединения по отношению к случаю его отсутствия указывает на то, что соединение может быть полезным при лечении состояния, связанного с пониженной активностью эндогенного АроЕ. Способ получения соединения для лечения состояния, связанного с накоплением апоптотических клеток, включает определение способности полипептида АроЕ стимулировать поглощение апоптотических клеток макрофагом в присутствии тестируемого соединения, стимулирующего фагоцитоз апоптотических клеток. Увеличение поглощения апоптотических клеток в присутствии тестируемого соединения по отношению к случаю его отсутствия указывает, что соединение является полезным в лечении состояния и может быть выделено. Способ лечения состояния включает повышение экспрессии и/или активности АроЕ у указанного индивида путем введения полипептида АроЕ или его миметика указанному индивиду. Использование заявленного изобретения позволяет оптимизировать способы и средства стимулирования фагоцитоза. 4 н. и 12 з.п.ф-лы., 8 ил., 1 пр.
Реферат
Настоящее изобретение относится к способам и средствам для стимулирования фагоцитоза и, в частности, фагоцитоза апоптотических клеток.
Аполипопротеин-Е (ароЕ) наряду с аполипопротеином-В составляет основную долю белков, присутствующих в богатых триглицеридами частицах липопротеинов - ЛНП и ЛОНП.
Компонент АпоЕ является лигандом рецептора ЛНП (РЛНП) и семейства родственных рецептору ЛНП белков или ЛРБ (LRPs, LDL-receptor-related proteins) [Herz, J. and U. Beffert. 2000. Nat Rev Neurosci 1:51]. Гомозиготная делеция гена ароЕ у мышей оказывает значительный эффект на транспорт холестерина, что приводит к значительному увеличению содержания ЛНП и ЛОНП в плазме вследствие отсутствия РЛНП и ЛРБ опосредовать удаление этих липопротеинов из крови [Moghadasian, M.H. et al 2001. Faseb J 15:2623', Zhang, S.H. et al 1992. Science 258:468]. Наиболее явной фенотипической особенностью мышей, дефектных по ароЕ, является формирование липидных поражений сосудов (бляшек), напоминающих ранний атеросклероз у людей, даже при диете с нормальным содержанием жиров.
У человека встречаются три основных аллельных варианта гена ароЕ, обозначаемых ароε2, ε3 и ε4, кодирующих АроЕ2, Е3 и Е4 соответственно.
Каждый из АроЕ2 и Е4 отличается от наиболее распространенного изотипа Е3 единственной аминокислотной заменой. Присутствие хотя бы одной копии аллели ароε4 приводит к увеличению риска развития коронарной болезни сердца по сравнению с гомозиготой ароε3 дикого типа [например, см. Davignon, J., et al 1988. Arteriosclerosis 8:1; Eichner, J.E. et al. 2002. Am J Epidemiol 155:487]. Присутствие аллели арое2 связано с комплексными нарушениями метаболизма липопротеинов, например гиперлипопротеинемией III типа, и было связано как с развитием, так и с подавлением атеросклероза в зависимости от модели исследования. Конкретные молекулярные основы связи между генотипом ароЕ и развитием сердечно-сосудистых заболеваний остаются неясными.
Присутствие аллели ароε4 связано с повышенным риском развития болезни Альцгеймера [Corder, Е.Н., et al 1993 Science 261:921, Poirier, J. et al 1993. Lancet 342:697, Mahley, R.W. et al 2000. Annu Rev Genomics Hum Genet 1:507] и повышенным риском развития остеопороза [Cauley, J.A. et al 1999. J Bone Miner Res 14:1175; Salamone, L.M., et al. 2000. J Bone Miner Res 15:308.]. Действительно, связь между гаплотипом ароЕ и рядом широко распространенных заболеваний достаточно устойчива, так что ароЕ остается одним из нескольких локусов, который напрямую связан с продолжительностью жизни: аллель ароε2 широко распространена среди долгожителей, которым более 80 лет, что позволяет предположить, что данный генотип ароЕ способствует долгожительству [Schachter, F. et al 1994. Nat Genet 6:29}.
АроЕ также может регулировать локальное воспаление посредством сигнальных каскадов, опосредованных рецептором, независимых от транспорта липопротеинов. Например, АроЕ, а также связывающийся с рецептором пептид, состоящий из 14 аминокислот, который не связывает холестерин, оказались способными подавлять локальный воспалительный ответ на ишемию головного мозга в экспериментах in vivo [Lynch, J.R. et al. 2001. J Neuroimmunol 114:107 and Sheng, Н. et al 1998. J Cereb Blood Flow Metab 18:361]. Исследования на клеточных культурах позволяют предположить, что данный эффект может быть связан с подавлением функции макрофагов [Laskowitz, D.Т. et al 1997 J Neuroimmunol 76:70 and Laskowitz, D.T. et al 2001. Exp Neurol 167:74]. Исследования хронических инфекций у мышей, дефектных по ароЕ, приводят к аналогичному выводу, что АроЕ каким-то образом подавляет функцию макрофагов [Van Oosten, M. et al. 2001. J Biol Chem 276:8820 and Roselaar, S.Е. and A. Daugherty. 1998 J Lipid Res 39:1740. and de Bont, N. et al. 1999. J Lipid Res 40:680].
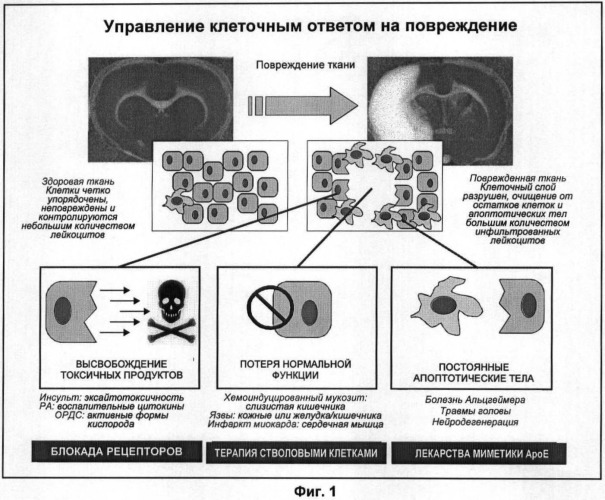
Настоящими изобретателями была обнаружена неожиданная роль белкового продукта гена ароЕ (аполипопротеинаЕ) в качестве регулятора уничтожения апоптотических клеток. Миметики АроЕ и другие соединения, которые стимулируют уничтожение апоптотических клеток, могут быть полезными при лечении ряда заболеваний.
В одном своем аспекте настоящее изобретение предусматривает способ выявления и/или получения соединения для лечения патологического состояния, связанного с уменьшением активности эндогенного АроЕ у индивида, включающий определение поглощения апоптотических клеток макрофагами в присутствии тестируемого соединения.
Поглощение апоптотических клеток макрофагами в присутствии тестируемого соединения можно сравнивать с поглощением в аналогичной реакционной среде и условиях, когда тестируемое соединение отсутствует. Увеличение поглощения апоптотических клеток в присутствии тестируемого соединения по сравнению со случаем, когда тестируемое соединение отсутствует, свидетельствует о том, что соединение может быть полезным при лечении патологического состояния, связанного с уменьшением активности эндогенного АроЕ.
В некоторых способах реализации макрофаги можно обработать тестируемым соединением до определения поглощения апоптотических клеток.
Патологическое состояние, связанное с уменьшением активности эндогенного АроЕ, может иметь генетическую природу (например, присутствие одной или более аллелей ароЕ4), определяться факторами окружающей среды (например, уменьшением образования АроЕ клетками под воздействием высокого уровня холестерина) или может являться болезненным состоянием, выбранным из группы, состоящей из болезни Альцгеймера, атеросклероза, инсульта и остеопороза.
В некоторых способах реализации поглощение можно определять в присутствии АроЕ. Например, способ может быть осуществлен при условиях, когда уровень АроЕ является нормальным, например с использованием макрофагов и апоптотических клеток дикого типа (в которых присутствует АроЕ) в буферном растворе с физиологическим уровнем содержания АроЕ. В таких способах реализации можно идентифицировать тестируемое соединение, которое представляет собой агонист АроЕ и которое увеличивает степень фагоцитоза относительно нормальных условий. В некоторых вариантах реализации настоящего изобретения способ может включать стадии обработки макрофагов тестируемым соединением и приведения макрофага в контакт с апоптотическим полипептидом.
В других способах реализации способ может быть осуществлен при отсутствии АроЕ, например, с применением дефектных по АроЕ макрофагов и апоптотических клеток (например, клеток, полученных от мышей, дефектных по ароЕ) при условиях, характеризующихся отсутствием АроЕ (например, с применением среды и буферном растворе, которые не содержат ароЕ). В таких способах реализации настоящего изобретения можно идентифицировать тестируемое соединение, которое воспроизводит функцию ароЕ при стимулировании фагоцитоза апоптотических клеток. Способ может включать определение поглощения дефектных по АроЕ апоптотических клеток дефектным по АроЕ макрофагом в условиях, характеризующихся отсутствием АроЕ, в присутствии тестируемого соединения.
В настоящем описании показано, что снижение эффективности уничтожения апоптотических клеток приводит к явному провоспалительному фенотипу. Способы, описанные в данной заявке, можно применять для идентификации соединений, имеющих противовоспалительные свойства. Соответствующие соединения стимулируют уничтожение апоптотических клеток, уменьшая необходимость рекрутирования большого числа фагоцитов к воспаленной ткани, уменьшая продукцию медиаторов воспаления вышеуказанными фагоцитами и тем самым оказывая системное противовоспалительное действие. В результате способы, описанные в данной заявке, можно применять для идентификации терапевтических агентов при широком спектре заболеваний с воспалительной составляющей, даже если такие заболевания явно не связаны со снижением функции АроЕ или с увеличением потребности уничтожения продуктов разрушения клеток.
В другом своем аспекте настоящее изобретение предусматривает способ идентификации и/или получения соединений для лечения или предотвращения патологических состояний, связанных с повышенной воспалительной активностью, включающий определение способности полипептида АроЕ стимулировать поглощение апоптотических клеток макрофагами в присутствии тестируемого соединения.
Стимулирование полипептидом АроЕ поглощения или фагоцитоза апоптотических клеток макрофагами в присутствии тестируемого соединения можно оценивать по сравнению с поглощением в аналогичной реакционной среде и условиях отсутствия тестируемого соединения. Увеличение поглощения апоптотических клеток в присутствии тестируемого соединения по сравнению с поглощением в его отсутствие может свидетельствовать о том, что соединение может быть полезным при лечении патологического состояния, связанного с повышенной воспалительной активностью.
Полипептид АроЕ может представлять собой полипептид АроЕ, происходящий от любого вида млекопитающих, например АроЕ мыши или АроЕ человека (например, АроЕ2, АроЕ3 или АроЕ4 человека) или может представлять собой его фрагмент или вариант, который сохраняет одну или более активностей белка дикого типа, в частности способность стимулирования фагоцитоза апоптотических клеток.
Например, полипептид АроЕ может иметь аминокислотную последовательность, которая имеет более около 30% идентичности (identity) с последовательностью АроЕ3 человека, более примерно 40%, более примерно 45%, более примерно 55%, более примерно 65%, более примерно 70%, более примерно 80%, более примерно 90% или более примерно 95%. Последовательность может иметь более около 30% сходства (similarity) с АроЕ3 человека, более примерно 40% сходства, более примерно 50% сходства, более примерно 60% сходства, более примерно 70% сходства, более примерно 80% сходства или более примерно 90% сходства.
Сходство и идентичность последовательностей обычно определяют согласно алгоритму GAP (Genetics Computer Group, Madison, WI). GAP использует алгоритм Нидлмана и Вунша (Needleman and Wunsch) для выравнивания двух полных последовательностей с максимальным числом совпадений и минимальным числом пробелов. Обычно применяют параметры по умолчанию при штрафе за создание пробела (gap creation penalty) = 12 и штрафе за продление пробела (gap extension penalty) = 4. Применение GAP может являться предпочтительным, но можно применять и другие алгоритмы, например, BLAST (который использует метод Альтшула и соавторов, Altschul et al. (1990) J. Mol. Biol. 215: 405-410), FASTA (который использует метод Пирсона и Липмана, Pearson and Lipman (1988) PNAS USA 85: 2444-2448) или алгоритм Смита-Уотермана (Smith and Waterman (1981) J. Mol Biol. 147: 195-197), или программу TBLASTN, Altschul et al. (1990) см. выше, обычно с применением заданных по умолчанию параметров. В частности, можно использовать алгоритм psi-Blast (Nucl. Acids Res. (1997) 25 3389-3402). Идентичность и сходство последовательностей можно также определить с применением программного обеспечения Genomequest™ (Gene-IT, Worcester MA USA). Сравнение последовательностей предпочтительно осуществляют относительно полноразмерной релевантной последовательности, описанной в данной заявке. Сходство допускает «консервативную изменчивость», то есть замену одного гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин, на другой, или замену одного полярного на другой, например аргинина на лизин, глутаминовой кислоты на аспарагиновую или глутамин на аспарагин.
В некоторых способах реализации настоящего изобретения полипептид АроЕ может представлять собой полипептид АроЕ млекопитающего, например АроЕ мыши, имеющий последовательность в базе данных под номером доступа ААН83351.1 или АроЕ человека, имеющий последовательность в базе данных под номером доступа Р02649 или NP_000032.1 или аллельный вариант, описанный в данной заявке.
Фрагмент полноразмерной последовательности может состоять из меньшего числа аминокислот, чем полная последовательность. Например, фрагмент может состоять из по меньшей мере 10, по меньшей мере 20, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 80, по меньшей мере 90 или по меньшей мере 100 аминокислот полноразмерной последовательности длины, но не более 290, не более 280, не более 270, не более 260, не более 250, не более 240, не более 230, не более 220, не более 210 или не более 200 аминокислот.
Патологические состояния, связанные с повышенной воспалительной активностью, могут включать рассеянный склероз, ревматоидный артрит, синдром раздраженного кишечника, болезнь Крона, инсульт, инфаркт миокарда, астму, аллергический ринит, экзему, псориаз и контактный дерматит с повышенной чувствительностью.
В некоторых способах реализации настоящего изобретения полипептид АроЕ находится на поверхности макрофага и/или апоптотических клеток. В других способах реализации настоящего изобретения полипептид АроЕ присутствует в реакционной среде.
В некоторых способах реализации настоящего изобретения способность тестируемого соединения стимулировать поглощение апоптотических клеток макрофагами можно определять в отсутствие АроЕ. Способ идентификации и/или получения соединения для лечения или предотвращения патологических состояний, связанных с повышенной воспалительной активностью, может включать определение поглощения одной или более дефектных по АроЕ апоптотических клеток макрофагами, дефектными по АроЕ, в присутствии тестируемого соединения.
Клетки, дефектные по АроЕ, можно, например, получить от дефектной по АроЕ мыши, которая может быть получена известными способам, как описано в данной заявке.
Поглощение дефектными по АроЕ апоптотических клеток макрофагами в присутствии тестируемого соединения можно оценивать по сравнению с поглощением в аналогичной реакционное среде без АроЕ и аналогичных условиях при отсутствии тестируемого соединения.
Накопление продуктов разрушения клеток у индивида, например, в результате повреждения ткани (например, травмы головы или огнестрельной раны) или выраженном инфекционном заболевании (таком, как бактериальный сепсис, панкреатит или перикардит) может привести к значительным медицинским осложнениям.
Способы, описанные в данной заявке, могут быть полезными для идентификации и/или получения соединений, которые стимулируют уничтожение апоптотических клеток, и могут быть полезным при лечении патологического состояния, связанного с накоплением апоптотических клеток.
Способ идентификации и/или получения соединения для лечения патологических состояний, связанного с накоплением апоптотических клеток, может включать определение способности полипептида АроЕ стимулировать поглощение апоптотических клеток макрофагами в присутствии тестируемого соединения.
Стимулирование поглощения или фагоцитоза апоптотических клеток макрофагами полипептидом АроЕ в присутствии тестируемого соединения можно сравнивать с поглощением в аналогичной реакционной среде и условиях отсутствия тестируемого соединения. Более сильное стимулирование в присутствии тестируемого соединения по сравнению со случаем его отсутствия свидетельствует о том, что соединение может быть полезным при лечении патологического состояния, связанного с накоплением апоптотических клеток.
В некоторых способах реализации настоящего изобретения полипептид АроЕ может находиться на поверхности макрофага и/или апоптотической клетки. В других способах реализации настоящего изобретения полипептид АроЕ может присутствовать в реакционной среде.
Патологические состояния, связанные с накоплением апоптотических клеток, включают повреждение тканей, травматическое повреждение мозга, острую дыхательную недостаточность, бактериальный сепсис, панкреатит или перикардит.
В некоторых способах реализации настоящего изобретения способность тестируемого соединения стимулировать поглощение апоптотических клеток макрофагами может быть определена в отсутствие АроЕ.
Способ идентификации и/или получения соединения для лечения или предотвращения патологических состояний, связанных с накоплением апоптотических клеток, может включать:
приведение в контакт дефектного по АроЕ макрофага с одной или более дефектной по АроЕ апоптотической клеткой в присутствии тестируемого соединения; и
определение поглощения макрофагами апоптотических клеток.
Поглощение апоптотических клеток дефектным по АроЕ макрофагом в присутствии тестируемого соединения можно сравнить с поглощением в аналогичной реакционной среде без АроЕ и условиях отсутствия тестируемого соединения.
Макрофаги представляют собой большие одноядерные фагоцитарные клетки, которые присутствуют в крови, лимфе и других тканях и поглощают чужеродные вещества и продукты разрушения клеток, включая апоптотические клетки. Макрофаги вовлечены как в специфический, так и в неспецифический иммунные ответы.
Макрофаг для применения в способах согласно настоящему изобретению может быть культивируемым макрофагом. Культивируемые макрофаги могут быть получены при помощи одного из ряда подходящих способов, включая, например, дифференцировку in vitro свежеприготовленных моноцитов периферической крови человека (например, под действием форболовых эфиров); дифференцировку in vitro моноцитарных клеточных линий, таких как миеломоноцитарная клеточная линия ТНР-1 человека; и получение перитонеальных макрофагов путем промывки брюшины животного (такого как мышь или крыса) стерильным буфером и культивирования образующегося в результате этого брюшинного экссудата.
Апоптотическая клетка представляет собой клетку, которая претерпевает или претерпела апоптоз или программируемую клеточную гибель. Апоптотическая клетка для применения в способах согласно настоящему изобретению предпочтительно представляют собой клетку млекопитающего и может происходить из той же ткани, из того же организма или организма того же вида, что и макрофаги или может происходить из другой ткани, организма и/или вида. Для удобства в способах настоящего изобретения можно применять апоптотические тимоциты.
В данной области техники известен ряд подходящих способов для получения апоптотических клеток, включающих, например, удаление сыворотки от культивируемых первичных лимфоцитов, обычно тимоцитов; обработку культивируемых клеток индукторами апоптоза, такими как Fas-лиганд или гранзим В; и выделение клеток, претерпевающих апоптоз, in vivo с применением селективных маркеров индукции апоптоза, располагающихся на поверхности клеток (например, связывание с аннексином V). Обычно более чем 50% используемой популяции клеток находятся в состоянии апоптоза, что определяют, например, при помощи окрашивания меченным аннексином V или окрашиванием на активированную каспазу 3.
Поглощение апоптотической клетки макрофагом можно определить любым из подходящих способов. Например, к макрофагу или популяции макрофагов добавляют фиксированное количество апоптотических клеток, например в серию дублированных лунок многолуночного планшета, варьируя от 0,1 апоптотической клетки на макрофаг до 1000 апоптотических клеток на макрофаг, обычно от 1 до 100 апоптотических клеток на макрофаг. В предпочтительных способах реализации настоящего изобретения тестируемое соединение присутствует в культуральной среде в то время, когда происходит фагоцитоз.
Макрофаги можно инкубировать с апоптотическими клетками в определенный период времени, в течение которого происходит фагоцитоз. Обычно инкубацию проводят при температуре между 25°C и 40°C, как правило, при 37°C. Длительность инкубации можно выбрать такую, при которой поглощается детектируемое число апоптотических клеток, но поглощается не более чем 50% от общего числа добавленных апоптотических клеток (чтобы доступность апоптотических клеток не стала лимитирующей для дальнейшего фагоцитоза). Инкубация может занимать, например, от 10 минут до 10 часов при 37°C, как правило, от 30 минут до 2 часов.
В некоторых способах реализации настоящего изобретения можно определить число или долю апоптотических клеток, которые поглотили макрофаги путем фагоцитоза. Это удобно выполнять путем детекции апоптотических клеток, которые были добавлены к макрофагам, и различения апоптотических клеток снаружи или на внешней поверхности, макрофагов и апоптотических клеток внутри или на внутренней поверхности макрофагов.
Апоптотические клетки можно детектировать любым пригодным способом, известным в данной области техники, это удобно выполнять с помощью предварительного мечения клеток до индукции апоптоза. Ряд подходящих меток и красителей коммерчески доступен, в том числе Cell Tracker Green (Molecular Probes Inc.). Меченые апоптотические клетки можно затем идентифицировать и подсчитать путем детекции метки в подходящих условиях, например при помощи микроскопии.
Апоптотические клетки, которые находятся снаружи или внутри, можно различить путем промывки макрофагов в условиях, при которых апоптотические клетки, которые находятся снаружи от (или на внешней поверхности) макрофагов, удаляют и не учитывают, тогда как апоптотические клетки, которые находятся внутри (или на внутренней поверхности) макрофагов остаются. Можно применять любой подходящий способ промывки, при котором удаляются внешние, но не внутренние апоптотические клетки, в том числе, например, многократные промывки холодным ФСБ-Дульбекко. После промывки можно подсчитать общее число поглощенных апоптотических клеток вместе с общим числом макрофагов, участвующих в фагоцитозе.
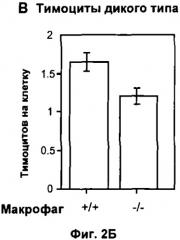
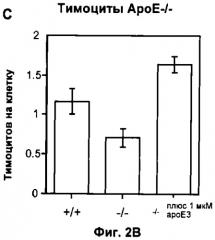
Скорость фагоцитоза можно вычислить на основе величины фагоцитоза, происходящего в течение определенного периода времени, и для удобства ее можно представить как количество апоптотических клеток (например, тимоцитов), поглощенных макрофагом за час. Обычно эта величина колеблется от 0,1 до 100 у клеток дикого типа при отсутствии стимулятора фагоцитоза. Например, для перитонеальных макрофагов мыши, поглощающих апоптотические тимоциты, эта величина может колебаться от 2 до 4, а для макрофагов, дефектных по ароЕ, поглощающих тимоциты, дефектные по АроЕ, эта величина может колебаться от 0,5 до 1.
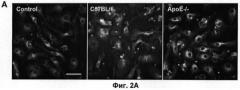
Эффект тестируемого соединения можно выразить в виде кратности изменения данной величины по сравнению с контрольными клетками, на которые не воздействовали данным соединением. Типичный ответ, полученный с применением рекомбинантного АроЕ человека в качестве тестируемого соединения, представлен на Фигуре 2.
Тестируемое соединение может быть добавлено в соответствующей концентрации, которую обычно определяют методом проб и ошибок, в зависимости от типа применяемого соединения, но которая обычно составляет от 10 пМ до 10 мМ, в основном от 1 нМ до 100 мкМ. Тестируемое соединение может быть добавлено в любой подходящий биосовместимый буфер, известный в данной области техники, в котором соединение достаточно хорошо растворимо, такой как ДМСО, этанол, метанол, ДМСО, ДМА, ДМФ или вода.
Обычно культивируемые макрофаги подвергают воздействию различных концентраций тестируемого соединения (включая контроли, на которых воздействуют только разбавителем), например тестируемое соединение может быть добавлено в продублированные лунки многолуночного планшета, в группах от двух до десяти лунок, как правило, от трех до пяти лунок. Клетки можно, кроме того, подвергать воздействию тестируемого соединения в течение различных временных интервалов, от нескольких минут до нескольких часов или более, обычно при 37°C.
Тестируемое соединение, пригодное для применения согласно способам настоящего изобретения, может быть малой химической молекулой, пептидом, молекулой антитела или другой молекулой, чье действие на фагоцитоз апоптотической клетки необходимо определить. Можно применять природные или синтетические химические соединения или растительные экстракты, которые содержат некоторое количество охарактеризованных или неохарактеризованных компонентов.
Подходящие тестируемые соединения могут быть соединениями, выбранными из коллекции, или сконструированными соединениями. Технология комбинаторных библиотек (Schultz, JS (1996) Biotechnol. Prog. 12:729-743) предоставляет эффективный способ тестирования потенциально большого числа различных веществ на способность стимулировать фагоцитоз апоптотических клеток.
В некоторых предпочтительных способах реализации настоящего изобретения соответствующее тестируемое соединение может быть пептидным фрагментом полипептида АроЕ млекопитающего, например АроЕ человека, или его аналогом, миметиком, производным или модифицированной формой. Например, пептидные фрагменты от 5 до 40 аминокислот, например от 6 до 10 аминокислот АроЕ, могут быть протестированы на способность стимулировать фагоцитоз апоптотических клеток.
Пептидные фрагменты АроЕ могут быть получены любым способом синтеза пептидов, известным в данной области техники, например химическим синтезом или путем экспрессии рекомбинантного гена in vitro или in vivo.
Пептиды АроЕ могут быть созданы целиком или частично путем химического синтеза. Пептид АроЕ, как здесь описано в данной заявке, может быть легко получен согласно общепринятым стандартным жидкостным или предпочтительно твердофазным способам пептидного синтеза, общее описание которых широко доступно (см, например, работу J.M.Stewart and J.D.Young, Solid Phase Peptide Synthesis, 2nd edition, Pierce Chemical Company, Rockford, Illinois (1984), работы М.Bodanzsky and A.Bodanzsky, The Practice of Peptide Synthesis, Springer Verlag, New York (1984); Applied Biosystems 430A Users Manual, ABI Inc., Foster City, California; Roberge, J.Y. et al. (1995) Science 269:202-204; Caruthers, М.H. et al. (1980) Nucl. Acids Res. Symp.Ser. 215-223; Horn, T. et al. (1980) Nucl. Acids Res. Symp. Ser. 225-232; and Merrifield J. (1963) J. Am. Chem. Soc. 85:2149-2154), или может быть получен в растворе, жидкофазным способом или при помощи любой комбинации твердофазного, жидкофазного способа или синтеза в растворе, например сначала путем получения соответствующей пептидной части и затем, если это является желательным и уместным, после удаления любой из присутствующих защитных групп, путем введения группы Х при помощи реакции с соответствующей карбоновой или сульфокислотой или их химически активным производным. Можно выполнять автоматизированный синтез, например, с применением пептидного синтезатора ABI 431 (Applied Biosystems).
Пептид АроЕ может иметь N-концевую кэпирующую (защитную) группу (например, ацетильную группу) и/или С-концевую кэпирующую группу, (например, амидную группу) для защиты концевого остатка от нежелательных химических реакций в ходе применения или для возможности осуществления последующего конъюгирования или манипуляций с пептидом. Например, модулирующие свойства пептидного фрагмента, как описано выше, можно усилить путем добавления одной из следующих групп к С-концу: хлорметилкетона, альдегида и бороновой кислоты. Эти группы являются аналогами переходного состояния [субстрата] для сериновых, цистеиновых и треониновых протеаз. N-конец пептидного фрагмента может быть блокирован карбобензилом для ингибирования аминопептидаза и увеличения стабильности (Proteolytic Enzymes 2nd Ed, Edited by R.Beynon and J.Bond Oxford University Press 2001).
Вновь синтезированный пептид может быть в значительной степени очищен препаративной высокоэффективной жидкостной хроматографией (Creighton, Т. (1983) Proteins, Structures and Molecular Principles, W H Freeman and Co., New York, N.Y.) или при помощи других аналогичных способов, доступных в данной области техники. Состав синтетических пептидов можно подтвердить анализом аминокислотного состава или секвенированием (например, при помощи деградации по методу Эдмана).
Получение рекомбинантного пептида АроЕ in vivo или in vitro можно осуществить путем экспрессии нуклеиновой кислоты, содержащей кодирующую нуклеотидную последовательность, с применением стандартных рекомбинантных способов.
Другие подходящие соединения могут быть основаны на моделировании 3-мерной структуры АроЕ и применении рационального дизайна лекарств, который обеспечивает потенциально активные соединения с конкретными характеристиками формы, размера и заряда молекулы. Способы и средства рационального дизайна лекарств хорошо известны в данной области техники.
Эффект соединения, идентифицированного описанным выше способом, можно оценить при вторичном скрининге. Например, действие соединения на один или более симптомов патологического состояния, описанного выше, можно определить in vivo на модельном животном.
Контрольные эксперименты могут быть выполнены в соответствии со способами, описанными в данной заявке. Постановка соответствующих контролей находится в пределах компетенции и способности специалиста в данной области техники.
Метод, как описано в данной заявке, может включать идентификацию тестируемого соединения как агента, стимулирующего, или повышающего, или увеличивающего фагоцитоз апоптотической клетки.
Идентифицированное соединение может быть изолировано и/или очищено. В некоторых способах реализации настоящего изобретения соединение может быть получено, синтезировано и/или произведено с применением стандартных способов синтеза.
Соединения, идентифицированные как агенты, стимулирующие фагоцитоз апоптотических клеток, с применением способа, описанного в данной заявке, факультативно могут быть модифицированы или подвергнуты технике рационального дизайна лекарств для оптимизации активности или обеспечения других полезных характеристик, таких как увеличение периода полувыведения или уменьшение побочных действий при введении индивиду.
Кроме того, можно проводить дальнейшую оптимизацию или модификацию для получения одного или более конечных соединений либо для in vivo или при клинических испытаниях.
Соединение, полученное способами согласно настоящему изобретению, описанными выше, может входить в состав композиции, например лекарственного препарата, фармацевтической композиции или лекарства, с фармацевтически приемлемым наполнителем, носителем, буфером, стабилизатором или другими веществами, хорошо известными специалисту в данной области техники.
Фармацевтически приемлемый наполнитель или другое вещество должен быть нетоксичным и не должен препятствовать действию активного компонента. Точная природа носителя или другого материала зависит от способа введения, который может быть пероральным, или путем инъекции, например, кожной, подкожной или внутривенной.
Способ создания фармацевтической композиции для применения при лечении патологического состояния, описанного в данной заявке, может включать;
идентификацию и/или получение соединения, стимулирующего фагоцитоз апоптотических клеток, с применением способа, описанного в данной заявке, и
смешивание идентифицированного таким образом соединения с фармацевтически приемлемым носителем.
Как описано выше, соединение может быть модифицировано для оптимизации его фармацевтических свойств.
Способ получения фармацевтической композиции для лечения патологического состояния, описанного в данной заявке, может включать;
i) идентификацию и/или получение соединения, стимулирующего фагоцитоз апоптотических клеток, например, с применением способа, описанного в данной заявке,
ii) синтез идентифицированного соединения и
iii) включение соединения в фармацевтическую композицию.
Фармацевтическая композиция может содержать в дополнение к соединению, идентифицированному в качестве стимулятора фагоцитоза апоптотических клеток, фармацевтически приемлемый наполнитель, носитель, буфер, стабилизатор или другие вещества, хорошо известные специалисту в данной области техники.
Фармацевтические композиции для перорального введения могут быть в форме таблеток, капсул, порошка или в жидкой форме. Таблетка может включать твердый носитель, такой как желатин или адъювант. Жидкие фармацевтические композиции обычно включают жидкий носитель, такой как вода, углеводороды, животные или растительные масла, минеральное масло или синтетическое масло. В состав композиции могут входить физиологический солевой раствор, раствор декстрозы или другого сахарида или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль.
Для внутривенной, кожной или подкожной инъекции или инъекции в область повреждения композиция может быть в форме приемлемого для парентерального введения водного раствора, который является апирогенным и имеет подходящие pH, изотоничность и стабильность. Специалисты в данной области техники способны подготовить соответствующие растворы с применением, например, изотонических разбавителей, таких как физиологический раствор для инъекций, раствор Рингера для инъекций или лактат Рингера для инъекций. В состав композиции при необходимости могут входить консерванты, стабилизаторы, буферы, антиоксиданты и/или другие вспомогательные вещества.
Изобретение охватывает соединение, идентифицированное и/или полученное с применением способа, описанного выше, в качестве агента, который может быть полезен при лечении патологического состояния, описанного выше, фармацевтическую или ветеринарную композицию, лекарственный препарат, лекарство или другой состав, включающий такое соединение, способ, включающий введение такой композиции индивиду, например человеку или животному, не являющемуся человеком, для лечения (которое может включать профилактическое лечение патологического состояния, описанного выше, применение такого соединения для производства композиции для введения, например для лечения патологического состояния, описанного выше, и способ получения фармацевтической или ветеринарной композиции, включающий смешивание такого соединения с наполнителем, разбавителем или носителем, например фармацевтически приемлемым наполниетелем, разбавителем или носителем, и, возможно, с другими компонентами.
Введение соединения предпочтительно осуществляют в «профилактически эффективном количестве» или «терапевтически эффективном количестве» (в зависимости от обстоятельств, хотя профилактику можно считать терапией), которое при этом является достаточным для оказания полезного действия на индивида. Фактическое вводимое количество, а также скорость и периодичность введения зависят от природы и тяжести заболевания, которое подвергают лечению. Назначение лечения, например определение дозы и т.п., находится в рамках обязанностей врачей общей практики и врачей других специальностей.
Другие аспекты изобретения относятся к применению полипептидов АроЕ и их миметиков для стимулирования уничтожения апоптотических клеток, например, при лечении патологического состояния, связанного с накоплением апоптотических клеток.
Способ лечения патологического состояния, связанного с накоплением апоптотических клеток у индивида, может включать: увеличение экспрессии и/или активности АроЕ у вышеуказанного индивида.
Патологические состояния, связанные с накоплением апоптотических клеток, включают повреждение ткани, травматическое повреждение мозга, острую дыхательную недостаточность, бактериальный сепсис, панкреатит или перикардит.
Активность АроЕ можно повысить, например, при введении полипептида АроЕ или его миметика указанному индивиду.
Полипептиды АроЕ описаны более подробно выше.
Миметики АроЕ представляют собой соединения, сохраняющие активность АроЕ при стимулировании фагоцитоза апоптотических клеток. Миметики АроЕ могут быть получены, например, при определении конкретных частей соединения, которые необходимы и/или важны для обладания требуемым свойством. Это можно сделать, например, путем систематичного изменения аминокислотных остатков в пептиде, например путем поочередного изменения каждого остатка. Эти части или остатки, составляющие активную область АроЕ, известны как «фармакофор».
После обнаружения фармакофора создают модель его структуры в соответствии с его физическими свойствами, например стереохимией, связями, размером и/или зарядом, с применением данных из различных источников, например, полученных способами спектроскопии, рентгенодифракционным методом и ЯМР. В процессе такого моделирования можно применять компьютерный анализ, подобное отображение (моделирующее заряд и/или объем фармакофора, но не связи между атомами) и другие способы.
Затем выбирают молекулу-матрицу, к которой можно присоединить химические группы, имитирующие фармакофор. Молекулу-матрицу и химические группы, присоединяемые к ней, удобно выбирать такими, чтобы модифицированное соединение можно было легко синтезировать, чтобы оно, насколько это возможно, было фармакологически приемлемым и не разрушалось in vivo и при этом сохраняло способность стимулировать фагоцитоз апоптотических клеток. Миметики АроЕ, полученные с помощью такого подхода, можно затем скринировать с применени