Пестициды, пестицидная композиция и способ контроля вредителей
Иллюстрации
Показать всеИзобретение относится к сельскому хозяйству. Соединение общей формулы
где
R1 представляет собой замещенный пиримидинил, пиридазинил или пиразинил, где каждый замещенный пиримидинил, пиридазинил или пиразинил содержит один или несколько заместителей, независимо выбранных из галогена или галоген (C1-С6) алкила; R2 представляет собой Н или (C1-С6) алкил; R3 представляет собой Н или (C1-С6) алкил; R4 представляет собой (C1-С6) алкил; R5 представляет собой NO2 или CN; и n равно 0, 1, 2 или 3. Пестицидная композиция содержит указанные соединения. Пестицидную композицию или указанные соединения наносят на участок с вредителями. Изобретение позволяет получать новые пестициды, преодолевающие резистентность у насекомых. 4 н. и 6 з.п. ф-лы, 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящая заявка испрашивает приоритет Предварительной Заявки на Патент США №61/092077, поданной 27 августа 2008 года. Изобретение, раскрытое в настоящем документе, относится к области пестицидов и их применению для контроля вредителей.
УРОВЕНЬ ТЕХНИКИ
Каждый год вредители являются причиной гибели миллионов человек во всем мире. Кроме того, существует более десяти тысяч разновидностей вредителей, которые наносят значительный ущерб сельскому хозяйству. Этот сельскохозяйственный ущерб ежегодно составляет до миллиарда долларов США. Термиты вызывают повреждения различных сооружений, таких как дома. Ущерб от повреждений, вызванных термитами, ежегодно составляет более миллиардов долларов США. И наконец, множество вредителей в хранящихся пищевых продуктах поедают и заражают эти продукты питания. Ущерб, наносимый пищевым продуктам при их хранении, составляет миллиарды долларов США ежегодно и, что более важно, лишает населения необходимой пищи.
Существует реальная необходимость в новых пестицидах. Насекомые вырабатывают резистентность к применяющимся в настоящее время пестицидам. Сотни видов насекомых являются резистентными к одному или нескольким пестицидам. Развитие резистентности к традиционно применяющимся пестицидам, таким как ДДТ, карбаматы и фосфорорганические соединения, хорошо известно, но резистентность вырабатывается даже к некоторым более новым пестицидам. Следовательно, существует потребность в новых пестицидах, в частности пестицидах, которые обладают новыми механизмами действия.
ЗАМЕСТИТЕЛИ (НЕИСЧЕРПЫВАЮЩИЙ ПЕРЕЧЕНЬ)
Приведенные примеры заместителей являются (за исключением галогенов) неисчерпывающим перечнем заместителей и не должны рассматриваться как примеры, ограничивающие изобретение, раскрытое в данном описании.
Термин «алкенил» означает ациклический, ненасыщенный (включающий в себя, по меньшей мере, одну двойную углерод-углеродную связь), разветвленный или неразветвленный заместитель, состоящий из атомов углерода и водорода, например винил, аллил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил и деценил.
Термин «алкенилокси» означает алкенил, дополнительно включающий в себя одинарную углерод-кислородную связь, например аллилокси, бутенилокси, пентенилокси, гексенилокси, гептенилокси, октенилокси, ноненилокси и деценилокси.
Термин «алкокси» означает алкил, дополнительно включающий в себя одинарную углерод-кислородную связь, например метокси, этокси, пропокси, изопропокси, 1-бутокси, 2-бутокси, изобутокси, трет-бутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси и декокси.
Термин «алкил» означает ациклический насыщенный разветвленный или неразветвленный заместитель, состоящий из атомов углерода и водорода, например метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропил, гексил, гептил, октил, нонил и децил.
Термин «алкинил» означает ациклический ненасыщенный (включающий, по меньшей мере, одну тройную углерод-углеродную тройную связь и любые двойные связи) разветвленный или неразветвленный заместитель, состоящий из атомов углерода и водорода, например этинил, пропаргил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил и децинил.
Термин «алкинилокси» означает алкинил, дополнительно включающий в себя одинарную углерод-кислородную связь, например пентинилокси, гексинилокси, гептинилокси, октинилокси, нонинилокси и децинилокси.
Термин «арил» означает циклический ароматический заместитель, состоящий из атомов водорода и углерода, например фенил, нафтил и бифенилил.
Термин «циклоалкенил» означает моноциклический или полициклический ненасыщенный (включающий в себя, по меньшей мере, одну двойную углерод-углеродную связь) заместитель, состоящий из атомов углерода и водорода, например циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, циклодеценил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
Термин «циклоалкенилокси» означает циклоалкенил, дополнительно включающий в себя одинарную углерод-кислородную связь, например циклобутенилокси, циклопентенилокси, циклогексенилокси, циклогептенилокси, циклооктенилокси, циклодеценилокси, норборненилокси и бицикло[2.2.2]октенилокси.
Термин «циклоалкил» означает моноциклический или полициклический насыщенный заместитель, состоящий из атомов углерода и водорода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
Термин «циклоалкокси» означает циклоалкил, дополнительно включающий в себя одинарную углерод-кислородную связь, например циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси, циклооктилокси, циклодецилокси, норборнилокси и бицикло[2.2.2]октилокси.
Термин «галоген» означает фтор, хлор, бром и йод.
Термин «галогеналкил» означает алкил, дополнительно включающий в себя от одного до максимально возможного количества одинаковых или различающихся атомов галогенов, например фторметил, дифторметил, трифторметил, 1-фторметил, 2-фторэтил, 2,2,2-трифторэтил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
Термин «гетероциклил» означает циклический заместитель, который может быть полностью насыщенным, частично ненасыщенным или полностью ненасыщенным, где циклическая структура содержит, по меньшей мере, один атом углерода и, по меньшей мере, один гетероатом и где указанный гетероатом представляет собой атом азота, атом серы или атом кислорода, например бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил, циннолинил, фуранил, индазолил, индолил, имидазолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, 1,3,4-оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, 1,2,3,4-тетразолил, тиазолинил, тиазолил, тиенил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил и 1,2,4-триазолил.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Пестицидная композиция согласно данному изобретению включает молекулу, имеющую следующую общую формулу:
,
где
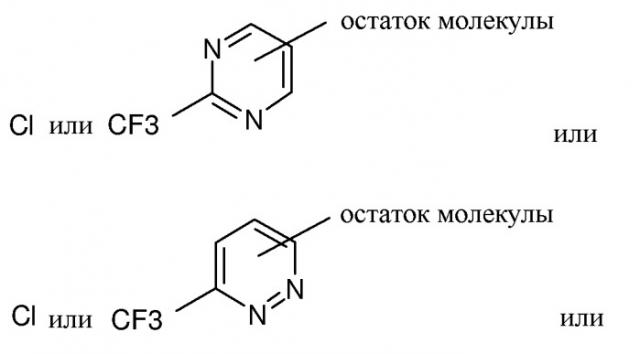
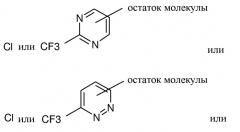
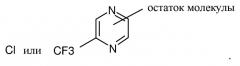
R1 представляет собой
(а) незамещенный пиримидинил, пиридазинил или пиразинил или
(b) замещенный пиримидинил, пиридазинил или пиразинил, где каждый замещенный пиримидинил, пиридазинил или пиразинил содержит один или несколько заместителей, независимо выбранных из (C2-C6)алкенила, (C2-C6)алкенилокси, (C1-C6)алкокси, (C1-C6)алкила, (C2-C6)алкинила, (C2-C6)алкинилокси, арила, (C3-C6)циклоалкенила, (C3-C6)циклоалкенилокси, (C3-C6)циклоалкила, (C3-C6)циклоалкокси, галогена, галоген(C1-C6)алкила или гетероциклила;
R2 представляет собой H, (C2-C6)алкенил, (C2-C6)алкенилокси, (C1-C6)алкокси, (C1-C6)алкил, (C2-C6)алкинил, (C2-C6)алкинилокси, арил, (C3-C6)циклоалкенил, (C3-C6)циклоалкенилокси, (C3-C6)циклоалкил, (C3-C6)циклоалкокси, галоген, галоген(C1-C6)алкил или гетероциклил;
R3 представляет собой H, (C2-C6)алкенил, (C2-C6)алкенилокси, (C1-C6)алкокси, (C1-C6)алкил, (C2-C6)алкинил, (C2-C6)алкинилокси, арил, (C3-C6)циклоалкенил, (C3-C6)циклоалкенилокси, (C3-C6)циклоалкил, (C3-C6)циклоалкокси, галоген, галоген(C1-C6)алкил или гетероциклил;
R2 и R3 могут необязательно образовывать цикл, где цикл содержит 3 или более атомов и необязательно включает в себя атом О, атом S или атом N;
R4 представляет собой H, (C2-C6)алкенил, (C2-C6)алкенилокси, (C1-C6)алкокси, (C1-C6)алкил, (C2-C6)алкинил, (C2-C6)алкинилокси, арил, (C3-C6)циклоалкенил, (C3-C6)циклоалкенилокси, (C3-C6)циклоалкил, (C3-C6)циклоалкокси, галоген, галоген(C1-C6)алкил или гетероциклил;
R4 и R2 необязательно соединяются вместе с образованием 4-, 5- или 6-членного цикла с -(CH2)-;
R5 представляет собой NO2, CN, CO2R6, незамещенный гетероциклил, замещенный гетероциклил, C(=(O или S))J(J1)(J2),
где замещенный гетероциклил содержит один или несколько заместителей, независимо выбранных из (C2-C6)алкенила, (C2-C6)алкенилокси, (C1-C6)алкокси, (C1-C6)алкила, (C2-C6)алкинила, (C2-C6)алкинилокси, арила, арил(C1-C6)алкила, (C3-C6)циклоалкенила, (C3-C6)циклоалкенилокси, (C3-C6)циклоалкила, (C3-C6)циклоалкокси, галогена, галоген(C1-C6)алкила, гетероциклила, и
где J представляет собой N или C(J3), и
где J1, J2 и J3 независимо выбраны из (C2-C6)алкенила, (C2-C6)алкенилокси, (C2-C6)алкенилтио, (C1-C6)алкокси, (C1-C6)алкила, (C1-C6)алкилтио, (C2-C6)алкинила, (C2-C6)алкинилокси, (C2-C6)алкинилтио, арила, (C3-C6)циклоалкенила, (C3-C6)циклоалкенилокси, (C3-C6)циклоалкенилтио, (C3-C6)циклоалкила, (C3-C6)циклоалкокси, (C3-C6)циклоалкилтио, H, гетероциклила или (C0-C6)алкил-C(=О)О(J4), где каждый из них может быть независимо замещенным (за исключением H) и содержать один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, (C1-C6)алкила, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкокси, (C1-C6)галогеналкила, (C1-C6)галогеналкокси, галоген(C1-C6)алкилтио, S(=O)n1(C1-C6)алкила (где n1=0-2), S(=O)n2галоген(C1-C6)алкила (где n2=0-2), OSO2галоген(C1-C6)алкила, C(=O)O(C1-C6)алкила, C(=O)(C1-C6)алкила, C(=O)галоген(C1-C6)алкила, арила, гидрокси(C1-C6)алкила, N(J5)(J6) и гетероциклила, и
где J1 и J2 могут также образовывать 4-, 5- или 6-членный цикл, и
где J4, J5 и J6 независимо выбраны из (C2-C6)алкенила, (C2-C6)алкенилокси, (C2-C6)алкенилтио, (C1-C6)алкокси, (C1-C6)алкила, (C1-C6)алкилтио, (C2-C6)алкинила, (C2-C6)алкинилокси, (C2-C6)алкинилтио, арила, (C3-C6)циклоалкенила, (C3-C6)циклоалкенилокси, (C3-C6)циклоалкенилтио, (C3-C6)циклоалкила, (C3-C6)циклоалкокси, (C3-C6)циклоалкилтио, H или гетероциклила, и
где R6=(C1-C3)алкил; и
n равно 0, 1, 2 или 3.
В одном варианте осуществления изобретения R1 представляет собой
Для получения молекулы, описанной в данном изобретении, могут использоваться представленные далее методики, известные в данной области техники.
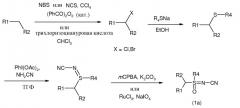
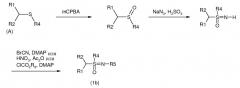
Соединения формулы (1а), где R5 представляет собой CN и R1, R2, R3, R4 принимают значения, определенные выше, могут быть получены способом, показанным на схеме А. Метиленовый атом углерода, соседний по отношению к гетероциклическому кольцу R1, сначала подвергается галогенированию с использованием N-бромсукцинимида, N-хлорсукцинимида или трихлоризоциануровой кислоты. Сульфид получают нуклеофильным замещением галогенида натриевой солью или алкилтиолом. Сульфид подвергается окислению диацетатом йодбензола в присутствии цианамида при 0°C с получением сульфилимина. Реакция может проводиться в полярном апротонном растворителе, таком как дихлорметан (CH2Cl2). Затем сульфилимин подвергается окислению мета-хлорпероксибензойной кислотой (mCPBA). Для нейтрализации кислотности mCPBA используется основание, такое как карбонат калия. Для повышения растворимости сульфилиминного исходного вещества и применяемого основания используются протонные полярные растворители, такие как этанол и вода. Сульфилимин также может подвергаться окислению водным раствором периодата натрия или калия в присутствии катализатора, такого как гидрат трихлорида рутения и т.п. Органическим растворителем для такого катализатора может быть полярный апротонный растворитель, такой как CH2Cl2, хлороформ или ацетонитрил.
Схема А
Соединения формулы (1b), где R1, R2, R3, R4 принимают значения, определенные выше, и R5 представляет собой CN, NO2 или CO2R6, могут быть получены из сульфида способами, представленными на схеме В. Сульфид подвергается окислению с помощью mCPBA в полярном растворителе при температуре ниже 0°C для получения сульфоксида. В большинстве случаев CH2Cl2 является предпочтительным растворителем для окисления. Сульфоксид затем подвергается иминированию с помощью азида натрия в присутствии концентрированной серной кислоты в апротонном растворителе при нагревании с получением сульфоксимина. В большинстве случаев хлороформ является предпочтительным растворителем для данной реакции. Атом азота сульфоксимина может либо подвергаться цианированию с помощью бромциана в присутствии основания, либо подвергаться нитрованию с помощью азотной кислоты в присутствии уксусного ангидрида при немного повышенной температуре, либо подвергаться карбоксилированию с помощью алкил(R6)хлорформиата в присутствии основания, такого как 4-диметиламинопиридин (DMAP) для получения N-замещенного сульфоксимина. Основание, которое необходимо для эффективного цианирования и карбоксилирования и которое является предпочтительным основанием, представляет собой DMAP, в то время как серная кислота используется в качестве катализатора для эффективной реакции нитрования.
Схема В
Соединения формулы (1с), где R1, R2, R3, R4 принимают значения, определенные выше, и R5 представляет собой тиокарбамат (-C(S)NH2), могут быть получены из незамещенного (N-H) сульфоксимина способами, представленными на схеме С. Сульфоксиминный атом азота подвергается взаимодействию с Fmoc-изотиоцианатом (Fmoc=9-флуоренилметоксикарбонил) для получения Fmoc-защищенной тиомочевины. Удаление защитной группы тиомочевины может достигаться посредством обработки основанием, таким как пиперидин, в растворителе, таком как N,N-диметилформамид (ДМФА).
Схема С
Соединения формулы (1d), где R1, R2, R3, R4 принимают значения, определенные выше, и R5 представляет собой замещенный или незамещенный тиазол, могут быть получены из тиокарбамат-замещенного сульфоксимина (1с) способом, представленным на схеме D. Взаимодействие (1с) с подходящим замещенным α-бромкетоном или α-бромальдегидом (где R7 и R8 независимо представляют собой Н, алкил, галогеналкил, замещенный или незамещенный арил или арил(С1-С6)алкил) приводит к получению N-тиазолилсульфоксимина (1d).
Схема D
Атом углерода в α-положении N-замещенного сульфоксимина, где R2 и R3=Н и R1, R4 и R5 принимают значения, определенные выше, могут подвергаться дополнительному алкилированию или галогенированию (R2) в присутствии основания, такого как гексаметилдисилазид калия (KHMDS) для получения N-замещенных сульфоксиминов формулы (1е), где R1, R4 и R5 принимают значения, определенные выше, и Z представляет собой подходящую удаляемую группу, как показано на схеме Е. Предпочтительными удаляемыми группами являются йодид (R2=алкил), бензолсульфонимид (R2=F), тетрахлорэтен (R2=Cl) и тетрафторэтен (R2=Br).
Схема Е
Как показано на схеме F, сульфид формулы (А1) может быть получен из соответствующего замещенного хлорметилгетероциклильного соединения обработкой тиомочевиной, гидролизом, последующим алкилированием подходящим бромхлоралканом (m=0, 1 или 2) в водных основных условиях и циклизацией в присутствии основания, такого как трет-бутоксид калия, в полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ).
Схема F
Сульфоксиминные соединения формулы (1f), где n=2, R2 и R3 представляют собой водород и R1, R4 и R5 принимают значения, определенные выше, могут быть получены способом, представленным на схеме G. Диметилсульфид подвергается окислению диацетатом йодбензола в присутствии цианамида при температуре 0°C для получения соответствующего сульфилимина. Реакция может проводиться в полярном апротонном растворителе, таком как CH2Cl2 или ТГФ. Затем сульфилимин подвергается окислению с помощью mCPBA. Для нейтрализации кислотности mCPBA используется основание, такое как карбонат калия. Для повышения растворимости сульфилиминного исходного вещества и применяемого основания используются протонные полярные растворители, такие как этанол и вода. Атом углерода в α-положении N-замещенного сульфоксимина может подвергаться алкилированию гетероароматическим метилгалогенидом в присутствии основания, такого как KHMDS или бутиллитий (n-BuLi), для получения целевого N-замещенного сульфоксимина. Предпочтительным галогенидом может быть бромид, хлорид или йодид.
Схема G
Сульфидные соединения формулы (А2) могут быть получены способом, представленным на схеме Н. Диэтиловый эфир 2-этоксиметиленмалоновой кислоты подвергается взаимодействию с трифторацетамидином для получения пиримидинона, который может затем подвергаться хлорированию с помощью оксалилхлорида. Хлорпиримидин может подвергаться восстановлению с использованием водорода и каталитического палладия на углероде с получением соответствующего пиримидина. Сложный эфир после этого может подвергаться восстановлению до альдегида с использованием гидрида диизобутилалюминия (DIBAL-H), который далее может подвергаться алкилированию с помощью реактива Гриньяра (R2MgBr). Полученный спирт может подвергаться хлорированию с использованием тионилхлорида, и затем нуклеофильное замещение галогенида с использованием натриевой соли алкилтиола будет приводить к получению целевого сульфида.
Схема Н
ПРИМЕРЫ
Приведенные далее примеры представлены только для иллюстрации раскрытого в данном описании изобретения и не должны рассматриваться как ограничение его области приведенными примерами.
Пример I: Получение [1-(2-хлорпиримидин-5-ил)этил](метил)оксидо-λ4-сульфанилиденцианамида (1)
Раствор 2-хлор-5-этилпиримидина (1,15 г, 8,1 ммоль) в 20 мл тетрахлорида углерода обрабатывают N-бромсукцинимидом (1,50 г, 8,4 ммоль) и каталитическим количеством (примерно 1 мольный процент из расчета на реагенты) пероксида бензоила и полученную смесь нагревают до 75°C. Спустя несколько часов и после добавления дополнительной порции катализатора исходные вещества полностью расходуются. Твердые продукты удаляют фильтрацией и фильтрат концентрируют. Полученный остаток дополнительно очищают флэш-хроматографией (колонка, силикагель, элюант: смесь этилацетата (EtOAc) и петролейного эфира). Растворители удаляют при пониженном давлении, получая 0,64 г (36%) 5-(1-бромэтил)-2-хлорпиримидина (A) в виде прозрачной жидкости: 1H ЯМР (CDCl3) δ 8,70 (с, 2H), 5,15 (кв, J=8,0 Гц, 1H), 2,10 (д, J=8,0 Гц, 3H); ГХ-МС (FID) m/z 222 (M+). Выделяют некоторое количество соответствующего дибром-производного 0,44 г (18%) в виде твердого белого вещества: т. пл. 84-85°C; 1H ЯМР (CDCl3) д 9,00 (с, 2H), 3,00 (с, 3H); ЖХ-МС (ESIMS) m/z 298 (M+H).
Суспензию метилтиолата натрия (245 мг, 3,50 ммоль) в этаноле обрабатывают раствором 5-(1-бромэтил)-2-хлорпиримидином в этаноле при комнатной температуре. Спустя 5 часов реакционную смесь распределяют между CH2Cl2 и разбавленной соляной кислотой, промывают насыщенным раствором соли и сушат над сульфатом натрия (Na2SO4). Растворитель удаляют при пониженном давлении, получая 0,45 г (89%) 2-хлор-5-[1-(метилтио)этил]пиримидина (B) в виде сиропа бледно-желтого цвета: 1H ЯМР (CDCl3) δ 8,60 (с, 2H), 3,85 (кв, J=8,0 Гц, 1H), 1,98 (c, 3H), 1,65 (д, J=8,0 Гц, 3H); ГХ-МС (FID) m/z 188 (M+).
Раствор 2-хлор-5-[1-(метилтио)этил]пиримидина (0,49 г, 2,61 ммоль) и цианамида (120 мг, 2,86 ммоль) в 20 мл CH2Cl2 охлаждают до 0°C и обрабатывают диацетатом йодбензола (860 мг, 2,59 ммоль). Смеси дают возможность нагреться до комнатной температуры в течение часа, растворитель удаляют при пониженном давлении и остаток распределяют между гексанами и ацетонитрилом. Ацетонитрил удаляют при пониженном давлении и остаток дополнительно очищают флэш-хроматографией (колонка, силикагель, элюент: 50% смесь ацетона и петролейного эфира). Растворители удаляют при пониженном давлении, получая 0,44 г (74%) (1Е)-[1-(2-хлорпиримидин-5-ил)этил](метил)-λ4-сульфанилиденцианамида (C) в виде сиропа бледно-оранжевого цвета. Полученный продукт представляет собой смесь (2:1) диастереомеров. Физические характеристики диастереомера, составляющего большую часть смеси: 1H ЯМР (CDCl3) δ 8,68 (с, 2H), 4,38 (кв, J=8,3 Гц, 1H), 2,68 (c, 3H), 1,92 (д, J=8,3 Гц, 3H); ЖХ-МС (ESI) m/z 229 (M+H).
Смесь периодата натрия (458 мг, 2,14 ммоль) в 10 мл смеси (1:1) воды (H2O) и CH2Cl2 при энергичном перемешивании обрабатывают сначала гидратом хлорида рутения(III) (13 мг, 0,06 ммоль) и затем раствором (1Е)-[1-(2-хлорпиримидин-5-ил)этил](метил)-λ4-сульфанилиденцианамида (242 мг, 1,06 ммоль) в 7 мл CH2Cl2, добавляя его по каплям в течение 15 минут. Смесь перемешивают в течение 18 часов при комнатной температуре. После этого темную реакционную смесь распределяют между CH2Cl2 и разбавленной соляной кислотой и органический слой сушат над Na2SO4. Растворитель удаляют при пониженном давлении, остаток переносят в ацетон и фильтруют через слой оксида алюминия. Ацетон удаляют при пониженном давлении, получая 122 мг (50%) [1-(2-хлорпиримидин-5-ил)этил](метил)оксидо-λ4-сульфанилиденцианамида (1) в виде прозрачного сиропа. Полученный продукт представляет собой смесь (2:1) диастереомеров. Физические характеристики диастереомера, составляющего большую часть смеси: 1H ЯМР (CDCl3) δ 8,68 (с, 2H), 4,52 (кв, J=9 Гц, 1H), 3,10 (с, 3H), 1,95 (д, J=9 Гц, 3H); ЖХ-МС (ESI) m/z 245 (M+H).
Пример II: Получение [(3-хлорпиридазин-6-ил)метил](метил)оксидо-λ4-сульфанилиденцианамида (2)
К раствору 3-хлор-6-метилпиридазина (5,0 г, 39 ммоль) в хлороформе (75 мл) при кипячении с обратным холодильником несколькими порциями добавляют трихлоризоциануровую кислоту (3,6 г, 16 ммоль). Раствор кипятят с обратным холодильником в течение ночи, после чего сырую реакционную смесь фильтруют, промывают 1M раствором гидроксида натрия (NaOH) и органическую фазу сушат над сульфатом магния. Сырой продукт концентрируют при пониженном давлении и очищают хроматографией (силикагель), получая 3-хлор-6-хлорметилпиридазин (D) в виде масла желтого цвета, которое по истечении некоторого времени становится твердым веществом коричневого цвета (2,9 г, 46%).
[(3-Хлорпиридазин-6-ил)метил](метил)оксидо-λ4-сульфанилиденцианамид (2) синтезируют из 3-хлор-6-хлорметилпиридазина (D) в соответствии с методикой синтеза, описанной в примере I. Целевой продукт выделяют в виде твердого вещества желтого цвета: 1H ЯМР (CDCl3) δ 7,3 (д, J=7,5 Гц, 1H), 7,2 (д, J=7,5 Гц, 1H), 4,8 (м, 2H), 2,8 (с, 3H); ЖХ-МС (ESI) m/z 230 (M+).
Пример III: Получение метил(оксидо){1-[2-(трифторметил)пиримидин-5-ил]этил}-λ4-сульфанилиденцианамида (3)
К раствору метил-производного реактива Гриньяра (19,9 мл, 3M раствор в эфире (Et2O), 59,7 ммоль) в Et2O (167 мл) при перемешивании магнитной мешалкой добавляют раствор 2-трифторметилпиримидин-5-карбальдегида* (9,56 г, 54,3 ммоль) в Et2O (50 мл) при 0°C, полученный раствор бледно-желтого цвета нагревают до комнатной температуры и перемешивают в течение 2,5 часов. Реакцию гасят добавлением насыщенного водного раствора хлорида аммония (NH4Cl) (50 мл) при 0°C и смесь нагревают до комнатной температуры. Фазы разделяют, органическую фазу сушат над Na2SO4, фильтруют и концентрируют до масла светло-желтого цвета (сырой продукт, 9,32 г). Масло очищают флэш-хроматографией (330 г SiO2, элюирование с градиентом: 0→100% EtOAc/гексаны), получая 1-(2-трифторметилпиримидин-5-ил)этанол (E) (8,87 г, 85%) в виде твердого вещества желтого цвета: т. пл. 43-45°C; 1H ЯМР (300 МГц, CDCl3) δ 8,92 (с, 2H), 5,15-5,07 (м, 1H), 2,26 (д, J=4,0 Гц, 1H), 1,62 (д, J=6,5 Гц, 3H); МС (EI) m/z 192 (M)+.
* 2-трифторметилпиримидин-5-карбальдегид может быть получен в четыре стадии способами, описанными в научной литературе:
1) Fenwick, A.E.; Hickey, D.M.B.; Ife, R.J.; Leach, C.A.; Pinto, I.L.; Smith, S.A. (SmithKline Beecham PLC, UK). WO 200066567, November 9, 2000.
2) Hickey, D.M.B.; Ife, R.J.; Leach, C.A.; Smith, S.A. (SmithKline Beecham PLC, UK). WO 200066566, November 9, 2000
А) К раствору 1-(2-трифторметилпиримидин-5-ил)этанола (E; 5,00 г, 26,0 ммоль) в безводном ацетонитриле (17 мл) при перемешивании магнитной мешалкой добавляют тионилхлорид (3,87 г, 32,5 ммоль) при 0°C. Ледяную баню удаляют и полученный раствор светло-желтого цвета перемешивают в течение 1 часа. Ход реакции отслеживают с помощью ГХ-МС анализа, который подтверждает полную конверсию исходного вещества в целевой промежуточный продукт 5-(1-хлорэтил)-2-трифторметилпиримидин ((EI) m/z 210 (M)+). Растворитель и избыток тионилхлорида удаляют на роторном испарителе, полученное масло янтарного цвета растворяют в безводном ацетонитриле (20 мл) и используют в следующей стадии без дополнительной очистки.
B) Раствор 5-(1-хлорэтил)-2-трифторметилпиримидина (F) охлаждают до 0°C и к полученному раствору порциями в течение 5 минут добавляют тиометоксид натрия (2,96 г, 42,3 ммоль, 3×0,99 г). Ледяную баню удаляют, полученную смесь оранжевого цвета нагревают до комнатной температуры и перемешивают в течение 1 часа. Реакционную смесь разбавляют раствором соли (100 мл) и экстрагируют Et2O (3×150 мл). Органические экстракты объединяют, сушат над Na2SO4, фильтруют и концентрируют, получая масло янтарного цвета (сырой продукт, 5,21 г). Масло очищают флэш-хроматографией (330 г SiO2, элюирование с градиентом: 0→100% EtOAc/гексаны), получая 5-(1-метилсульфонилэтил)-2-трифторметилпиримидин (G; 4,16 г, 72%) в виде масла желтого цвета: 1H ЯМР (300 МГц, CDCl3) δ 8,86 (с, 2H), 3,92 (кв, J=7,3, 1H), 1,98 (c, 3H), 1,68 (д, J=7,2, 3H); МС (EI) m/z 222 (M)+.
A) К раствору 5-(1-метилсульфонилэтил)-2-трифторметилпиримидина (G; 0,50 г, 2,60 ммоль) и цианамида (0,114 г, 2,73 ммоль) в безводном ацетонитриле (5,2 мл) с перемешиванием с помощью магнитной мешалки при 0°C в атмосфере азота (N2) добавляют диацетат йодбензола (0,924 г, 2,87 ммоль). Ледяную баню удаляют, реакционную смесь бледно-желтого цвета нагревают до комнатной температуры и полученный раствор оранжевого цвета перемешивают в течение 16 часов. Ход реакции отслеживают с помощью ЖХ-МС анализа, который подтверждает образование метил-{1-[2-(трифторметил)пиримидин-5-ил]этил}-λ4-сульфанилиденцианамида (H) ((ESI) m/z 263 [M+H]+, 261 [M-H]-). Раствор промывают гексанами (5×10 мл), ацетонитрил удаляют на роторном испарителе, получая масло оранжевого цвета, которое растворяют в CH2Cl2 (26 мл) и используют в следующей стадии без дополнительной очистки.
B) К раствору метил-{1-[2-(трифторметил)пиримидин-5-ил]этил}-λ4-сульфанилиденцианамида (H; 0,68 г, 2,60 ммоль) в CH2Cl2 (26 мл) при перемешивании с помощью магнитной мешалки медленно добавляют водный раствор перманганата натрия (NaMnO4) (0,92 г 40%, 2,60 ммоль) при 0°C. Ледяную баню удаляют, полученную темную смесь нагревают до комнатной температуры и перемешивают в течение 1,5 часов. Реакционную смесь промывают водным раствором бисульфита натрия и фильтруют. Фазы разделяют и водную фазу экстрагируют CH2Cl2 (2×25 мл). Органические фазы объединяют, промывают раствором соли (25 мл), сушат над Na2SO4, фильтруют и концентрируют, получая белый пастообразный остаток (сырой продукт, 0,517 г). Сырой продукт очищают флэш-хроматографией (80 г SiO2, элюирование с градиентом: 0→100% ацетон/гексаны), получая смесь (1:1) диастереомеров метил(оксидо){1-[2-(трифторметил)пиримидин-5-ил]этил}-λ4-сульфанилиденцианамида (I; 0,33 г, 46%) в виде бесцветного воскообразного вещества: 1H ЯМР (300 МГц, CDCl3) δ 9,20 (д, J=1,3 Гц, 2H), 5,40 (кв, J=7,1 Гц, 0,5H), 5,38 (кв, J=7,1 Гц, 0,5H), 3,54 (c, 1,5H), 3,53 (c, 1,5H), 1,92 (д, J=7,1 Гц, 1,5H), 1,91 (д, J=7,0 Гц, 1,5H); MC (ESI-MC) m/z 279 [M+H]+, m/z 277 [M-H]-.
Пример IV: Определение инсектицидной активности
Соединения, идентифицированные в представленных выше примерах, испытывают в отношении тли хлопковой в соответствии с методиками, описанными ниже.
Определение инсектицидной активности в отношении тли хлопковой (Aphis gossypii) при лиственном опрыскивании
Рассаду тыквы с полностью раскрытыми листьями семядоли подрезают до одной семядоли на растение и инвазируют тлей хлопковой (бескрылые взрослые особи и нимфы) за 1 день до применения химических веществ. Каждое растение обследуют перед нанесением химического вещества для обеспечения равномерного инфицирования (приблизительно 30-70 особей на растение). Соединения (2 мг) растворяют в 2 мл растворителя, который представляет собой смесь ацетон/метанол (1:1), получая исходные растворы с концентрацией 1000 м.д. Исходные растворы разбавляют 5X 0,025% раствором Tween 20 в H2O c получением раствора с концентрацией действующего вещества 200 м.д. Для применения растворов опрыскиванием с обеих сторон листьев растения тыквы до стекания раствора используют опрыскиватель аспираторного Devilbiss. Каждое соединение применяют по четырем растениям (4-кратная повторность опыта). Контрольные растения (проверка растворителя) опрыскивают только растворителем. Обработанные растения выдерживают в помещении при температуре приблизительно 23°C и относительной влажности 40% в течение 3 дней до регистрации количества живых особей тли на каждом растении. Инсектицидную активность определяют посредством скорректированного % контроля с использованием формулы корректировки Абботта, полученные значения представлены в таблице 1:
Скорректированный % контроля=100*(X-Y)/X
где Х = количество живых особей тли на контрольных растениях, обработанных растворителем;
Y = количество живых особей тли на растениях, обработанных соединениями.
Результаты представлены в таблице 1.
| Таблица 1 Активность | |
| % контроля тли хлопковой на растении тыквы при обработке раствором указанной концентрации (м.д.) (лиственное опрыскивание) | |
| Соединение № | 200 м.д. |
| 1 | А |
| 2 | А |
| 3 | А |
В каждом случае в таблице 1 используется следующая шкала оценок:
| % Контроля (смертность) | Оценка |
| 80-100 | А |
| Менее 80 | В |
| Не испытано | С |
КИСЛОТЫ, И СОЛЕВЫЕ ПРОИЗВОДНЫЕ, И СОЛЬВАТЫ
Соединения, раскрытые в настоящем изобретении, могут быть представлены в форме пестицидно приемлемых кислотно-аддитивных солей.
Например, но без ограничения, аминная функция может образовывать соли с соляной, бромистоводородной, серной, фосфорной, уксусной, бензойной, лимонной, малоновой, салициловой, яблочной, фумаровой, щавелевой, янтарной, винной, молочной, глюконовой, аскорбиновой, малеиновой, аспарагиновой, бензолсульфоновой, метансульфоновой, этансульфоновой, гидроксиметансульфоновой и гидроксиэтансульфоновой кислотами.
В качестве дополнительного примера, но без ограничения, кислотная функция может образовывать соли, включая соли щелочных или щелочноземельных металлов, а также соли аммония и аминные соли. Примеры предпочтительных катионов включают катионы натрия, калия, магния и аминия.
Соли получают контактированием соединения в форме свободного основания с количеством желательной кислоты, которое достаточно для получения соли. Формы свободного основания могут регенерироваться обработкой соли подходящим водным раствором основания, таким как разбавленный водный раствор NaOH, карбоната калия, аммиака и бикарбоната натрия. В некоторых случаях пестицид превращают в более растворимую форму: например, диметиламинная соль 2,4-дихлорфеноксиуксусной кислоты является более растворимой формой 2,4-дихлорфеноксиуксусной кислоты, которая является хорошо известным гербицидом.
Соединения, раскрытые в данном изобретении, могут образовывать стабильные комплексы с молекулами растворителя, которые остаются интактными после удаления молекул растворителя, не входящих в состав комплекса. Указанные комплексы называют «сольватами».
СТЕРЕОИЗОМЕРЫ
Некоторые соединения, раскрытые в данном изобретении, могут существовать в виде одного или нескольких стереоизомеров. Различные стереоизомеры включают геометрические изомеры, диастереомеры и энантиомеры. Таким образом, соединения, раскрытые в данном изобретении, включают рацемические смеси, отдельные стереоизомеры и оптически активные смеси. Специалисту в данной области техники будет понятно, что один стереоизомер может быть более активным, чем другие. Отдельные стереоизомеры и оптически активные смеси могут быть получены в соответствии с методиками селективного синтеза, обычными методами синтеза с использованием разделенных исходных веществ или с помощью стандартных методик разделения.
СЕЛЬСКОХОЗЯЙСТВЕННЫЕ ВРЕДИТЕЛИ
В одном варианте изобретение, раскрытое в данном описании, может применяться для контроля сельскохозяйственных вредителей.
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к типу Нематоды (Phylum Nematoda).
В еще одном варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к типу Членистоногие (Phylum Arthropoda).
В другом варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к подтипу Хелицеровые (Subphylum Chelicerata).
В еще одном варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к классу Арахниды (Arachnida).
В еще одном варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к надклассу Многоножки (Subphylum Myriapoda).
В еще одном варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к классу Симфилы (Symphyla).
В еще одном варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к подклассу Шестиногие (Subphylum Hexapoda).
В еще одном варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля вредителей, относящихся к классу Насекомые (Insecta).
В еще одном варианте осуществления изобретение, раскрытое в данном описании, может применяться для контроля представителей отряда Жесткокрылые (Coleoptera) (жуки). Неполный перечень этих вредителей включает, но без ограничения, Acanthoscelides spp. (долгоносик), Acanthoscelides obtectus (зерновка фасолевая), Agrilus planipennis (златка узкотелая), Agriotes spp. (проволочники), Anoplophora glabripennis (усач азиатский), Anthonomus spp. (долгоносики), Anthonomus grandis (долгоносик хлопковый), Aphidius spp. (тли), Apion spp. (апионы), Apogonia spp. (грибы), Ataenius spretulus (черный корневой жук рода Ataenius), Atomaria linearis (крошка свекловичная), Aulacophore spp., Bothynoderes punctiventris (долгоноси свекловичный обыкновенный), Bruchus spp. (зерновки), Bruchus pisorum (зерновка гороховая),