Магнитные наночастицы для применения при гипертермии, их приготовление и применение в магнитных системах для фармакологического использования
Иллюстрации
Показать всеИзобретение относится к магнитной системе, которая имеет структуру, содержащую магнитные нанометровые частицы формулы , где MII=Fe, Со, Ni, Zn, Mn; MIII=Fe, Cr, или маггемита, которые функционализированы бифункциональными соединениями формулы R1-(CH2)n-R2.(где n=2-20, R1 выбран из: CONHOH, CONHOR, РО(ОН)2, PO(OH)(OR), СООН, COOR, SH, SR; R2 является внешней группой и выбран из: ОН, NH2, СООН, COOR; R является алкильной группой или щелочным металлом, выбранным из С1-6-алкила и K, Na или Li соответственно). Структура также включает полимер, возможно содержащий фармакологически активную молекулу, и внешний защитный слой поверхностных агентов. Фармакологически активная молекула может выбираться из противоопухолевых агентов, антимикробных агентов, противовоспалительных агентов, иммуномодуляторов, молекул, действующих на центральную нервную систему или способных маркировать клетки так, чтобы позволить проводить их идентификацию обычными средствами диагностического детектирования. Изобретение также относится к способу получения нанометровых частицы формулы , который заключается в добавлении соли металла к спирту, нагревании до полной солюбилизации солей, добавлении воды для облегчения гидролиза солей и нагревании до температуры 150-180°С с получением суспензии, которую затем функционализируют. Изобретение также относится к способу приготовления магнитной системы, в котором функционализированные наночастицы и фармакологически активные молекулы встраивают в матрицу нерастворимого в воде полимера, и полученную структуру покрывают подходящими поверхностными агентами непрерывно и в одну стадию. Изобретение направлено на получение магнитной системы, которая пригодна для проведения гипертермических процедур. 5 н. и 11 з.п. ф-лы, 4 табл., 1 ил., 26 пр.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к области нанометровых частиц, в особенности к оксидам металлов, обладающим магнитными свойствами, и их применению в области фармакологии.
Предшествующий уровень техники
Наночастицы являются объектами, имеющими диаметр ниже 300 нм. В последние годы отмечается значительный интерес научного и технологического сообщества к особым физико-химическим свойствам данных материалов.
В частности, магнитные наночастицы имеют потенциальную область применения в диагностическом секторе в качестве контрастной среды в методиках создания изображения (магнитный резонанс), в методиках магнитной локализации, и главным образом, в особой терапевтической области гипертермии, опосредованной магнитными полями.
Главная особенность этих материалов по существу включает четыре элемента:
- состав центрального ядра частиц (которое должно включать материалы, обладающие магнитными характеристиками);
- размер магнитного центрального ядра (который составляет порядка десятков нанометров или меньше);
- стабильность физиологического окружения;
- биосовместимость.
Действительная полезность магнитных наночастиц, в окончательном анализе, связана с их способностью повышать температуру среды, в которой они заключены, при взаимодействии с внешними электромагнитными полями.
Во многих патентах обсуждаются магнитные наночастицы, покрытые биосовместимыми материалами до получения композитных частиц, имеющих диаметр в диапазоне между 5 и 500 нм, которые могут образовывать стабильные суспензии в водной системе (см. патент US 5427767, Kresse; патент US 2541039, Lesniak; патент US 6541039, Lesniak).
Особое внимание было направлено на способы получения оксидов металлов, образующих сердцевину частиц, и все они фокусировались на получении оксидов железа (см. патент US 4677027, Porath; патент US 5160725, Pilgrim; патент US 4329241, Massart; патент US 4101435, Hasegswa).
Во всех цитированных патентах, даже если в некоторых случаях, в целом, упоминаются «оксиды металлов» или «оксиды железа с добавлением других элементов металлов», изложенные примеры конкретно относятся только к оксидам железа в их различных формах, и не приводятся случаи гипертермического эффекта, связанного с другими видами оксидов металлов.
В целом, эти наночастицы из оксидов обладают низкой гипертермической эффективностью и, таким образом, для получения терапевтического результата требуется введение большого их количества.
Далее имеется широкая серия патентов, относящихся к способам получения различных видов покрытий, стабилизаторов и защиты для магнитных частиц посредством различных методов (см. патент US 4452773, Homola; патент US 6576221, Kresse; патент US 4452773, Molday; патент US 4827945, Groman; патент US 5545395, Toumier; ЕР 0272091, Eley).
Описаны серии различных методик для производства полимерных наночастиц, включающих внутри фармакологически активные продукты; эти методики можно разделить на четыре класса:
a) Методики улавливания лекарства в полимерах, нерастворимых в воде и растворимых в растворителях, смешиваемых с водой.
b) Методики коацервации (водорастворимого) лекарства с белками или полимерами, растворимыми в воде, с последующим образованием наночастиц путем разбавления растворителями, в которых белки или полимеры не растворяются, стабилизацией структуры наночастиц подходящими связующими агентами и удалением «осаждающего» агента.
c) Методики включения (водорастворимого или нерастворимого в воде) лекарства путем эмульгирования в присутствии поверхностных агентов, приводящего к образованию микрометровых частиц, с последующим удалением растворителя для уменьшения размера частиц до нанометровых уровней.
d) Методики включения (водорастворимого или нерастворимого в воде) лекарства путем эмульгирования в присутствии белков, приводящего к образованию микрометровых частиц, с последующим удалением растворителя для уменьшения размера частиц до нанометровых уровней.
Можно отметить, что описание такого большого числа способов, каждый из которых обладает своими специфическими вариантами, уже указывает на трудности в получении необходимого продукта, имеющего размер, пригодный для применения (обычно в диапазоне между 100 и 300 нм), с ограниченным распределением по размеру и способностью оставаться стабильным в физиологическом окружении.
Учитывая рассмотренные методики, можно отметить следующие проблемы:
- Методики улавливания для «активной субстанции» в полимерах, нерастворимых в воде и растворимых в подходящих органических растворителях, ведут к «простому» образованию наночастиц, размер которых определяется главным образом концентрацией полимера и лекарства и отношением разбавления растворитель/вода. Главная проблема состоит в том, что нанометровые частицы, полученные таким образом, стабильны в воде, но нестабильны уже в физиологическом растворе, и таким образом, их применение в биомедицинской области мало приемлемо.
- Методики коацервации (водорастворимого) лекарства с белками, растворимыми в воде, с последующим образованием наночастиц путем разведения растворителями, стабилизацией структуры наночастиц подходящими связующими агентами и удалением «осаждающего» растворителя определенно не применимы для продуктов, нерастворимых в воде. С другой стороны, преимущество применения систем наночастиц уменьшается для продуктов, уже растворимых в водной среде, поскольку эти активные вещества могут также напрямую применяться с эффектами, похожими на те, что получены с системой наночастиц.
- Методики эмульгирования в присутствии поверхностных агентов всегда представляют проблему системы эмульгирования, которая плохо сочетается со способностью образовывать достаточно малые мицеллы, обладающие совместимостью с организмом человека при применяемых концентрациях.
- Методики включения (водорастворимого или нерастворимого в воде) лекарства путем эмульгирования в присутствии белков представляют значительные технические трудности в том, что касается применения продуктивных типов. Эмульгирование в этих случаях очень затруднительно, что вынуждает использовать сложные методики, обладающие низкой промышленной производительностью, являющиеся очень дорогостоящими (например, методики эмульгирования под высоким давлением).
В свете вышеизложенного очевидна необходимость наночастиц магнитных оксидов, обладающих высокой гипертермической эффективностью, и способов включения для магнитных систем, и фармакологических принципов, ведущих к приготовлению магнитных систем, эффективных с гипертермической и фармакологической точки зрения, и в то же время стабильных и биологически совместимых.
Краткое описание чертежей
Фиг.1. является диаграммой, на которой сравнивается гипертермическая эффективность функционализированной частицы и соответствующей окончательной магнитной системой, в которой указанная эффективность выражена как ΔT в °С.
Краткое изложение сущности изобретения
Данное изобретение относится к магнитным нанометровым частицам оксида металла и к магнитным системам, состоящим из: указанных магнитных нанометровых частиц, функционализированных бифункциональными соединениями, полимера, возможно содержащего фармакологически активную молекулу, и, если указанный полимер нерастворим в воде, из внешнего защитного слоя поверхностных агентов; и к их применению в гипертермическом лечении.
Подробное раскрытие изобретения
Данное изобретение позволяет преодолеть вышеупомянутые проблемы благодаря магнитной системе, включающей: магнитные нанометровые частицы, функционализированные бифункциональными соединениями, полимер, возможно содержащий фармакологически активную молекулу, и, если указанный полимер нерастворим в воде, внешний защитный слой поверхностных агентов.
Вышеуказанная фармакологически активная молекула, если она присутствует, может быть соединена с полимером или диспергирована в нем.
Нанометровые частицы в соответствии с изобретением являются шпинелями и оксидами типа, в котором MII=Fe, Со, Ni, Zn, Mn; MIII=Fe, Cr в нанометровой форме.
Среди вышеупомянутых шпинелей было неожиданно установлено, что феррит кобальта обладает высокой гипертермической эффективностью.
Среди других шпинелей и оксидов железа неожиданно было открыто, что магнетит и маггемит контролируемого размера, приготовленные в соответствии со способами, описанными в данном изобретении, обладают лучшей гипертермической эффективностью, чем подобные продукты, описанные в литературе.
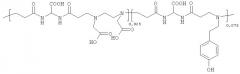
Под бифункциональными соединениями в соответствии с изобретением подразумеваются: тиолы, карбоновые кислоты, гидроксамовые кислоты, фосфорные кислоты, их эфиры и соли, имеющие алифатическую цепь, несущую вторую функциональную группу на концевом положении (обозначенном ω).
Более конкретно, бифункциональными соединениями являются соединения с общей формулой:
R1-(CH2)n-R2,
в которой:
n является целым числом в диапазоне между 2 и 20;
R1 выбран из: CONHOH, CONHOR, РО(ОН)2, PO(OH)(OR), СООН, COOR, SH, SR;
R2 является внешней группой и выбран из: ОН, NH2, СООН, COOR;
R является алкильной группой или щелочным металлом.
Среди щелочных металлов предпочтительными являются K, Na или Li, при этом среди алкильных групп предпочтительным является C1-6алкил, более конкретно этил.
Особо предпочтительным среди вышеуказанных бифункциональных групп является этил-12-(гидроксиамино)-12-оксододеканоат.
Полимеры, составляющие магнитную систему, могут быть водорастворимыми полимерами или нерастворимыми в воде полимерами, стабилизированными поверхностными агентами.
Водорастворимыми полимерами в соответствии с изобретением являются, например, полиэлектролиты, полипептиды и водорастворимые белки; предпочтительными являются водорастворимые полимеры, выбранные из блок-сополимеров, модифицированных полиэтиленгликолей, модифицированных полисахаридов, фосфолипидов, полиаминамидов, глобулярных белков. Нерастворимыми в воде полимерами являются, например, выбранные из: полиэфиров, полиамидов, полиангидридов, полиортоэфиров, пептидов, полиаминамидов; или нерастворимых органических молекул, например, таких как холестерин; предпочтительными являются полиэфиры и холестерин.
Поверхностными агентами в соответствии с данным изобретением могут быть: полиэлектролиты, полипептиды и водорастворимые белки; блок-сополимеры, модифицированные полиэтиленгликоли, модифицированные полисахариды, фосфолипиды, полиаминамиды, глобулярные белки; предпочтительными являются белки сыворотки человека и плюроники блок-сополимеры.
Полимеры являются известными, или могут быть легко получены в соответствии со способами, известными в данной области техники, например, полиприсоединением первичных моноаминов или вторичных диаминов с бис-акриламидами, при комнатной температуре в течение времени, включающего от нескольких часов до нескольких суток, например, так как сообщалось в Macromolecular Rapid Communication, 2002, 23, №5/6, р.332-355.
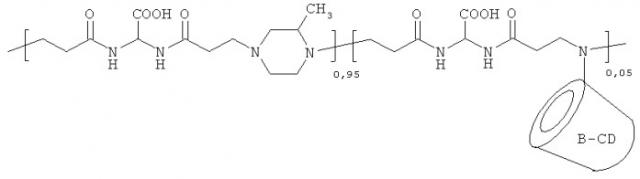
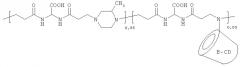
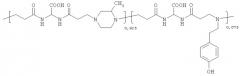
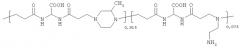
Примерами полимеров, как водорастворимых, так и поверхностных агентов, в соответствии с изобретением являются:
где n включает между 3-300, предпочтительно между 10-100.
Фармакологически активные молекулы в соответствии с изобретением являются биологически активными молекулами, обычно используемыми в различных видах лечения, например противоопухолевыми агентами (такими как антрациклин), антимикробными агентами, противовоспалительными агентами, иммуномодуляторами, молекулами, действующими на центральную нервную систему и т.д., или молекулами, способными маркировать клетки так, чтобы позволять проводить их идентификацию обычными средствами диагностического детектирования (например, флуоресцентными красителями).
Способы приготовления магнитных систем, описанных в данном изобретении, являются крайне гибкими.
Далее, благодаря способности контроля их размера, и, следовательно, их гипертермических свойств, магнитные наночастицы в соответствии с данным изобретением особенно пригодны для приготовления биосовместимых магнитных систем, содержащих наночастицы, которые являются крайне гибкими и активными даже при низких концентрациях магнитных наночастиц.
Это определенно является преимуществом во всех возможных биомедицинских применениях. В случае когда магнитные системы основаны на гидрофильных полимерах, применяемых в качестве сурфактантных агентов, известно, что требуется использовать количества сурфактанта более 300% по сравнению с фармакологически активным продуктом; при применении наночастиц в соответствии с данным изобретением количество сурфактаната, как известно, имеющего плохую биосовместимость, может быть значительно снижено.
Что касается, в особенности, феррита кобальта, было неожиданно установлено, что при эквивалентном размере он обладает гипертермической эффективностью примерно на один порядок величины больше, чем оксиды железа; более того, в противоположность тому, что наблюдалось для оксидов железа, описанных в литературе, гипертермические свойства физически иммобилизованных наночастиц феррита кобальта не изменялись по отношению к материалу, диспергированному в жидком матриксе. Это делает их более эффективными в тех случаях, когда экстрацеллюлярный матрикс или цитозольный матрикс представляет препятствие для их вращения.
При облучении электромагнитными волнами с частотой в диапазоне между 10 и 1000 кГц, предпочтительно между 50 и 500 кГц, наночастицы феррита кобальта проявляют значительно лучшее гипертермическое поведение по сравнению с оксидами железа, имеющими эквивалентный размер наночастиц (также с добавлением примесей Со, Ni или других металлоэлементов). При вышеупомянутых частотах частицы магнетита и маггемита, приготовленные нами, также проявляли лучшие гипертермические эффективности, чем эквиваленты, описанные в литературе.
Магнитные наночастицы в соответствии с изобретением могут быть приготовлены с помощью известных процессов, таких, например, как полиоловый процесс, широко описанный в литературе, который, вкратце, состоит в применении высоко кипящего спирта, позволяющего работать при высоких температурах, и приводит к образованию частиц, которые приводят к образованию комплексов, таким образом предотвращая их рост.
Обычно необходимые металлические предшественники (предпочтительно ацетаты, карбонаты, сульфаты, оксалаты, хлориды) добавляют к известному объему спирта (например, диэтиленгликоля, ДЭГ). Раствор затем нагревают при перемешивании до завершения солюбилизации предшественников, возможно добавление воды в подходящем количестве для облегчения гидролиза предшественников, проводят нагревание в течение нескольких часов при температуре выше 150°С и затем оставляют остывать, таким образом получая стабильную суспензию монодисперсных наночастиц с ограниченным распределением по размеру.
Далее, поскольку гипертермический эффект феррита кобальта значительно более зависит от размера наночастиц, чем эффект, который наблюдается в новых способах синтеза магнетита или маггемита, было разработано обеспечение в воспроизводимой манере контроля размера наночастиц, и, соответственно, их гипертермического эффекта, что также является частью данного изобретения. Контроль размера также создает значительные преимущества в синтезе магнетита и маггемита, позволяя получать продукты, альтернативные ферриту кобальта, и более эффективные, чем их эквиваленты с точки зрения гипертермии.
Далее приводятся новые способы синтеза, способные обеспечить контроль размера (и таким образом, гипертермию) магнитных наночастиц, которые всегда получают в суспензии.
Непрерывный процесс
В этом случае процедуру проводят, как описано выше, для полиолового процесса, но синтез выполняют с добавлением (в количестве, эквимолярном реагентам) «праймера», состоящего из предварительно синтезированных наночастиц. При этом способе на конце реакции получают магнитные наночастицы, имеющие больший размер, чем те, которые вводились в начале синтеза.
На практике процедуру для первого приготовления проводят как для полиолового процесса; далее новую реакцию проводят в тех же самых условиях, как первую, со всеми исходными материалами в количествах, идентичных уже использованным, и с добавлением продукта, полученного в первой реакции. Полученные таким образом магнитные частицы (удвоенные и имеющие больший размер по сравнению с теми, которые были введены в начале синтеза) могут применяться вновь в качестве «праймера» для следующей реакции. Цикл может быть повторен неопределенное число раз до получения частиц с необходимым размером.
Полунепрерывный процесс замещения
На практике первый синтез выполняют в соответствии с полиоловым процессом, но в конце периода стационарного нагревания при 180°С продукт не охлаждают, но скорее сливают во флакон, имеющий двойной размер, в который все исходные материалы загружают в количествах, идентичных продукту, который уже прореагировал. Температуру вновь доводят до 180°С, поддерживают в течение 3 часов, а затем повторяют цикл различное число раз до получения продукта с необходимым размером.
Процесс выращивания
В этом случае синтез проводят в соответствии с вышеописанным полиоловым процессом, но период, в течение которого продукт поддерживают при температуре 180°С, продлевают на различное число часов. Таким образом, получают продукт, размеры которого зависят от времени поддержания температуры.
Далее магнитные наночастицы могут дополнительно быть приготовлены с помощью процесса, подобного вышеописанному полиоловому процессу, но с проведением нагревания исключительно в микроволновой печи, что позволяет значительно уменьшить время реакции, и проводить лучший контроль размера и морфологии.
Дополнительным преимуществом вышеописанных процессов является то, что с помощью этих методик приготовления стехиометрия наночастиц может быть модифицирована: например, маггемит может быть произведен из полученного магнетита, в соответствии с одним из предыдущих процессов, путем его окисления при контролируемой температуре в окисляющей уксусной среде, ускоряющей окислительный процесс, который может происходить естественным образом, но в течение более длительного времени. В этом случае контроль размера магнитных наночастиц выполняют в непрямой манере, контролируя размер предшественника магнетита в соответствии с одним из предварительно описанных способов.
Для наночастиц феррита кобальта, магнетита и маггемита, полученных в соответствии с описанным способом, контролируют размер частиц посредством ДСР (Malvern Zetasizer nano-S).
Полученные таким образом наночастицы имеют размер в диапазоне между 4 и 200 нм, предпочтительно между 10 и 70 нм.
Функционализацию наночастиц проводили в соответствии с известными способами, т.е. путем реакции бифункциональных производных, растворенных в этаноле, с наночастицами, как определено выше, чтобы покрыть их поверхность.
Процесс приготовления происходит путем реакции дисперсии наночастиц в органическом растворителе (например, этиленгликоле) с выбранным связующим агентом при перемешивании при сниженной температуре в течение нескольких часов. Продукт затем разделяют, как только возможно, экстракцией с определенными растворителями, или осаждают, например, ацетоном, центрифугируют, отделяют и, как только возможно, редиспергируют в подходящем растворителе.
Вышеупомянутые полимерные магнитные системы обладают различными характеристиками в зависимости от типа полимера, применяемого для их приготовления.
А именно, полимеры могут быть нерастворимыми или растворимыми в воде; и их применение в синтезе магнитных систем в соответствии с изобретением приведено далее.
Магнитные системы на основе нерастворимых в воде полимеров.
Они заключаются в магнитных наночастицах, функционализированных как указано выше, в комбинации с фармакологически активным агентом, встроенных в нерастворимый в воде полимер, как определено выше, в свою очередь стабилизированный поверхностными агентами, как определено выше.
Поверхностными агентами в соответствии с изобретением могут быть: полиэлектролиты, полипептиды и водорастворимые белки; предпочтительными являются поверхностные агенты, выбранные из блок-сополимеров, модифицированных полиэтиленгликолей, модифицированных полисахаридов, фосфолипидов, полиаминамидов, глобулярных белков. Процесс приготовления этих магнитных систем в соответствии с данным изобретением является непрерывным и одноэтапным процессом встраивания магнитных наночастиц в нерастворимый в воде полимерную матрицу и покрытия данной структуры подходящими поверхностными агентами.
Процедура подразумевает применение воды (в которой предварительно растворяют поверхностный агент) и органического растворителя, смешивающегося с ней (в степени, большей 10%), в которых предварительно солюбилизируют магнитные наночастицы, функционализированные, как описано выше, и полимерную матрицу. Две жидкости затем смешивают в подходящих условиях, чтобы получить самосборку компонентов, предварительно солюбилизированных в фазах, до образования магнитной системы контролируемого размера.
Встраивание лекарства в магнитную систему происходит на этапе сборки путем солюбилизации в воде или органическом растворителе. Таким образом, число фармакологически активных видов, которые можно ввести в магнитную систему, возрастает.
Данный способ позволяет получить конечный продукт с выходом в диапазоне между 90 и 99%; неожиданно гипертермическая эффективность магнитных систем, собранных таким образом, подобна той, что у исходных неорганических частиц.
Средний диаметр магнитных систем находится в диапазоне между 50 и 300 нм, а отношение между концентрацией возможно присутствующего лекарства и концентрацией магнитных частиц можно легко изменить во время сборки.
Тесная связь магнитных частиц и лекарства позволяет добиться контролируемого высвобождения лекарства за счет термического эффекта, индуцированного при взаимодействии магнитных наночастиц с внешним электромагнитным полем.
Таким образом, с одной стороны может быть получена магнитная гипертермия, а с другой стороны может быть получен синергетический эффект фармакологически активных видов.
Присутствие магнитных частиц в процентах, изменяющихся по отношению к лекарству, позволяет усилить гипертермический эффект, т.е. обеспечить строгий фармакологический эффект в наиболее показанной манере для специфической патологии, подлежащей лечению.
Полученные магнитные системы являются стабильными в среде физиологического раствора, и таким образом, обоснованно пригодными для лечебного применения.
Магнитные системы, основанные на водорастворимых полимерах.
Они состоят из магнитных наночастиц, функционализированных, как указано выше, возможно в комбинации с фармакологически активным агентом, встроенным в водорастворимый полимер или в поверхностный агент, как определено выше.
Процесс в соответствии с изобретением подразумевает органический растворитель, смешиваемый с водой в степени, большей 10%, в качестве «несущего» растворителя для магнитных частиц и лекарства. Органический растворитель выбирают из группы, включающей: ацетон, диэтиленгликоль, ацетонитрил, диметилсульфоксид, диметилформамид, метилэтилкетон, диметилкарбонат, метанол, этанол, пропанол.
Процедура подразумевает применение воды (в которой предварительно растворен водорастворимый полимер) и жидкости, смешиваемой с водой (в степени, большей 10%), в которой предварительно солюбилизированы функционализированные магнитные наночастицы. Две жидкости затем смешивают в подходящих условиях так, чтобы получить самосборку компонентов, предварительно солюбилизированных на этапах, до образования магнитной системы контролируемого размера.
Встраивание лекарства в магнитную систему происходит на этапе сборки посредством солюбилизации в воде или в органическом растворителе. Таким образом, число фармакологически активных видов, которые можно встроить в магнитную систему, возрастает, а отношение между концентрацией лекарства и концентрацией магнитных частиц можно легко изменить.
Таким образом, могут быть получены магнитные системы, имеющие средний диаметр между 30 и 100 нм и очень строго ограниченное распределение по размеру (индекс полидисперсности PDI=0,10-0,15), в то время как с помощью способов, описанных в литературе (с более сложным и трудно масштабируемым способом), получают частицы с размером примерно 200 нм с более широким индексом полидисперсности (около 0,25). Данный способ позволяет получить конечный продукт с выходом в диапазоне между 80 и 98%, неожиданно гипертермическая эффективность магнитной системы, собранной таким образом, сходна с таковой у исходных неорганических частиц.
Полученные магнитные системы являются стабильными в среде физиологического раствора и, таким образом, обоснованно пригодны для лечебного применения.
Возможность получить такие малые магнитные системы, равномерно распределенные и стабильные в физиологической среде представляет значительное преимущество для возможного лечебного применения, поскольку частицы могут лучше распределяться в участках организма, подвергающихся лечению, более трудно выявляются и удаляются иммунной системой, и более легко встраиваются в целевые клетки (I.Brigger, С.Dubernet, P.Couvreur, Adv. Del. Rev., 2002, 54, 631. Nanoparticles in cancer therapy and diagnosis).
Общие данные по синтезированным наночастицам, функционализированным наночастицам и магнитным системам, как определено выше, установлены в Таблице 1, которая подразделена следующим образом:
Таблицы 1(a) и 1(b): магнитные частицы;
Таблица 1(c): функционализированные магнитные частицы;
Таблица 1(d): магнитные системы с полимерным покрытием.
В Таблице 2 представлен размер полученных частиц с процессами в соответствии с данным изобретением, в то время как в Таблице 3 представлен соответствующий гипертермический эффект.
Общие данные по функционализированным наночастицам представлены в Таблице 4, в которой указаны исходные продукты, типы функционализации и гипертермический эффект (выраженный в виде ΔT) предшественника и конечного продукта при одних и тех же условиях измерения.
Из Диаграммы 1 видно, что гипертермический эффект магнитной системы всегда подобен эффекту предшественника.
Кристаллическую структуру образцов идентифицировали посредством рентгеновской дифракции (XRD), записывая отражения в диапазоне 10-70° с диапазоном сканирования 0,05° (2Θ) в течение 5 сек на дифрактометре Philips X'pert Pro (Cu Ka излучение). Размер кристаллитов определяли по пикам дифракции с применением метода Шеррера.
Охарактеризованные таким образом образцы (нефункционализированные частицы, функционализированные частицы, конечные магнитные системы) подвергали анализу на гипертермию, для которого образцы диспергировали в различных средах, и анализировали на приборе для облучения осциллирующим магнитным полем Novastar 5W-5 Kw, обеспеченном Ameritherm. Анализы проводили в адиабатических условиях с электромагнитным полем 170 кГц с интенсивностью магнитного поля 21 кА/m2, с применением в алюминиевом тигеле с емкостью 0,30 мл, полностью заполненном дисперсией образца в подходящем растворителе. Концентрация образца (выраженная в виде концентрации оксида металла) в диспергирующей среде находилась в диапазоне между 0,1% и 3%.
Исходную и конечную температуру дисперсии измеряли с помощью термокамеры FLIR E65.
Для лучшей иллюстрации изобретения приведены следующие примеры.
Пример 1
Приготовление нанометрового феррита кобальта в соответствии с известным процессом (полиоловый процесс).
Формула продукта: NFeCo31
Использованные реагенты:
Отношение Fe:Co=2:1
9,53 г Со(Ас)2·4H2O (23,7% Со в/в)
Со(II)=2,259 г=0,038 моль
21,42 г Fe(СН3СОО)3 (Паста Шеперда; конц.20% Fe в/в)
Fe(III)=4,284 г=0,077 моль
269,04 г ДЭГ
Синтез:
Четырехгорлую колбу оборудовали лопастной мешалкой, барботажным конденсатором, оснащенным клапаном для возможной дистилляции, зондом и пробкой (дополнительная горловина). Реагенты помещали с ДЭГ в реакционную колбу. Систему доводили до температуры 110°С для этапа солюбилизации (время: 1 час). Далее температуру повышали до 180°С и систему оставляли под обратным холодильником в течение 3 часов. Процесс проводили при перемешивании, приводящем к образованию черной суспензии.
Пример 2
Приготовление нанометрового магнетита в соответствии с известным процессом (полиоловый процесс).
Формула продукта: Fe74
Реагенты:
Отношение FeIII:FeII=2:1
21,42 г Fe(Ac)2 раствора (7% Fe в/в)
Fe(II)=2,122 г=0,038 моль
21,42 г Fe(СН3СОО)3 (Паста Шеперда; конц. 20% Fe в/в)
Fe(III)=4,284 г=0,077 моль
269,04 г ДЭГ
Синтез:
Четырехгорлую колбу оборудовали лопастной мешалкой, барботажным конденсатором, оснащенным двухходовой системой обратного оттока и дистилляции, зондом и пробкой (дополнительная горловина). Реагенты помещали с ДЭГ в реакционную колбу. Систему доводили до температуры 120°С для этапа солюбилизации и поддерживали в течение одного часа при данной температуре. Далее смесь нагревали до 180°С, поддерживая этап дистилляции. При достижении внутренней температуры 180°С систему оставляли под обратным холодильником в течение 3 часов. Процесс проводили при перемешивании, приводящем к образованию коричневой суспензии.
Пример 3
Приготовление нанометровой смешанной FeIII, FeII, Ni шпинели в соответствии с известным процессом (полиоловый процесс).
Формула продукта: FeDoNi03
Спецификации реагентов:
Fe(СН3СОО)3 М.м.=232,98 г/моль
Ре(СН3СОО)2 М.м.=173,93 г/моль
Ni(СН3СОО)2 М.м.=176,78 г/моль
Fe М.м.=55,85 г/моль
Ni М.м.=58,69 г/моль
ДЭГ М.м.=106,12 г/моль
Реагенты:
Отношение FeIII:FeII:Ni=8:3:1
22,34 г Fe(Ас)3 (Паста Шеперда; конц. 20% Fe в/в)
Fe(III)=4,468 г=80 ммоль
23,94 г Fe(Ac)2 раствора (7% в/в в Со)
Fe(II)=1,675 г=30 ммоль
1,77 г Ni(Ac)2
Ni=0,588 г=10 ммоль
269,04 г ДЭГ
Синтез:
Четырехгорлую колбу оборудовали лопастной мешалкой, барботажным конденсатором, оснащенным двухходовой системой обратного оттока и дистилляции, зондом и пробкой (дополнительная горловина). Реагенты помещали с ДЭГ в реакционную колбу. Систему доводили до температуры 110°С для этапа солюбилизации и поддерживали в течение одного часа при данной температуре. Далее смесь нагревали до 180°С, поддерживая этап дистилляции. При достижении внутренней температуры 180°С систему оставляли под обратным холодильником в течение 3 часов. Процесс проводили при перемешивании, приводящем к образованию коричневой суспензии.
Пример 4
Приготовление нанометрового феррита кобальта при непрерывном процессе в соответствии с данным изобретением.
Формула продукта: NFeCo36 Этап 1 (Формула продукта: NFeCo35)
Спецификация реагентов:
Fe(СН3СОО)3 М.м.=232,98 г/моль
Со(СН3СОО)2·4H2O М.м.=248,93 г/моль
CoFe2O4(NFeCo31) М.м.=234,62 г/моль
Со М.м.=58,93 г/моль
Fe М.м.=55,85 г/моль
ДЭГ М.м.=106,12 г/моль
Реагенты:
Отношение Fe:Со=2:1
9,53 г Со(Ас)2·4H2O (23,7% Со в/в)
Со(II)=2,259 г=0,038 моль
21,42 г Fe(СН3СОО)3 (Паста Шеперда; конц. 20% Fe в/в)
Fe(III)=4,284 г=0,077 моль
269,04 г ДЭГ
287 г NFeCo31
Синтез:
Четырехгорлую колбу оборудовали лопастной мешалкой, барботажным конденсатором, оснащенным клапаном для возможной дистилляции, зондом и пробкой (дополнительная горловина). Реагенты помещали с ДЭГ в реакционную колбу. Систему доводили до температуры 110°С для этапа солюбилизации (время: 1 час). Далее температуру повышали до 180°С и систему оставляли с обратным холодильником на 3 часа. Процесс проводили при перемешивании, приводящем к образованию черной суспензии. Было получено 570 г продукта.
Этап 2 (формула продукта: NFeCo36)
Спецификация реагентов: как выше.
Реагенты:
Отношение Fe:Со=2:1
19,06 г Со(Ас)2·4H2O (23,7% Со в/в)
Со(II)=4,518 г=0,076 моль
42,84 г Fe(СН3СОО)3 (Паста Шеперда; конц. 20% Fe в/в)
Fe(III)=8,568 г=0,154 моль
538 г ДЭГ
570 г NFeCo35
Синтез:
Четырехгорлую колбу оборудовали лопастной мешалкой, барботажным конденсатором, оснащенным клапаном для возможной дистилляции, зондом и пробкой (дополнительная горловина). Реагенты помещали с ДЭГ в реакционную колбу. Систему доводили до температуры 110°С для этапа солюбилизации (время: 1 час). Далее температуру повышали до 180°С и систему оставляли с обратным холодильником на 3 часа. Процесс проводили при перемешивании, приводящем к образованию черной суспензии. Было получено 1105 г продукта.
Пример 5
Приготовление нанометрового магнетита, формула продукта Fe76 в непрерывном процессе в соответствии с данным изобретением.
Этап 1 (формула продукта Fe75)
Спецификация реагентов:
Fe(СН3СОО)3 М.м.=232,98 г/моль
Fe(СН3СОО)2 М.м.=248,93 г/моль
Fe3O4(Fe74) М.м.=231,53 г/моль
Fe М.м.=55,85 г/моль
ДЭГ М.м.=106,12 г/моль
Реагенты:
Отношение FeIII:FeII=2:1
30,32 г Fe(Ac)2 раствора (7% Fe в/в)
Fe(II)=2,122 г=0,038 моль
21,42 г Fe(СН3СОО)3 (Паста Шеперда; конц. 20% Fe в/в)
Fe(III)=4,284 г=0,077 моль
269,04 г ДЭГ
279 г Fe74
Синтез:
Четырехгорлую колбу оборудовали лопастной мешалкой, барботажным конденсатором, оснащенным двухходовой системой для возврата и дистилляции, зондом и пробкой (дополнительная горловина). Реагенты помещали с ДЭГ в реакционную колбу. Систему доводили до температуры 120°С для этапа солюбилизации и поддерживали при такой температуре в течение 1 часа. Далее смесь нагревали до 180°С, поддерживая этап дистилляции. При достижении внутренней температуры 180°С систему оставляли с обратным холодильником на 3 часа. Процесс проводили при перемешивании, приводящем к образованию коричневой суспензии.
Всего получено: 552 г.
Этап 2 (формула продукта: Fe76)
Спецификация реагентов: как выше.
Реагенты:
Отношение FeIII:FeII=2:1
60,64 г Fe(Ac)2 раствора (7%